Линии дикого типа
Линия Canton-S
Линия дикого типа характеризуется отсутствием генетических нарушений.
 |
 |
|
самец |
самка |
Направления исследований
С использованием линии дикого типа Canton-S в нашей лаборатории проводятся исследования по следующим направлениям:
1) Изучение механизмов устойчивости к неблагоприятным факторам среды разной модальности (ионизирующие излучения, экотоксиканты, инфекции, и т.д.) (Перегудова и др., 2015; Moskalev et al., 2014a; Moskalev et al., 2014b; Moskalev et al., 2015; Shostal, Moskalev, 2012; Zhikrevetskaya et al., 2015).
2) Оценка геропротекторных свойств фармакологических препаратов и веществ природного происхождения (Белый и др., 2010; Москалев, Шапошников, 2008; Шапошников и др., 2014; Danilov et al., 2013; Danilov et al., 2015; Lashmanova et al., 2015; Moskalev, Shaposhnikov, 2011; Moskalev, Shaposhnikov, 2010; Proshkina et al., 2016; Shaposhnikov et al., 2014).
Результаты исследований
На линии дикого типа Canton-S нами исследованы геропротекторные свойства специфических фармакологических ингибиторов продуктов ассоциированных со старением эволюционно консервативных сигнальных путей, таких как IGF-I/PI3K/AKT/TOR, NF-kB и Pkh2/ypk1/lem3/tat2. Показано, что обработка имаго дрозофилы ингибиторами фосфоинозитол-3-киназы (5 мкM LY-294002 и 0.5 мкM вортманнин) и TOR-киназы (0.5 мкM рапамицин) приводит к увеличению медианной и максимальной продолжительности жизни самок и самцов Drosophila melanogaster (Москалев, Шапошников, 2008; Moskalev, Shaposhnikov, 2010). Кроме того, нами было обнаружено, что предварительная обработка вортманнином (5 µМ) и LY294002 (5, 100 µМ) приводила к увеличению устойчивости имаго обоих полов к воздействию острого облучения в дозе 30 Гр по показателям выживаемости (Шапошников et al., 2010). Также нами было установлено, что ингибирование активности транскрипционного фактора NF-kB пирролидин дитиокарбаматом (125 мкМ) вызывает увеличение медианной (на 13–20 %) и максимальной (на 11–14 %) продолжительности жизни у самок и самцов, соответственно (Moskalev, Shaposhnikov, 2011; Shaposhnikov et al., 2011). Нестероидный противовоспалительный препарат ибупрофен входит в перечень жизненно необходимых и важнейших лекарственных препаратов. Его эффекты обычно связывают со способностью ингибировать циклооксигеназу-2. Впервые показано, что ибупрофен проявляет геропротекторные свойства у нескольких модельных систем - дрожжей, нематод и дрозофил. При этом данный эффект не зависит от способности ибупрофена ингибировать циклооксигеназу-2, так как у исследованных моделей ген данного фермента отсутствует (He et al., 2014). Нами было обнаружено, что геропротекторное действие ибупрофена и ряда других нестероидных противовоспалительных препаратов (аспирин, валерил-салицилат, транс-ресвератрол, SC-560, APHS, NS-398, SC-58125, вальдекоксиб, CAY10404 и ликофелон) опосредовано ингибированием эволюционно-консервативного внутриклеточного сигнального пути Pkh2/ypk1/lem3/tat2 (Danilov et al., 2015; He et al., 2014). Мы также показали, что каротиноиды ?-каротин и фукоксантин увеличивают продолжительность жизни у двух модельных организмов Drosophila melanogaster и Caenorhabditis elegans (Lashmanova et al., 2015).
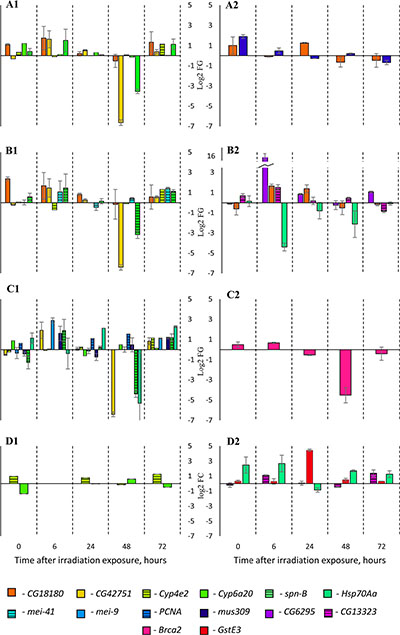
На лини дикого типа Canton-S нами проанализированы изменения продолжительности жизни и уровня экспрессии генов стресс-ответа после воздействия малых доз гамма-излучения (5-40 сГр). Хотя были выявлены некоторые изменения в продолжительности жизни самцов (эффект гормезиса после воздействия 5, 10 и 40 сГр), а также у самок (эффект гормезиса после облучения в дозе 5 и 40 сГр), они не были связаны с закономерными изменениями в уровне экспрессии генов (Рис. 1). Эти результаты отражают нелинейные эффекты малых доз радиации и поло-специфическую радиорезистентность постмитотического имаго дрозофилы (Zhikrevetskaya et al., 2015).
В настоящее время недостаточно поняты молекулярные механизмы, определяющие реакцию организма на разнообразные по силе и модальности стрессовые воздействия. Мы исследовали влияние ионизирующего излучения (144, 360 и 864 Гр), энтомопатогенных грибков (10 и 100 КОЕ), гипотермии (+4, 0 и -4°С) и голодания (16 ч) на показатели жизнеспособности организма (выживаемость и локомоторная активность) и экспрессию генов у особей мужского пола Drosophila melanogaster. Все виды стрессов за исключением гипотермии вызывали пропорциональное дозе снижение продолжительности жизни. Локомоторная активность снижалась после всех воздействий за исключением голодания. Наши данные выявили как сходство, так и различие в дифференциальной экспрессии генов и активности биологических процессов под влиянием стрессовых факторов. Полученные данные свидетельствуют, что острые стрессовые воздействия приводят к неблагоприятным эффектам на уровне организма и сопровождаются активацией как неспецифических, так и стресс-специфичных механизмов клеточного стресс-ответа (Moskalev et al., 2015).
Список публикаций
Белый В.А., Печникова А.А., Кочева Л.С., и др. Лигнины родиолы розовой и серпухи венценосной: особенности химической структуры и антиоксидантные свойства // Успехи геронтологии.—2010.—Vol. 23, № 2.—P. 221-227.
Москалев А.А., Шапошников М.В. Продление жизни Drosophila melanogaster путем специфического ингибирования PI3K // Успехи геронтологии.—2008.—Vol. 21, № 4.—P. 602-606.
Перегудова Д.О., Шапошников М.В., Москалев А.А. Влияние стресс-факторов различной природы на экспрессию генов стресс-ответа у самцов Drosophila melanogaster // Известия Коми научного центра УрО РАН.—2015.—Vol. 2, № 22.—P. 40-44.
Шапошников М.В., Данилов А.А., Москалев А.А. Фармакологические ингибиторы PI3-киназы оказывают радиопротекторное действие на имаго Drosophila melanogaster // Радиационная биология. Радиоэкология.—2010.—Vol. 50, № 6.—P. 649-655.
Шапошников М.В., Шилова Л.А., Плюснина Е.Н., и др. Влияние препаратов, содержащих фитоэкдистероиды и стероидные гликозиды растений, на продолжительность жизни и стрессоустойчивость Drosophila melanogaster // Экологическая генетика.—2014.—Vol. XII, № 4.—P. 3-14.
Danilov A., Shaposhnikov M., Plyusnina E., et al. Selective anticancer agents suppress aging in Drosophila // Oncotarget.—2013.—Vol. 4, № 9.—P. 1507-1526.
Danilov A., Shaposhnikov M., Shevchenko O., et al. Influence of non-steroidal anti-inflammatory drugs on Drosophila melanogaster longevity // Oncotarget.—2015.—Vol. 6, № 23.—P. 19428-19444.
He C., Tsuchiyama S.K., Nguyen Q.T., et al. Enhanced longevity by ibuprofen, conserved in multiple species, occurs in yeast through inhibition of tryptophan import // PLoS genetics.—2014.—Vol. 10, № 12.—P. e1004860.
Lashmanova E., Proshkina E., Zhikrivetskaya S., et al. Fucoxanthin increases lifespan of Drosophila melanogaster and Caenorhabditis elegans // Pharmacol Res.—2015.—Vol. 100.—P. 228-241.
Moskalev A., Shaposhnikov M. Pharmacological inhibition of NF-?B prolongs lifespan of Drosophila melanogaster // Aging (Albany NY).—2011.—Vol. 3, № 4.—P. 391-394.
Moskalev A., Shaposhnikov M., Plyusnina E., et al. Exhaustive data mining comparison of the effects of low doses of ionizing radiation, formaldehyde and dioxins // BMC Genomics.—2014a.—Vol. 15, № Suppl 12.—P. S5.
Moskalev A., Shaposhnikov M., Snezhkina A., et al. Mining gene expression data for pollutants (dioxin, toluene, formaldehyde) and low dose of gamma-irradiation // PloS one.—2014b.—Vol. 9, № 1.—P. e86051.
Moskalev A., Zhikrivetskaya S., Krasnov G., et al. A comparison of the transcriptome of Drosophila melanogaster in response to entomopathogenic fungus, ionizing radiation, starvation and cold shock // BMC Genomics.—2015.—Vol. 16 Suppl 13.—P. S8.
Moskalev A.A., Shaposhnikov M.V. Pharmacological inhibition of phosphoinositide 3 and TOR kinases improves survival of Drosophila melanogaster // Rejuvenation Research.—2010.—Vol. 13, № 2-3.—P. 246-247.
Proshkina E., Lashmanova E., Dobrovolskaya E., et al. Geroprotective and radioprotective activity of quercetin, (-)-epicatechin, and ibuprofen in Drosophila melanogaster // Frontiers in Pharmacology.—2016.—Vol. 7, № 505.
Shaposhnikov M., Latkin D., Plyusnina E., et al. The effects of pectins on life span and stress resistance in Drosophila melanogaster // Biogerontology.—2014.—Vol. 15, № 2.—P. 113-127.
Shaposhnikov M.V., Moskalev A.A., Plyusnina E.N. Effect of PARP-1 overexpression and pharmacological inhibition of NF-?B on the lifespan of Drosophila melanogaster // Advances in Gerontology.—2011.—Vol. 24, № 3.—P. 405–419.
Shostal O.A., Moskalev A.A. The genetic mechanisms of the influence of the light regime on the lifespan of Drosophila melanogaster // Front Genet.—2012.—Vol. 3.—P. 325.
Zhikrevetskaya S., Peregudova D., Danilov A., et al. Effect of Low Doses (5-40 cGy) of Gamma-irradiation on Lifespan and Stress-related Genes Expression Profile in Drosophila melanogaster // PloS one.—2015.—Vol. 10, № 8.—P. e0133840.