РОССИЙСКАЯ
АКАДЕМИЯ НАУК
Уральское
ОТДЕЛЕНИЕ ран
Институт
биологии Коми НЦ Уро РАН
Русское
ботаническое общество
Российский фонд
фундаментальных исследований
II Всероссийская
научно-практическая конференция
«Водоросли:
проблемы таксономии, экологии
И ИСПОЛЬЗОВАНИЕ
в мониторинге»
(Материалы докладов)
5 - 9 октября 2009 г.
Сыктывкар, Республика Коми, Россия
Сыктывкар, 2009
УДК 582.26/.27-15 (063)
ББк 28.591:28.58
Водоросли: проблемы таксономии,
экологии и использование в мониторинге: Материалы II всероссийской
конференции (Сыктывкар, 5-9 октября 2009 г.) [Электронный ресурс]. – Сыктывкар:
Институт биологии Коми НЦ УрО РАН, 2009. - 362 с. – Режим доступа: http://ib.komisc.ru/add/conf/algo_2009/,
свободный.
В
электронной публикации представлены материалы докладов II всероссийской
научно-практической конференции «Водоросли: проблемы таксономии, экологии и
использование в мониторинге», которые содержат результаты фундаментальных и
прикладных исследований в различных областях альгологии. Материалы опубликованы
в авторской редакции и распределены оргкомитетом по пяти секциям. 1. Современная
таксономия водорослей (морфологические, функциональные,
молекулярно-генетические аспекты). 2. Разнообразие, экология и география
водорослей. Структура и функционирование альгоценозов. 3. Флоры водорослей.
Редкие виды и малоизученные группы. 4. Использование альгоиндикации в оценке
качества водной и наземной среды. 5. Современные методы и подходы к изучению
пресноводных и почвенных водорослей.
The Algae: problems of
taxonomy, ecology and use in the monitoring. Abstracts of the II Russian
scientific-practical Conference (Syktyvkar,
5-9 October 2009) [Electronic resource]. –Syktyvkar: Institute of biology of
Komi Sci. Center, Ural Div. RAS, 2009. - 362 pp. - Access mode: http://ib.komisc.ru/add/conf/algo_2009/, free.
The electronic publication contains the reports
of the II Russian scientific-practical conference “The Algae: problems of taxonomy,
ecology and use in the monitoring”, that include the results of fundamental and
applied investigations in the different spheres of phycology. Reports are
published as authors wrote and put into fife sections. 1. Modern taxonomy of
algae (morphological, functional, molecular and genetical aspects). 2.
Diversity, ecology and geography of algae. 3. Algal floras. Rare species and
little studied groups. 4. Use of algae in water and terrestrial environment
assessment. 5. Modern methods and approaches in freshwater and soil algae
investigation.
Информационная поддержка



© Институт
биологии Коми НЦ УрО РАН, 2009
©
Коллектив авторов, 2009
Содержание
|
Вступительное
слово…………………………………………………………………...……………
|
14
|
|
Секция 1
Современная
таксономия водорослей (морфологические,
функциональные,
молекулярно-генетические аспекты)
|
|
|
Болдина О.Н. Принципы
классификации пиреноидов у зеленых монад
Boldina O.N. Classification
principles of pyrenoids in green monads……………………………….
|
15
|
|
Волошко Л.Н. Золотистые водоросли в экосистеме северных широт:
новые подходы к изучению биоразнообразия
Voloshko L.N.Golden algae in high latitude ecosystem: new approaches of
biodiversity studies…………………………………………………………………………………………..………….
|
18
|
|
Гайсина Л.А.Понятие вида и внутривидовых категорий в современной
альгологии
Gaysina L.A. Species and intraspecific categories conceptions in modern phycology………..……...
|
19
|
|
Гончаров А.A.Проблемы систематики конъюгат (Zygnematophyceae, Streptophyta) с точки зрения молекулярно-филогенетических
данных
Gontcharov A.A.Problems of the conjugates
(Zygnematophyceae, Streptophyta) taxonomy with a view to the molecular-phylogenetic data……………………………………….……………….…….
|
21
|
|
Куликовский М.С.Современные
проблемы таксономии навикулоидных диатомовых водорослей
Kulikovskiy M.S. Modern
problems of naviculoid diatoms taxonomy…………..……………………
|
25
|
|
Натяганова А. В.Особенности организации диатомей, не
согласующиеся с представлениями об их эукариотической природе: литературные и
собственные данные
Natyaganova A.V.Diatoms organization peculiarities unmatched with conception of their
eukaryotic nature: literature and original data………………………………………………………..….
|
27
|
|
Селиванова О.Н.Представители
порядка Palmariales в
дальневосточных морях России
Selivanova O.N. The Palmariales order members in the Far
Eastern seas of Russia…….…………...
|
30
|
|
Степанова О.А., Галатонова О.А. Определение вида микроводоросли с использованием альговирусов
Stepanova O.A., Galatonova O.A. Identification
of microalgae species using algoviruses…………..
|
33
|
|
Теренько Л.М. Cовременная
система динофлагеллят, экология и их роль в экосистеме Черного моря
Terenko L.M. Modern system of Dinophyta. Their ecology and role in
ecosystem of the Black Sea…………………………………………………………………………………………………….
|
35
|
|
Секция 2
Разнообразие,
экология и география водорослей.
Структура
и функционирование альгоценозов
|
|
|
Абдуллин Ш. Р. Сравнительный
анализ цианобактериально-водорослевых ценозов некоторых пещер России
Abdullin Sh. R.Comparative analysis of the
cyanobacterial-algae coenoses in some Russian
caves……………………………………………………………………………………………….….
|
39
|
|
Бакиева Г.Р., Мельников А.С. Специфика альгофлоры различных
участков лесных экосистем Башкирского государственного природного заповедника
(Южный Урал)
Bakieva G.R., Melnikov A.S. Specific characters of algal flora in
different forest ecosystems plots of the Bashkir State Natural Reserve (South
Ural)………………………………………………..…..
|
42
|
|
Беляева
П.Г. Альгологическая характеристика реки Сылва и ее притоков
Belyaeva P.G.Algological characteristics of the Sylva river and its tributaries…………………..…..
|
44
|
|
Габышев В.А., Иванова А.П.,
Габышева О.И. К изучению фитопланктона
малых рек бассейна средней Лены
Gabyshev V.A., Ivanova A.P.,
Gabysheva O.I. Phytoplankton studies in small rivers of the
Lena River middle course……………………………………………………………………...……………
|
47
|
Гаврилова Е.В., Духовная Н.И., Пряхин Е.А.Токсичность цианобактерий Шершневского водохранилища.
Влияние экологических факторов
Gavrilova E.V., Dukhovnaya N.I., Pryakhin E.A. Cyanobacteria toxicity of the
Shershnevskoe reservoir. Ecological factors influences……………………………………………………………….…
|
50
|
|
Гасанова А.Ш., Гусейнов К.М. Структура и пространственное
распределение весеннего планктонного фитоценоза западного побережья Среднего
Каспия в современных условиях
Gasanova A.S., Guseynov K.M. The structure and spatial distribution of
spring plankton in the Caspian Sea western
coast in modern conditions…………………………………………………….…...
|
52
|
|
Генкал С.И., Михеева Т.М. , Куликовский М.С., Лукьянова Е.В. Центрические Диатомовые водоросли реки
Свислочь (Беларусь)
Genkal S.I., Mikheeva T.M., Kulikovskiy M.S., Lukyanova E.V.Centric diatoms of the Svisloch River (Belarus)…………………………………………………………….……………………...…..
|
55
|
|
Герасимюк В. П., Шихалеева Г. Н., Эннан А. А., Кирюшкина А. Н. Видовой
состав водорослей реки Большой Куяльник (Северо-Западное Причерноморье,
Украина)
Gerasimyk V.P., Shikhaleeva G.N., Ennan A.A., Kiryushkina A.N. Algae species composition of the Bolshoy Kuyalnik River
(North-west Black Sea Area, Ukraine)……………………………………..
|
57
|
|
Герасимюк В. П., Зинченко В. Л., Герасимюк Н. В. Пленки
диатомовых обрастаний китов в водах Антарктики
Gerasimyk V.P., Zinchenko D.L., Gerasimyk N.V. Diatoms biofilms of whales in the Antarctica’s waters……………………………………………………………………………..………………..…
|
60
|
|
Голоколенова Т.Б. Структурно-функциональные характеристики
фитопланктона Цимлянского водохранилища (2006-2008 гг.)
Golokolenova T.B.Structural and functional characteristics of
phytoplankton in the Tsimlyanskoe reservoir (2006-2008)…………………………………………………..……………………………..
|
62
|
|
Горохова О.Г.,
Номоконова В.И. Рафидофитовые водоросли и условия их развития в водоемах
охраняемых территорий Самарской области
Gorochova O.G., Nomokonova V.I. Raphidophyta algae
and conditions of their
development in the lakes of the Samara region protected territories……………………………………..…………….....
|
64
|
|
Гусев Е.С. Вертикальное
распределение фитопланктона в небольших карстовых озёрах Центральной России
Gusev E.S. Vertical distribution of phytoplankton in the small karst lakes of Central Russia……….
|
68
|
|
Дмитриева А.Н., Анисимова О.В. Сравнительная характеристика видового разнообразия фитопланктона рек
бассейна Иваньковского водохранилища
Dmitrieva A., Anissimova O. Comparative
analyses of phytoplankton species diversity in the rivers of the Ivankovo
reservoir basin…………………………………………………………………..…...
|
70
|
|
Духовная Н.И., Гаврилова Е.В., Савочкина А.Ю., Мезенцева Е.А., Пряхин
Е.А. Продукция микроцистина цианобактериями Шершневского водохранилища
Dukhovnaya N.I., Gavrilova E.V., Savochkina A.Y., Mezenceva E.A., Pryakhin E.A. Cyanobacteria microcystine production in the Shershnevskoe reservoir……………………………………...……..
|
72
|
|
Ермолаев В.И. Водоросли и
их роль в экосистеме водоемов
Ermolaev V.I. Significance and functions of algae in water
ecosystems………….……….…………
|
74
|
|
Журавлева О.В., Юлова Г.А. Альгоэпифитон рдеста блестящего (Potamogeton lucens L.) озера Великого (Нижегородская область)
Zhuravleva O.V., Julova G.A. Algal epiphyton of Potamogeton lucens L. in the Velikoe Lake (Nizhny Novgorod Region)……………………………………………………………..…………………
|
76
|
|
Зубишина А.А., Бабаназарова О.В., Сахарова Е. Изменение структуры микрофитобентоса вдоль
градиента освещенности
Zubishina A. А., Babanazarova O.V., Saharova E. Change
of the microphytobenthos structure along light gradient……………………………………………………………………………………
|
79
|
|
Иевлева Н.А. Состав и
структура альгоценозов макрофитов на побережье Белого моря
Ievleva N.A. Composition and structure of macrovegetation
algal coenoses in the White Sea coast…………………………………………………………………………………………………...
|
83
|
|
Комиссаров А. Б. Сравнительная хараткеристика фитопланктона
рек-притоков Верхней Волги
Komissarov A. Comparative description of the Volga
upstream tributaries phytoplankton……….....
|
84
|
|
Комулайнен С.Ф. Экологические
группировки водорослей в водных экосистемах
Komulaynen S.F. Ecological groups of algae in water ecosystems……………………………....…..
|
88
|
|
Комулайнен С.Ф., Чекрыжева
Т.А. Структура альгоценозов в водоемах озерно-речной системы реки
Кенти, Республика Карелия
Komulaynen S.F., Chekryzheva T.A. Algacoenosis structure in some waterbodies of the
Kentri river lake-river system, Karelia………………………………………………………………………..……
|
90
|
|
Корнева Л.Г. Экологические классификации планктонных водорослей
Korneva L.G. Ecological classifications of planktonic algae…………….…………………………...
|
93
|
|
Кузяхметов Г. Г. Ценотическая
роль почвенных водорослей в агроэкосистемах
Kuzyakhmetov G.G. Coenotic role of soil algae in agroecosystems…….………………………...….
|
96
|
|
Лихачёв С.Ф., Артёменко Б.А.Фитопланктон реки Миасс в черте г.
Челябинска
Lilhachov S.F., Artyomenko B.A. Phytoplankton of the Miass
River within the outskirts of Chelyabinsk………………………………………………………………………………………………….....
|
97
|
|
Лужняк О.Л., Горлачева Г.Ю. Динамика
фитопланктона озера Маныч-Гудило в разные сезоны года
Luzhniak O.L., Gorlacheva G.Y. Dynamics of the Manych-Gudilo lake
phytoplankton in different seasons………………………………………………………………………………………………...
|
100
|
|
Макаревич Т.А., Мастицкий С.Э., Савич И.В. Продукционно-деструкционные характеристики
перифитона на раковинах Dreissena polymorpha Pallas в мезотрофном озере
Makarevich T.A., Mastitsky S.E., Savich I.V. Production-destruction parameters
of periphyton on Dreissena polymorpha Pallas shells in a mesotrophic lake………………………………………...…
|
101
|
|
Митрофанова Е.Ю. Водоросли планктона горных водотоков (на примере
водотоков бассейна Телецкого озера, Россия)
Mitrofanova E.Yu. Plankton algae of mountain streams case study in the Lake Teletskoye
basin, Russia………………………………………………………………………………………………….
|
104
|
|
Номоконова В.И. Флуоресценция хлорофилла в
малых водоемах Самарской области
Nomokonova V.I. Chlorophyll fluorescence in small lakes of
Samara Region……….………….…...
|
107
|
|
Палагушкина О.В., Назарова Л.Б., Веттерих С. Исследования диатомовых водорослей современных
донных отложений водоемов сибирской Арктики
Palagushkina O.V., Nazarova L.B., Wetterich S. Investigations of diatoms in modern
sediments in Siberian arctic lakes…………………………………………………………………………………...
|
110
|
|
Пивоварова Ж.Ф., Благодатнова А.Г. Фитоценотические особенности организации почвенных водорослей
олиготрофного осушенного болота (Плесецкого района, Архангельской области)
Pivovarova J.F., Blagodatnova A.G. Phytocenological features of soil algae organization in the oligotrophic
drained bog (the Plesetsk area, the Arkhangelsk Region)……………………….……...
|
111
|
|
Пивоварова Ж. Ф.,
Илюшенко А. Е. Динамика развития альгокомплексов Pineta vacciniosum
Pivovarova Z. P., Ilyushenko A. E. The Pineta vacciniosum
algocomplexes development dynamics……………………………………………………………………………….……………………..
|
115
|
|
Романов Р.Е. Репрезентативность
таксономического состава речного фитопланктона разных гидрологических сезонов
(на примере малых равнинных рек бассейна Верхней Оби)
Romanov R.E. The representativeness of river phytoplankton taxonomic structure in
different hydrological seasons (by example of small lowland river in the Ob
River upstream)……………….….
|
118
|
|
Рябова А.А.,
Старцева Н.А. Фитопланктон
малого озера Юрьевское (Нижегородская область)
Ryabova A.A., Startseva N.А. Phytoplankton of the small lake
Yuryevskoe (Nyzhny
Novgorod Region) …………………………………………………………………………………………………..
|
121
|
|
Садогурский
С.Е., Белич Т.В., Садогурская С.А. Фитобентос у побережья
ботанического заказника "Канака" (Крым, Чёрное море)
Sadogursky S.E., Belich T.V.,
Sadogurskaya S.A. Phytobenthos at the coast of the botanical preserve "Kanaka"
(Crimea, Black Sea) ……………………………………………….………………………
|
124
|
|
Свирид А.А.,
Самойленко В.М., Митрахович П.А. Многолетняя
динамика фитопланктона водоема-охладителя Лукомольской ТЭС
Svirid A.A., Samoylenko V.M., Mitrakhovich P.A. Phytoplankton long-term dynamics
in water reservoir-cooler of the thermal power station Lukomolskaya…………………………………………
|
127
|
|
Сигарева Л.Е., Тимофеева Н.А.Оценка роли фитопланктона в формировании продуктивности донных
отложений в Горьковском водохранилище по растительным пигментам
Sigareva L.E., Timofeeva N.A. Estimation
of phytoplankton role in formation of bottom sediment productivity in the
Gorky reservoir using plant pigments……………………………….....................
|
128
|
|
Сиделев С.И., Бабаназарова О.В. Экология и сукцессия фитопланктона мелководных высокоэвтрофных озер
планктотрихетового типа (на примере оз. Неро, Ярославская область, Россия)
Sidelev
S.I., Babanazarova O.V. Phytoplankton
ecology and succession in a shallow, highly eutrophyc, planktotrichetic lakes
(case study, the Lake Nero, the Yaroslavl region, Russia) ……………..
|
131
|
|
Сластина Ю.Л., Комулайнен
С.Ф. Особенности видовой структуры и пигментных характеристик
фитопланктона реки Лижма
Slastina Y.L., Komulainen S.F. Distinctive
features of phytoplankton structure and pigmental characteristics of the Lizhma River………………………………………………………….…………….
|
133
|
|
Станиславская Е.В. Сезонная динамика структуры и уровня
биомассы фитоперифитона в разнотипных озерах
Stanislavskaya E.V. Seasonal dynamics of periphyton structure and biomass in different
types of lakes………………………………………………………………………………...............................
|
135
|
|
Старцева Н.А., Воденеева Е.Л., Охапкин
А.Г. Состав массовых видов
фитопланктона разнотипных водоемов в условиях урбанизированного и
заболоченного ландшафтов (Нижегородская область)
Startseva N.А.,
Vodeneeva Е.L., Оkhapkin А.G.
Composition of dominant phytoplankton species of different water bodies
in urban and wetland territories (the Nizhni Novgorod Region) …………….
|
137
|
|
Стенина А.С. Состав
диатомовых водорослей в озерах бассейна реки Вангыр (Приполярный Урал)
Stenina A.S. Diatoms composition in the lakes of the Vangyr River basin (Subpolar Ural)…………
|
140
|
|
Стерлягова И.Н., Патова Е.Н. Количественные
показатели развития фитопланктона в двух разнотипных озерах на Приполярном Урале
Sterljagova I.N., Patova
E.N. Quantitative indicators of phytoplankton in
two different types lakes in the Subpolar Ural…………………..……………………………………………………………..
|
142
|
|
Тарасова Н.Г. Фитопланктон ветланда Солодовка (Самарская область)
Tarasova N.G. Phytoplankton of the wetland Solodovka (the
Samara region)………………………
|
143
|
|
Теренько Л.М., Теренько Г.В. Фитопланктон и фитоперифитон
прибрежной зоны северо-западной части Черного моря (Украина)
Terenko L.M., Terenko G.V. Littoral phytoplankton and periphyton of the
Black Sea north-west (Ukraine) ……………………………………………………………………..……………………….
|
145
|
|
Турская С.А. Диатомовые
водоросли в различных фитоценозах Главного канала Вилейско-Минской водной
системы
Turskaja S.A. Diatoms in
different phytocoenoses of the Vileysko-Minskaya aquatic system main channel ………………………………………………………………………………………………..
|
147
|
|
Унковская Е.Н., Палагушкина О.В. Экологические особенности альгоценозов разнотипных озер
Волжско-Камского заповедника
Unkovskaya E.N., Palagushkina O.V. Ecological
peculiarities of algae communities in different types of lakes in the
Volzhsko-Kamsky national biosphere reserve……………..…………………...
|
151
|
|
Халиуллина Л.Ю. Особенности структурной организации фитопланктона прибрежных
мелководий Волжского и Волжско-Камского плесов Куйбышевского водохранилища
Khaliullina L.Y. Features of structural organization of littoral phytoplankton in the Volzhskiy and the
Volzhsko-Kamskiy reservoirs………………………………………..………….……..................
|
154
|
|
Шарипова М.Ю. Биоразнообразие альгоценозов водно-наземных
экотонов
Sharipova M. Ju.Algocoenoses biodiversity in aquatic-terrestrial ecotones……………….…............
|
157
|
|
Ясакова О.Н. Сезонная динамика развития динофитовых водорослей в
акватории Новороссийской бухты Черного моря
Yasakova O.N. The
seasonal development dynamics of Dinophyta in water area of the Novorossiysk bay of the Black Sea……………………………………………………….….………………….
|
159
|
|
Секция 3
Флоры
водорослей. Редкие виды и малоизученные группы
|
|
|
Levanets A., van Rensburg L. Southern African desmids: history, current
studies and perspectives…………………………………………………………………………………….……………..
|
162
|
|
Анисимова О.В., Дмитриева А.Н. Материалы к флоре водорослей Шараповского болота (Московская обл.)
Anissimova O.V., Dmitrieva A.N. Materials
to algae flora of the Sharapovskoe swamp (the Moscow Region) ……………………………………………………………………………..………………...
|
163
|
|
Ахмедьянов Д.И. Таксономический
обзор альгофлоры степей Баймакского района Республики Башкортосан
Achmedjanov D.I.
Taxonomy review of steppe algal flora of the Baimak Region of the Bashkortostan Republic……………………………………………………………………………..................
|
165
|
|
Балашова Н.Б. Альгофлора
островов Финского залива Балтийского моря
Balashova N.B. Island algal flora in the Gulf of Finland, the Baltic Sea……………….…………….
|
168
|
|
Виноградова О.Н., Михайлюк
Т.И. Альгофлора пещер и
гротов национального природного парка «Подольские Товтры» (Украина)
Vinogradova O.N., Mikhailyuk T.I. Algal
flora of caves and grots of the natural National Park «Podolskye Tovtry» (Ukraine) ………………………………………………….……………..................
|
170
|
|
Давыдов Д.А. Цианопрокариоты
западного берега Грен-Фьерда (Архипелаг Шпицберген)
Davydov D.A. Cyanoprokaryota of Grønfjord
west coast (Spitsbergen archipelago)…….…………..
|
173
|
|
Дариенко Т.М. К изучению видового состава наземных водорослей о.
Змеиный (Украина)
Darienko T.M. Study of terrestrial algae species composition of Zmeiniy island (Ukraine)…............
|
176
|
|
Дубовик И.Е., Рахматуллина И.В., Климина И.П.,
Смирнова Н.Г. Почвенная и эпифитная
альгофлора территории Национального парка «Башкирия»
Dubovik I.E., Rachmatullina I.V., Klimina I.P.,
Smirnova N.G. Soil and epiphytic algal flora of the National
Park «Bashkiria»………………………………………………………….…………………
|
178
|
|
Евстигнеева И.К.,
Таковская И.Н. Пространственно–временная
динамика структуры ценопопуляций редкой черноморской водоросли Cladostephus spongiosus (Huds.) C. Ag. (Рheophyta)
Evstigneeva I.K., Tankovskaya I.N. Spatio–temporal dynamics
of the rare Black sea’s alga Cladostephus
spongiosus (Huds.) C. Ag. (Рhaeophyta) coenopopulations structure………………...
|
180
|
|
Егорова И.Н., Судакова Е.А. Водоросли в наземных экосистемах
Байкальской Сибири
Egorova I.N., Sudakova E.A. Algae in terrestrial ecosystems of Baicalian
Siberia……….………….
|
182
|
|
Еремкина Т. В., Ярушина М. И. Степень изученности видового
состава водорослей некоторых водоемов Среднего и Южного Урала
Eremkina T.V., Yarushina M.I. The state of some
water bodies’ algae biodiversity studies in Middle and Southern Ural……………………………………………………………………..........................
|
186
|
|
Жигадлова Г.Г. Альгологические исследования на острове Старичков (восточная Камчатка).
Предварительные данные
Zhigadlova G.G. Phycological studies on Starichkov Island
(Eastern Kamchatka). Preliminary data…………………………………………………………………………………………………….
|
189
|
|
Капитонова Е.Ю. Альгофлора минерализованных водоёмов курорта
“Старая Русса” (Новгородская обл.)
Kapitonova E.Y. Algal flora of mineralized water bodies of
spa «Staraya Russa» (the Novgorod Region)
……………………………………………………………………………………………….
|
192
|
|
Кобанова Г.
И. О малоизученном виде рода Gymnodinium (Dinophyta) из Байкала
Kobanova G.I. About the little studied species from genus Gymnodinium (Dinophyta) from Baikal…………………………………………………………………………………………………….
|
194
|
|
Копырина Л. И. Таксономический
состав водорослей Нижней Колымы
Kopirina L.I. Algae taxonomic composition of the Kolyma River downstream……………………..
|
197
|
|
Васильева-Кралина И.И., Копырина Л.И. , Пшенникова Е.В. Водоросли бассейна реки Колымы
Vasilyeva-Kralina I.I., Kopirina L.I., Pshennikova E.V. Algae of the Kolyma River basin………….
|
198
|
|
Кухалеишвили Л.К. К изучению альгофлоры национального парка
Алгети (Грузия)
Kukhaleishvili L.K. Studies of algal flora in the National Park “Algeti” (Georgia)………...………..
|
200
|
|
Лисовская О.А. Макроэпифиты прибрежных фитоценозов Черного моря
Lisovskaya O.A. Macroepiphytes of the Black Sea
coastal phytocenoses……………….…………..
|
203
|
|
Лукницкая А.Ф. К флоре пресноводных
зеленых водорослей класса Zygnematophyceae Северо-Запада России
Luknitskaya A.F. Flora of freshwater green algae from class
Zygnematophyceae in the north-west of Russia………………………………………………………………………………..…………….
|
205
|
|
Мальцева И.А. Альгофлора
почв лесов степной зоны Украины
Malseva I.A. Forest soil algal flora of Ukraine
steppe zone…………………….…………………….
|
208
|
|
Нестерович А.С., Балашова Н.Б. Альгофлора природного парка «Вепсский лес»
Nesterovich A.S, Balashova N.B. Algal flora of the
«Vepssky forest» Natural
Park…………………
|
211
|
|
Патова Е.Н. Видовое разнообразие цианопрокариот восточноевропейских тундр России
Patova E.N. Cyanoprokaryota
species diversity in Russian east European tundra…………………...
|
214
|
|
Патова Е.Н., Бришкайте Р., Демина И.В. Водоросли водоемов комплексного
заказника «Хребтовый» (Полярный Урал)
Patova E.N., Briskajte R., Demina
I.V. Algae in the
water bodies of the wildlife preserve “Khrebtoviy” (Polar Ural) …………………………………………………………….……………………..
|
219
|
|
Пестрякова Л.А. Разнообразие,
экология и география диатомовых водорослей озер Якутии
Pestryakova L.A. Diversity, ecology and geography of diatoms from Yakutia lakes………………
|
222
|
|
Пшенникова Е.В. Почвенные водоросли Якутии
Pshennikova E.V. Soil algae of Yakutia………………………………………………………………
|
225
|
|
Свириденко Т.В., Свириденко Б.Ф. Коллекция харофитов (Charophyta) в лаборатории
гидроморфных экосистем Сургутского государственного университета
Sviridenko T.V., Sviridenko B.F. A collection of charophytes
(Charophyta) in the laboratory of hydromorphic ecosystems of Surgut State University…………………………………………………..
|
227
|
|
Смирнова С.В. Балашова Н.Б. Материалы к альгофлоре заповедника «Кологривский лес» (Костромская
область)
Smirnova S.S. Balashova N.B. Algal
flora of the «Kologrivskiy forest» reserve (the Kostroma Region) ………………………………………………………………………….……………………
|
230
|
|
Смирнова С.В. Балашова Н.Б. Диатомовые водоросли родников в окрестностях г. Мурманска
Smirnova S.S. Balashova N.B. Diatoms
of springs in Murmansk
suburb………………….…………
|
232
|
|
Сугачкова Е.В. Разнообразие
почвенных водорослей Австрийских Альп
Sugachkova E.V. Soil algae diversity of Austrian Alps (Austria)………………………….…............
|
233
|
|
Харитонов В.Г. Диатомовые
водоросли в отложениях трех горных олиготрофных озер бас. р. Амгуэма
(Чукотка)
Kharitonov W.G. Diatoms (Bacillariophyceae) in the sediments
of three mountain oligotrophic lakes in the Amguema River basin
(Chukotka) …………………………………………....................
|
234
|
|
Чемерис Е.В., Бобров А.А., Филиппов Д.А. Cladophora
aegagropila (Chlorophyta) в реках Вологодской области
Chemeris E.V., Bobrov A.A., Philippov D.A. Cladophora
aegagropila (Chlorophyta) in rivers of the Vologda Region…………………………………………………………………………………..
|
237
|
|
Чемерис Е.В., Бобров А.А. Макроскопические водоросли в реках на
севере европейской России
Chemeris E.V., Bobrov A.A. Macroscopic algae in rivers in the north of European Russia………….
|
239
|
|
Шабалина Ю.Н. Водоросли отдела Chlorophyta в стоячих водоемах Cреднего Тимана (бассейн р.
Ижмы)
Shabalina J.N. Chlorophyta of stagnant water bodies in the Middle Timan (the Izhma River basin)…………………………………………………………………………………………………….
|
242
|
|
Шалыгин С.С., Давыдов Д.А. Цианопрокариоты хребта Монче-тундра (Лапландский заповедник)
Shalygin S.S., Davydov D.A. Cyanoprokaryota of
Monche-Tundra range (the Lapland Reserve)…..
|
245
|
|
Шмелёв Н.А. Почвенные
водоросли лиственных лесов Южно-Уральского заповедника
Shmelev N.A. Soil algae of leafy woods of the South-Urals reserve………………………..………..
|
248
|
|
Яровая Т.А., Гузий О.В., Олейник А.И. К изучению водорослей
галинного водоема Охримовского пода
Yarovaya T.A., Guzi O.V., Olejnik A.I. Study of saline water body algae in the
Okhrymovsky bay…………………………………………………………………………………………………….
|
249
|
|
Яровой С.А.,
Солоненко А.Н. Водоросли
приморских солончаков полуострова Чонгар (Сиваш)
Yarovoy S.A.,
Solonenko A.N. Algae
of the coastal salt-marshes Chongar peninsula (Sivash)………
|
250
|
|
Ярушина М.И., Исакова Н.А. К истории изучения диатомовых водорослей Ильменского заповедника (Южный
Урал)
Yarushina M.I., Isakova N.A. To the history of
Ilmensky Reserve diatoms study (South Ural)……...
|
252
|
|
Секция 4
Использование
альгоиндикации в оценке качества
водной и наземной
среды
|
|
|
Бакаева Е.Н., Черникова Г.Г., Игнатова Н.А. Альгоиндикация и альготесты в
эколого-токсикологической оценке качества водных экосистем
Bakaeva E.N., Chernikova G.G., Ignatova N.A. Algal indication and algal tests in toxicological-ecological assessment
of water ecosystems quality……………………….………………………….
|
256
|
|
Бакулина Л.С., Самодурова Л.Е., Емельянов А.В. Видовое разнообразие
диатомовых водорослей – интегральный показатель техногенного загрязнения
Bakulina L.S., Samodurova L.E., Emeliyanov A.V. Species diversity of diatoms as
integral indice of anthropogenic contamination……………………………………………….………...........................
|
258
|
|
Баринова С.С. Интегральные методы выделения мониторинговых групп
и таксонов водорослей
Barinova S.S.
Integral methods of algal monitoring groups and taxa allocation……….…………….
|
261
|
|
Бачура Ю.М., Храмченкова О.М. Заселение почвенными водорослями отвалов фосфогипса
Bachura Y.M., Hramchenkova O.M. Colonization of
phosphogypsum dumps by soil algae………..
|
264
|
|
Воякина Е.Ю., Жаковская З.А., Мильман Б.Л., Русских Я.В, Целикова
Л.В. Сезонная динамика фитопланктона и цианотоксинов, определяемых методом жидкостной
хроматографии, тандемной масс-спектрометрии
высокого разрешения, в оз. Сестрорецкий Разлив (2008 г.)
Voyakina E.Ju., Zhakovskaja Z.A., Milman B.L., Russikh Ya.V., Tselikova L.V. Seasonal dynamics of phytoplankton and cyanotoxins detected by high performance liquid chromatography and tandem mass-spectrometry in the Sestroretskyi flood lake (2008)……....................................................
|
267
|
|
Денисов Д.Б. Водорослевые сообщества различных ландшафтов Кольского Севера в оценке
состояния водных экосистем
Denisov D.B. Algae communities from different landscapes
of the Kola North in freshwaters state monitoring………………………………………..…………………………………………………..
|
270
|
|
Дорохова М.Ф. Сообщества почвенных водорослей как индикаторы
состояния почв в районах нефтедобычи
Dorokhova M.F. Soil algae communities as indicators of soil conditions in oil
production regions…………………………………………………………………………………………………
|
272
|
|
Зимонина Н.М. К вопросу о численности, биомассе и
продукции почвенных водорослей на породных отвалах Крайнего Севера (на
примере Юньягинского угольного разреза)
Zymonina N.M. Studies of soil
algae quantity, biomass and production on mine dumps in Extreme North (case
study of Yunyaginsky coal pit)……………………………………….………………….
|
275
|
|
Каган Л.Я. Изменение сообществ диатомей Кольского полуострова в
связи с антропогенной трансформацией водных экосистем
Kagan L. Changes
of Kola Peninsula diatoms communities as a
result of water ecosystems anthropogenic transformation………………...…………………………………….………………………..
|
277
|
|
Киселёв Г.А. Оценка
степени органического загрязнения пойменных озер государственного природного
заповедника «Нургуш» (Кировская область)
Kiselev G.A. Estimation of the organic pollution degree
in floodplain lakes of the state natural reserve «Nurgush» (the Kirov Region) ………………………………………..………………………..
|
279
|
|
Ковалевская Р.З., Михеева Т.М., Лукьянова Е.В. Интегральные показатели количественного
развития фитопланктона и его фотосинтетическая активность на отрезке реки
Свислочь в границах мегаполиса
Kovalevskaya R.Z., Mikheyeva T.M., Lukyanova E.V. The integral indices of
phytoplankton quantitative development and its photosynthetic activity on the
Svisloch River section within the limits of
megalopolis……………………………………………………..……………………………………..
|
281
|
|
Ковтун О. А., Герасимюк В. П. Оценка экологического состояния солоноватоводных водоемов по
индикаторным видам водорослей (на примере Тилигульского лимана,
северо-западное Причерноморье)
Kovtun O.A., Gerasimyk V.P. Ecological
assessment of brackish water bodies state by indicate species of algae (case
study of the Tigulskiy estuary, northwest Prichernomorye)……...........................
|
284
|
|
Минеева Н.М. Продукционные характеристики фитопланктона и их
индикаторное значение
Mineeva N.M. Phytoplankton production
characteristics and their indicator significance…...............
|
287
|
|
Набатова В.А.,
Гаевский Н.А., Решеткина Н.А., Чупров С.М. Сезонные особенности развития фитопланктона водоема охладителя тепловой
станции (Березовская ГРЭС-1, Красноярский край)
Nabatova V.A., Gaevsky N.A., Reshetkina N.A., Chuprov S.V. Seasonal features of phytoplankton development in the cooler-reservoir
of the heat power station (Berezovsky SDPS-1, the Krasnoyarsk Region)………………………………………………………………………………………
|
289
|
|
Остапчук Т.В. Некоторые
результаты исследований альгофлоры воды в местах содержания морских животных
Оstapchuk T.V. Some results of water algal flora researches
in the environment of marine mammals........................................................................................................................................................
|
292
|
|
Павлова О.А., Афанасьева А.Л. Состав и сапробиологическая характеристика
фитопланктона некоторых внутригородских водоемов Санкт-Петербурга
Pavlova O.A., Afanasieva A.L. Phytoplankton structure and saprobity characteristic of some urban water-bodies
in St.-Petersburg………………………………………………………………………..
|
293
|
|
Пушина
З.В. Голоценовые диатомовые
водоросли в донных осадках озер в оазисе Бангера (Восточная
Антарктида)
Pushina Z.V. Diatoms from the Holocene lake sediment
sequences in Bunger Hills (East Antarctica)……………………………………………………………………………………………………
|
296
|
Романова О.Л.
Водоросли, достигающие
массового развития и вызывающие «цветение» воды в водоемах г. Москвы
Romanova O.L. Algae reaching mass development and causing bloom in ponds of Moscow……….
|
299
|
|
Русанов А.Г., Станиславская Е.В. Модификация диатомового индекса для оценки загрязнения
рек Ладожского бассейна
Rusanov A.G., Stanislavskaya E.V. Modification of diatoms index for assessing
stream water quality in the lake Ladoga basin…………………………...………………………………………………
|
300
|
|
Сафиуллина Л.М., Фазлутдинова А.И., Бакиева Г.Р., Гайсина Л.А. Устойчивость Eustigmatos magnus (B. Petersen) Hibberd Eustigmatophyta к воздействию хлорида калия
Safiullina L.M., Fazlutdinova A.I., Bakieva G.R., Gaysina L.A. Resistance of Eustigmatos magnus (B. Petersen) Hibberd Eustigmatophyta to
influence of potassium chloride…………………………
|
303
|
|
Серяков
С.А. Альгоиндикация состояния
водоемов-охладителей Калининской АЭС
Serjakov S.A. Algal
indication of water condition in cooling reservoirs of the Kalinin nuclear power plant……………...…………………….…………………...………………………………………….
|
305
|
|
Смирнова Л.Л., Андреева Н.А., Антонова Л.С. Стратификация морских
микроводорослей в перифитоне и донных отложениях микрокосмов под действием
мышьяка
Smyrnova L.L.,
Andreeva N.A., Antonova L.S. Stratification of the marine microalgae in periphyton and bottom
sediments of microcosms under arsenic impact………………………………………….
|
308
|
|
Снитько Л.В. К изучению
условий массового развития Cyanoprokaryota в природных экосистемах
Snitko L.V. Studying
conditions of Cyanoprokaryota mass development in natural ecosystems…….
|
311
|
|
Темралеева А.Д., Пинский Д.Л. Содержание
суммарного хлорофилла в альго-цианобактериальных сообществах при модельном
загрязнении свинцом
Temraleeva A.D., Pinsky D.L. Total chlorophyll content in
algo-cyanobacterial communities under model lead contamination………………………………………………………………......................
|
313
|
|
Филиппов А.С. Документирование материалов альгоиндикационных
исследований водоемов разного назначения
Filippov A.S. Materials documentation of algal indicative
studies of different water bodies………..
|
316
|
|
Чермных Л.П., Бабий
О.П Оценка качества среды водохранилищ Верхней Волги по состоянию сообществ
фитопланктонных организмов
Tchermnych L., Babyi
O. The Volga
River upstream
reservoirs environment water quality assessment based on phytoplankton
coenoses state…………………………………………………………
|
318
|
|
Чумачева Н. М. Почвенные
водоросли – индикаторы постпирогенных процессов
Chumacheva N.M. Soil
algae as indicators of postpyrogenic processes……………………………
|
321
|
|
Секция 5
Современные
методы и подходы к изучению
пресноводных
и почвенных водорослей
|
|
|
Анненкова Н.В., Беликов С. И., Белых О.И. Обнаружение
динофлагеллят рода Gyrodinium в фитопланктоне и
губках озера Байкал путем анализа нуклеотидных последовательностей
Annenkova N.V., Belikov S.I., Belykh O.I. Finding dinophlagellates from genus Gyrodinium in the Baikalian phytoplankton and sponges by analysis of nucleotide sequences…………………………..
|
324
|
|
Бабаназарова О.В., Кармайер Р., Сиделев С.И., Зубишина А.А.,
Рахмангулов Р.A., Александрина А.М. Анализ токсичности фитопланктона
гипертрофного оз. Неро
Babanazarova O.V., Kurmayer R., Sidelev S.I., Zubishina A.A., Rahmangulov R.A., Aleksandrina A.M. Toxic analysis of the hightrophic lake Nero phytoplankton……………………………………..
|
327
|
|
Гольдин Е.Б. Некоторые
особенности взаимоотношений цианобактерий и микроводорослей с членистоногими
Goldin E.B. Some aspects of interrelations between
Cyanobacteria and microalgae and arthropods…………………………………………………………………………………………………….
|
329
|
|
Девяткин В.Г. Анализ структуры сообществ водорослей
Devyatkin V.G. Analysis of the algal communities structure………………………………………….
|
331
|
|
Дзюбенко В.С., Ладыгин В.Г., Шегай И.Д. Спектральные
свойства и термоустойчивость нативных светрсобирающих комплексов I и II в клетках мутантов Chlamydomonas reinhardtii
Dzyubenko V.S., Ladygin V.G., Shegay I.D. Spectral characteristics and termostability
of native light-harvesting complexes I and II in cells of mutants Chlamydomonas reinhardtii…………………
|
334
|
|
Иванова Н. А.
Шарипова Л. А. Особенности
производственного гидробиологического анализа в МУП г. Ижевска «Ижводоканал»
Ivanova N.A., Sharipova L.A. Features of hydrobiologycal
analysis in the water supply structure “Izhvodokanal” of Izhevsk town…………………………………………………………....................
|
336
|
|
Кабиров Р.Р. О
возможности использования водорослей при создании искусственных экосистем и
биосфер на других планетах
Kabirov R.R. About possible using algae for creation of
artificial ecosystems and biospheres on the other planets……………………………………………………………………………………………
|
338
|
|
Кравцова Г.В., Калинина С.Г. Изменение структуры планктонного
альгоценоза при внесении в среду зеленых микроводорослей р. Chlorella
Kravsova G.V., Kalinina S.G. Changes of planktonic algal coenosis
structure during inclusion of green algae from genus Chlorella……………………………………………………………………...
|
340
|
|
Ладыгин В. Г. Структурно-функциональная организация нативных
комплексов фотосистем у мутантов зеленой водоросли Chlamydomonas reinhardtii
Ladygin V. G. Structural-functional organization of photosystems chloroplast native
complexes in the mutants of green alga Chlamydomonas
reinhardtii……………………………………………….
|
343
|
|
Новаковкий А.Б., Новаковская И.В. Использование современных методов математической обработки данных в
альгологических исследованиях (на примере анализа альгогруппировок еловых
лесов)
Novakovsky A.B., Novakovskaya I.V. The modern mathematical methods for
algological data analysis (by the example of spruce forest soil algae
communities)…………………………………………
|
344
|
|
Орлеанский В.К., Колотилова Н.Н., Жегалло Е.А., Тембрел Е.И., Карпов Г.А., Брянская А.В. Морфологические структуры осцилляториевых водорослей Cyanophyta (Cyanoprokaryota). Полевые
и лабораторные наблюдения
Orleansky V.K., Kolotilova N.N., Zhegallo E.A., Tembrel E.I., Karpov G.A., Bryanskaya A.V. Morphological structures of Oscillatoriales algae Cyanophyta
(Cyanoprokaryota, Cyanobacteria). Natural and laboratory
observations…………………………………………………………………..
|
346
|
|
Разумовский Л.В. Оценка трансформации пресноводных экосистем по
структуре диатомовых комплексов
Razumovskiy L.V. Assessment of transformation in freshwater ecosystems by diatom
assamblages structure………………………………………………………………………………………………..
|
351
|
|
Семенова Г. А., Ладыгин В. Г. Мутагенез в изучении формирования
мембранной системы хлоропласта у зеленой водоросли Chlamydomonas reinhardtii
Semenova G. A., Ladygin V. G. Mutagenesis in studying formation
of green alga Chlamydomonas reinhardtii
chloroplast membrane system……………………….............……………………………
|
254
|
|
Сигарёва Л.Е. Современные
методы изучения содержания растительных пигментов в водоемах
Sigareva L.E. Modern methods of studies of
plant pigments in water bodies……………..………….
|
355
|
|
Сысова Е.А. Начальная стадия колонизации
субстрата фитоперифитоном: эксперимент и моделирование
Sysova E.A. Initial stage of phytoperiphyton’s substrate
colonization: experiment and simulation…..
|
257
|
|
Танковская И.Н., Евстигнеева И.К. Макроперифитон акваторий, перспективных
для организации береговых биотехнических комплексов
Tankovskaya I.N., Evstigneeva I.K. Macrophytoperiphyton of water areas,
perspective for the organization of coastal biotechnical complexes…………………………………………..……………...
|
360
|
Вступительное
слово
В электронной
публикации представлены материалы II Всероссийской научно-практической конференции «Водоросли:
проблемы таксономии, экологии и использование в мониторинге», которая состоится
в Институте биологии Коми Научного центра Уральского отделения РАН (Сыктывкар, 5-9
октября 2009 г.). Конференция проводится по решению Всероссийской
научно-практической конференции "Альгологические исследования: современное
состояние и перспективы на будущее" (Уфа, 16-18 ноября 2006 г., БашГПУ). Основной
целью она ставит ознакомление с современными подходами и методами в области изучения
таксономии, разнообразия, генетики и
экологии водорослей.
Всего представлено 139 материалов докладов.
Работы прислали ученые из 80 научно-исследовательских институтов и университетов
России, Белоруссии, Грузии, Израиля, Украины и Литвы, соавторами работ являются
также ученые Австралии, Германии, США, ЮАР.
В них представлены результаты научных исследований, поддержанных
грантами Министерства образования и науки Российской Федерации, Российского
фонда фундаментальных исследований,
Программами Президиума РАН, Фонда содействия отечественной науке, Аналитической
ведомственной целевой программы «Развитие научного потенциала высшей школы
(2009-2010 гг.)», ИОП по направлению «Живые системы», Белорусским республиканским
фондом фундаментальных исследований и другими.
Материалы
расположены согласно рубрикации, которая отвечает структуре секций по
направлениям работы конференции.
1.
Современная таксономия водорослей (морфологические,
функциональные, молекулярно-генетические аспекты).
2.
Разнообразие, экология и география водорослей.
Структура и функционирование альгоценозов.
3.
Флоры водорослей. Редкие виды и малоизученные группы.
4.
Использование альгоиндикации в оценке качества водной и
наземной среды.
5.
Современные методы и подходы к изучению пресноводных и
почвенных водорослей.
В секциях материалы докладов
расположены в алфавитном порядке.
Материалы
публикуются в авторской редакции.
Доклады, заслушанные
на конференции и отобранные оргкомитетом,
планируется издать после ее проведения в
виде монографии «Водоросли: проблемы таксономии, экологии и
использование в мониторинге» (Изд-во: «Наука», Екатеринбург, 2010).
Надеемся, что
данная конференция станет регулярной и будет способствовать обсуждению новых направлений
исследований и обмену опытом в различных областях изучения водорослей.
Оргкомитет
конференции
Секция 1
Современная
таксономия водорослей (морфологические,
функциональные,
молекулярно-генетические аспекты)
Принципы классификации пиреноидов у зеленых
монад
Болдина О.Н.
Classification
PRINCIPLES of pyrenoids in green monads
Boldina O.N.
Учреждение Российской академии наук Ботанический институт им. В. Л.
Комарова РАН
Санкт-Петербург, 197376, ул. проф. Попова д. 2
тел. 8(812)346-44-28; факс 8(812) 346-37-44
e-mail: olgab1999@mail.ru
В
клетках водорослей пиреноид является
заметной структурой. У зеленых монад наличие или отсутствие пиреноида в
хлоропласте – таксономический признак в ранге рода. Различия в строении
пиреноидов на светооптическом уровне позволили альгологам создать первые
классификации, предложенные Geitler (1926), Pascher (1927), Chaedefaud
(1941), Ettl (1976) и др. Применение трансмиссионной электронной
микроскопии у представителей различных родов Chlorophyta позволило выявить тонкое строение основных компонентов пиреноида: крахмальной обкладки, стромы и, в особенности, проникающих в
строму тилакоидов. Данные о тонком строении пиреноидов опубликованы (Hori, Ueda, 1967; Gibbs, 1972; Dodge,1973; Griffith, 1980) и на их основе
предложены классификации (Hori, Ueda, 1967; Gibbs, 1972;
Lokhorst, 1985; Friedl, 1989; Nozaki
et al.1994 и
др.).
В основу нашей классификации были положены следующие
признаки:
1.
Обкладка. Признак не основной, но важный. Учитывается степень ее
расчлененности. Она может быть сплошной (охватывать тело пиреноида равномерно,
подобно кожуре апельсина) или расчлененной, фрагментированной. Фрагменты обкладки
могут быть в виде небольшого числа довольно
крупных пластинок, более мелких пластинок, но в большем количестве
покрывающих тело (строму) пиреноида, или даже совсем мелких зерен.
2.
Строма (тело) пиреноида. Учитывается
степень ее цельности: цельная или разделенная на части.
3.
Строение тилакоидов внутри пиреноида. Тилакоидая система пиреноидов была
выявлена только с помощью электронного микроскопа и оказалась наиболее
разнообразной. Учитывается а) форма, б) число в пачке, в)
расположение пачек в строме. При входе в тело пиреноида тилакоиды могут изменять
свою форму за счет расширения внутритилакоидного пространства и становиться трубчатыми,
а на поперечных сечениях округлым, или оставаться без существенных изменений,
плоскими, уплощенными. Число тилакоидов, входящих в строму пиреноида,
как правило, является стабильным признаком. Оно формируется после процесса
редукции в пачке на уровне ее вхождения в строму. Итогом этой редукции являются
пачки из одного, двух, трех, а реже большего числа тилакоидов. Причем в пачках
тилакоидов, образующих трубки, процесс редукции может продолжаться и внутри
стромы. Расположение пачек тилакоидов в строме, может быть хаотичным и более
или менее упорядоченным. Но эта особенность учитывается нами в меньшей степени,
как и число самих пачек в строме.
Вышеописанные признаки легли в основу предложенной
нами классификации 5 типов пиреноидов (Константинова, Болдина, 2000),
дополненной впоследствии 6 типом пиреноида (Болдина, 2008).
Результаты исследования ультраструктуры клеток 53
штаммов зеленых монад, преимущественно представителей рода Сhlamydomonas, представлены в
прилагаемой ниже таблице.
Таблица
Типы пиреноидов у исследованных видов Chlamydomonas
|
Группа
|
Штамм
|
Вид
|
Синоним
|
Тип
пиреноида
|
|
Euchlamydomonas
|
SAG 5.73
|
C. augusta Skuja
|
-
|
IV
|
|
SAG 26.86
|
C. augusta
|
|
IV*
|
|
SAG 14.72
|
C. debaryana Goroschankin var. debaryana
|
-
|
IV
|
|
SAG 15.72
|
C. debaryana var. cristata Ettl
|
-
|
IV
|
|
SAG 11-1
|
C. debaryana
|
C. agloeformis Pascher
|
IV
|
|
SAG 26.72
|
C. debaryana
|
C. komma
Skuja
|
IV
|
|
SAG 4.72
|
C. debaryana
|
|
IV
|
|
SAG 11-56A
|
C. debaryana
|
|
IV
|
|
SAG 11-56B
|
C. debaryana
|
|
IV
|
|
SAG 69.72
|
C. gelatinosa Korsch.
|
Sphaerellopsis aulata ?
|
IV
|
|
SAG 11.72
|
C. nasuta Korsch.
|
C. proboscigera var. conferta (Korsch.)Ettl
|
III*
|
|
SAG 2.73
|
C. parallelistriata Korsch.
|
|
IV
|
|
CCAP 11/82
|
C. pseudomacrostigma Peterfi
|
|
III
|
|
SAG 73.72
|
C. reinhardtii Dang.
|
|
IV
|
|
PGC CC-124
|
C. reinhardtii
|
|
IV
|
|
PGC CC-125
|
C .reinhardtii
|
|
IV
|
|
PGC mut14
|
C. reinhardtii
|
|
IV
|
|
PGC mut 7
|
C. reinhardtii
|
|
IV
|
|
CALU 61
|
C. reinhardtii
|
-
|
IV
|
|
CALU 87
|
C. reinhardtii
|
|
IV
|
|
SAG 25.72
|
C. sphaeroides Gerloff
|
-
|
IV
|
|
GALU 449
|
C. zebra Korsch. ex Pascher
|
|
IV
|
|
Chlamydella
|
SAG 64.72
|
C. culleus Ettl
|
C. elliptica
var.britannica Fritsch et John
|
III
|
|
SAG 65.72
|
C. culleus
|
|
III
|
|
SAG 19.73
|
C. noctigama Korsch.
|
|
V
|
|
SAG 22.72
|
C. noctigama
|
|
V
|
|
SAG 23.87
|
C. noctigama
|
|
V
|
|
SAG 30.90
|
C. noctigama
|
|
V
|
|
SAG 35.72
|
C. noctigama Korsch.
|
|
V
|
|
SAG 36.72
|
C. noctigama var. ellipsoidea Ettl
|
|
V
|
|
SAG 38.72
|
C. peterfii Gerloff
|
Heterochlamydomonas lobata
|
IV
|
|
LABIK 46-8-7
|
C. planoconvexa Lund
|
|
V
|
|
CALU 228
|
C. moewusii Gerloff
|
C. eugametos
Moewus
|
III
|
|
Chlorogoniella
|
SAG 11-9
|
C. applanata Pringsheim
|
|
II*
|
|
SAG 11.41
|
C. asymmetrica Korsch.
|
|
IV
|
|
CCAP 11/41
|
C. asymmetrica Korsch.
|
|
IV
|
|
SAG 12.83
|
C. asymmetrica Kosch.
|
|
IV
|
|
SAG 11-7
|
C. asymmetrica Kosch.
|
|
IV
|
|
SAG 123-80
|
C. badensis Moewus
|
|
III
|
|
SAG 12.96
|
C. chlorococcoides Ettl
|
|
VI
|
|
SAG 15.82
|
C. chlorococcoides Ettl
|
|
VI
|
|
SAG 12-4
|
C. gloeophila var. irregularis Ettl
|
|
I
|
|
SAG 12-5
|
C. gloeophila var. irregularis Ettl
|
|
I
|
|
SAG 27.72
|
C. minutissima Korsch.
|
-
|
IV
|
|
SAG 28.72
|
C. minutissima Korsch.
|
-
|
IV
|
|
SAG 37.72
|
C. oblonga Pringsheim
|
C. minuta
Pringsheim
|
IV
|
|
SAG 41.72
|
C. proteus Pringsheim
|
-
|
IV
|
|
SAG 2.79
|
C. pitschmannii Ettl
|
|
III
|
|
|
SAG 14.73
|
C. pitschmannii Ettl
|
|
0
|
|
Amphichloris
|
SAG 42.72
|
C. pseudopertusa Ettl
|
|
III
|
|
Pseudagloe
|
SAG 34.72
|
C. mutabilis Gerloff
|
-
|
II
|
|
Agloe
|
SAG 47.72
|
C. radiata Deason et Bold
|
-
|
II
|
|
SAG 11-53
|
C. philotes Lewin
|
-
|
III
|
|
Pleiochloris
|
SAG 46.72
|
C. carrizoensis Deason et Bold
|
C. chlorococcoides Ettl et Schwartz
|
II
|
|
Sphaerella
|
SAG 29.83
|
Chloromonas clathrata Korsch.
|
C. yellowstoniensis Kohl
|
0
|
Следует отметить, что штаммы, принадлежащие к одному
виду хламидомонад, в каждом случае имеют пиреноиды, не только одного типа, но
более того, идентичные по своему строению. Исключение составляет только штамм
14.73 SAG C. pitschmannii, у которого пиреноид вообще отсутствует. И соответственно этот штамм,
также как и исследованный нами ранее штамм 29.83 SAG (Болдина, 1998), следует отнести к виду рода Сhloromonas. различия в типах пиреноидов позволило нам настаивать
нам на самостоятельности видов C.
carrizoensis и C. chlorococcoides (Болдина,
2008), которые согласно каталогу коллекции UTEX (www.utex.org) предлагалось объединить. Следовательно тип пиреноида можно использовать
для уточнения таксономической (видовой и родовой принадлежности того или иного
штамма.
С развитием методом молекулярной биологии и появлением
многочисленных кладограмм, построенных на основе рибосомальных генов,
содержащих различные виды зеленых
водорослей, представилась возможность оценить расположение типов пиреноидов в
кладах (Proeschold et al., 2001; Nozaki et al., 2002; Pocock et al., 2004). Проанализировав
имеющуюся литературу со сведениями о тонкой организации клеток других родов Chlorophyta, мы смогли
выполнить сопоставление типов пиреноидов у этих объектов с нашими данными, полученными
для Chlamydomonas. Оказалось,
что виды, имеющие один и тот же тип пиреноида, часто образуют общие клады. Таким
образом, тип пиреноида может косвенно указывать на родственные связи субъектов
клады. При этом виды в пределах клады могут относиться к разным родам и даже
семействам. Однако, поскольку разные клады могут содержать разное количество
штаммов водорослей с одинаковым типом пиреноида, следует располагать
достаточным по объему материалом для оценки объема каждого из видов.
Таким
образом, руководствуясь выбранной нами техникой классификации пиреноидов, мы
смогли решить некоторые вопросы спорного таксономического положения видов у
хламидомонады и предложить дополнительный критерий для идентификации видов у
зеленых монад.
Золотистые
водоросли в экосистеме северных широт:
новые
подходы к изучению биоразнообразия
Волошко Л.Н.
Golden algae in high latitude ecosystem: new
approaches of biodiversity studies
Voloshko L.N.
Ботанический
институт им. В.Л. Комарова РАН, г. Санкт-Петербург, Россия
e-mail: L.Voloshko@inbox.ru
Золотистые водоросли – широко распространенная группа преимущественно
пресноводных организмов. Они характеризуются неравными жгутиками, наличием в
составе пигментов хлорофиллов а и с, а из каротиноидов – фукоксантина, придающего
хлоропластам желто-коричневую окраску, и эндогенными кремниевыми цистами.
Золотистые водоросли изучаются более 200 лет и широко известно, что
экологическая значимость их в пресноводных водоемах велика. Однако до настоящего
времени идентификация этих микроскопических объектов затруднена, в результате
видовой состав их во многих пресноводных водоемах остается неизученным. Слишком
мало достоверных таксономических признаков на уровне световой микроскопии для
оценки их биоразнообразия. С начала активного использования методов электронной
микроскопии была описана тонкая структура кремниевых покровов (чешуек и
щетинок) многих видов золотистых водорослей. Стандартным инструментом для
изучения кремниевых структур стал электронный микроскоп (ЭМ). Кремниевые
структуры имеют свыше 300 видов (из 1200) золотистых водорослей из сем. Paraphysomonadaceae
(класс Chrysophyceae) и все виды класса Synurophyceae (Kristiansen,
2005).
В течение 2002-2007 гг. в водоемах Большеземельской тундры и Полярного
Урала нами был проведен мониторинг золотистых водорослей с использованием ЭМ (Siver, Voloshko
et al.,
2005; Voloshko, 2008). Впервые в водоемах этой экосистемы выявлена
разнообразная и обильная флора золотистых водорослей, что указывает на исключительную
важность этих водорослей в Арктическом регионе в противовес существовавшему
мнению об их исчезновении в условиях Крайнего Севера (Siver, 2002). Высокое разнообразие золотистых водорослей
можно объяснить физиологическими особенностями золотистых и специфическими
условиями их существования в этом регионе. В олиготрофных условиях сложились
благоприятные условия для развития этой группы водорослей: температура воды и
рН, близкие к оптимальным величинам, низкая электропроводность и трофность водоемов,
а также отсутствие конкурентных отношений со стороны синезеленых водорослей.
Способность к миксотрофному питанию дает золотистым водорослям преимущество в
олиготрофных водоемах. Золотистые водоросли являются чувствительными
индикаторами условий окружающей среды (Волошко, 2008). В естественных условиях
с увеличением техногенной нагрузки в водоемах происходит смена доминирующих
видов и обеднение биоценозов золотистых водорослей, до полного их исчезновения.
Морфологические изменения кремниевых структур у золотистых водорослей с панцирем
могут быть использованы при биоиндикации условий окружающей среды и при проведении токсикологических
экспериментов. Результаты токсикологических экспериментов с охромонадами
при биотестировании загрязненных вод с использованием охромонад обсуждаются.
Понятие вида и внутривидовых
категорий
в современной альгологии
Гайсина Л.А.
Башкирский государственный педагогический университет им. М. Акмуллы,
кафедра ботаники, биоэкологии и ландшафтного проектирования
450000, Уфа, ул. Октябрьской революции, 3а
Species and intraspecific categories conceptions
in modern phycology
Gaysina L.A.
Bashkir state
pedagogical university named after M. Akmullah,
Department of Botany,
Bioecolgy and Landscape Design
450000, Ufa, ul. Oktyabrskoy
revoluccii, 3a
e-mail: lira.gaisina@mail.ru
Понятие вида является одной из основных категорий
современной биологии. Так называемая «проблема вида» особенно актуальна
сейчас, в эпоху глобального экологического кризиса. Без четкого определения
того, что же мы понимаем под словом «вид», невозможно оценить число видов живых
организмов и выстроить эффективную систему охраны окружающей среды.
Концепции вида являются своеобразными моделями,
объясняющими, каким образом эволюционные процессы реализуются в различных
условиях (Winston, 1999). В настоящее время
насчитывается большое количество концепций вида, однако наиболее
распространенными являются биологическая, филогенетическая, эволюционная и
экотипическая концепции.
Использование понятия вида у водорослей сопряжено с
определенными сложностями. Это связано с тем, что водоросли представляют собой
«искусственную группу низших автотрофных растений» (Паламарь-Мордвинцева, Царенко,
2007, с. 421). Многие группы водорослей характеризуются отсутствием полового процесса. В связи с
этим, на наш взгляд, использование биологической концепции вида (Dobzhansky, 1951; Mayr, 1957),
которая долгое время была доминирующей в биологии, в отношении водорослей, не
совсем корректно. Один из авторов этой концепции Э. Майр (Mayr, 2000) подчеркивал, что биологическая концепция вида
неприменима к бесполым организмам. Также проблематично и использование эволюционной
концепции, так как она в качестве основного критерия для разграничения видов
использует токогению (tokogeny) и
репродуктивное единство (сплоченность, связь) (cohesion) (Wiley, Mayden, 2000). Эту точку зрения разделяют Д. Джохансен и Д.
Касаматта (Johansen, Casamatta, 2005). Они предлагают использовать филогенетическую
концепцию В. Мишлера и Э. Териота (Mishler, Theriot, 2000) для цианобактерий при наличии молекулярно-генетических
данных, и экотипическую концепцию (Cohan,
2001), если есть сведения только о морфологии и экологии видов. Э. Териот (Theriot, 1992) использовал филогенетическую концепцию для
изучения вида Stephanodiscus niagarae (Bacillariophyta).
Существуют определенные сложности с использованием у
водорослей внутривидовых категорий. Согласно ICBN, различают 5 внутривидовые категории растений:
подвид, разновидность, субразновидность, форму и субформу. Обычно используются
только три понятия – подвид, разновидность и форма (Winston, 1999). Все эти категории определяются с
использованием понятия «популяция».
Термин «популяция» обсуждался в работах Э. Майра
(1968, 1974), К.М. Завадского (1968) и ряде других. Наибольшей популярностью
пользуется определение популяции, данное Н.В. Тимофеевым-Ресовским с соавторами
(1977): популяцией является совокупность особей определенного вида, в течение
достаточно длительного времени населяющих определенное пространство, внутри
которого осуществляется та или иная степень панмиксии, нет заметных
изоляционных барьеров и которая отделена от соседних таких же совокупностей
особей данного вида.
Возникает вопрос: насколько оправдано использование понятия
«популяция» для организмов, размножающихся преимущественно вегетативно? В этом
вопросе нет полной ясности. Э. Майр утверждает, что бесполые организмы
существуют в виде клонов, а не популяций (Mayr, 2000). В. Мишлер и Э. Териот (Mishler, Theriot, 2000)
считают, что между организмами с половым и бесполым размножением нет резких
отличий. Организмы можно расположить в порядке увеличения частоты полового
размножения от агамных до панмиктичных.
Даже один случай половой рекомбинации на миллион бесполых поколений не
приведет к резкому изменению статуса вида.
Существует и другая проблема, связанная с
методическими аспектами изучения микроскопических водорослей. Для проведения
таксономических исследований водорослей необходимо получение альгологически
чистых культур. Эта процедура предполагает, что будет изолировано несколько (а
иногда и одна) клетка, которая затем будет выращиваться в лабораторных
условиях. Таким образом, многие культуры водорослей представляют собой клоны.
Если эти клоны будут иметь достаточно четкие морфологические отличия от
существующих видов, то они могут быть описаны как новые виды. Конечно,
морфологические данные можно подтвердить или опровергнуть с помощью молекулярно-генетических
методов. Но не нужно забывать, что это возможно только в случае, если имеются
сиквенсы близкородственных видов. Кроме того, эти методы не являются
общедоступными. Таким образом, для микроскопических водорослей возможны
ситуации, когда вид представлен многими поколениями одного единственного организма.
Поэтому совершенно справедливо замечание Г.М.
Паламарь-Мордвинцевой и П.М. Царенко (2007) о том, что следует избегать
описания новых видов на основании одного клона или единственного экземпляра.
Очевидно, что проблема вида и внутривидовых
совокупностей водорослей требует дальнейших исследований и широкого
обсуждения этой проблемы специалистами, изучающими разные систематические
группы. Для оценки реального числа видов водорослей в природе необходимо остановиться
на одной концепции или выработать единую унифицированную методику, которую
можно будет использовать при описании новых видов или ревизии известных таксономических
групп.
Список литературы
Завадский К.М. Вид и видообразование. Л.: Наука, 1968.
179 с.
Майр Э. Зоологический вид и эволюция. М.: Мир, 1968. 598 с.
Майр Э. Популяции, виды и эволюция. М.: Мир,1974. 460 с.
Паламарь-Мордвинцева Г.М., Царенко П.М. Концепция вида
и современные задачи систематики водорослей // Альгология. Т.17. № 4. С.
421-449.
Тимофеев-Ресовский Н.В., Воронцов Н.Н., Яблоков А.В.
Краткий очерк теории эволюции. М., 1977. 297 с.
Cohan F.M.
Bacterial species and speciation // Syst. Biol. 2001. V.50. P. 513-524.
Dobzhansky T.
Genetics of the origin of species, third edition. Columbia
University Press, New York. 1951. 364p.
Johansen J.R., Casamatta D.A. Recognition
cyanobacterial diversity through adoption of e new species paradigm //
Algological Studies. V.117. P.71-93.
Mayr E. Species
concept and definitions // Mayr E. The species problem. American Association
for the Advancement of Science, Publ. Washington,
D.C. 22 p.
Mayr E. The
Biological Species Concept // Species concepts and phylogenetic theory: a
debate / edited by Q.D.Wheeler and R.Meier. Columbia
University Press, New York. 2000. P.17-29
Mishler B.D.,
Theriot E.C. The Phylogenetic Species Concept
(sensu Mishler and Theriot):
Monophyly, Apomorphy, and Phylogenetic Species Concepts // Species concepts and
phylogenetic theory: a debate / edited by Q.D. Wheeler and R. Meier. Columbia University
Press, New York.
2000. P.31-44.
Theriot E.
Clusters, species concept, and morphological evolution of diatoms // Systematic
Biology. 1992. V.41. P. 141-157.
Wiley E.O., Mayden
R.L. The Evolutionary Species Concept // Species concepts and phylogenetic
theory: a debate / edited by Q.D. Wheeler and R. Meier. New
York: Columbia
University Press. 2000.
P.70-92.
Winston J.E.
Practical taxonomy procedure for biologist. New York:
Columbia University Press. 1999. 518p.
Проблемы систематики конъюгат
(Zygnematophyceae, Streptophyta)
с точки зрения
молекулярно-филогенетических данных
Гончаров А. A.
Problems
of the conjugates (Zygnematophyceae, Streptophyta) taxonomy with a view to the
molecular-phylogenetic data
Gontcharov A. A.
Биолого-почвенный институт ДВО РАН
690022, Владивосток-22, факс: 4232-310-193
e-mail: gontcharov@biosoil.ru
Конъюгаты - коккоидные, нитчатые и колониальные водоросли,
отличительными признаками которых являются: уникальный тип полового размножения
– конъюгация и полное отсутствие подвижных репродуктивных стадий и центросом на
протяжении всего жизненного цикла. Традиционно
классификационные схемы Zygnematophyceae
были основаны на фенотипических признаках, таких как особенности
ультраструктуры клеточной стенки, тип организации таллома и морфология хлоропластов.
В составе класса выделяют два порядка: Zygnematales и Desmidiales (Mix, 1972). Zygnematales
характеризуется просто устроенной, цельной (не разделенной на фрагменты)
гладкой, не имеющей пор клеточной стенкой. Порядок разделяют на два семейства,
различающиеся только типом организации (Zygnemataceae и Mesotaeniaceae). Порядок Desmidiales
характеризуется орнаментированной клеточной стенкой, разделенной на два или
более частей, и имеющей поры (Mix, 1972). На
основании морфологии клетки, типа организации и особенностей строения клеточной
стенки в порядке выделяют четыре семейства: Peniaceae, Gonatozygaceae, Closteriaceae и Desmidiaceae. Большинство родов и видов конъюгат были описаны
преимущественно на основании признаков организации таллома (нитчатые или
одноклеточные), симметрии клетки, ее размеров и формы, наличия утолщений,
выростов или шипов на клеточной оболочке и морфологии хлоропластов. Стабильность
этих признаков и их эволюционный статус (плезиоморфный или апоморфный) никогда
серьезно не оценивался. За более чем 200-летнюю
историю изучения конъюгат было описано более 4000 видов, которые в настоящее
время классифицируются в примерно 60 родах. Родственные связи между семействами,
родами и видами зигнемофициевых, а также концепция рода в классе остаются
противоречивыми.
В последние два десятилетия развитие молекулярно-филогенетических
исследований существенно изменило наше представление о взаимоотношениях между
организмами на разных таксономических уровнях, поставило под сомнение многие
традиционные гипотезы эволюции живого и оказало огромное влияние на
систематику, в том числе и у конъюгат. Результаты сравнения последовательностей
белков и генов поставили под сомнение естественность многих таксонов в классе Zygnematophyceae, монофилию самого класса, а так же его
положение в Streptophyta.
Ранние ультраструктурные и биохимические исследования
установили, что Zygnematophyceae является одной из продвинутых групп стрептофитных водорослей,
однако точное положение класса в отделе оставалось под вопросом. На филогенетическом древе Streptophyta, основанном на
совместном анализе четырех генов из трех геномов конъюгаты помещались после Mesostigma, Chlorokybus
и Klebsormidium, но до Coleochaete и Chara, которая явилась
сестринской группой наземных растений (Karol et al., 2001). В целом, близость Chara к наземным растениям хорошо согласуется с традиционной
гипотезой о направлении эволюции фенотипических признаков у водорослей (Graham, 1993, 1996; Lewis, McCourt, 2004; McCourt et al., 2004). Однако последующие
анализы 16S и 23S рДНК поставили под сомнение сестринство Charales и наземных растений (Turmel et al., 2002). Еще больше путаницы в ситуацию внесли
результаты совместного анализа 76 хлоропластных генов, согласно которым не Charales, а конъюгаты являются наиболее продвинутой группой
среди стрептофитных водорослей. Столь неожиданное положение Zygnematophyceae на древе было поддержано не только высокими
значениями бутстрепа, но и порядком расположения генов в хлоропластном геноме,
его генным и интронным составом и синапоморфными инделями (вставками и
делециями) в кодирующих регионах (Turmel et al., 2005, 2007; Adam et al., 2007). Большой набор данных, репрезентативность
выборки и совершенные методы анализа не позволяют усомниться в результатах
данных исследований, однако их практически невозможно объяснить с позиции
традиционных взглядов на ход эволюции в Streptophyta. Coleochaete
и Chara имеют более сложную, чем у конъюгат структуру таллома,
механизм деления клетки, и обладают другими фенотипическими признаками, общими
с наземными растениями (McCourt
et al.,
2004). Можно ожидать, что сестринские отношения между эмбриофитами и
конъюгатами будут подвергнуты проверке другими генами и наборами данных, однако
вовсе не обязательно, что ответ на интригующий вопрос о том, какая же группа
была предком наземных растений, будет получен в ближайшее время.
Зеленые конъюгирующие водоросли всегда считались
естественной, четко ограниченной группой, монофилитичность которой была
подтверждена в первых исследованиях молекулярными методами. Однако позже было
установлено, что один из родов: Spirotaenia – может иметь лишь дальнее родство с
остальными конъюгатами или даже происходить от иного предка (Gontcharov, Melkonian, 2004; Гончаров, 2005). В анализах 18S рДНК и rbcL последовательностей виды Spirotaenia не проявляли близости с остальными Zygnematophyceae, а формировали высокоустойчивую кладу с родом
Chlorokybus (Gontcharov, Melkonian, 2004). Удаленность Spirotaenia от клады класса была поддержана высокими
значениями бутстрепа, а также фактом отсутствия 1506 интрона I группы, характерного для конъюгат, в 18S рДНК всех изученных видов Spirotaenia. В анализах матриц данных, не включавших Chlorokybus, Spirotaenia помещалась в качестве сестринской группы Zygnematopyceae, однако без поддержки короткой общей
ветви (Gontcharov, Melkonian, 2004). Таким образом, вопрос о том,
является ли Spirotaenia первой ветвью древа конъюгат, независимой группой в составе Streptophyta или же сестринской кладой Chlorokybus, остается открытым.
Синапоморфный признак класса: половое размножение в форме конъюгации –
описан у нескольких видов Spirotaenia,
однако у них она отличается от типичной для остальных зигнематофициевых тем,
что проходит без образования конъюгационного канала или слизистой обвертки.
Вместо этого, у Spirotaenia освобождение гамет
происходит путем полного ослизнение клеточной стенки. Еще одной особенностью
полового размножения в этом роде является образование в клетке двух гамет (Hoshaw, Hilton, 1966; Biebel, 1975; Haga, Ehara, 1977). Вполне возможно, что описанные выше
особенности отражают различия в тонкой механике полового процесса между двумя
эволюционными линиями конъюгат и могут объяснять глубокую дивергенцию между Zygnematophyceae и Spirotaenia.
Особенности деления клетки в роде Spirotaenia остаются практически не изученными и столь же мало известно об
ультраструктуре клеточной стенки у его представителей. Можно ожидать, что исследования
в этом направлении обнаружат неизвестные ранее особенности, отличающие этот
своеобразный род от остальных конъюгат.
Уже первые молекулярно-филогенетические исследования
показали, что порядок Zygnematales не является монофилетичным таксоном (McCourt et al., 2000; Gontcharov et al., 2003; Hall et al., 2008a). Более того, молекулярные данные не
подтвердили монофилетичность семейств Zygnemataceae и Mesotaeniaceae этого порядка, смешав их представителей в
нескольких кладах, а представители мезотениевых Netrium и Roya обнаружили близости к пор. Desmidiales. Зигнемовые водоросли (как нитчатые, так и
одноклеточные) до сих пор были представлены в анализах ограниченным числом
видов, поэтому филогенетическая структура этой группы остается лишь
предварительной. В настоящее время определено семь клад, слагаемых видами из
пор. Zygnematales: Roya, Planotaenium, Nucleotaenium, Netrium, Spirogyra, клада ‘‘Zygnemataceae s. str.’’, включающая большинство видов порядка
(см. ниже), и Mesotaenium 1 (Gontcharov et al., 2004; Hall et al., 2008a; Gontcharov, Melkonian, в печати).
Картина родственных отношений, вскрытая в Zygnematales, указывает на то, что в систематике
порядка слишком большое значение придавалось типу организации таллома
(коккоидный или нитчатый) и морфологии хлоропласта (лентовидно-пристенные,
звездообразные и ламинатные) на родовом, а в некоторых случаях и на видовом
уровнях. Считалось, что общая для некоторых родов одноклеточных и нитчатых
зигнемовых морфология хлоропластов предполагает их возможное происхождение от
одного предка (Palla,
1894; Randhawa, 1959; Yamagishi, 1963), и эта гипотеза была частично
поддержана результатами первых молекулярно-филогенетических исследований (McCourt et al., 1995; 2000). Однако при анализе большего
числа видов стало очевидным, что хлоропласты различной морфологии, как и одноклеточность
или многоклеточность, встречаются в нескольких независимых кладах Zygnematales, предполагая многократное независимое
возникновение этих признаков в группе (Gontcharov et al., 2003, 2004 Gontcharov, Melkonian, 2004). Необходимо отметить, что особенности
морфологии хлоропластов слабо изучены в пор. Zygnematales, и в целом в классе Zygnematophyceae, поэтому нельзя исключать, что
хлоропласты, относимые к одному морфологическому типу, могут отличаться своей
тонкой организацией. Полифилетичная природа родов зигнемовых, основанных на
признаках морфологии хлоропластов (Cylindrocystis, Mesotaenium и Netrium), может свидетельствовать в пользу данного
предположения.
Очевидно, что дальнейшие филогенетические исследования требуются для
того, чтобы привести таксономическую структуру традиционного порядка Zygnematales в соответствие с родством слагающих его видов. Однако
уже сейчас можно сделать предварительное заключение о составе и структуре
семейства Zygnemataceae. Учитывая, что его
типовой род Zygnema входит в кладу ‘‘Zygnemataceae s. str.’’, можно именно ее рассматривать как основу семейства.
Вероятно, эта клада и семейство будут включать все роды нитчатых зигнемовых, за
исключением Spirogyra, и большинство
одноклеточных форм, за исключением Roya,
Netrium s. l. и, возможно, клады Mesotaenium 1 (McCourt et al., 2000; Gontcharov et al., 2003; 2004; Hall et al., 2008a). В этом случае диагноз семейства Zygnemataceae необходимо будет изменить для того, чтобы он
охватывал и одноклеточных представителей и, в то же время, позволял отграничивать
членов семейства от таксонов, имеющих близкую морфологию, но не проявляющих
близости к Zygnemataceae. Маловероятно, что
какие-либо из известных в настоящее время признаков ультраструктуры клеточной
стенки и морфологии клетки или хлоропластов могут служить этим целям.
В отличии от пор. Zygnematales, монофилия Desmidiales получила высокую поддержку в большинстве
филогенетических анализов (Denboh et al., 2001; Gontcharov et al., 2003, 2004). Молекулярные данные подтвердили монофилию
семейств Gonatozygaceae и Closteriaceae из этого порядка, но поставили под сомнение независимость Peniaceae и Desmidiaceae, образующих единую вершинную кладу древа
конъюгат. Было установлено, что Penium – парафилетичный род, распадающийся на
две лини, одна из которых слагаемая мелкоклеточными видами (P. cylindrus, P. exiguum) близка сем. Desmidiaceae (Gontcharov et al., 2004). Тесные отношения между Phymatodocis, имеющим типичные для Desmidiaceae полуклетки, но примитивные поры и не
отделяющуюся от вторичной первичную клеточную стенку (Engels, Lorch, 1981), и некоторыми видами Penium, указывают на то, что эти, переходные
между двумя семействами, признаки, могут быть обнаружены и у последних.
Дальнейшие исследования, как молекулярные, так и ультраструктурные, необходимы
для того, чтобы установить основные группировки в составе клады Desmidiaceae/Peniaceae и
определить их таксономический статус. По нашему мнению, сочетание признаков
ультраструктуры клеточной стенки в роде Phymatodocis позволяет признать его в качестве
подсемейства в составе Desmidiaceae или даже самостоятельного семейства.
Однако независимый статус Phymatodocis пока не поддержан молекулярными данными (Gontcharov et al., 2004; Hall et al., 2008a). Примечателен тот факт, что недавние
филогенетические анализы выявили еще два вида десмидиевых: Actinotaenium cruciferum и
Cosmarium tinctum - проявляющих близость к
мелкоклеточным видам Penium (Gontcharov, Melkonian,
2008).
СОВРЕМЕННЫЕ
ПРОБЛЕМЫ ТАКСОНОМИИ НАВИКУЛОИДНЫХ
ДИАТОМОВЫХ
ВОДОРОСЛЕЙ
Куликовский М.С.
Институт биологии
внутренних вод им. И.Д. Папанина РАН,
Россия, 152742,
Ярославская обл., Некоузский р-н, пос. Борок
e-mail: max-kulikovsky@yandex.ru
Modern problems of
naviculoid diatoms taxonomy
Kulikovskiy M.S.
I.D. Papanin Institute for Biology of Inland
Waters RAS
Russia,
152742, Yaroslavl,
Nekouz, Borok
За последние двадцать лет в систематике диатомовых
водорослей произошли сильные изменения. Значительный пересмотр таксономии на
видовом и родовом уровне был произведен и среди навикулоидных таксонов. Во многом
эти изменения обусловлены сменой парадигмы в систематике диатомовых и отказе от
«широкой» концепции рассмотрения видов и родов и использовании, в настоящее
время, «узкой» концепции. Накопление обширного фактологического материала для
этого было осуществлено в работах F. Hustedt, который был сторонником широкого понимания родов. R. Simonsen (1987)
опубликовал каталог типов F. Hustedt, в котором представил световые фотографии многочисленных
таксонов. Наиболее масштабное изучение типовых коллекций с использованием
световой техники было предпринято K. Krammer, H. Lange-Bertalot (1986,
1988, 1991). В четырех томах по диатомовым Süßwasserflora von Mitteleuropa, написанных в ключе «широкой» концепции, были
задокументированы в световых фотографиях многие таксоны диатомовых водорослей и
произведена попытка объединения их на основе сходной морфологии. Масштабное
использование электронной микроскопии показало правомерность выделения новых
родов из обширного Navicula s.l., что особенно проявилось в монографии The Diatoms: Biology and Morphology of the Genera (Round et al., 1991). Правомерность использования «узкой»
концепции была показана в работах Mann
(2004) и Droop et al.
(2000), в которых ими изучались некоторые виды из родов Sellaphora Mereschkowsky и Diploneis Ehrenberg. Во многом этот подход подтверждается и
молекулярно-генетическими методами (Beszteri et al., 2001; Bruder, Medlin, 2008; и другие).
Таксономической ревизии подверглись многие «старые»
навикулоидные рода, но больше всего изменилось положение многих представителей Navicula s.l. Из этого рода были выделены, восстановлены или
описаны как новые около 50 родов: Adlafia Lange-Bertalot, Aneumastus D.G. Mann & Stickle, Cavinula Stickle, Chamaepinnularia Lange-Bertalot & Krammer, Cosmioneis D.G. Mann & Stickle, Craticula Grunow, Decussata (Patrick) Lange-Bertalot, Diadesmis Kützing, Eolimna Lange-Bertalot & Schiller, Fallacia Stickle, Fistulifera Lange-Bertalot, Geissleria Lange-Bertalot & Metzeltin, Haslea Simonsen,
Hippodonta Lange-Bertalot, Metzeltin & Witkowski, Kobayasiella Lange-Bertalot, Luticola D.G. Mann, Lyrella Karajeva,
Mayamaea Lange-Bertalot, Neidiopsis Lange-Bertalot & Metzeltin, Parlibellus Cox, Petroneis Stickle
& D.G. Mann, Placoneis Merschkowsky, Sellaphora Mereschkowsky, Nupela Vyverman & Compère, Prestauroneis Bruder & Medlin, Envekadea Van de Viver, Gligora, Kralj & Cocquyt, Boreozonacola Lange-Bertalot, Kulikovskiy
& Witkowski, Biremis D.G. Mann & Cox, Krsticiella Levkov, Naviculadicta Lange-Bertalot, Microcostatus Johansen & Sray, Veigaludwigia Lange-Bertalot & Rumrich, Lecohuia Lange-Bertalot, Sieminskia Metzeltin & Lange-Bertalot, Germainiella Lange-Bertalot & Metzeltin, Lacunicula Lange-Bertalot, Cavacini, Tagliaventi, Alfinito, Navigiolum Lange-Bertalot, Cavacini, Tagliaventi, Alfinito, Brevilinea Siver, Hamilton & Morales, Amicula Witkowski,
Lange-Bertalot, Metzeltin, Austariella Witkowski, Lange-Bertalot, Metzeltin, Cocconeiopsis Witkowski, Lange-Bertalot, Metzeltin, Kurpiszia Witkowski, Lange-Bertalot, Metzeltin, Fogedia Witkowski, Lange-Bertalot, Metzeltin, Lunella Snoeijs, Pinnuavis Okuno, Proschkinia Karayeva
(Kараева, 1978; Сox, 1987, 1988; Mann, 1989; Round
et al.,
1990; Lange-Bertalot, 1997,
2001; Lange-Bertalot, Metzeltin, 1996; Schiller, Lange-Bertalot, 1997; Lange-Bertalot, Genkal, 1999; Witkowski et al., 2000; и другие).
В докладе показаны основные отличительные
характеристики приведенных выше родов, дана информация по их распространению и
эколого-географической приуроченности. Анализируются проблемы таксономической
интерпретации некоторых навикулоидных родов на основе, как морфологических
критериев, так и молекулярно-генетическх методов. Это, например, дискуссия по
самостоятельности рода Caloneis Cleve и его сходство с Pinnularia Ehrenberg,
морфологии и таксономии рода Sellaphora и
Eolimna, также как Craticula и Lacunicula (Morales, Le, 2005; Bruder et al., 2008; Mann et al., 2008; Kulikovskiy et al., 2009).
Освещена история и необходимость описания H. Lange-Bertalot (1994) рода Naviculadicta. Этот таксон был создан с целью стабилизации
систематики навикулоидных диатомовых, для включения в него видов, не характерных
для Navicula Bory s. str. Типовым таксоном был выбран Navicula vaucheriae Peteresen
(Lange-Bertalot, 1994).
Несмотря на то, что многие виды Naviculadicta, в настоящее время, переведены в новые рода, данный подход получил
неоднозначную оценку (Kociolek, 1996).
Показано, что при описании таксонов родового ранга
наибольшее значение играют строение порового аппарата, шва, вид и расположение
хроматофоров. Обсуждается проблема использования дорсивентральности панциря,
как признака для описания новых родов.
Особенности организации диатомей,
не согласующиеся
с представлениями об их
эукариотической природе:
литературные и собственные
данные
Натяганова А. В.
Diatoms organization peculiarities unmatched with conception
of their eukaryotic nature: literature and original data
Natyaganova A.V.
Лимнологический институт СО РАН, Уланбаторская, 3, Иркутск, Россия
e-mail: avn61@mail.ru
Диатомеи или диатомовые водоросли (Bacillariophyta) процветают повсюду, где есть вода или влажные условия:
в лужах и океанах, озёрах и морях, ручьях и реках; на стволах деревьев и стенах
зданий и даже на коже морских млекопитающих, а также в экстремальных условиях –
в термальных источниках и толще льда. Развиваясь в огромных количествах, диатомеи
являются одними из главных водных продуцентов органического вещества, а,
отмирая, образуют на дне озёр, морей и океанов толстые слои диатомового ила. В
различные геологические эпохи, когда океан отступал, такой ил превращался в
богатую осадками диатомовую землю или диатомит – природный материал, издавна
используемый человеком.
История изучения диатомовых водорослей, продолжающаяся
вот уже три столетия, по мнению автора одного из современных изданий об этих
организмах (Лосева, 2002), является весьма любопытной. Оказывается, длительное
время одни учёные относили диатомей к животным, другие - к растениям, третьи
вообще называли их зоофитами или животнорастениями. На основании призматической
формы диатомей и наличия у них панцирей шведский миколог Фриз (1805) предположил,
что диатомеи - это существа промежуточные между органическим и неорганическим миром,
в некотором роде органокристаллы. Только к концу 50-х годов XIX в. мнение о
диатомеях как о растениях стало общепризнанным. Согласно современным таксономическим
схемам, диатомеи – одноклеточные
(0,00075-1,5 мм)
эукариотные водоросли (Масюк, Костиков, 2002). Вместе с тем, у них выявлен целый
ряд биологических особенностей, нетипичных для эукариотных клеток, в связи с
чем их характеризуют как резко очерченную и своеобразную ветвь растительного
мира (Топачевский, 1962; Седова, 1996).
Самая яркая и необычная черта диатомовых водорослей -
сложно устроенные видоспецифичные внешние покровы в виде кремнезёмных панцирей,
вследствие чего их называют «жителями стеклянных
домиков» (Лосева, 2002). Панцирь состоит из двух створок: верхней - эпитеки и
нижней - гипотеки. Считается, что большая по размеру зпитека покрывает
гипотеку, как крышка коробку. Вместе с тем, отмечены случаи одинаковых размеров
эпитеки и гипотеки (Round, 1972; Giri and Chowdary 1991). Способность диатомей формировать такие довольно
прочные и изящно орнаментированные кремнистые структуры до настоящего времени
остаётся для учёных загадкой.
Следующая особенность – вегетативное размножение,
сопровождающееся уменьшением размеров водорослей до 1/3 от первоначальных,
получившее название закона «биноминального деления клеток» (Smith, 1955 – цитир. по Agrawal and Chaudhary, 1996).
Восстановление исходных величин происходит через половой процесс, сопровождающийся
образованием быстро растущей беспанцирной стуктуры – ауксоспоры (Mac-Donald,
1869; Pfitzer, 1871). Эту стадию ауксоспорообразования наблюдают только в
жизненном цикле диатомей. Вместе с тем, работы ряда исследователей (Beger,
1927; Husteld, 1930; Wimpenny, 1936-1966; Toman, 1950; Geitler, 1952a; Stosch,
1965, и др.) показали, что теория Пфитцера-Дональда несостоятельна, так как
выяснилось, что у многих видов размеры панцирей могут уменьшаться более, чем на
1/3 их первоначальной величины, ауксоспоры наблюдаются не у всех исследованных
видов, половой процесс имеет место и у не измельчённых делениями диатомей, а
некоторые виды в течение длительного времени (до 10 лет) не меняют размеров
своих панцирей, несмотря на нормальный процесс деления (Allen, Nelson, 1910;
Wiedling, 1948, и др.- цитир. по Прошкиной–Лавренко, 1974). Например, в
популяциях диатомей Eunotia pectinalis,
E. rostellata и E. arcus var. fallax
вообще не наблюдали вариации в размерах кремнистых покровов (Agrawal and Chaudhary,
1996). Кроме того, одни природные популяции диатомовой водоросли Asterionella formosa демонстрируют
размерные вариации панцирей, а другие, наоборот, в этом отношении выглядят
стабильными. Экспериментально также показано, что у некоторых видов не наблюдается
измельчения клеток в ходе их культивирования (Комарницкий и др., 1975). По
мнению одного из представителей индийской школы цитологов-диатомологов (Giri,
1996) наблюдаемые факты одинаковых размеров эпитеки и гипотеки у некоторых
видов (Round, 1972; Giri and Chowdary 1991) также могут свидетельствовать об
отсутствии уменьшения клеточных размеров в ходе их размножения. Множественное
бесполое размножение посредством микроспор, обеспечивающее массовое развитие
вида за короткий период, выявлено недавно в байкальских популяциях двух видов диатомовых
водорослей Asterionella formosa и Aulacoseira baicalensis (Кобанова, 2001; Кобанова, Изместьева, 2003).
Описанный механизм этого размножения, по словам одного из авторов (Кобанова,
2001), также ставит под сомнение существующую гипотезу об измельчении диатомовых
водорослей вследствие многократного вегетативного деления.
Нетипичны для эукариотических клеток и многие кариологические
характеристики диатомовых водорослей (Lauterborn, 1896; Рощин, 1974; Tippit and
Picket-Heaps, 1977; Agrawal and Chaudhary, 1996; Седова 1996). Так, ядрам
диатомей свойственны перемещения или миграции внутри панциря в течение их
жизненного цикла. Замечено, что у диатомей могут появляться безъядерные или с несколькими
и даже гетероморфными ядрами клетки. Практически все события, происходящие, в
ходе деления диатомей существенно отличаются от тех, которые протекают в
течение типичного митоза эукариот. Так, установлено, что ядерная мембрана в
ходе клеточного деления полностью не разрушается. Веретено деления в виде
полого цилиндра формируется за пределами ядра и затем перемещается в него через
определённые отверстия в мембране. Вместо центриолей на полюсах веретена образуются
совершенно другие по своей организации структуры, так называемые, постоянные
полярные комплексы. Интересно, что хромосомы имеют в метафазе характерное
расположение в виде кольца или нескольких плотных скоплений вокруг веретена.
Ещё в первых цитологических работах (Lauterborn, 1896) было замечено, что
дочерние хромосомные наборы в анафазе двигаются самостоятельно к
противоположным полюсам. Даже ультраструктурное исследование деления диатомей
не смогло объяснить механизма движения хромосом к полюсам в анафазе, поскольку
система кинетохоры-микротрубочки, общая для всех веретён, не выявлена (Tippit
and Picket-Heaps, 1977). В анафазе также отмечено удаление дочерних хромосомных
наборов на необычно большое расстояние друг от друга. Нетипично поведение
ядрышек у диатомей. Как известно, в эукариотических клетках ядрышки участвуют в
образовании рибосом и находятся в контакте с определёнными участками хромосом
(ядрышковыми организаторами). В ходе митоза ядрышки претерпевают циклические
изменения: в начале клеточного деления (в профазе) они исчезают; к концу
деления (в телофазе) - появляются вновь (Робертис и др., 1962; Свенсон,
Уэбстер,1980). Ядра большинства видов диатомовых содержат одно ядрышко, которое,
наоборот, появляется в профазе (на первой стадии митоза). Интересно, что у ряда
видов отмечено сохранение ядрышек почти до конца кариокинеза (Giri, 1992). У
некоторых видов в ядрах обнаружено несколько гетероморфных ядрышек (разных по
размеру и светооптической плотности) (Drum and Pankratz, 1964; Eppley et al.,
1967 Crawford, 1973; Doucett and Fryxell, 1985; Giri, 1992). Очень
нестандартное для эукариотных клеток поведение ядрышка наблюдали у вида
диатомеи Gyrosigma kuetzingii: здесь
показано увеличение размеров ядрышка в ходе ядерного деления в 1,5 раза (Giri,
1989). Однако, несмотря на все эти особенности, вегетативное деление кремнистых
водорослей всё-таки считается особой разновидностью митоза и определено, как
ацентрический, полузакрытый митоз (Седова, 1996). В отношении данных о числах
хромосом нередки случаи, когда для одного вида сообщается несколько существенно
различающихся значений диплоидного числа. Так, у диатомеи Cyclotella meneghiniana по данным одних авторов (Iyengar and
Subrahmanyan, 1944) n = 32 и 2n= >60, и по другим данным – намного меньшее
значение: 2n = 18 (Giri and Chowdary, 1991).
Своеобразие хлоропластов диатомей, окружённых не двумя,
как в типичной растительной клетке, а четырьмя мембранами, обусловило появление
гипотезы симбиогенеза о происхождении хроматофоров в растительных клетках от внедрившихся
фотосинтезирующих организмов-симбионтов (Мережковский, 1905; 1906). По словам
К.С. Мережковского, внутри диатомей, как будто гости живут независимо
самостоятельные организмы, развивающиеся по своим законам. По мнению одного из
российских диатомистов (Рощин, 1974), в клетках диатомовых следует выделять два
цитоплазматических тела с качественно различным распределением органоидов: постенный
слой цитоплазмы с многочисленными хлоропластами и не содержащее хлоропластов гетеротрофное тело со своей цитоплазмой, ядром и тяжами, которые связывают гетеротрофный
компонент с постенной цитоплазмой. Такая ситуация расценивается
им как проявление дополнительного уровня организации клетки, который он
обозначил как надорганоидный. Два надорганоидных комплекса обладают
относительной самостоятельностью.
В последнее десятилетие получены данные о том, что
диатомеи прекрасно сожительствуют с разнообразными бактериями (Schmid
Anna-Maria M, 2003; Bruckner et al., 2008). В этом симбиозе бактерии, проявляя
себя либо в качестве эндоцитобионтов, либо в качестве членов сообществ диатомей,
играют важную роль в жизнедеятельности диатомовых водорослей. Так, при
сокультивировании бактерий с диатомеями, первые значительно повышают фотосинтетическую
активность вторых. Наряду с этим, представляются весьма любопытными результаты
полногеномных анализов двух видов диатомей – Thalassiosira pseudonana и Phaeodactylum tricornutum, показавшие
присутствие в их геномах сотни бактериальных генов (Armbrust, E.V. et al., 2004; Chris Bowler et al., 2008). Полагают, что работа
этих генов обуславливает протекание ряда биохимических реакций, не свойственных
эукариотным клеткам.
В нашей работе, цель которой состояла в идентификации
и описании хромосомных наборов двух видов диатомей Asterionella formosa
Hass и Synedra acus Kütz, были выявлены ещё некоторые необычные
цитохимические особенности кремнистых водорослей (Натяганова, 2006).
Исследование показало, что панцири интенсивно окрашиваются агентами,
используемыми при окраске хромосомных препаратов: реактивом Шиффа в реакции
Фёльгена (широко применяющийся тест на ДНК), красителем Гимза при выявлении
структурного гетерохроматина, а также красителями для прижизненного окрашивания
ДНК: метиловым зелёным и флуоресцентным красителем DAPI. Кроме того, при
обработке суспензий диатомей реагентами, специфически связывающимися с
молекулами ДНК (ферментом дезоксирибонуклеаза I и этидиумом бромида) показано,
что оба агента вызывают существенные деформации панцирей, проявляющиеся как в
частичном изменении их морфологии, так и в полном их разрушении. В
цитохимическом анализе и других видов диатомей с применением DAPI и антител на
гистоны также наблюдается интенсивное окрашивание стенок панцирей (Heather Allaway et al., 2008; Bruckner et al., 2008). На основе этих фактов
сделано заключение о наличии ДНК и дезоксирибонуклеопротеиновых комплексов
(ДНП) в химическом составе материала панцирей (Натяганова, 2006, 2008). Учитывая, что важным
компонентом биокремнезёма диатомей являются также и белки (силаффины,
фрустулины, плевралины) (Kröger, Rainer, Sumper, 1999) вывод о том, что
ДНК - ещё один компонент строительного материала панцирей, представляется вполне
логичным. Этот вывод также согласуется с современными достижениями молекулярной
биологии, показавшими, что молекулы ДНК могут служить идеальным материалом для
создания микро- и наноструктур (Seeman, 2003; Rothemund, 2006). Таким образом, диатомеи весьма выразительно
демонстрируют то, что и природа использует ДНК не только для хранения
наследственной информации, но и как строительный материал.
В докладе для объяснения ДНК- и ДНП-содержания в
панцирях будет представлена другая модель биологической организации диатомей,
существенно отличающаяся от современного представления о них, как об одноклеточных
эукариотах (Натяганова, 2006). Новый взгляд на биологию диатомовых водорослей
позволяет достаточно близко подойти не только к пониманию механизма образования
кремнистых панцирей диатомей, но и получить дополнительные свидетельства для
обоснования гипотезы о симбиотическом происхождении эукариотной клетки.
Работа
частично профинансирована за счёт средств гранта Президиума РАН № 10.3.
Представители порядка Palmariales
в дальневосточных морях россии
Селиванова О.Н.
The Palmariales order
members in the Far Eastern seas of Russia
Selivanova O.N.
Камчатский филиал
Тихоокеанского института географии ДВО РАН
Петропавловск-Камчатский,
683000, Партизанская 6, тел./факс (4152) 41-24-64
e-mail: oselivanova@mail.ru
Порядок Palmariales Guiry et Irvine in Guiry,
1978, был выделен как самостоятельный из
порядка Rhodymeniales на основании особенностей формирования и развития
спорангиев. Долгое время он считался
монотипным, т.е. включающим единственное семейство Palmariaceae Guiry, 1974. К настоящему времени в его состав
включено семейство Rhodophysemataceae Saunders et McLachlan, 1990, представители которого (Rhodophysema Batters,
1900 и Halosacciocolax Lund,
1959) прежде относились к порядку Acrochaetiales. Позднее в составе этого семейства был описан род Meiodiscus Saunders et McLachlan, 1991. Большинство из них – это эпифитные или паразитические водоросли, имеющие
субмикрокопические размеры и форму корочек, подушечек или войлочка. В семействе Palmariaceae также имеется один род
субмикроскопических паразитических водорослей Neohalosacciocolax I.K. Lee et Kurogi,
1978, но более известны 3 рода макроскопических, чаще всего эпилитных растений:
Palmaria Stackhouse, 1801, Halosaccion Kützing, 1843 и Devaleraea Guiry 1982. Представители большинства из
вышеперечисленных родов водорослей отмечены в морях
Дальнего Востока России.
Из трех родов макроскопических пальмариевых, пожалуй,
только Palmaria не вызывает особых
проблем при идентификации на родовом уровне, хотя в истории имеются случаи
ошибочного определения и даже описания на образцах пальмарии отдельного вида Halosaccion tilesii Kjellman, 1889 (Перестенко, 1981). Согласно монографической
работе по красным водорослям Дальневосточных морей России (Перестенко, 1994) в
их акватории произрастают 3 вида рода Palmaria: P. stenogona (Perest.) Perest., P.
marginicrassa I.K. Lee и P. moniliformis (Blin. et A. Zin.) Perest. Наши исследования существенно расширяют этот список, нами обнаружены также Palmaria callophylloides Hawkes et Scagel, P. hecatensis Hawkes, P.
mollis (S. et G.) Van der Meer et Bird (юго-восточная Камчатка, Берингово море, Командорские
о-ва).
Все виды рода Palmaria, не смотря на значительные морфологические различия,
имеют пластинчатую структуру, без
внутренней полости, на срезе слоевища видна мелкоклеточная кора из нитей,
включающих от 1 до 6 клеток у разных видов, и сердцевина, состоящая из одного
или нескольких слоев крупных округлых или овальных клеток разного диаметра.
Отметим, что P. callophylloides
очень близка к P. stenogona, но имеет более обильное пролиферирование,
при этом пролификации, почти равные по длине пластине, столь густо покрывают
ее, что придают растению вееровидную форму. Вид широко распространен у берегов
Восточной Камчатки и Командорских о-вов, но часто указывался ранее как P.
stenogona. По мнению Л.П. Перестенко (1994), последняя представляет собой
тихоокеанский викариат атлантической P. palmata (L.) Kuntze. Однако
зарубежные фикологи придерживаются другого мнения. Так, Ван дер Меер и Берд
(Van der Meer and Bird, 1985) считают, что описанная Перестенко P. stenogona
имеет очень большую морфологическую изменчивость и может включать несколько
видов. В первоначальном описании Rhodymenia stenogona Perest. (Перестенко, 1973) два образца, изображенные на
рисунках (табл. I, рис.б, в), предположительно представляют собой отдельный
таксон, описанный как Palmaria mollis (Van der Meer et Bird, 1985). В то же время эти авторы
также считают, что P. mollis отлична от атлантической P. palmata.
Еще один обнаруженный нами новый для российской акватории Тихого океана вид P.
hecatensis близок к P. marginicrassa. Оба вида произрастают
на Командорских о-вах и имеют значительное сходство по вегетативной анатомии,
представляя собой отдельную группу, отличную от других видов Palmaria своей
«толстокожистостью», которая обусловлена многослойностью коры.
Систематика рода Halosaccion не столь однозначна. Долгое время пальмариевые
водоросли трубчатой или мешковидной формы с внутренней полостью считались
принадлежащими этому роду. Затем ирландским фикологом М. Гайри (Guiry, 1982) в результате сравнительного изучения вегетативной
анатомии было установлено, что входящие в род Halosaccion виды распадаются на 2 группы. Представители первой
имеют относительно крупноклеточную многослойную кору и нечетко отделенную от
нее сравнительно мелкоклеточную сердцевину, при этом протопласт клеток сердцевины
часто имеет звездчатую форму, а в коре имеются многочисленные боковые клеточные
слияния. Для второй группы видов свойственны анатомические признаки, сближающие
их с видами рода Palmaria – мелкоклеточная кора
без клеточных анастомозов, четко отграниченная от крупноклеточной сердцевины
без звездчатых протопластов. На основании этих различий М. Гайри выделил из
рода Halosaccion отдельный
новый род Devaleraea (Guiry, 1982). В составе Halosaccion остались представители первой группы, а во второй род
Devaleraea вошли представители второй группы видов. Типовым видом
рода Devaleraea стала D.
ramentacea (L.) Guiry (базионим Halosaccion ramentaceum (L.) J.Ag.), к этому же
роду была отнесена D. yendoi (I.K.Lee) Guiry (базионим Halosaccion yendoi I.K.Lee). Позднее, проведя
ревизию пальмариевых из российской акватории Тихого океана, мы перевели два
других вида Halosaccion в род Devaleraea и предложили новые
номенклатурные комбинации: Devaleraea microspora (Rupr.) Seliv. et Kloczc. для
Halosaccion microsporum Rupr. и D. compressa (Rupr.) Seliv.et Kloczc. для H. compressum Rupr. соответственно (Клочкова, Селиванова, 1989).
Продолжив работу по ревизии пальмариевых водорослей, я обнаружила, что и Halosaccion firmum (P. et R.) Kütz. имеет анатомические особенности, сближающие его с
комплексом P. marginicrassa-P. hecatensis и характерные для рода Devaleraea (Селиванова,
1998), поэтому высказала предположение о целесообразности перевода вида в этот
род. Новая комбинация пока приводится здесь как предварительная:
Devaleraea firma (P. et R.) Selivanova, nom. prov. Базионим: Dumontia firma Postels et Ruprecht, Illustrationes
Algarum: 19. 1840.Синоним: Halosaccion firmum (P. et R.) Kützing 1843.
Правомерность такого предложения, помимо
анатомического обоснования, подкрепляется также данными сравнительного
молекулярно-генетического анализа (ДНК малых субъединиц рибосом - SSU). Из генетического древа (рис.), явствует, что
водоросли с побережья Камчатки, относимые к H. firmum,
образуют общий кластер с видами родов Palmaria и Devaleraea и
отличны от видов рода Halosaccion.
Тем не менее, отметим, что не всеми авторами, как
отечественными, так и зарубежными род Devaleraea был безоговорочно признан. Так, согласно Л.П.
Перестенко (1994) в морях Дальнего Востока России произрастают 5 видов рода Halosaccion: H. microsporum Rupr., H. firmum
(P. et R.) Kütz., H. hydrophorum (P. et R.) Kütz., H. minjaii I.K. Lee, H. yendoi I.K. Lee, из чего
следует, что третий род семейства Palmariaceae
этим автором не признан. Ряд японских авторов также не признали род Devaleraea (Yoshida, 1998; Yoshida
et al.,
2000), и виды, переведенные в род Devaleraea (Guiry, 1982), по-прежнему
приводятся ими в составе рода Halosaccion.
В частности, спорным остается таксономический статус H. yendoi (= D. yendoi). В мировой базе данных по водорослям (Guiry M.D. and Guiry G.M., 2009) оба видовых названия приводятся как
«действующие» (“current”), однако генетические
данные (рис.) все-таки свидетельствуют в пользу принадлежности таксона к роду Halosaccion.
Также пока нет ясности в отношении типового вида рода Halosaccion. Проведение неолектотипификации и определение H. firmum
в качестве такового (Guiry, 1982) не
получили подтверждения, а наши исследования показали, что как анатомически, так
и генетически этот вид ближе к комплексу Palmaria-Devaleraea.
Попытка установления H. hydrophorum типовым видом рода также оказалась неудачной,
поскольку существуют разногласия в статусе этого вида и его соотношения с H. glandiforme (Gmel.) Rupr. Согласно Перестенко (1994), типовой образец данного
вида, известный как Ulva glandiformis Gmelin, был навсегда утерян, тогда как его более поздний
таксономический синоним Dumontia hydrophora P. et R. (базионим для Halosaccion hydrophorum),
сохранился и может считаться неотипом. Однако мне представляется целесообразным
сохранить прежнее широко признанное название H. glandiforme, а
H. hydrophorum рассматривать как его синоним. С другой стороны, в той же базе данных
(Guiry M.D. and Guiry G.M., 2009) оба вида приводятся как самостоятельные Очевидно,
что разрешение этих вопросов требует дополнительных исследований.

Рис. Генетическое древо пальмариевых водорослей,
построенное методом объединения ближайших соседей
Выражаю глубокую признательность доктору Хан-Гу Чою из
Института полярных исследований республики Корея (Dr. Han-Gu Choi, KOPRI, Incheon, Korea) за проведение молекулярно-генетического анализа
пальмариевых водорослей с побережья Камчатки.
Список литературы
Клочкова Н.Г., Селиванова О.Н. Виды Halosaccion Kuetz. и Devaleraea Guiry (Palmariales, Rhodophyta) в
дальневосточных морях СССР // Бот. журн., 1989. Т. 74. N 7. C.
953-958.
Перестенко Л.П. О новых видах Rhodymenia Grev. и Odonthalia Lyngb. (Rhodophyta) // Нов. сист. низш. раст., 1973. Т. 10.
С. 61-68.
Перестенко Л.П. Существует ли вид Halosaccion
tilesii Kjelm.? // Нов. сист. низш. раст., 1981. Т. 18. С. 23-24.
Перестенко Л.П. Красные водоросли дальневосточных
морей России // СПб: Изд. "Ольга", 1994. 331 с.
Селиванова О.Н. Макрофиты Командорских островов
(видовой состав, экология, распределение) // Автореф. дисс. … канд. биол. наук.
Владивосток: ДВГУ, 1998. 25 c.
Guiry M.D. Devaleraea,
a new genus of the Palmariaceae (Rhodophyta) in the North
Atlantic and North Pacific // J. Mar. Biol. Association of the
UK.1982. V. 62. P. 1-13
Guiry M.D. and
Guiry G.M. 2009. AlgaeBase. World-wide electronic
publication, National University of Ireland, Galway.
http://www.algaebase.org
Meer van der J.P.
and Bird C.J. Palmaria mollis (Setchell et Gardner) stat. nov.: a
newly recognized species of Palmaria (Rhodophyceae) from the northeast Pacific Ocean // Can. J. Bot., 1985. V. 63. P. 398-403.
Yoshida T. Marine
algae of Japan
// Uchida Rokakuho Publishing CO., LTD, 1998, 1222 pp. (на япон. яз.)
Yoshida T.,
Yoshinaga K., Nakajima Y. Check-list of marine algae of Japan (revised
in 2000) // Jpn. J. Phycol., 2000. V. 48. P. 113-166.
ОПРЕДЕЛЕНИЕ ВИДА МИКРОВОДОРОСЛИ С ИСПОЛЬЗОВАНИЕМ
АЛЬГОВИРУСОВ
Степанова О.А.,
Галатонова О.А.
Identification of
microalgae species using algoviruses
Stepanova O.A., Galatonova O.A.
Институт биологии
южных морей НАН Украины
Проспект Нахимова
2, Севастополь, Украина, 99011
тел.
(810380692)544110, факс (810380692)557813
е-mail: solar-ua@ya.ru
В настоящее время известно, что у 44 таксонов
эукариотических водорослей обнаружены вирусы или вирусоподобные частицы,
которые распространены среди 10 из 14 известных классов (типов) водорослей.
Поиск альговирусов в Черном море на базе Института биологии южных морей НАНУ
проводится с 2002 г.
по разработанному и запатентованному автором способу (Степанова О.А., 65864A
UA, N2003065499). За период 2002-2008 гг. из проб морской воды, мантийной жидкости
черноморских мидий Mytilus galloprovincialis и рыб были изолированы и
описаны новые альговирусы, хозяевами которых являются микроводоросли Tetraselmis
viridis (T. viridis), Phaeodactylum tricornutum (P. tricornutum)
и Dunaliella viridis (D. viridis). Сезонность выделения
альговирусов из образцов черноморской среды отражает сезонность распределения
их хозяев – микроводорослей. Однако выявление в воде обычными альгологическими
методами с использованием световой микроскопии таких микроводорослей, как T.
viridis, P. tricornutum и D. viridis, связано с определенными трудностями,
что приводит к искажению сведений об экологии этих водорослей в Черном море (их
наличии, сезонности, географической распространенности и пр.). Так уже на
протяжении многих лет в образцах морской воды в бухтах Севастополя не
определялись клетки микроводорослей T. viridis, P. tricornutum и D. viridis,
однако регулярная сезонная изоляция альговирусов к этим хозяевам свидетельствовала
об их присутствии.
Учитывая видовую специфичность альговирусов к их
хозяевам, мы впервые предприняли попытку провести предварительное определение
вида изолированной и неизвестной зеленой микроводоросли путем тестирования с
заведомо известными альговирусами на эффект появления или отсутствия лизиса.
Этот эксперимент проводился на основе разработанной и запатентованной автором методики
(Степанова О.А., 65864A UA, N2003065499), суть которой заключается в визуально
обнаруживаемом лизисе заведомо известной жидкой культуры микроводорослей в
присутствии специфических альговирусов.
Изучаемая нами неизвестная зеленая микроводоросль была
изолирована из пробы морской воды, отобранной в летнее время 2006 г. из поверхностного
слоя недалеко от берега в поселке Кацивели. Культивирование этой микроводоросли
выполнялось в лабораторных условиях в отделе экологической физиологии
водорослей ИнБЮМ НАНУ в жидкой питательной среде (стабилизирующей среде
Гольдберга) в виде альгологически чистой культуры.
В качестве лизирующих специфических альговирусов были
использованы вирусные суспензии трех штаммов вируса T. viridis (TvV-S1,
TvV-S20, TvV-SI1), выделенных в разные годы, и одного штамма вируса D. viridis
(DvV-SI2). Контроль специфичности штаммов альговирусов в опыте осуществляли
путем их контакта с жидкими (в стабилизирующей среде Гольдберга) культурами
чувствительных к ним хозяев микроводорослей (T. viridis и D. viridis)
с последующим их лизисом. Помимо изучаемой неизвестной культуры зеленой
микроводоросли (опыт) и чувствительных к альговирусам культур микроводорослей
(положительные контроли), для отрицательных контролей проводимого эксперимента
были использованы жидкие культуры нечувствительных к альговирусам T. viridis
и D. viridis, микроводорослей
Dunaliella salina, Clorella vulgaris и Stichococcus bacillaris.
Полученные в опыте результаты свидетельствовали о специфической
активности альговирусов по отношению к своим хозяевам – чувствительным
микроводорослям, что проявляется лизисом. Отсутствие активной вирусной инфекции
(отсутствие лизиса) с нечувствительными к альговирусам культурами Dunaliella
salina, Clorella vulgaris и Stichococcus bacillaris
проявлялось их продолжающимся ростом и развитием.
Однако при проведении этого эксперимента впервые была
выявлена способность штаммов альговируса T. viridis лизировать культуру
микроводоросли D. viridis. Поскольку черноморские альговирусы
микроводорослей T. viridis и D. viridis являются уникальными и их
свойства пока находятся в стадии изучения, то и этот факт взаимодействия между
штаммами вируса T. viridis и микроводорослью D. viridis с
проявлением специфической активной инфекции (лизиса) описывается впервые. Можно
предположить, что альговирус T. viridis обладает более широкой, межвидовой
специфической активностью, по сравнению с альговирусом D. viridis.
Выявленный факт свидетельствует о больших возможностях для сохранения
альговируса T. viridis в природе и его преимуществах перед вирусами,
специфичными только по отношению к одному виду хозяина. Вероятно, более широкая
видовая специфичность альговируса T. viridis обусловлена особенностями
их экологии и экологии их хозяев и, вероятно, закреплена эволюционно.
Как можно видеть из результатов, представленных в
таблице, поведение неизвестной зеленой микроводоросли по отношению к
альговирусам T. viridis и D. viridis соответствует поведению музейной
культуры D. viridis.
Таблица
Определение вида культивируемой неизвестной зеленой
микроводоросли
путем тестирования заведомо известными альговирусами
|
Культура
микроводорослей
|
Штаммы альговирусов (год изоляции)
|
|
Штаммы TvV
|
Штамм DvV
|
|
TvV-S1 (2002г)
|
TvV-S20(2003г)
|
TvV-SI1(2008г)
|
DvV-SI2(2008г)
|
|
Tetraselmis viridis
|
Лизис культуры
|
Лизис культуры
|
Лизис культуры
|
Рост культуры
|
|
Dunaliella viridis
|
-«-
|
-«-
|
-«-
|
Лизис культуры
|
|
Неизвестная культура
|
-«-
|
-«-
|
-«-
|
-«-
|
|
Dunaliella salina
|
Рост культуры
|
Рост культуры
|
Рост культуры
|
Рост культуры
|
|
Clorella vulgaris
|
-«
|
-«-
|
-«-
|
-«-
|
|
Stichococcus bacillaris
|
-«-
|
-«-
|
-«-
|
-«-
|
Анализ полученных результатов позволил предположить,
что изучаемая неизвестная зеленая культура микроводорослей, изолированная в 2006 г. и поддерживаемая в
отделе экологической физиологии водорослей ИнБЮМ НАНУ, относится к виду Dunaliella
viridis. Несколько сотрудников ИнБЮМ НАНУ, специализирующихся в работе с
культурой микроводоросли Dunaliella viridis, любезно согласились сделать
свои заключения по определению вида изучаемой микроводоросли путем просмотра
этой культуры в световом микроскопе под разными увеличениями. В своих
заключениях они пришли к единому мнению, что клетки культуры изучаемой
микроводоросли имеют морфологические признаки, типичные для клеток водоросли Dunaliella
viridis.
Таким образом, мы впервые провели предварительное
определение вида неизвестной зеленой микроводоросли путем тестирования заведомо
известными альговирусами. Предложенная нами методика отличается простотой и высокой
специфичностью, в связи, с чем может быть использована и в полевых условиях, а
также при отсутствии микроскопа или квалифицированного специалиста альголога.
Cовременная система
динофлагеллят,
экология и их роль в экосистеме
Черного моря
Теренько Л.М.
Modern system of Dinophyta. Their ecology and role
in ecosystem of the Black
Sea
Terenko L.M.
Одесский филиал
Института биологии южных морей им. А.О. Ковалевского НАН Украины
Пушкинская, 37, Одесса 65125, Украина
e-mail: galla@paco.net
Динофлагелляты или динофитовые водоросли (Dinophyta) – одна из доминирующих групп микроводорослей в водных
экосистемах, которые отличаются морфологическим и экологическим разнообразием.
Это типичные обитатели пелагиали морей и океанов, хотя встречаются и в пресных
континентальных водоемах. В настоящее время эта группа занимает ведущее место
по числу видов (2500) современных динофлагеллят (Williams et al., 1998). Крупнейший специалист в области исследования динофлагеллят
Д. Додж (Dodge, 1983) считает, что уникальное сочетание примитивных и эволюционно
продвинутых особенностей строения обеспечивает им процветание в современный период.
Из-за неясного таксономического положения в системе
органического мира, обладая признаками как растений, так и животных,
динофлагелляты привлекают внимание ботаников и протистологов. Для них
характерны сложные жизненные циклы, особые формы бесполого и полового размножения,
своеобразный сложный наружный скелет, уникальные экструсомы. Эту
таксономическую группу рассматривают либо в составе фитопланктона, либо как
компонент протозоопланктона, преимущественно гетеротрофного. «Двойственное»
положение динофлагеллят служит источником трудностей при оценке их роли в
водных сообществах. По типу питания они делятся на две примерно равные группы:
авто- и миксотрофы, среди которых облигатные автотрофы встречаются довольно
редко, и гетеротрофы, с животным типом питания. Среди динофлагеллят известны
хищники, паразитические формы и комменсалы. На этом основании, на протяжении 19
и 20 веков динофлагелляты относились как к царству растений, так и к царству
животных. До сих пор одни и те же виды (при сохранении их видовых и родовых
названий) входят в состав двух систем – ботанической и зоологической,
подчиняясь двум разным номенклатурным кодексам. К концу прошлого века эта группа
протистов была названа двуцарственными, однако на основе современных
представлений она не относится ни к одному из имеющихся царств растений и животных
(Кусакин, Дроздов, 1998).
Система динофлагеллят (Dinophyta) разработана еще недостаточно, главным образом, из-за
крайне неравномерной изученности отдельных групп. Их классификация
разрабатывалась в значительной степени независимо ботаниками и зоологами. При
этом ботаники, что естественно, больше внимания уделяли автотрофным группам,
тогда как зоологи – гетеротрофным, особенно паразитическим. Создавались в
значительной степени параллельные, во многом отличительные системы, различен
также состав групп, которые исследователи считают нужным или возможным включать
в состав динофлагеллят как отдела.
Следуя правилам
зоологической номенклатуры, классификация Р. Берга (Bergh, 1881) разделила динофлагеллят на десмоконтных – с
апикальным расположением жгутиков, и диноконтных – с вентральным расположением
жгутиков. Позднее, используя ботаническую номенклатуру, А. Пашер (Pascher, 1931) разработал систему, в которой объединил
динофлагеллят, криптомонад и рафидофициевых в единую группу Pyrrophyta. В дальнейшем было установлено, что криптофитовые и
динофитовые отличаются по многим признакам – строению ядра, набору пигментов,
строению жгутиков и являются самостоятельными линиями эволюции, не имеющими
общих предков. Хотя ряд ботаников обосновали неправомерность отнесения
криптомонад и динофлагеллят к одному отделу, тем не менее, долгое время
встречался отдел Pyrrophyta, включающий в качестве
классов как Cryptophyceae, так и Dinophyceae.
С начала 19 века,
при первых попытках систематизации водорослей, в основу их классификации был
положен пигментный принцип, сохранивший свое значение до наших дней. Часть
ботаников (Steidinger, Tangen, 1997) склоняется к отнесению динофлагеллят в
качестве класса Dinophyceae к обширному типу Chromophyta на том основании, что у всех этих водорослей (Cryptophyceae, Prymnesiophyceae,
Chrysophyceae, Dictyochophyceae,
Bacillariophyceae, Raphidophyceae)
зеленый цвет пигмента маскируется ксантофиллами, придающими им буроватую или
желтоватую окраску, имеется хлорофилл с, но отсутствует хлорофилл b. Однако динофлагелляты существенно отличаются от настоящих
хромофитов целым рядом признаков, включая отсутствие хлорофилла с,
наличие трех, а не четырех мембран в оболочке хлоропласта, иной состав
продуктов ассимиляции. Уже одной этой суммы признаков вполне достаточно для отделения
их от хромофитов и выделения в самостоятельный отдел, как это делают исследователи
в последние годы (Карпов, 1990; Масюк, Костиков, 2002).
Во второй половине
20 века было описано много ископаемых видов, и ряд этих организмов был отнесен
к родам современных динофлагеллят. Существовала еще одна система, созданная
палеонтологами, главным образом, на основании спор вымерших и ныне живущих
динофлагеллят, где одни и те же виды имели разные названия, что было причиной
дополнительных затруднений.
В настоящее время можно считать доказанным
принадлежность динофлагеллят к эукариотам. Эту группу низших эукариот,
объединяет наличие у них, хотя бы на одной из стадий жизненного цикла,
своеобразного ядра – динокариона, сочетающего признаки настоящего ядра
эукариотов, с таковым прокариотов, митотическое деление этих протистов имеет
специальный термин «диномитоз».
В современный период
филогенетическая систематика водорослей должна учитывать происхождение и родство
каждого из трех основных геномов эукариотической клетки: ядерного, пластидного
и митохондриального, и контролируемых ими клеточных структур. Однако
систематика этой группы все еще находится в стадии становления и разработок, в
современных версиях систем организмов (и ботанических, и зоологических) им
присваивается высокий таксономический ранг типа или отдела, а в системе
эукариот (Adl et al.,
2005) они наряду с Ciliophora (инфузории) и Apicomplexa (споровики) образуют группу Alveolata.
В 1993 г. была опубликована
единая классификация современных и ископаемых динофлагеллят, в которой обобщены
все достижения в области систематики и таксономии этой группы (Fensome,
Taylor, Norris, 1993). Отдел (Dinophyta) Dinoflagellata разделен на два подотдела: Dinokaryota
и Syndinea. В современной системе динофлагеллят в качестве
основного критерия для разграничения таксонов использованы наиболее стабильные
признаки табуляции теки. В систему Р. Фенсома и др. внесены изменения и
дополнения, касающиеся филогении некоторых динофлагеллят, в том числе рода Glenodinium,
отнесенного на основании табуляции теки в семейство Cladopyxaceae порядка Gonyaulacales. В последние 20 лет диагностические признаки табуляции пояска и
брюшного поля особенно активно используются систематиками при классификации
внутри порядка Peridiniales, Э. Балеч (Balech, 1974)
отделил пресноводные Peridinium
от морских, которые теперь отнесены к роду Protoperidinium. На этом же основании из рода Peridinium выделен род Scrippsiella. В связи с невалидностью род Exuviaella (Dodge, 1975) перенесен в род Prorocentrum.
Методология изучения динофлагеллят. Несмотря на развитие новых биохимических и молекулярно-биологических
методов, морфологический подход в исследованиях динофлагеллят по-прежнему
остается основным. Однако часто морфологический критерий понимается слишком
узко и односторонне, например, как внешний вид единственной клетки, без
использования всех широких возможностей морфологического метода. В.Н. Беклемишев
(1994) под формой организма понимал весь цикл его изменений в онтогенезе,
считая, что истинным объектом сравнительной анатомии являются морфопроцессы.
Очевидно, что современную диагностику динофлагеллят следует основывать на
изучении морфологии всех стадий жизненного цикла вида, включая спору.
Традиционно диагностика динофитовых базируется на морфологических методах
исследования вегетативной клетки жгутиковой стадии как у текальных (панцирных),
так и у атекальных (беспанцирных, или “голых”) видов. Если для первых метод
полного текального анализа приводит к четкому распознаванию таксона, по крайней
мере, на уровне рода, то для вторых, ввиду отсутствия панциря, определение не
только вида, но и рода всегда было сопряжено с рядом трудностей. Специфические
морфологические признаки поверхности клеток беспанцирных динофлагеллят, к
которым относится большинство родов (Gymnodinium, Gyrodinium, Amphidinium, Katodinium и др.), были изначально положены в основу их
идентификации на уровне рода. Большие затруднения в диагностике этих видов
вызывает необходимость исследования их живыми при оптической микроскопии, так
как при применении большинства фиксаторов динофлагелляты теряют отличительные
признаки, либо полностью разрушаются. Практически разделение вышеперечисленных
родов осуществляется по одному главному признаку: положению пояска и величине
расхождения его концов на брюшной стороне, т.е. по соотношению размеров эписомы
и гипосомы. Особенно нелегкие проблемы возникают при идентификации видов двух
крупнейших родов Gymnodinium и Gyrodinium. Определение беспанцирных динофлагеллят требует
сочетания экспериментальных лабораторных и естественных полевых наблюдений
(Коновалова, 1998; Теренько, 2002).
Динофлагелляты Черного моря. Обычно динофлагелляты
Черного моря изучались как компонент фитопланктона, а с 1970-х годов появились
работы, посвященные изучению отдельных видов, вызывающих «цветения» воды
(Нестерова, 1979). В последние годы в Черном море описаны новые для науки виды
динофлагеллят (Крахмальный, Теренько, 2002; Vershinin, Morton, 2005), а
также отмечены десятки новых для Черного моря видов (Теренько, 2007). Динофлагелляты представлены
в Черном море 345 видами и внутривидовыми таксонами, которые относятся к 54 родам, 25 семействам, 8 порядкам и 2
классам. К наиболее многочисленным порядкам относятся Peridiniales и Gonyaulacales, доля которых составляет 48,0%, наибольшее
видовое разнообразие характерно для родов Protoperidinium, Gymnodinium,
Dinophysis, Ceratium, Amphidinium и Prorocentrum. Современный список включает 57 новых, ранее
неизвестных для Черного моря динофлагеллят родов Gymnodinium (16), Dinophysis (10), Amphidinium и Oxytoxum (по 6), Ceratium, Gyrodinium и Cochlodinium (по 4), Alexandrium
и Warnowia (по 2), Protoperidinium, Prorocentrum и Thecadinium (по 1). Из
них обнаружено у берегов Украины – 45, России и Турции – по 5, Болгарии – 2.
Большинство впервые отмеченных в планктоне динофлагеллят (71,0%) являются
беспанцирными, среди них виды рода Gymnodinium (12), Amphidinium (8), Cochlodinium (5), Gyrodinium (4) и Warnowia (2).
В многолетнем аспекте отмечено увеличение количества
видов динофлагеллят, вызывающих «цветение» воды, так их число возросло от 1 – в
1960-х, 2 – в 1970-х и до 9 видов в настоящее время. В современный период в Украинском
секторе Черного моря «цветение» воды вызывают 9 видов динофлагеллят Akashiwo sanguinea, Gymnodinium simplex, Gyrodinium cornutum, G. instriatum, Lingulodinium polyedrum, Heterocapsa triquetra, Scrippsiella trochoidea, P. minimum и P. micans.
Отмечено появление 7 новых видов, ранее не вызывавших «цветение» воды Akashiwo sanguinea, Gymnodinium simplex, Gyrodinium cornutum, Gyrodinium instriatum, Lingulodinium polyedrum, Scrippsiella trochoidea и Prorocentrum micans. Три
вида H. triquetra, A. sanguinea и S. trochoidea
явились возбудителями «красных приливов». В
прибрежных эвтрофных районах Черного моря часто наблюдается массовое развитие
беспанцирных динофлагеллят с миксотрофным (A. sanguinea, G. simplex) и
гетеротрофным (Gyrodinium cornutum, Polykrikos schwartzii)
типами питания. Эти виды часто доминируют в планктоне после «цветений» крупных форм
диатомовых (Pseudosolenia calcaravis, Dactyliosolen fragilissimus
и Leptocylindrus danicus), которые
являются вероятным источником органического вещества для гетеротрофных клеток. Данные о массовом развитии динофлагеллят
в прибрежных районах Черного моря позволяют судить о трофности и рассматривать
их в качестве биологических индикаторов экстремально-эвтрофных морских вод.
Таким образом, внедрение новых методов исследования,
включая электронно-микроскопические в сочетании с методами молекулярной
биологии, способствуют заметному прогрессу в области систематики и филогении
динофлагеллят.
Список литературы
Беклемишев
В.Н. 1994. Методология систематики. М.: КМК Scientific Press Ltd. 250с.
Карпов
С.А. Система протистов. 2-е изд. – Омск, 1990. – 261 с.
Кусакин О.Г., Дроздов А.Л. Филема
органического мира. Ч. 2. – СПб: Наука, 1998. – 358 с.
Коновалова Г.В. Динофлагелляты (Dinophyta) дальневосточных морей России и сопредельных акваторий
Тихого океана. – Владивосток: Дальнаука, 1998. – С. 37-40.
Масюк
Н.П., Костиков И.Ю. Современные взгляды на положение водорослей в системе органического
мира // Альгология. – 2002. – Т. 12, №2. – С. 151-182.
Нестерова Д.А. Развитие перидинеи Exuviaella cordata Ostf. и явление
«красного прилива» в северо-западной части Чёрного моря // Биология моря.
–1979. – № 5. – С. 24-29.
Теренько Л.М. Некоторые методические аспекты
исследования динофлагеллят // Сб. научн. тр. НАН Украины, МГИ, ИнБЮМ
«Экологическая безопасность прибрежной и шельфовой зон и комплексное
использование ресурсов шельфа». – 2002.
– Вып. 1(6). – С. 310–316.
Теренько
Л.М. Видовой состав и распространение динофитовых водорослей (DINOPHYTA) Черного моря. // Альгология. – 2007. –Т. 17, №1 с.
53-70.
Крахмальный А. Ф., Теренько Г. В.
Prorocentrum ponticus Krachmalny et Terenko sp. nov. – новый вид Dinophyta из Чёрного моря //
Альгология. – 2002. – Т. 12, № 3. – С. 371-375.
Adl S. M., Simpson A. G.V., Farmer M.A et al. The new higher level
classification of eukaryotes with emphasis on the taxonomy of protists, // J.
Eukaryot. Microbiol. – 2005. –52(5). – P. 399-451.
Balech E. El genero
Protoperidinium Bergh, 1881 (=Peridinium Ehr., 1831) partim // Rev.
Mus. argent. cienc. nature. Hidrobiol. – 1974. – Vol. 4, № 1. – P. 1-79.
Bergh R.S. Der Organismus der
Cilioflagellaten. Eine phylogenetische Studie // Morphol. Jahrb. – 1881. – Vol.
7, № 2. – S. 177-288, Taf. 12-16.
Dodge J.D. The Prorocentrales (Dinophyceae). II.
Revision of the taxonomy within the genus Prorocentrum // Bot. J. Linn. Soc. –
1975. – Vol. 71, № 2. – P. 103-125.
Dodge J. Dinoflagellates: investigation and
phylogenetic speculation // J. Phycol. – 1983. – Vol. 18, №4. – P. 335-356.
Fensome R.A., Taylor F.J.R., Norris G. Sarjeant W.A.S.,
Wharton D.I. and Williams G.L. A classification of living and fossil
dinoflagellates. Hanover, Pennsylvania. – 1993. – 351 p.
Pascher A. Systematisch
Übersicht über die mit Flagellaten in Zusammenhang stehenden Algenreihen
und Versuch einer Einreihung dieser Algenstämme in die Stämme des
Pflanzenreiches // Beih. Bot. Zentralblatt. – 1931. – Vol. 48-II, № 2. – S.
317-332.
Steidinger K.A., Tangen K.
Dinoflagellates // Identifying Marine Phytoplankton / Ed. C.R.Tomas. – San
Diego: Acad. Press, 1997. – 858 p.
Vershinin
A., Morton S. Protoperidinium ponticum sp. nov. (Dinophyceae) from the
northeastern Black Sea coast of Russia
// Botanica Marina – 2005. – (48) – P. 244-247.
Williams G.L.,
Lentin J.K., Fensome R.A. The
Lentin and Williams index of fossil dinoflagellates 1998 edition. American
Association of Stratigraphic Palynologists, Contribution Series. – 1998. – Vol.
34. – 817 p.
Секция 2
Разнообразие,
экология и география водорослей.
Структура и
функционирование альгоценозов
СРАВНИТЕЛЬНЫЙ
АНАЛИЗ ЦИАНОБАКТЕРИАЛЬНО-ВОДОРОСЛЕВЫХ ЦЕНОЗОВ НЕКОТОРЫХ ПЕЩЕР РОССИИ
Абдуллин Ш. Р.
Comparative analysis
of the cyanobacterial-algae coenoses
in some Russian caves
Abdullin Sh. R.
Башкирский
государственный университет,
450074, г. Уфа,
ул. З. Валиди, 32, кафедра экологии,
тел.: (347)
273-66-56, факс: (347) 273-67-78
e-mail: abdullinshrbsu@mail.ru
Пещеры – это специфические экосистемы со своей
уникальной биотой, в состав которой входят цианобактерии и водоросли (Coute, Chauveau, 1994).
Региональные исследования видового состава данных организмов приобретают все
большую актуальность, так как восполняют пробел в инвентаризации общего
видового разнообразия флоры. Целью данной работы был сравнительный флористический
анализ цианобактериально-водорослевых ценозов (ЦВЦ) пещер Ледяная (Красноярский
край), Аскинская (Республика Башкортостан) и Кунгурская Ледяная (Пермский
край).
Пещера Ледяная расположена в 6 км от поселка Водники г.
Красноярска на землях Берёзовского
района, Красноярского края, РФ. Протяженность полости – 720 м; глубина – 32 м; площадь – 960 м2; объем – 2800 м3. Пещера
имеет два входа в форме воронок. Тип полости – карстовый, горизонтальный, ходы
расположены на трех горизонтах. Во входном гроте расположен не тающий даже в
летнее время ледник площадью 360
м2. Температура воздуха в пещере +3 ºС,
относительная влажность около 96 %. Экологическое состояние пещеры Ледяной
неудовлетворительное в связи с массовой посещаемостью (Цыкин и др., 1974). Ледяная
пещера по карстовому районированию относится к Саяно-Енисейской карстовой провинции
(Дублянский, Дублянская, 2008). Аскинская пещера –
одна из карстовых пещер Южного Урала мешкообразного типа с наибольшим по
площади ледником и самыми значительными ледяными сталагмитами. Полость
расположена в Архангельском районе Республики Башкортостан, в 2 км вверх по течению р. Малый
Аскын от д. Солонцы, на восточном склоне хребта Улу-Тау. Вход в пещеру находится на левом склоне долины, на высоте примерно 70 м над уровнем речки. Полость представляет собой зал длиной 104 м, шириной 40-60 м и высотой 10-12 м. Общая длина ходов – 230 м, площадь – 5200 м2, объем –
51100 м3,
глубина – 24 м,
амплитуда – 34 м
(Реестр…, 2006). Аскинская пещера по карстовому районированию относится
к Западно-Уральской карстовой провинции (Дублянский, Дублянская, 2008).
Кунгурская Ледяная пещера, знаменитая своими ледяными образованиями, расположена
на правом берегу р. Сылва, на северо-восточной окраине г. Кунгур (Пермская
область). Полость залегает в гипсах, ангидритах, доломитах и известняках;
протяженность – 5,7 км.
В пещере насчитывается 70 озер. Температура воздуха изменяется от -3,7 до +5,0 ºС.
В полости присутствует туристический маршрут с искусственным освещением. Входной
и выходной тоннели пещеры оборудованы шлюзами, естественные условия движения
воздуха в пещере нарушены (Дублянский, Кадебская, 2003). По карстовому
районированию Кунгурская Ледяная пещера относится к Волго-Уральской карстовой
провинции (Дублянский, Дублянская, 2008).
Выявление видового состава цианобактерий
и водорослей проводили стандартными методами (Кузяхметов, Дубовик, 2001).
В
результате анализа систематической структуры флор было выявлено, что наибольшая
насыщенность семейств и родов видами и разновидностями характерна для Ледяной
пещеры, семейств родами – для Кунгурской Ледяной пещеры (табл. 1). Наибольшее
среднее количество видов в одной пробе также было характерно для Ледяной
пещеры. Среди Cyanoprokaryota наибольшая
насыщенность семейств и родов видами и разновидностями отмечена для Аскинской
пещеры, семейств родами – для Кунгурской Ледяной пещеры (табл. 1).
Таблица 1
Систематическая структура цианобактерий и водорослей,
выявленных в пещерах Аскинская, Ледяная и Кунгурская
Ледяная
|
Таксоны
|
Аскинская
пещера
|
Ледяная
пещера
|
Кунгурская
Ледяная
пещера
|
|
Общее число видов и
внутривидовых таксонов
|
|
Число порядков
|
11
|
10
|
10
|
|
Число семейств
|
15
|
17
|
16
|
|
Число родов
|
20
|
22
|
22
|
|
Число видов и
разновидностей
|
24
|
29
|
25
|
|
Среднее количество видов в
одной пробе
|
4,7
|
5,5
|
2,5
|
|
Общие пропорции флор
|
|
Род / семейство
|
1,33
|
1,29
|
1,38
|
|
Вид и разновидность /
семейство
|
1,60
|
1,71
|
1,56
|
|
Вид и разновидность / род
|
1,20
|
1,32
|
1,14
|
|
Cyanoprokaryota
|
|
Число порядков
|
2
|
2
|
3
|
|
Число семейств
|
4
|
5
|
6
|
|
Число родов
|
4
|
6
|
9
|
|
Число видов и
разновидностей
|
8
|
8
|
11
|
|
Пропорции флор Cyanoprokaryota
|
|
Род / семейство
|
1,00
|
1,20
|
1,50
|
|
Вид и разновидность /
семейство
|
2,00
|
1,60
|
1,83
|
|
Вид и разновидность / род
|
2,00
|
1,33
|
1,22
|
|
Bacillariophyta
|
|
Число порядков
|
5
|
3
|
4
|
|
Число семейств
|
6
|
5
|
5
|
|
Число родов
|
6
|
7
|
6
|
|
Число видов и
разновидностей
|
6
|
11
|
7
|
|
Пропорции флор Bacillariophyta
|
|
Род / семейство
|
1,00
|
1,40
|
1,20
|
|
Вид и разновидность /
семейство
|
1,00
|
2,2
|
1,40
|
|
Вид и разновидность / род
|
1,00
|
1,57
|
1,17
|
|
Chlorophyta
|
|
Число порядков
|
4
|
5
|
3
|
|
Число семейств
|
5
|
7
|
5
|
|
Число родов
|
10
|
9
|
7
|
|
Число видов и
разновидностей
|
10
|
10
|
7
|
|
Пропорции флор Chlorophyta
|
|
Род / семейство
|
2,00
|
1,29
|
1,40
|
|
Вид и разновидность /
семейство
|
2,00
|
1,43
|
1,40
|
|
Вид и разновидность / род
|
1,00
|
1,11
|
1,00
|
Из
Bacillariophyta наибольшая насыщенность семейств и родов видами и
разновидностями, а также семейств родами выявлена для Ледяной пещеры (табл. 1).
Для Chlorophyta наибольшая насыщенность семейств видами и разновидностями,
а также родами отмечена для Аскинской пещеры, родов видами и разновидностями –
для Ледяной пещеры (табл. 1).
Представители
доминирующих отделов в указанных полостях полностью различались, доминирующие
семейства, виды, роды, порядки, жизненные формы и наиболее часто встречающиеся виды
имели среднее сходство (табл. 2). В результате сранительного флористического
анализа по качественному коэффициенту Съеренсена-Чекановского было выявлено,
что сходство видового состава также является средним и изменяется от 41,5 % (Аскинская
– Ледяная) до 53,1 % (Аскинская – Кунгурская). Во всех пещерах встречались
виды: Leptolyngbya gracillima
(Zopf.) Anagn. et Kom., Leptolyngbya boryanum (Gom.) Anagn. et Kom., Calothrix elenkinii Kossinsk., Nostoc
punctiforme f. populorum (Geitl.) Hollerb., Diadesmis contenta (Grun. ex Van Heur.) Mann, Hantzschia amphioxys (Ehr.) Grun., Mychonastes homosphaera (Skuja) Kalina et Punč. и Chlorhormidium flaccidum var. nitens Menegh. emend. Klebs.
Таблица 2
Доминирующие таксоны, наиболее часто встречающиеся
виды и спектр жизненных форм
цианобактерий и водорослей в
пещерах Аскинская, Ледяная и Кунгурская Ледяная
|
Таксоны
|
Аскинская
пещера
|
Ледяная
пещера
|
Кунгурская
Ледяная
пещера
|
|
Отдел
|
Chlorophyta
|
Bacillariophyta
|
Cyanoprokaryota
|
|
Порядки
|
Oscillatoriales,
Chlorococcales
|
Naviculales,
Oscillatoriales, Chlorococcales
|
Oscillatoriales,
Nostocales, Chlorococcales
|
|
Семейства
|
Phormidiaceae, Chlorellaceae
|
Diadesmidaceae, Pseudanabaenaceae, Naviculaceae
|
Pseudanabaenaceae, Nostocaceae
|
|
Роды
|
Phormidium, Leptolyngbya, Nostoc
|
Leptolyngbya, Navicula
|
Leptolyngbya, Nostoc, Navicula
|
|
Виды
|
Leptolyngbya gracillima, Nostoc punctiforme f. populorum
|
Mychonastes homosphaera, Muriella terrestris Boye-Pet., Leptolyngbya
gracillima, Nostoc punctiforme f. populorum, Chlorococcum
minutum Starr
|
Muriella magna Fritsch et John, Leptolyngbya gracillima, Mychonastes
homosphaera, Calothrix elenkinii, Leptolyngbya boryanum, Amphora
montana Krasske, Nostoc punctiforme f. populorum
|
|
Наиболее часто встречающиеся
виды
|
Leptolyngbya gracillima, Nostoc paludosum (Kütz.) Elenk.
|
Mychonastes homosphaera, Leptolyngbya gracillima, Chlorococcum minutum
|
Muriella magna, Leptolyngbya gracillima, Leptolyngbya boryanum, Amphora montana, Mychonastes homosphaera
|
|
Спектр
жизненных форм
|
P5Ch5hydr.4amph.2
CF2B2PF1C1H1X1
|
hydr.6B6Ch5P4CF2
amph.2PF1C1H1X1
|
Ch5P4hydr.4B4CF2
C2PF1M1H1
|
Таким образом, установлено, что в пещерах Аскинская, Ледяная и
Кунгурская Ледяная систематическая структура флор и доминирующие отделы
различаются. Тогда как доминирующие семейства, виды, роды, порядки, жизненные
формы, наиболее часто встречающиеся виды, а также видовой состав ЦВЦ имели
среднее сходство. Следовательно, на распределение ЦВЦ географическое положение
пещер оказывает среднее влияние.
Список литературы
Дублянский В.Н., Дублянская Г.Н. Карстоведение. Ч. 2:
Региональное карстоведение. – Пермь, 2008. – 267 с.
Дублянский В.Н., Кадебская О.И. 300 лет исследования
Кунгурской Ледяной пещеры // Кунгурская Ледяная пещера. 300 лет научной и
туристической деятельности: Материалы международной научно-практической конференции.
– Кунгур, 2003. – С. 12-40.
Кузяхметов Г.Г., Дубовик И.Е. Методы изучения почвенных водорослей. –
Уфа, 2001. – 56 с.
Реестр особо охраняемых природных
территорий Республики Башкортостан. – Уфа: Гилем, 2006. – С. 160.
Цыкин Р.А., Цыкина Ж.Л., Добровольский М.Н. Пещеры Красноярского края.
- Красноярск: Красноярское книжное изд-во, 1974. - 104 с..
Coute A., Chauveau
O. Algae // Encyclopaedia biospeleologica, tome 1 // C. Juberthie et V. Decu eds.,
Société de biospéologie. – ISSN 0398-7973. – 1994. – P.
371-380.
Специфика альгофлоры различных
участков лесных экосистем Башкирского государственного природного заповедника
(Южный Урал)
Бакиева Г.Р.,
Мельников А.С.
Specific characters of algal flora in different forest ecosystems plots
of the Bashkir State Natural Reserve (South Ural)
Bakieva G.R., Melnikov A.S.
Башкирский государственный педагогический университет им. М. Акмуллы,
450000 Республика Башкортостан, г. Уфа, ул. Октябрьской революции, 3а,
тел.: 8 (347) 273-02-90, факс: 8 (347) 273-34-90
е-mail: bakieva-gr@mail.ru
Башкирский государственный природный заповедник (БГПЗ)
организован в 1930 г.
и расположен в южной лиственно-светлохвойной средне- и низкогорной провинции
горнолесной зоны Южного Урала. В растительном покрове БГПЗ преобладают леса,
уникальные по экологическому разнообразию сообществ и по насыщенности их
редкими и исчезающими видами (Мартыненко и др., 2003). Для более тщательного и
эффективного мониторинга за состоянием этих лесных сообществ необходимо
изучение флоры почвенных водорослей, которые являются неотъемлемым компонентом
экосистем и хорошо отражают изменения условий среды.
Отбор проб и их культивирование выполнены по
общепринятым в почвенной альгологии методам. Глубина отбора проб составила 0-15 см. Для выявления видового
разнообразия использовали метод чашечных
культур со стеклами обрастания, а также культуральные методы с применением
жидких и агаризованных сред Болда, Бристоль. Для оценки обилия видов
использовали 15 бальную шкалу Р.Р. Кабирова и И.И. Шиловой (1990). Для
обнаружения сходства видового состава альгогруппировок различных участков
лесных экосистем использовали коэффициент Съеренсна-Чекановского, рассчитанный
с помощью программного модуля «GRAPHS»
(Новаковский, 2004).
Почвенно-альгологические сборы были проведены на
пробных площадках в разные периоды вегетационного сезона с июня по октябрь
2007-2008 г.
Исследовались различные участки лесных экосистем БГПЗ, расположенные на
невысоких горных областях массива Южный Крака: на склонах невысоких хребтов и
на более пологих отрогах, которые постепенно переходят в речные террасы.
Всего на исследованных участках лесных экосистем
обнаружено 95 видов и внутривидовых таксонов водорослей из шести отделов.
Ведущим отделом как уже не раз отмечалось исследователями (Алексахина, Штина,
1984) для лесных фитоценозов является Chlorophyta (табл.).
Таблица
Таксономическое разнообразие почвенных водорослей
лесов БГПЗ
|
Отдел
|
Число таксонов / %
|
|
классов
|
порядков
|
семейств
|
родов
|
Видовых и внутривидовых таксонов
|
|
Chlorophyta
|
2/30
|
6/32
|
11/35
|
13/36
|
35/37
|
|
Bacillariophyta
|
1/14
|
5/26
|
8/26
|
9/25
|
33/35
|
|
Cyanoprocaryota
|
1/14
|
3/16
|
7/23
|
9/25
|
22/23
|
|
Xanthophyta
|
1/14
|
3/16
|
3/10
|
3/8
|
3/3
|
|
Streptophyta
|
1/14
|
1/5
|
1/3
|
1/3
|
1/1
|
|
Eustigmatophyta
|
1/14
|
1/5
|
1/3
|
1/3
|
1/1
|
|
Всего
|
7/100
|
19/100
|
31/100
|
36/100
|
95/100
|
Анализ флористического сходства водорослевых сообществ
(или альгосинузий или альгогруппировок) с помощью коэффициента
Съеренсена-Чекановского и, построенная на его базе, дендрограмма (рис.1)
показывают, что, в целом, для альгогруппировок всех исследованных участков, характерно
относительно невысокое сходство видового состава. Величина коэффициента
варьировала с 21% до 76%.
По рассчитанным коэффициентам обособляются 3 группы
кластеров, которые включают в себя альгогруппировки со сходным видовым составом
(рис.1).



Рис.1. Дендрограмма сходства видового состава
водорослей исследованных участков.
По оси абсцисс – различные участки лесных
экосистем, по оси ординат – процент сходства видового состава по коэффициенту
Съеренсена-Чекановского
Первый кластер включает группировки почвенных
водорослей участков (№17-23) лесных экосистем расположенных на склонах
невысоких отрогов с преобладанием светлохвойных лесов с небольшой примесью березы.
Здесь преобладают грубоскелетные каменистые почвы. Основу разнообразия
альгогруппировок на этих участках составили представители отдела Chlorophyta
(23 вида и внутривидовых таксона).
Ведущая роль принадлежит порядку Chlorellales. Наибольшее количество
видов выявлено в семействах Chlamydomonadaceae, Chlorococcaceae.
Второй кластер объединяет группировки почвенных
водорослей участков (№3, 10, 14, 16) светлохвойных лесов с примесью березы,
расположенных в широкой долине р. Узян. Почвы более развиты, лучше увлажнены.
По сравнению с альгогруппировкой первого кластера повышается доля
представителей Bacillariophyta
(23 вида и внутривидовых таксона)
и они занимают доминирующее положение. Ведущим семейством является Naviculaсеае.
Третий кластер включает альгогруппировки, развивающиеся на участках светлохвойных лесов
с примесью березы, также расположенных в долине р. Узян (№1,2, 4-9, 11-13, 15,
17). Почвы характеризуются тяжелым механическим составом с преобладанием ила и
пылеватых частиц, хорошо увлажнены. Наибольший вклад в видовое разнообразие
альгофлоры этих участков вносили представители Bacillariophyta (35 видов и внутривидовых таксонов). На
втором месте по видовому разнообразию были отделы Cyanoprocaryota и Chlorophyta. Ведущий порядок Naviculales (21
вид и внутривидовых таксона).
Список литературы
Алексахина Т.И., Штина Э.А. Почвенные водоросли лесных
биогеоценозов. – М.: Наука, 1984. – 149 с.
Кабиров Р.Р., Шилова И.И. Почвенные водоросли свалок и
полигонов твердых бытовых отходов в условиях крупного промышленного города //
Экология. 1990. №5. С. 10-18.
Мартыненко В.Б., Соломещ А.И., Жирнова Т.В. Леса
Башкирского государственного природного заповедника: синтаксономия и
природоохранная значимость. Уфа: Гилем, 2003. 203 с.
Новаковский А.Б. Возможности и принципы работы
программного модуля «GRAPHS». -
Сыктывкар, 2004. – 28 с.
Альгологическая характеристика реки Сылва И ЕЕ ПРИТОКОВ
Беляева П.Г.
Algological
characteristics of the Sylva
River
and its
tributaries
Belyaeva P.G.
Институт экологии и
генетики микроорганизмов УрО РАН
614081 Пермь, ул.
Голева, 13, факс (342)2446711
е-mail: belyaeva@psu.ru
Сообщение основано на материалах
обработки проб фитоперифитона, собранных в маршрутных съемках на протяжении
среднего течения р. Сылва, ее притоках (реках
Ирень, Шаква, Иргина, Бабка) в 2005-2006 гг. и Сылвенском заливе Камского
водохранилища (2004-2005 гг.). Пробы отбирали с
камней и макрофитов, фиксацию проводили формалином. Обрабатывали пробы общепринятыми
гидробиологическими методами (Водоросли..., 1989).
За годы исследований (2004-2006) в фитоперифитоне исследованных
водотоков найдено 246 видов (278 разновидности и формы, включая номенклатурный
тип вида), относящихся к 52 родам, 27
семействам, 13 порядкам и 6 отделам. Высоким
видовым богатством отличаются в фитоперифитоне Сылвы и ее притоков диатомовые
водоросли, число их видов, разновидностей и форм составляет более половины
таксономического списка (189 таксонов рангом ниже рода или 68 % от их общего числа).
По видовому разнообразию выделялись роды Navicula (19),
Achnanthes (14), Nitzschia (14), Fragilaria (11), Cymbella
(10), Gomphonema (8). Наиболее часто встречались Cocconeis
placentula Ehr., С. pediculus Ehr., Navicula viridula (Kütz.) Ehr., N. rhynchocephala Kütz., Gomphonema
olivaceum (Lyngb.) Kütz., Diatoma
vulgare var. productum Grun, Synedra ulna (Nitzsch.)
Ehr., Amphora ovalis Kütz., Cymbella lanceolata (Ehr.) V.H.,
Fragilaria capuchina Desm., Aulacosira granulatа (Ehr.) Sim., Achnanthes lanceolata (Bréb.) Grun.
Зеленые водоросли в исследованных реках заметно
уступают по видовому богатству диатомовым (20% от общего числа водорослей). Летом разнообразие зеленых водорослей
значительно увеличивается. Среди зеленых водорослей наиболее распространенными
являются представители порядка Chlorococcales из родов Scenedesmus (12),
Monoraphidium (5),
Pediastrum (5). Постоянно встречались Scenedesmus falcatus Chodat,
S. quadricauda (Turp.) Bréb, S. sempervirens Chodat.,
Monoraphidium arcuatum (Korsch.) Hindák, Pediastrum boryanum (Turp.) Menegh.
из нитчатых форм обычно присутствуют представители родов Сladophora и
Mougeotia, реже Ulothrix и Oedogonium.
Цианобактерии в фитоперифитоне занимают
третье место по видовому богатству (30 таксонов рангом ниже рода или 10%
списочного состава). Летом их численность увеличивается за счет распространения многовидовых родов Merismopedia,
Glоeocapsa и Anabаena реже Oscillatoria, но удельное значение в общей биомассе
фитоперифитона невелико. Преобладание
этих групп водорослей характерно для большинства водотоков и водоемов умеренных
широт (Никулина 1976; Станиславская, 2003), что отражает специфику
фитоперифитона речных систем бореальной и субарктической зон (Никулина 1976;
Гецен, 1985).
В последние годы в
Сылве и ее притоках впервые обнаружены водоросли из отделов Euglenophyta, Chrysophyta и Rhodophyta,
вклад которых в видовое разнообразие альгофлоры обрастаний составил 1-2% от
списочного состава водорослей (рисунок). Эвгленовые водоросли представлены 3
видами: Trachelomonas volvocina Ehrenberg,
T. intermedia Dangeard
и Euglena proxima Dangeard.
Из золотистых встречается Dinobryon divergens Imhof
и Dinobryon sp.
Красные водоросли (Batrachospermum sp.) были
встречены лишь в эпилитоне р.Сылва.
Другой
отличительной чертой настоящего времени является исчезновение или значительное
сокращение численности некоторых видов водорослей свойственных чистой воде, в
частности: диатомовых (Tabellaria fenеstrata (Roth) Kütz., Meridion circulare (Grev.) Ag., Gomhponema intricatum Kütz.), зеленых (Closterium gracile Ralfs, Cosmarium granatum Ralfs, C. reniforme (Ralfs) Arch.), синезеленых (Gloeocapsa turgida (Kütz.) Hollerb., Gomphospheria lacustris Chod.). Весьма
существенным отличием современных альгоценозов является значительное повышение
численности и, соответственно, усиление роли мелкоклеточных видов водорослей,
среди которых наиболее многочисленны представители родов Scenedesmus, Monoraphidium и Achnanthes.
Коэффициент сходства
альгофлоры реки Сылва и ее притоков (по Сёренсену) составил 64.2-74.6%, что говорит
о высоком сходстве видового состава водорослей данных водотоков. Однако по мере
снижения скорости течения в исследуемых водотоках нами отмечены значительные
изменения таксономической структуры (рисунок). Так, в Сылвенском заливе
наблюдается значительное падение относительной доли диатомовых и, наоборот,
увеличение доли зеленых водорослей. На подобные изменения в соотношении видов
альгоценозов в условиях зарегулированного
стока обращено внимание и других исследователей (Девяткин, 2003; Охапкин, 2002).
В альгофлоре Сылвы кроме перифитонных форм,
морфологически приспособленных к прикрепленному образу жизни, постоянно
присутствуют планктонные (10.8-27.8%) и бентосные водоросли (17.2-44.6%). Такое
флористическое своеобразие в перифитоне часто отмечается другими авторами
(Бутакова, Станиславская, 2004; Комулайнен, 2005). В последнее время в Сылве
существенно возрастает абсолютное и относительное количество бентосных видов.
Положение по шкале галобности известно для 224
таксонов водорослей, подавляющее большинство которых относится к олигогалобам.
В течение последних лет доля галофилов в
р. Сылва несколько возросла, до 14.8% от общего числа таксонов. Среди
индикаторов рН среды в альгофлоре возросла доля алкалифилов (51% от общего
числа таксонов). Количество видов индифферентов к рН среды сократилось на 5%
(16.8%).
Рисунок. Соотношение
биомассы различных отделов водорослей (%).
По оси ординат – процентное соотношение биомассы различных
отделов водорослей.
1- р. Шаква, 2- р. Ирень, 3-
р. Бабка, 4- р. Иргина, 5- р. Сылва 1992-1999 гг., 6- р.Сылва 2000-2006 гг.,
7- Сылвенский залив Камского
водохранилища
Основу альгофлоры
исследованных рек составляют широко распространенные виды и космополиты – 81.0%
от числа таксонов; доля бореальных (3.3%) и арктоальпийских видов (1.3%) в сообществах
невелика и продолжает сокращаться. В альгофлоре был обнаружен как «южный»
комплекс видов (Cymbella, Gomphonema, Cladophora), так и элементы
«северной» флоры (Synedra, Achnanthes, Mougeotia).
Количество
видов-индикаторов сапробности в р. Сылва и ее притоках варьирует от 65 до 80%
от общего числа водорослей; преобладают β- и ο-β-мезосапробы (38.6%), α-β-мезосапробов
– 10.4%. Значения индекса сапробности по Пантле и Буку на протяжении всего
течения Сылвы и в притоках в целом изменялись от 1.61 до 2.05 (среднее значение
– 1.86±0.10) и не выходят за пределы β-мезосапробной зоны, что
соответствует III классу качества речных вод и
позволяет отнести их к категории умеренно загрязненных.
Список литературы
Баринова С.С., Медведева Л.А.,
Анисимова О.В. Биоразнообразие водорослей – индикаторов окружающей среды.
Тель-Авив, 2006. 498 с.
Бутакова
Е.А., Станиславская Е.В. Перифитон бассейна реки Исеть (Свердловская область)
// Ботан. журн. 2004. Т.89. № 92. С. 1420-1436.
Водоросли: Справочник. Под. ред. Вассера С.П.
Киев: Наукова думка, 1989. 608 с.
Гецен М. В. Водоросли
в экосистемах Крайнего Севера. Л.: Наука, 1985. 165 с.
Девяткин В.Г. Структура и продуктивность литоральных
альгоценозов водохранилищ Верхней Волги //
Автореф. дис. … д-ра биол. наук. М., 2003. 43 с.
Комулайнен С.
Ф. Структура и функционирование фитоперифитона в малых реках Восточной
Фенноскандии // Автореф. дис. … д-ра биол. наук. СПб., 2005. 50 с.
Никулина В. Н.
Первичная продукция и альгологические исследования некоторых рек Ленинградской
области с разной степенью сапробности // Гидробиологические исследования
самоочищения водоемов. Л., 1976. С. 18-43.
Охапкин А.Г., Юлова Г.А., Старцева Н.А.
Состав и эколого-флористическая характеристика фитопланктона малых водоемов
урбанизированных территорий (на примере города Нижнего Новгорода) // Ботан.
журн. 2002. Т. 87. № 2. С. 78 – 88.
Станиславская Е.В.
Перифитон притоков Ладожского озера. // Охрана и рациональное использование
водных ресурсов Ладожского озера. СПб., 2003. С. 249-252.
К ИЗУЧЕНИЮ
ФИТОПЛАНКТОНА МАЛЫХ РЕК БАССЕЙНА СРЕДНЕЙ ЛЕНЫ
Габышев В.А.,
Иванова А.П., Габышева О.И.
Phytoplankton
studies in small rivers of the Lena River
middle course
Gabyshev V.A., Ivanova A.P.,
Gabysheva O.I.
Учреждение Российской Академии
наук
Институт биологических проблем
криолитозоны СО РАН
677980 г.
Якутск, пр. Ленина, 41, тел. (411-2)33-56-90; факс (411-2)33-58-12
е-mail: v.a.gabyshev@ibpc.ysn.ru
К изучению водорослей планктона р. Лены, а также ее
крупных и средних притоков приступали неоднократно (Габышев, 1999, 2008а;
2008б; Ремигайло, Габышев, 2001). Однако альгологические исследования малых
притоков р. Лены ранее не проводились. Нами впервые предпринято изучение
планктонных водорослей и химико-физических параметров их среды обитания правых
притоков Средней Лены – рр. Тамма, Суола и Мыла. Это небольшие реки, длина
которых не превышает 250 км,
а площадь водосбора – не более 5500 км2 (Ресурсы поверхностных вод СССР, 1967). Начало
ледостава наступает в первых числах октября, начало весеннего ледохода – в
начале мая, продолжительность периода с ледовыми явлениями – около 220 дней.
Для отдельных участков описываемых рек отмечается полное промерзание русла в зимний
период и пересыхание в летнюю межень. Территория района исследований расположена
в зоне сплошного распространения вечномерзлых грунтов, климат –
резкоконтинентальный.
Цель работы: изучение особенностей таксономического и
эколого-флористического состава, а также количественного развития планктонных
водорослей малых рек бассейна Средней Лены.
В планктоне исследованных рек выявлено 197 видов
водорослей (206 таксонов рангом ниже рода, включая номенклатурный тип вида) из
7 отделов, 11 классов, 23 порядков, 58 семейств, 99 родов. Наиболее богат по
числу видов отдел зеленых водорослей
(44,9% от общего числа видов), за которым следуют диатомовые (28,4%) и
синезеленые (12,1%). Разнообразно представлены желтозеленые (5,6%) и
эвгленовые (4,1%). Беден видовой состав золотистых и динофитовых, суммарная
доля которых – 5,0%. Основу выявленного сводного списка на 85,4% составляют
зеленые, диатомовые и синезеленые водоросли, что характерно для водоемов
центральной Якутии (Васильева, 1989). На уровне классов выделяется Chlorophyceae
(36,5% видового состава), Pennatophyceae
(24,3%), Hormogoniophyceae и Conjugatophyceae
(по 8,1%); на уровне порядков – Chlorococcales (28,9%) и Raphales (20,8%). Самые высокие позиции в спектре семейств
принадлежат Naviculaceae (11,6% видового
состава), Scenedesmaceae (8,6%), Nostocaceae и Selenastraceae
(по 5,1%), Desmidiaceae (4,6%). К ведущим родам относятся Navicula и Scenedesmus
(по 6,6% видового состава), Cosmarium (3,0%), Nitzschia, Tetraedron и Monoraphidium (по 2,5%). Одно- и двувидовых семейств – 29, т.е.
половина их общего числа. Одно- и двувидовые роды составляют 78,9% списка
родов, на их долю приходится 51,8% видового состава. Преобладание маловидовых
семейств и родов, отличает северные флоры (Гецен, 1985). Пропорции флоры
1:1,7:3,4:3,6. Родовая насыщенность 2,0.
Вариабельность вида 1,0. Новым для флоры Якутии является 31 таксон
водорослей.
В фитопланктоне исследованных рек преобладают
истиннопланктонные виды (51,5% видового состава), с участием донных форм
(18,0%), что характерно для проточных водоемов с небольшими глубинами. Воды
р.р. Тамма, Суола и Мыла среднеминерализованы (по нашим данным минерализация
варьирует от 169,00 до 478,65 мг/л), что обусловливает преобладание олигогалобов (49,5%). Реакция среды слабощелочная
(pH 7,60-8,12), поэтому значительна доля индифферентов
(18,9%) и алкалифилов (12,6%). В
географическом плане облик флоры водорослей планктона исследованных водоемов
определяет бореальный комплекс видов, что характерно для ненарушенных водоемов
Севера Евразии. Исследованные реки принадлежат к водоемам
олиго-β-мезосапробного типа, и по системе Сладечека классифицируются как
слабозагрязненные. Колебания индекса сапробности в большинстве пунктов
наблюдений происходят в пределах 1,68-1,99. Отмечена закономерность сезонного
изменения уровня сапробности исследованных рек. Уровень сапробности в
большинстве пунктов наблюдений в весенний период выше, чем летом. Подобная
тенденция зафиксирована нами и при изучении фитопланктона Средней Лены
(Габышев, 1999). Это объясняется тем, что в весенний период во время паводка,
в реки со стоком с прибрежных территорий попадают аккумулированные в зимний
период загрязняющие вещества, что вызывает увеличение числа высокосапробных
видов фитопланктона. Летом во время межени, в реках происходят естественные
процессы (в том числе, и с участием водорослей планктона) очищения воды, и
развитие получают виды водорослей с меньшим сапробным индексом.
Сезонная периодичность развития фитопланктона
исследованных водоемов характеризуется повышением количественных и качественных
показателей планктонных альгогруппировок от весны, к летнему периоду максимальных
температур водной среды, и лимитируется относительно коротким периодом открытой
воды. Уровень количественного развития фитопланктона исследованных рек соответствует
имеющимся данным по водоемам Центральной Якутии (Васильева, 1989; Габышев,
1999).
Весной на исследованных реках наблюдения были
проведены 28-29 мая. В этот период реки имеют высокие уровень и скорость
течения воды; температура водной среды колеблется по разным пунктам от 14,0 до
17,0 ºС. Численность фитопланктона весной невысокая (от 0,96 до 39,44 тыс.
кл/л), биомасса также невелика (от 0,0030 до 0,0408 мг/л), что обусловлено
неблагоприятными условиями для развития фитопланктона в этот период. Весенний
планктон характеризуется преобладанием диатомовых водорослей, доля которых в
общей биомассе фитопланктона варьирует по разным участкам от 16,6 до 91,5%.
Зеленые водоросли стоят на втором месте в сложении биомассы фитопланктона – от
0,8 до 66,2%. Доля биомассы синезеленых водорослей колеблется по различным пробам
в пределах от «не обнаружено» до 12,2%. Доминирование в биомассе весеннего
планктона диатомовых водорослей, с участием зеленых и синезеленых характерно
для рек северных регионов, и в частности Якутии. В исследованных реках в мае
активно вегетируют представители эвгленовых водорослей, их доля в биомассе
фитопланктона достигает 16,6%. Динофитовые составляют до 9,9% биомассы
весеннего планктона. Золотистые и желтозеленые водоросли имеют в весеннем планктоне
очень низкие показатели развития, их доля в общей биомассе планктонных
водорослей не превышает соответственно – 1,7% и 1,1%. Индекс биоразнообразия
фитопланктона (Hb) весной варьирует по различным
пунктам наблюдений от 1,62 до 3,64, и в среднем составляет 2,83, что для
речного планктона является высоким показателем. В составе доминирующих по
биомассе видов водорослей в весенний период отмечены широко распространенные в
планктоне представители диатомовых и зеленых: Synedra ulna (Nitzsch) Ehr., Dictyococcus
mucosus Korsch., Cosmarium didymoprotupsum W. et G. S. West, Closterium
moniliferum (Bory) Ehr.
В летнюю межень наблюдения были проведены 16-17 июля.
В это время уровень воды и скорость течения исследованных рек минимальные за
безлёдный период; вода хорошо прогревается – температура колеблется по разным
пунктам от 23,5 до 27,0 ºС. В июле фитопланктон рр. Тамма, Суола и Мыла
находится на пике своего развития. Численность фитопланктона в этот период
достигает максимума (от 14,88 до 1122,22 тыс. кл/л), биомасса также имеет
высокие значения (от 0,0029 до 0,1616 мг/л). Летом планктон характеризуется
преобладанием зеленых водорослей, доля которых в общей биомассе водорослей
варьирует на разных участках от 5,6 до 90,3%. На втором месте в сложении
биомассы фитопланктона водоросли из отдела синезеленых – до 64,1%. Высокую роль
в планктоне сохраняют диатомовые, они составляют до 21,4% биомассы, а в
предустьевом участке р. Суола имеют два пика – до 69,9% и до 93,3% на разных
пунктах. Колебания биомассы эвгленовых водорослей в пробах происходят в
пределах от «не обнаружено» до 16,0% общей биомассы фитопланктона. А в р. Мыла
эвгленовые составляют летом от 28,1 до 36,8% биомассы. Желтозеленые и
динофитовые водоросли в летний период имеют низкие показатели развития, их доля
в общей биомассе планктонных водорослей не превышает соответственно – 6,7% и
2,9%. Золотистые летом в исследованных водоемах встречаются крайне редко и их
роль в формировании биомассы фитопланктона незначительна – до 0,2%. В летний
период, индекс биоразнообразия (Hb) варьирует по
различным пунктам наблюдений от 2,01 до 3,88, и в среднем составляет 3,08, это
высокий показатель для речного планктона. В составе структурообразующих видов
планктона летом происходят существенные изменения. Выделено 4 доминирующих
вида летнего планктона: Aphanizomenon flos-aquae (L.) Ralfs, Closterium
moniliferum (Bory) Ehr., Pandorina morum (Mill.) Bory, Pediastrum
boryanum (Turp.) Menegh. Это широко
распространенные планктонные виды. Следует отметить, что среди них нет
диатомей, это представители зеленых и синезеленых водорослей.
Доминирование в биомассе планктона зеленых, диатомовых
и синезеленых водорослей в летний период характерно для небольших, хорошо
прогреваемых, медленнотекущих рек. Эвгленовые водоросли в исследованных реках
играли заметную роль в формировании биомассы фитопланктона (после диатомовых,
зеленых и синезеленых), что не характерно для проточных водоемов Центральной
Якутии (Васильева, 1989). Представители эвгленовых интенсивно развиваются в водоемах
замедленного стока с умеренной минерализацией и повышенным содержанием
органических веществ и биогенных элементов (Вассер и др., 1989). Отмеченный
нами факт незначительного количественного развития в данных реках золотистых
водорослей также нехарактерен для северных рек. Золотистые водоросли преимущественно
обитатели холодных чистых вод. В водах рр. Тамма, Суола и Мыла нами отмечены
высокие концентрации биогенных и органических веществ, ПДК по некоторым из них
многократно превышены: аммонийная (до
3,6 ПДК) и нитритная (1,6 ПДК) формы азота; фосфора минерального (до 1,6 ПДК),
общего (до 2,9 ПДК); железа общего (до 6,8 ПДК); легкоокисляемых органических
веществ (до 2,2 ПДК); трудноокисляемых органических веществ (до 7,3 ПДК). В
районе, где протекают исследованные реки, развито сельское хозяйство и причины
повышенного содержания аммонийной и
нитритной форм азота, а также фосфорных соединений носят антропогенный
характер и вызваны стоком с прилегающих территорий. Превышение ПДК по железу,
легко- и трудноокисляемым органическим веществам – природного характера.
Таким образом, фитопланктон данных рек находится под
влиянием преимущественно природных факторов со слабо выраженным антропогенным
воздействием, богат в видовом отношении, а по эколого-флористическому составу
и количественным показателям развития сохраняет черты ненарушенных северных
водоемов. Об оригинальности полученного материала свидетельствует наличие в
планктоне исследованных рек 31 нового для региональной флоры вида водорослей.
Уровень количественного развития фитопланктона исследованных рек соответствует
имеющимся данным для водоемов Центральной Якутии и лимитируется относительно
коротким безледным периодом и слабым прогревом воды. Сезонная периодичность
развития фитопланктона исследованных водоемов характеризуется повышением
количественных и качественных показателей от весны к лету и по классификации
Богорова является моноциклической. Основу биомассы фитопланктона исследованных
рек формируют диатомовые, зеленые, и синезеленые водоросли. Отмеченное нами
высокое содержание органики и биогенных элементов в водах исследованных рек –
причина повышенного уровня вегетации водорослей из отдела эвгленовых и слабого
развития золотистых. Среди структурообразующих видов фитопланктона широко
распространенные планктонные виды из отделов зеленых, синезеленых и диатомовых
водорослей. Индекс биоразнообразия фитопланктона исследованных рек высокий,
следовательно планктонные альгоценозы не испытывают серьезного пресса внешних
ингибирующих факторов природного или антропогенного характера. Сезонное
варьирование индекса сапробности свидетельствует, с одной стороны, о
поступлении органических веществ со стоком, с другой – о наличии
самоочистительной способности экосистемы исследованных рек, в том числе и за
счет функциональной роли водорослей планктона.
Список литературы
Васильева И.И. Анализ видового состава и
динамики развития водорослей водоемов Якутии.- Якутск: Изд-во ЯНЦ СО АН СССР,
1989. - 48с.
Вассер С.П., Кондратьева Н.В., Масюк Н.П.
и др. Водоросли: Справочник. Киев: Наукова думка, 1989. - 608 с.
Габышев В.А. Водоросли планктона реки
Лены в зоне влияния г. Якутска: Автореф. дис. канд. биол. наук. Новосибирск,
1999. - 16 с.
Габышев В.А. Водоросли планктона водоемов
бассейна р. Молодо (Россия, Якутия) // Гидробиологический журнал. 2008. -
Т.44, №3.- С. - 12-18.
Габышев В.А. Фитопланктон некоторых
притоков Средней Лены // Фундаментальные и прикладные проблемы ботаники в
начале XXI века: материалы XII съезда Русского ботанического общества. - Ч.
2. - Петрозаводск: Карельский научный центр РАН, 2008. - С. 21-23.
Гецен М.В. Водоросли в экосистемах
Крайнего Севера. - Л.: Наука, 1985. - 165 с.
Ремигайло П.А., Габышев В.А.
Таксономическая структура и видовое разнообразие фитопланктона верховьев реки
Алдан // Сибирский экологический журнал. 2001. - Т. 8, №4. - С. - 385-387.
Ресурсы поверхностных вод СССР. Основные
гидрологические характеристики. - Т. 17 (Лено-Индигирский р-н). - Л.:
Гидрометеоиздат, 1967. - 164 с.
токсичность
цианобактерий Шершневского водохранилища. Влияние экологических факторов
Гаврилова Е.В., Духовная Н.И., Пряхин Е.А.
Cyanobacteria toxicity of the Shershnevskoe
reservoir. Ecological factors influences
Gavrilova E.V., Dukhovnaya
N.I., Pryakhin E.A.
ФГУН
«Уральский научно-практический центр радиационной медицины»
454076, г. Челябинск, ул. Воровского, 68А; тел.:
(351) 232-79-25; факс: (351) 232-79-13
e-mail: pryakhin@urcrm.chel.su
Предсказание возможности развития
токсического «цветения» водоемов – источников питьевого водоснабжения является
важным этапом на пути быстрого реагирования системы водоочистки для обеспечения
безопасности населения. Недопонимание масштаба развития токсического «цветения»
водоемов в нашей стране не позволяет защитить население при использовании воды
в питьевых и рекреационных целях
В настоящей работе оценивали токсические
свойства цианобактерий Шершневского водохранилища с использованием мышей линии СВА,
а также проводили анализ факторов, оказывающих влияние на их токсичность. В
приплотинной области Шершневского водохранилища в течение вегетационных сезонов
2004-2007 гг. еженедельно проводились исследования количественного развития,
видового состава, токсических свойств цианобактерий и содержания микроцистина в
воде (2006-2007 гг.). Для оценки численности и видового состава цианобактерий
отбирали поверхностные пробы воды и концентрировали их на мембранных фильтрах с
размером пор 0,45 мкм (МФАС–ОС-2 Владипор). Анализ проб фитопланктона проводили
стандартными гидробиологическими методами с использованием соответствующих
определителей [1,
2, 3, 4, 5, 6, 7, 8, 9, 10, 11]. Кроме того, одновременно отбирали воды
для гидрохимического анализа (анализ был проведен химической лабораторией
Сосновских очистных водопроводных сооружений).
Для оценки токсических свойств получали
концентрированную суспензию цианобактерий путем фильтрации большого объема воды
через двухслойную сеть из мельничного газа. Животным внутрибрюшинно вводили
взвесь препарата из цианобактерий. В каждом опыте испытывали 7 доз
цианобактерий в диапазоне 25 - 650 мг/кг (сухой вес). Экспериментальные группы
состояли из 5 животных. Длительность наблюдения за животными в остром опыте составляла
не менее 14 дней после введения. Всего в экспериментах было использовано более
1500 животных.
Среднюю летальную дозу, ошибку и 95%
доверительный интервал вычисляли с помощью метода пробит-анализа по Личфилду.
Влияние различных факторов (температуры воды, количества солнечных дней,
количества осадков, солнечной активности (количество пятен на Солнце, выраженное
в числах Вольфа), средней скорости ветра, содержания биогенных веществ (P, N, N/P), средней
проточности, численности и биомассы цианобактерий, качественного состава проб
цианобактерий) оценивали с помощью регрессионного анализа, однофакторного
дисперсионного анализа и многофакторного дисперсионного анализа признаков
сопряженности в главной линейной модели.
Было
выявлено, что LD50 цианобактерий (сухой вес) варьирует в
широких пределах – от 48,4 до 572 мг/кг, причем за короткие сроки. При анализе
характера распределения значений ЛД50 было выявлено, что данные лучше всего
описываются логнормальным распределением (D критерий Колмогорова-Смирнова = 0,15; р ≥ 0,1).
Распределение данных по ЛД50 имело следующие характеристики: среднее
значение 126 мг/кг (доверительный интервал 103-154 мг/кг); медиана 102 мг/кг
(доверительный интервал 83 - 153 мг/кг); максимум 572 мг/кг; минимум 48 мг/кг. Из
43 проанализированных проб цианобактерий (в соответствии с классификацией ВОЗ)
49% можно было отнести к высокотоксичным (ЛД50 < 100мг/кг); 49% –
к умеренно токсичным (ЛД50 100-500 мг/кг); 2% – к низкотоксичным.
При оценке влияния факторов на токсичность
цианобактерий (в регрессионном анализе) было выявлено, что в пробах, взятых из
районов образования нагонных явлений, токсичность цианобактерий снижена.
Однако, даже с учетом некоторого снижения токсичности цианобактерий, при образовании
нагонных явлений создается опасность для здоровья населения из-за огромной концентрации
клеток цианобактерий в воде, а также выделения цианотоксинов непосредственно в
воду.
При проведении регрессионного анализа не
было выявлено влияния следующих факторов на токсичность цианобактерий:
температуры воды (во время отбора); температуры воздуха (среднемесячной);
среднего количества солнечных дней, средней солнечной активности по числам
Вольфа и средней скорости ветра за неделю, предшествующую отбору пробы;
среднемесячного количества осадков; содержания биогенных веществ (P, N, N/P); проточности,
численности и биомассы цианобактерий в воде в день отбора; качественного
состава концентрированных проб цианобактерий.
При проведении многофакторного дисперсионного анализа
была описана следующая модель, учитывающая факторы, сочетание которых оказывает
влияние на токсичность цианобактерий Шершневского водохранилища. Характеристики
модели приведены в таблице 1.
Таблица 1
Характеристики модели влияния факторов
на токсичность цианобактерий Шершневского
водохранилища
|
Фактор
|
Коэффициент b
|
Статистика Вальда
|
Значимость
|
|
Солнечная
активность
|
- 0,9 ± 0,5
|
3,9
|
0,048
|
|
Проточность
|
1,7·102
± 0,7·102
|
5,6
|
0,018
|
|
Количество
солнечных дней
|
- 12 ± 6
|
3,8
|
0,050
|
|
Примечание – критерий
отношения правдоподобия c2 = 9,9;
р =0,019
|
Наиболее сильное влияние на токсичность в
рамках данной модели оказывает среднемесячная проточность водохранилища
(статистика Вальда 5,6). Причем повышение проточности оказывает отрицательное
влияние на токсичность цианобактерий, что легко объяснимо, т.к. цианобактерии
предпочитают условия с низким водообменом.
Примерно одинаковыми по силе влияния на
токсичность являются факторы солнечной активности и количества солнечных дней
(средние за неделю до отбора пробы цианобактерий показатели), статистика Вальда
составила 3,9 и 3,8 соответственно. Оба эти фактора оказывают положительное
влияние на токсичность. Это вполне согласуется с литературными данными о том,
что на пиках солнечной активности происходят всплески токсичности цианобактерий
и возникновения случаев отравления людей и животных [12].
Таким образом, при поведении
многофакторного анализа выявлено, что оптимальными условиями для продукции
токсинов цианобактериями Шершневского водохранилища является установление
солнечной погоды в сочетании с высокой солнечной активностью и низкой
проточностью.
Список литературы
1. Методические рекомендации по сбору и обработке
материалов при гидробиологических исследованиях на пресноводных водоемах:
Фитопланктон и его продукция / под ред. Г. Г. Винберга. Л., 1984. 31 с.
2. Голлербах М.М., Косинская Е.К., Полянский В.И.
Синезеленые водоросли // Определитель пресноводных водорослей СССР. М., 1953.
Вып. 2. 653 с.
3. Дедусенко-Щеголева Н.Т., Голлербах М.М.
Желтозеленые водоросли // Определитель пресноводных водорослей СССР. М.-Л.,
1962. Вып.5. 271 с.
4. Кондратьева Н.В., Коваленко О.В. Краткий
определитель видов токсических синезеленых водорослей. Киев, 1975. 80 с.
5. Косинская Е.К. Десмидиевые водоросли // Флора
споровых растений СССР. М., 1960. Т.5. Вып. 1. 707 с.
6. Матвиенко А.М. Золотистые водоросли // Определитель
пресноводных водорослей СССР. М., 1954. Вып. 3. 188 с.
7. Мошкова Н.А., Голлербах М.М. Зеленые водоросли.
Класс Улотриксовые // Определитель пресноводных водорослей СССР. Л., 1987.
Вып.10 (1). 360 с.
8. Паламарь-Мордвинцева Г.М. Зеленые водоросли. Класс
Конъюгаты. Порядок Десмидиевые // Определитель пресноводных водорослей СССР.
Л., 1982. Вып. 11 (2). 620 с.
9. Попова Т.Г. Эвгленовые водоросли // Определитель
пресноводных водорослей СССР. М., 1955. Вып. 7. 282 с.
10. Царенко П.М. Краткий определитель хлорококковых
водорослей Украинской ССР. Киев, 1990. 208 с.
11. Коршиков О. А. Пiдклас протококовi (Protococcinea) // Визначник прiсноводних водоростей Украiнскоi РСР. Киiв, 1953. Вип. 5. 439 с.
12. Логинова Е.В. Возможность проявления токсичности
водорослей в водоемах Беларуси // Вестник БГУ. 1995. сер.2. №1. С. 55-63.
СТРУКТУРА И ПРОСТРАНСТВЕННОЕ РАСПРЕДЕЛЕНИЕ
ВЕСЕННЕГО ПЛАНКТОННОГО ФИТОЦЕНОЗА ЗАПАДНОГО ПОБЕРЕЖЬЯ
СРЕДНЕГО КАСПИЯ В СОВРЕМЕННЫХ УСЛОВИЯХ
Гасанова А.Ш.,
Гусейнов К.М.
The
structure and spatial distribution of spring plankton
in
the Caspian Sea western coast in modern
conditions
Gasanova A.S., Guseynov K.M.
Прикаспийский институт биологических ресурсов, Дагестанский научный
центр РАН
г. Махачкала, ул. Магомеда Гаджиева, д. 45, 367000
e-mail: ais61@mail.ru,
pibrdncran@iwt.ru
Характерные для
Каспия периодические колебания уровня и биологические инвазии определяют трудно
предсказуемые изменения в его экосистеме и определяют актуальность
исследований.
Каспийское море – величайший в мире естественный
замкнутый водоем, вытянутый в мередиальном направлении на 1300км., по параллели
– от 200 до 560 км.
Общая площадь береговой линии Каспия составляет 7000 км. Протяженность
береговой линии акватории дагестанского побережья Каспия составляет 530 км и занимает всю
западную часть Среднего и южную оконечность Северного Каспия, что определяет
большой размах пространственно-временной изменчивости солености ее вод. Ее
гидрологический режим формируется под воздействием стока рек Волга, Терек,
Сулак, а также причинами
естественного и антропогенного характера. При средней солености среднекаспийских
вод 12,84‰, средняя соленость морских вод в траверзе р. Терек составляет 7,53‰,
в районе г. Махачкалы – 10‰ , в акватории г. Избербаш – 11,21‰ , в южной части
побережья – 12,85‰. Амплитуда синоптических, сезонных колебаний солености
прибрежных морских вод достаточно велика. Испытывая распресняющее воздействие
стока дагестанских рек и северокаспийских вод, градиент солености между
экстремальными значениями достигает 7,53‰.
Материалом послужили гидробиологические пробы,
собранные весной 2006г. в акватории дагестанского побережья Среднего Каспия.
Фиксированные пробы отстаивались в темноте не менее 15 суток. Материал
концентрировали общепринятым методом осаждения (Усачев, 1961, Киселев, 1969).
Камеральная обработка проводилась в камере типа Ножотта, объемом 0,1мл
(Абакумов, 1983) с трехкратной повторностью под световым микроскопом Биолам Р15
(увеличение х400 и х200). Массу водорослей рассчитывали используя формулы
геометрического подобия клеток. Обилие всего фитопланктона и отдельных видов
оценивали по сырой массе, выраженной в мг/м3 и г/м3.
Плотность (численность) фитопланктона выражали в млн. экз./м3.
Развитие водорослей зависит от комплекса факторов,
сочетание которых определяет состояние альгоценоза. Видовой состав
фитопланктона в целом, а также распределение по акватории тех или иных видов,
отражают неоднородность среды и
конкретную экологическую обстановку, совпадая с пространственно-временной
динамикой основных абиотических факторов: солености, температуры, концентрации
биогенов. В настоящей работе представлен материал о составе и распределении
фитопланктона в зонах с различной структурой вод.
Наибольшее таксономическое разнообразие, а также
максимальные величины биомассы и численности фитопланктона отмечены в Северной
зоне (Кизлярский залив – устьевая зона реки Сулак) дагестанского побережья Каспия.
Эта зона отличается низкой и постоянно колеблющейся соленостью (7,53 – 10‰),
малыми глубинами (6 – 30м), большим притоком биогенных веществ, вносимых водами
Волги, Терека и Сулака. Фитопланктон Северного района акватории наиболее богат.
В нем обитают виды характерные для Северного Каспия и не наблюдаемые в других
районах. Здесь наблюдалась вегетация Aphanizomenon flos-aguae, Anabaenopsis tanganyikae,
Coscinodiscus lacustris, Actinocyclus ehrenbergii var. ehrenbergii и др. Основная роль в формировании биомассы в этом
районе принадлежала водорослям отдела Bacillariaphyta (85,8%). Вклад других таксонов был несоизмеримо меньше: Cyanophyta – 9,3%, Dinophyta
– 5,7%, Chlorophyta – 0,1%. Наибольшие показатели численности образовывали
Cyanophyta – 59,3%. Диатомовые занимали второе место и
составляли 24,1%. На долю динофитовых и зеленых приходилось 11 и 5,4% соответственно.
В планктоне доминировала диатомовая аутакклиматизант Pseudosolenia
calcar-avis. Виды весеннего фитокомплекса – диатомовые Pseudosolenia calcar-avis, Cyclotella caspia var. lacustris, Actinocyclus ehrenbergii, Coscinodiscus jonesianus, Coscinodiscus radiatus,
которые преобладали в альгоценозе данного района, вносили основной вклад в
формирование биомассы. При анализе состава фитопланктона в местах наивысших
концентраций выявлено, что они обусловлены развитием Pseudosolenia calcar-avis. Ее биомасса на отдельных станциях достигала 15282,18
мг/м3 при численности 201млн. экз./м3. Наблюдалось обильное
развитие Cyclotella caspia,
характерное для поздневесеннего комплекса, при численности 27 млн. экз./м3
ее биомасса не превышала 8,70мг/м3. Одновременно начинает
формироваться летний фитопланктон. Водоросли семейства Chaetoceros,
характерные для ранневесеннего комплекса, полностью отсутствовали в планктоне.
Из зеленых водорослей присутствовали виды, характерные для летнего альгоценоза
– Planctonema lauterbornii и Scenedesmus guadricauda. Теплолюбивые
динофитовые были представлены водорослями рода Prorocentrum, Goniaulax, Glenodinium, однако значения их биомассы в это время не превышали
89,1мг/м3. Доминировала среди динофитовых Prorocentrum cordata. Наиболее
многочисленны в этой зоне были Cyanophyta (59,3%) (рис. 1). Доминировала Oscillatoria sp.
С продвижением на юг, увеличением солености (11,3 –
12,6‰) и прогревом водной толщи, в Центральной зоне исследуемой акватории
(акватории городов Махачкала, Избербаш) наблюдалось обеднение видового состава
и уменьшение значений биомассы в 3,3 раза и численности на 89,9 млн. экз./м3.
(рис. 1). Многие синезеленые и зеленые угасали в своем развитии или совсем выпадали
из планктона. Фитопланктон состоял из солоноватоводных и морских видов и
становился все более «летним». В этом ареале наблюдалось возрастание роли
теплолюбивого динофитового комплекса, который составлял 39,9% от общей
биомассы, что в 34,2 раза больше чем в Северной зоне дагестанского побережья. Cyanophyta и Chlorophyta составляли 10,3 и 0,1% соответственно. В планктоне преобладали
диатомовые водоросли (49,6%), большой вклад в биомассу которых внесли крупные
водоросли морского происхождения – Rhizosolenia
fragilissima и водоросли рода Coscinodiscus.
Обычная для летнего альгоценоза пресноводная Planctonema lauterbornii в незначительных количествах встречалась по всей
акватории. Руководящая роль в количественном отношении в этой зоне принадлежала
синезеленым водорослям. Oscillatoria sp. вегетировала
в значительных количествах на станциях этой части акватории и составляла 63,8%
от общей численности, что на 4,5% больше чем в Северной зоне. Второе место по
численности занимали динофитовые (21,5%), что в 1,9 раз больше чем в предыдущем
районе акватории. Bacillariophyta, Chlorophyta и Cryptophyta составляли 13,1; 1,0; 0,4%
А
Б
Рис. 1. Распределение численности (млн. экз./м3)
(А) и биомассы (мг/м3) (Б) основных таксонов
весеннего фитопланктона в разных зонах акватории
дагестанского побережья Каспия
соответственно.
Преобладание мелкоклеточных форм водорослей в Центральной зоне привело к значительному
снижению общей биомассы (рис.1).
Район Южной части дагестанского побережья Каспия
(прибрежная акватория г. Дербент, и далее до реки Самур) отличается большими
глубинами, слабым притоком пресных вод, постоянством физико-химического режима
и большими значениями солености (12 – 13‰), так как большая часть речных и
морских вод поступает сюда уже в трансформированном виде. В этой зоне акватории
наблюдался полный переход к летнему фитокомплексу. В планктоне
вегетировали теплолюбивые очень
эвригальные морские солоноватоводные виды. Наблюдалось увеличение роли
динофитовых водорослей. Биомасса в этой зоне увеличилась в 1,9 раз за счет
вегетации крупноклеточных диатомовых рода Coscinodiscus и динофитовых рода Prorocentrum. Основная роль в формировании биомассы в этом районе,
так же, как и в предыдущих районах, принадлежала диатомовым, которые составляли
67,8% от общей биомассы. По сравнению с центральным районом исследуемой
акватории их биомасса увеличилась в 2,6 раз. Второе место сохранили
микроводоросли из отдела динофитовые. В этой части акватории они получили
наибольшее развитие. Их биомасса выросла на 76,5 мг/м3 и составила
28,9% от общей биомассы. Вклад в общую биомассу синезеленых и зеленых был
невелик и составил 3,3 и 0,03% соответственно, что почти в три раза меньше, чем
в Центральной зоне акватории. В численном отношении в этом районе, так же как и
в предыдущих районах, преобладали синезеленые (55,7%). Однако их плотность
уменьшилась в 1,8 раз. Второе место принадлежало динофитовым (31,5%).
Численность диатомовых уменьшилась в 1,6 раз и составляла 12,3%. Зеленые в этой
части акватории составляли 0,4% от общей численности. В целом, в этой части
акватории численность уменьшилась в 1,58 раз. Наблюдалось уменьшение плотности
микроводорослей по всем отделам. Интересно отметить, что в планктоне южной
части исследуемой акватории диатомеи Cyclotella caspia, Pseudosolenia calcar-avis, Rhizosolenia fragilissima отсутствовали.
Работа выполнена при финансовой поддержке РФФИ (проект
№ 09-04-96579 «Разработка эффективных механизмов защиты экосистемы Среднего
Каспия в условиях биоинвазий»)
Список литературы
Абакумов В.А. Руководство по методам гидробиологического анализа
поверхностных вод и донных отложений. Л.: Гидрометиздат. 1983. 239с.
Киселев И.А. Планктон морей и континентальных водоемов. Л.: Наука,
1969. Т. 1. 658с.
Усачев П.И. Количественная методика сбора и обработки
фитопланктона // Труды ВГБО. 1961. Вып. 11. С. 411 – 415.
Центрические Диатомовые водоросли реки
Свислочь (Беларусь)
Генкал С.И.1,
Михеева Т.М. 2, Куликовский М.С.1, Лукьянова Е.В.2
1Институт биологии внутренних вод, Борок,
Россия
2Белорусский
государственный университет, Минск, Беларусь
Centric diatoms of the
Svisloch River
(Belarus)
Genkal S.I.1, Mikheeva T.M.2, Kulikovskiy M.S.1, Lukyanova E.V.2
1 Institute for Biology of Inland
Waters RAS, Borok, Russia
2 Belarusian State University, Minsk, Belarus
Река Свислочь –
самый крупный приток р. Березины (длина
реки 297 км,
площадь водосбора 5160 км2) – классический пример небольшого
водотока, подверженного мощному антропогенному воздействию. Еще в начале 40-х
гг. прошлого столетия р. Свислочь считалась самой загрязненной рекой в Европе.
В настоящее время, несмотря на предпринимаемые мероприятия по улучшению качества
ее вод, она является наиболее загрязненной рекой республики Беларусь. Являясь главной
водной магистралью г. Минска и важным элементом городской среды (эстетика
города, зоны рекреации и др.), она требует повышенного внимания к своей
дальнейшей судьбе.
Исследования р. Свислочь проводились разными авторами
и коллективами на разных ее участках с 1928 г. по настоящее время, но весьма
нерегулярно и были направлены, в основном, на выяснение химических и
бактериологических условий в реке, а в более поздние годы – на изучение процессов
биологического самоочищения. В последней публикации, основанной на
исследованиях 1973 г.,
для фитопланктона приводится 210 видовых и внутривидовых таксонов из 77 родов,
в том числе по Bacillariophyta 23
рода и 67 таксонов более низкого ранга включая 12 представителей класса Centrophyceae: Attheya zachariazii,
Aulacoseira granulata, A. italica, Cyclostephanos dubuis, Cyclotella bodanica, C. comta, Cyclotella sp., Stephanodiscus binderanus, S. hantzschii f. hantzschii, S. hantzschii f. tenuis, S. parvus, S. rotula. При круглогодичных ежемесячных исследованиях в 1995–1996
гг. нами (Т.М.Михеевой) выявлено значительно меньшее число видов, как в общем
фитопланктоне, так и среди диатомовых водорослей (102 и 37 соответственно), из
них только 9 видов относилось к центрическим диатомеям.
По данным свето-микроскопических исследований,
проведенных в 2006–2007 гг., в фитопланктоне выявлено 222 таксона из 87 родов,
в том числе 78 диатомовых видового и внутривидового ранга из 21 рода, в том
числе 11 представителей Centrophyceae. По сравнению с данными 1974 г.видовое богатство водорослей
увеличилось, что, возможно, является следствием проведенных в реке
восстановительных мероприятий. При этом, максимальная численность центрических
диатомовых водорослей (млн. кл/л) на исследованных станциях и в разные месяцы
варьировала от 13.2 до 88.9 % от общей численности фитопланктона, а биомасса
(мг/л) соответственно – от 48.6 до 83.2% и в составе доминантов по численности
и биомассе отмечены Aulacoseira granulata, Aulacoseira sp., Cyclotella bodanica, Cyclotella meneghiniana, Cyclotella sp.
По данным электронно-микроскопического исследования материалов
за 2006–2008 гг. выявлены Aulacoseira granulata, Cyclostephanos dubuis, Puncticulata radiosa, Stephanodiscus hantzschii, S. minutulus, а также 20 новых для флоры р. Свислочь представителей
центрических диатомовых водорослей: Aulacoseira ambigua (Gruno
w) Simonsen, A. islandica (O. Műller) Simonsen, Aulacoseira sp., A. subarctica (O. Műller) Haworth, Cyclotella atomus Hustedt var. atomus, Cyclotella atomus var. gracilis Genkal et Kiss, C. comensis Grunow, C.meneghiniana Kűtzing, C. ocellata Pantocsek, Discostella pseudostelligera (Cleve et Grunow) Houk et Klee, Melosira varians Agardh, Stephanodiscus delicatus Genkal, S. invisitatus Hohn et Hellermann,
S. makarovae Genkal, S. neoastraea Håkansson et Hickel emend. Casper, Scheffler et Augsten, Thalassiosira faurii (Gasse) Hasle, T. pseudonana Hasle
et Heimdal, Thalassiosira sp.1, Thalassiosira sp.2, T. weissflogii (Grunow) Fryxell
et Hasle. Из
них 5 оказались новыми для флоры Беларуси: Aulacoseira sp., Cyclotella atomus var. gracilis, Thalasiossira faurii, Thalasiossira sp. 1, Thalasiossira sp. 2.
Работа выполнена при финансовой поддержке Российского
фонда фундаментальных исследований (грант № 08-04-90007) и Белорусского
республиканского фонда фундаментальных исследований (грант № Б 08 Р-104).
ВИДОВОЙ СОСТАВ ВОДОРОСЛЕЙ РЕКИ БОЛЬШОЙ КУЯЛЬНИК
(СЕВЕРО-ЗАПАДНОЕ ПРИЧЕРНОМОРЬЕ, УКРАИНА)
Герасимюк В. П.1,
Шихалеева Г. Н.2, Эннан А. А.2, Кирюшкина А. Н.2
Algae species composition of the Bolshoy Kuyalnik
River
(North-west Black Sea Area,
Ukraine)
Gerasimyk V.P. 1, Shikhaleeva G.N.
2, Ennan A.A. 2, Kirushkina A.N. 2
1Одесский национальный университет им. И. И. Мечникова
ул. Дворянская, 2, г.
Одесса, 65082, Украина
2Физико-химический институт защиты окружающей среды и
человека
МОН Украины и НАН Украины
ул. Преображенская, 3,
г. Одесса, 65082, Украина, тел. (факс) 8 (048)723-75-61
е-mail: fornute@ukr.net; ekko@ukr.net
Река Большой Куяльник, которая относится к малым рекам
Украины, играет существенную роль в формировании водного режима и
продуктивности Куяльницкого лимана, известного своими богатейшими природными
рекреационными ресурсами: лечебными сульфидными илами, рапой и источниками
минеральной воды хлоридно-натриевого типа. Протяженность реки согласно с топографическими
картами конца XIX века составляет 130-135 км, ширина колеблется от 4 до 10 м, площадь бассейна
достигает 1860 км2. Речка мелководная, глубина не превышает 0,5 м, летом пересыхает, зимой
иногда замерзает. Существуют данные, что еще в начале XIX века в устье реки
Большой Куяльник ловились карпы, большие щуки и сюда более чем на 50 миль заходили
рыболовецкие лодки [1]. Сегодня речка Большой Куяльник достигает зеркала воды
Куяльницкого лимана только во время весеннего половодья и ливней. Строительство
в ее русле рыбоводных прудов (с. Севериновка, площадь пруда 0,03 км2,
г. Ширяево, площадь пруда 0,355 км2), дамб, шлюзов привело к
значительным изменениям ее природного гидрологического режима, качества воды и биологического разнообразия, важным
компонентом которого являются водоросли. Они продуцируют органические вещества,
обогащая водоемы кислородом, образуют ил, очищают водоемы от загрязнения, могут
служить показателем экологического состояния водоема и определять степень загрязнения
вод. Однако исследования водорослей реки Большой Куяльник ограничены
практически одной работой [2], авторами которой приведены три наиболее массовых
вида (Cyclotella comta, Scenedesmus quadricauda и Tetrastrum glabrum).
Целью наших исследований было изучение видового
разнообразия водорослей реки Большой Куяльник в условиях современного
гидролого-гидрохимического режима.
Работа выполнялась в рамках плановых исследований
Физико-химического института защиты окружающей среды и человека МОН Украины и
НАН Украины в 2004 – 2008 гг.
Отбор проб водорослей осуществляли во время
экспедиционных выездов на протяжении 2004 – 2008 гг. на 6 станциях в русле р.
Большой Куяльник в пределах г. Ширяево – с. Севериновка.
Пробы водорослей отбирали на макрофитах (Batrachium aquatile (L.) Dumort., Ceratophyllum demersum L., Chara vulgaris L. emend Wallr., Cladophora sp., Phragmites australis (Cav.) Trin ex Steud, Typha angustifolia L., Ulothrix tenerrima Kütz.), в обрастаниях камней, на илистых грунтах, а также в воде. Cбор и обработку собранного материала осуществляли по
общепринятым методикам [3, 4]. Всего было собрано и обработано 36
проб.
На каждой станции параллельно с отбором водорослей
отбирали пробы воды на гидрохимический анализ по основным показателям ионного
состава, биогенным веществам и показателям токсичности (pH, Na+, K+, Ca2+, Mg2+, Cl-, SO43-, HCO3-, O2, ХСК, БПК5, NH4+, NO2-,NO3-, PO43-, Pb, CH3COH, C6H5OH).
В результате исследований основного солевого состава
установлено, что водоем согласно [5]
относится к классу солоноватых вод, третьей категории качества воды –
β-мезогалинные; по критериям ионного склада вода р. Большой Куяльник
относится к хлоридно-сульфатному классу, преимущественно натриевой группы,
третьего типа. Вклад отдельных ионов (в %) в общую минерализацию определяется
следующим рядом ранжирования: CI- (32,3), SO42- (25,0), Na+ + K+ (15,7), HCO3- (14,4), Mg2+ (7,3), Ca2+ (5,1).
Основные показатели качества воды р. Большой Куяльник
за период наблюдений 2004 – 2008 гг. представлены в таблице 1.
По экологической классификации качества поверхностных
вод суши и эстуариев Украины [5], качество воды на обследованных участках р.
Большой Куяльник по блоку солевого состава
и блоку эколого-гигиенических показателей (табл. 1) колебалось от «слабо
загрязненной» (β-мезосапробной)
Таблица 1
Показатели качества воды р. Большой Куяльник за 2004 –
2008 гг.
|
Показатели
|
Диапазоны изменений
|
Средние значения за период исследований
|
|
Аммонийный азот, мг/дм3
|
0,33-7,54
|
2,40
|
|
Нитратный азот, мг/дм3
|
0,011- 0,275
|
0,088
|
|
Нитритный азот, мг/дм3
|
0,003 – 0,046
|
0,021
|
|
Фосфор фосфатный, мг/дм3
|
0,005 – 0,533
|
0,165
|
|
Растворенный кислород, мг/дм3
|
12,8-16,2
|
14,6
|
|
БПК5, мг/дм3 О2
|
10,9-19,3
|
13,9
|
|
ХПК, мг/дм3 О2
|
29,3-119,9
|
55,6
|
|
рН
|
7,27-8,75
|
8,13
|
|
Свинец, мг/дм3
|
0,0351-0,0932
|
0,0547
|
|
Формальдегид, мг/дм3
|
0,012-0,014
|
0,011
|
|
Фенолы, мг/дм3
|
0,01-0,024
|
0,018
|
до
«грязной»; по блоку показателей токсического действия (табл. 1) – от «умеренно
загрязненной» до «очень загрязненной».
Видовое разнообразие водорослей, которые
приспособились к данным гидролого-гидрохимическим условиям водоема, составляют
111 видов, которые принадлежат к 59 родам, 37 семействам, 21 порядку, 11
классам и 6 отделам (табл. 2).
Таблица 2
Таксономический спектр водорослей р.
Большой Куяльник
|
Отдел
|
Количество
|
|
классов
|
порядков
|
семейств
|
родов
|
видов, (%)
|
|
Bacillariophyta
|
3
|
12
|
23
|
40
|
79 (71,2)
|
|
Cyanophyta
|
2
|
3
|
4
|
6
|
16 (14,4)
|
|
Chlorophyta
|
3
|
3
|
7
|
8
|
10 (9,0)
|
|
Euglenophyta
|
1
|
1
|
1
|
3
|
4 (3,6)
|
|
Chrysophyta
|
1
|
1
|
1
|
1
|
1 (0,9)
|
|
Charophyta
|
1
|
1
|
1
|
1
|
1 (0,9)
|
|
Всего:
|
11
|
21
|
37
|
59
|
111 (100)
|
Наиболее разнообразно представлены Bacillariophyta (71,2
% от общего числа видов), Cyanophyta и Chlorophyta (14,4 % и 9,0 % от общего числа видов, соответственно).
Остальные виды (Euglenophyta, Chrysophyta и
Charophyta) представлены практически единичными
экземплярами, которые в сумме составляли
около 6 %. Доминирование диатомовых во
флористическом спектре реки отмечалось
практически на каждой станции наблюдений, однако их долевое участие не одинаково.
В зарегулированной части русла в условиях
замедленного водообмена доля диатомовых водорослей уменьшалась, и
увеличивалась доля синезеленых водорослей.
Следует отметить, что появление синезеленых водорослей
не случайно и определяется не только гидрологическими, но и гидрохимическими
условиями. При наличии на данном участке реки соотношения фосфора к азоту
(1:24) процессы самоочищения, как известно [6], осуществляются по автотрофному механизму с
обязательным развитием азотфиксирующих синезеленых водорослей, что в свою
очередь, приводит к ухудшению качества воды и указывает на антропогенное эвтрофирование
водоема.
По результатам исследований 2004 – 2008 гг. нами впервые составлен список
водорослей для р. Большой Куяльник и установлено, что основу видового богатства
альгофлоры составляли следующие ведущие семейства: Bacillariaceae – 18 видов; Oscillatoriaceae – 13; Naviculaceae – 7; Fragilariaceae
– 5; Cymbellaceae – 5; Pleurosigmataceae – 5; Catenulaceae
– 5; Surirellaceae – 5; Gomphonemataceae – 4; Euglenaceae
– 4. Наибольшим видовым разнообразием отличались роды Nitzschia Hass (11 видов), Oscillatoria Vauch. (10), Navicula Bory (6), Amphora Ehr. (5), Tryblionella W. Sm. (5), Cymbella Ag. (4) и
Surirella Turp. (4).
Водоросли р. Большой Куяльник распределяются на
одиночные (63 вида или 56,8 %), колониальные (31 вид или 27,9 %) и
многоклеточные (17 видов 15,3 %). Среди них выделяются подвижные (62,2%) и
неподвижные (37,8 %) формы.
По географическому распространению водоросли р.
Большой Куяльник относятся к бореальной (44,0%) и космополитной (44,0%)
группам. Виды с неизвестным географическим распространением составили 12,0%.
Согласно места произрастания встречаются планктонные
(19,0 %), бентосные (46,8 %) и формы, которые входят в состав обрастаний (34,2
%). Планктон представлен 21 видом из 4 отделов водорослей, среди которых 9
видов из отдела диатомовых и 8 – из отдела синезеленых. Бентос представлен 51
видом, преимущественно диатомеями (46 видов). Формы обрастаний представлены 39
видами, среди которых также доминируют диатомовые (24 вида).
В соответствии с соленостью воды преобладают
олигогалобы (71 вид или 64,0 %), которые в свою очередь подразделяются на
индифференты (42,4 %) и галлофилы (21,6 %). Мезогалобы составляют 24,3 %, а
полигалобы – 5,4 %. Формы с неизвестным значением солености составляют 6,3 %.
По отношению к активной реакции среды (рН) преобладают
алкалифилы, которые составляют 76 видов (68,5 %). Им значительно уступают
индифференты (17,1 %). Формы с неизвестным оптимумом рН для
роста составили 14,4 %.
Из 111 выявленных таксонов водорослей 75 видов
являются индикаторами сапробности, среди которых доминируют представители
мезосапробных форм – 42 вида, которые охватывают 55,9 % всех индикаторных
видов. Из них 34,2 % составляет группа β-мезосапробов, 18,0 % – группа
α-мезосапробов, 3,7 % – группа β-α-мезосапробов, 3,6% - группа полисапробов.. К группе ксеносапробов
принадлежит только 1 вид (0,9%). Виды с неизвестным значением сапробности
насчитывают 39,6 %. Таким образом, по соотношению основных групп сапробионтов
исследуемый участок р. Большой Куяльник принадлежит к β-мезосапробной зоне
самоочищения.
Полученные результаты показывают, что водоросли могут
служить надежными индикаторами экологического состояния водоемов.
Список литературы
1. Паламарчук М. М., Закорчевна Н. Б. Водний фонд
України: довідковий посібник / За ред. В. М. Хорєва, К. А. Алієва. – К.: Ніка –
Центр, 2001. – 392 с.
2. Ковтун Т. М., Клоченко П. Д. Фитопланктон устьевых
участков рек и вершин лиманов Северо – Западного Причерноморья // Гидробиол.
исслед. водоемов юго-западной части СССР. – К.: Наук. думка, 1982. - С. 64 –
65.
3. Диатомовые водоросли СССР. Ископаемые и современные
/ З. И. Глезер, А. П. Жузе, Макарова И. В. и др.- Л.: Наука, 1974.- Т. 1.- 403
с.; Т. 2.- Вып. 1. - 115 с.; Вып. 2. - 118 с.; Вып. 3. - 111 с.
4. Водоросли. Справочник
/ Вассер С.
П., Кондратьева Н. В., Масюк Н. П. и др. - К.: Наук.
думка, 1989. - 608 с.
5. Методика встановлення і використання екологічних
нормативів якості поверхневих вод суші та естуаріїв України / В. Д. Романенко,
В. М. Жукинський, О. П. Оксіюк та ін. – К., 2001. – 48 с.
6. Сиренко Л. И. Физиологические основы размножения
синезеленых водорослей в водохранилищах. – К.: Наук. думка, 1972. – 203 с.
ПЛЕНКИ ДИАТОМОВЫХ ОБРАСТАНИЙ КИТОВ В ВОДАХ АНТАРКТИКИ
Герасимюк В. П.1,
Зинченко В. Л.2, Герасимюк Н. В.1
Diatoms biofilms of whales in the Antarctica’s
waters
Gerasimyk V.P. 1, Zinchenko D.L.
2, Gerasimyk N.V. 1
1Одесский национальный
университет им. И. И. Мечникова
65026 Украина, Одесса, ул. Дворянская, 2, 80974799117
е-mail: gerasimyuk2007@ukr.net
2Украинский научный центр моря
65009 Украина, Одесса, Французский бульвар, 89, 0487665641
Общеизвестно, что диатомовые водоросли избирают в
качестве своего субстрата не только неживые объекты (камни, песчаные и илистые
грунты, искусственные сооружения), но поселяются также на растительных
(водорослях-макрофитах, высших водных растениях) и животных (моллюсках,
кораллах, ракообразных, млекопитающих) субстратах. К последним относятся киты.
Первые сведения о том, что киты, обитающие в
антарктических водах, очень часто покрываются желтыми пятнами, принадлежат
майору Баррету-Хамильтону (Barett-Hamilton) в 1913- 1914 гг. (цит. по Bennett, 1920). В дальнейшем эти данные подверглись проверке
и более детальному исследованию со стороны Беннета (Bennett, 1920). Последний
сделал вывод, что желтые пятна на коже живых китов обусловлены присутствием в
очень больших количествах диатомовых водорослей. По сборам Беннета альголог
Нельсон установил, что преобладающим видом в обрастаниях китов является вид
диатомовых водорослей Cocconeis ceticola
Nelson ex Bennett. На основании материалов
экспедиции ''Дискавери'' (1925-1927) Макинтош и Уиллер (Mackintosh, Wheeler,
1929) подтвердили заключение Беннета о том, что киты обрастают диатомеями
главным образом в антарктических водах. В 1935 г. появилось в печати
большое исследование по обрастаниям китообразных Д. Гарта (Hart, 1935), в
котором он пришел к выводу, что диатомеи встречаются на всех видах китов,
известных в антарктических водах. Много видов диатомовых водорослей на китах
описаны в северной части Тихого океана и Антарктике (Hart, 1935; Hustedt, 1952;
Nemoto, 1956, 1958). Изучение обрастаний пленок Cocconeis ceticola привело к заключению, что эти диатомовые
водоросли наиболее обычны на китообразных в холодных водах высоких широт. В 1985 г Cocconeis ceticola Р. Холмсом (Holmes, 1985) согласно данных,
полученных с помощью электронной микроскопии, был переименован в Bennettella ceticola (Nelson ex Bennett)Holmes. Некоторые исследователи (Ивашин, 1958; Зинченко,
1986) полагали, что по степени обрастания кожи китов диатомеями можно
ориентировочно определять сроки пребывания млекопитающих в Антарктике, что в
свою очередь могло служить указателем при изучении миграции китов.
Целью нашей работы было изучение морфологических
особенностей створок диатомовых водорослей и установление их количественных
характеристик.
Материалом для работы послужили пробы, собранные в
период 1981- 1985 гг. во время китобойного промысла малых полосатиков (Balaenoptera actorostrata Burmeister)
на китобойной базе “Советская Украина” в Антарктике.
Малый полосатик (минке) – космополит. Он является
самым малоразмерным представителем рода, максимальная отмеченная нами длина
тела- 10,4 м,
вес- 9,0 т, возраст- 64 года. У этих китов наблюдается половой диморфизм,
одновозрастные самки в среднем крупнее самцов. Предполагается существование
двух популяций этих китов, которые не смешиваются, - в Северном и Южном полушарии.
Северные малые полосатики питаются рыбой, южные - зоопланктоном. Зимний
репродуктивный ареал- тропики и субтропики, летом самки и самцы приходят на
нагул в высокие широты полярных вод. В Антарктике киты питаются крилем (рачки Euphausia superba), в
массе развивающимся в условиях поднятия с глубины биогенных веществ, вызванного
апвеллингом. Поднятые биогены вызывают и массовое развитие диатомовых Bennettella ceticola, специфическим
субстратом которых является поверхность тела кита.
При помощи скальпеля снимали покрытые диатомеями куски
кожи китов размерами 10 х 10 см, после чего материал
фиксировался 4% раствором формалина. Пленки диатомей отбирались с различных
частей тела (брюхо, бок, хвостовая лопасть, голова, спина и др.). Исследованиям
подвергли животных разного пола. Всего было собрано и исследовано 206 проб.
В результате исследований было установлено, что тела
китов малых полосатиков в основном были покрыты пленкой желто- зеленого цвета,
которая состояла из створок Bennettella ceticola (Nelson ex Bennett) Holmes, развившихся в массе. Толщина пленки достигала 1 мм. Она у самок в 2- 3 раза
превышала таковую у самцов. Киты заражаются микроспорами, которые внедряются в
кожу и прорастают. Фактически на коже китов формируется моноценоз, в котором
доминирующим видом является Bennettella ceticola, а
в качестве сопутствующих видов очень редко встречаются отдельные створки Fragilariopsis kerguelensis
(O’Meara) Hust., Grammatophora oceanica (Ehr.)Grun. и Nitzschia media Hant.
С экологической точки зрения по отношению к солености
воды Bennettella ceticola является
полигалобом, по отношению к рН среды – алкалифилом, с географической – аркто-
антарктическим циркумполярным видом. Тип питания миксотрофный. Не исключено, что этот
вид является полупаразитом, так как на других субстратах, за исключением китов,
он не встречался.
Результаты измерений длины и ширины 20 створок, число
структурных элементов (число штрихов в 10 мкм) и результаты статистической
обработки приведены в табл. 1. Доказано,
что наиболее вариабельными являются длина и ширина створок и в меньшей степени
число структурных элементов (количество штрихов в 10 мкм).
Степень обрастания различных частей китов сильно
варьирует. Так, в большей степени диатомовым обрастаниям подвержены такие части
тела, как хвостовой стебель, хвостовая лопасть, брюхо, бок и в меньшей – голова
и спина.
Таблица 1
Вариабельность размеров и структурных элементов
створок B. сeticola
|
Признак
|
lim
|
M± m
|
Mo
|
Me
|
Xmax/Xmin
|
C
|
|
Длина
|
17,0- 34,5
|
22,8± 3,8
|
23,0
|
22,5
|
2,03
|
16,7
|
|
Ширина
|
9,0- 15,0
|
12,8± 1,5
|
13,5
|
13,5
|
1,67
|
11,7
|
|
n
|
11,0- 15,0
|
13,5± 1,2
|
14,0
|
14,0
|
1,36
|
8,9
|
Примечание: n - число
штрихов в 10 мкм, lim - лимиты, M - среднее арифметическое, Mo - мода, m -
стандартное отклонение, Me - медиана, Xmax – максимальная величина признака, Xmin – минимальная величина признака, С - коэффициент вариации.
Интересные данные были получены при изучении
количественных характеристик диатомей. Так, численность микрофитов, отмеченная
на самцах, изменялась от 1050,6 до 3024,0 млн кл /кв. м, тогда как на самках
она достигала значительно больших величин: 2080,0- 12087,0 млн кл / кв. м. При
этом среднее значение численности микроводорослей у самцов составляло 2190,4, а
у самок почти в 4 раза выше- 8229,9 млн кл /кв. м. Такие различия в численности
диатомей, наблюдавшиеся на самцах и самках, очевидно связаны с большим слоем
подкожного жира у самок, а также с тем, что Bennettella ceticola
является полупаразитом.
Биомасса варьировала в таких же широких пределах:
самцы – 3,06-8,84 г/кв. м; самки - 6,08- 35,30 г/кв. м. Средняя величина
биомассы у самок почти в 3 раза превышала таковую у самцов.
Список литературы
Ивашин М. В. Обрастание финвалов диатомовыми
водорослями в Антарктике // Тр. ВНИРО.- 1958- 33
Зинченко В. Л. Изменение структуры популяции малого полосатика
Южного полушария в течение нагульного периода в Антарктике // Морск. млекопитающие.
Тез. докл. IX Всесоюзн. совещ. по изучению,
охране и рацион. использ. морск. млекопитающих.- Архангельск, 1986.- С. 159- 160.
Bennett A. G. On
the occurrence of diatoms on the skin of whales with an Appendix by E. W. Nelson
// Royal Soc. London
Proc.-1920. - 91.- P. 352- 357.
Hart T. J. On the
diatoms of the skin film of whales and their possible bearing on problems of
whales’ movements // Disc. Rep. - 1935. - 10.- P. 249- 282.
Holmes R. W. The
Morphology of Diatoms Epizoic on Cetaceans and their Transfer from Cocconeis to Two New Genera, Benetella and Epipellis // Br. Phyc. J. - 1985.- 20.- P. 43- 57.
Hustedt F. Deatomeen aus der
Lebensgemein- schaft des Buckelwals (Megaptera
nodosa) // Arch. Fur Hydrobiol.- 1952- 46, 12
Mackintosh N. A., Wheeler I.
E. G. // Discovery Reports.- 1929.- 1.
Nemoto T. On the
diatom of the skin film of whales in the northern Pacific // Pacific. Sci. Rep.
Whales Res. Inst. (Tokyo).
- 1956. - 11. - P. 97- 132.
Nemoto T. Cocconeis
diatoms infected on whales in the Antarctic // Pacific. Sci. Rep. Whales Res. Inst. (Tokyo). - 1958. - 13. - P. 185- 192.
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ
ХАРАКТЕРИСТИКИ ФИТОПЛАНКТОНА ЦИМЛЯНСКОГО ВОДОХРАНИЛИЩА (2006-2008 гг.)
Голоколенова Т.Б.
Structural
and functional characteristics of phytoplankton
in the
Tsimlyanskoe reservoir (2006-2008)
Golokolenova T.B.
Волгоградское отделение
ФГНУ
Государственный
научно-исследовательский институт
озерного и речного
рыбного хозяйства
Волгоград, ул. Пугачевская,
1, тел/факс (8442) 97-82-71
е-mail: Lysak-alga@yandex.ru
Цимлянское
водохранилище образовано на р. Дон в 1952 г. Водохранилище озерного типа (площадь
2702 км2), с низким водообменом (0,9), небольшими глубинами (6-8м,
мах – 35м), продолжительным вегетационным период и высокой продуктивностью
биоценозов (Лапицкий, 1970). Водохранилище разделяется на четыре плеса,
которые характеризуются различием гидрологического режима. Верхний –
сохранивший элементы речного режима, пререходный - Чирской и два типично озеровидных
плеса – Потемкинский и Приплотинный. В двух верхних преобладают стоковые течения,
обусловленные поступлением вод р. Дон и р. Чир. В динамике вод озеровидных
плесов на протяжении меженного сезона преобладают ветровые течения и
ветроволновые перемешивания.
Мониторинг проводился
ежесезонно (весна, лето, осень) на 30 станциях охватывающих все плесы и биотопы
водохранилища. Изучалась динамика содержания хлорофилла а (Хл а),
биомассы и продукции фитопланктона. Биомасса фитопланктона (БФ) определялась
счетно-весовым методом, хлорофилл – спектрофотометрически. Измерение первичной
продукции осуществлялось скляночным методом в кислородной модификации.
Гидрометеорологические
условия трех лет исследования были сходны и характерны для климатических условий
региона, но наиболее благоприятные для вегетации фитопланктона сложились в 2007
году, отличительной чертой которого был долгий период стояния высоких
температур воды..
В общем списке фитопланктона отмечено 489 таксонов
рангом ниже рода, относящиеся к девяти отделам. Преобладали Chlorophyta (32,7%), Bacillariophyta (29,2%), и Cyanophyta (15,5%). Сравнение
полученных данных с материалами 70-х годов прошлого столетия показывает, что
видовое разнообразие увеличилось в полтора раза, за счет мелкоклеточных форм
отделов Chrysophyta, Bacillariophyta
(в основном класса Centrophyceae), Cryptophyta и в отделе Cyanophyta
увеличилось число представителей рода Oscillatoria. Основной фон
фитопланктона создают β-мезосапробы (103 вида) и олиго-β-мезосапробы
(43 вида). Виды-индикаторы сапробности составляют 57% от всего состава водорослей.
Наиболее продуктивный Потемкинский
плес, где средневегетационная БФ составила 12,6 мг/л, с преобладанием
синезеленых и диатомовых водорослей – 47 и 37% от общей биомассы, соответственно.
Вторым по продуктивности плесом был Приплотинный – 11,4 мг/л, где доминировали
синезеленые водоросли – 79%. Продуктивность же Чирского плеса ежегодно меньше в
2-3 раза низлежащих плесов и в 1,5 раза Верхнего.
В весенний период средневзвешенная БФ составляла около
- 5 мг/л, основу которой формировали центрические диатомовые водоросли на всей
акватории водохранилища (доминанты Stephanodiscus hantzschii, S. invisitatus и комплекс мелких центрических
диатомей Stephanodiscus minutulus, S.
triporus, S. makarovae, Cyclotella meduanae, Cyclostephanos dubius, в
поздневесенний период (май 2006г.) уровень развития фитопланктона был несколько
выше – 8 мг/л. В летний период БФ достигает максимальных значений 10 - 16 мг/л.
Обычные доминанты Microcystis aeruginosa+
Aphanizomenon flos-aquae +Aulacoseira granulata, в период
штилевой жаркой погоды – Aph. flos-aquae + Planktothrix agardhii +
Anabaena flos-aquae. Осенью после снижения температуры воды БФ падала до 4
мг/л, но в аномально теплом октябре 2007г. достигала - 9 мг/л. В этот период в
верхней части водохранилища доминируют диатомеи и криптофиты, в средней - синезеленые
и диатомовые, в нижней - синезеленые.
В среднем по водохранилищу численность водорослей
составила 76742 тыс. кл/л, биомассой – 9,8 мг/л, что несколько выше, чем в 80-е
годы – 8,5 мг/л (Калинина, 1987).
В течение этого периода содержание Хл «а» в
водохранилище изменялось в широком диапазоне от 0,7-9,0 до максимальных 85-324
мкг/л, при наиболее часто встречаемых до 10 мкг/л. Максимальных значений и
наибольшего диапазона величин достигало в июле, в период летнего пика в сезонном
развитии фитопланктона.
В весенний период содержание Хл «а» колебалось в очень
широких пределах. Максимальные значения (около 40 мкг/л) были характерны для
Верхнего и Потемкинского плесов, что отражает тренд БФ (r=0,45-0,72). И все же наиболее встречаемые
концентрации Хл «а» отмечались до 10 мкг/л. Необходимо отметить неравномерное
распределение Хл «а» в толще воды весной, когда фиксируется обратная
стратификация, почти в двое показатели придонных значений Хл «а» выше
поверхностного 3-х метрового горизонта.
В середине летнего сезона в водохранилище отмечены
самые высокие концентрации Хл «а», достигающие 100-300 мкг/л. В данный период
отмечен и наибольший диапазон величин, самые низкие из которых наблюдались в
двух верхних плесах. Основная масса фитопланктона с доминированием синезеленых
формируется в верхних пленках «цветения» в озеровидной части водохранилища, где
и регистрируются максимальные значения Хл «а». Распределение водорослей по вертикали,
по-видимому, довольно однородное, так как различия между концентрациями Хл «а»
в верхнем 3-х метровом слое и во всем столбе воды – несущественны, однако в
придонных глубоководных участках значения несколько ниже. Взаимосвязь биомассы
и концентрации Хл «а» пропорциональна (r=0,82).
Наиболее встречаемые значения Хл «а» осенью до 30 мкг/л.
В этот период регистрируется наибольшая стратификация этого показателя в толще
воды и различия в концентрациях Хл«а» в поверхностном 0-3 слое и в интегрированных
почти в трое выше. Зафиксировано в октябре 2007г. высокое содержание Хл «а» в
Верхнем плесе, за счет «цветения» центрических диатомовых водорослей.
В среднем для вегетационного периода концентрация Хл
«а» в водохранилище составила 28,3 мкг/л, с максимумом летом – 43,7 мкг/л, что
сопоставимо с данными 1986 г. - 25,9 и 77,9 мкг/л,
соответственно (Калинина, 1987).
С содержанием хлорофилла связан фотосинтез
фитопланктона, величины которого в максимуме вертикального профиля Аmax измерялась от 0,25-1,52 до 3,2-11,4 мгО2/л·сут
при средневегетационной 3,85 мгО2/л·сут (весной – 1,32, летом –
5,51, осенью – 1,42). Фотосинтетическая активность водорослей высокая, суточные
ассимиляционные числа составили: весной – 175,6 мгО2/мгХл, летом –
287,5 мгО2/мгХл, осенью – 128,9 мгО2/мгХл. Интегральная
первичная продукция в столбе воды ∑А при этом составляла от 0,92-4,5 до
6,64-26,4 гО2/м2·сут, при средневегетационной 8,96 гО2/м2·сут
(весной – 3,7, летом - 12,2, осенью – 4,93).
Сезонный ход и распределение по плесам Аmax соответствуют показателям обилия фитопланктона. Об
этом свидетельствует тесная корреляционная зависимость между Аmax и Хл «а» (r = 0,64-0,89). Наибольшей фотосинтетической активностью
характеризуется летнее сообщество фитопланктона, а самой низкой – осеннее.
Повышенной ПП, как БФ и содержанием Хл «а», выделяется Потемкинский плес, а так
же пойменные участки Верхнего плеса. Пониженные величины отмечаются в Чирском
плесе, который является участком седиментации минеральной взвеси.
Интенсивность фотосинтеза, существенно превышала
деструкцию органического вещества R и изменялась
в пределах 0,05-3,12 мгО2/л·сут для отдельных станций и 0,47-2,11
мгО2/л·сут в среднем для биологических сезонов. Суммарная деструкция
в толще воды ∑R варьировала в более широких
пределах от 0,03 до 36,55 гО2/м2·сут, при этом баланс
органического вещества (∑А/∑R) менялся в течение сезона и неодинаков на различных
участках водоема. Автотрофная фаза (∑А/∑R>1) как правило, совпадала с весенним и летним
максимумами фитопланктона, гетеротрофная (∑А/∑R<1) отмечалась чаще осенью. В Чирском и
Приплотинном плесе, которые принимают наибольший объем аллохтонных поступлений,
деструкционные процессы в большинстве случаев преобладали над продукционными и
в среднем за сезон примерно на половину обеспечивались за счет фотосинтеза
фитопланктона. В Верхнем и Потемкинском плесах в основном преобладали продукционные
процессы, что соответствует высокоэвтрофному состоянию этих участков,
подверженных наибольшей антропогенной нагрузке.
На основании величин ПП по классификации Г.Г. Винберга
(1960) водохранилище попрежнему относится к категории высокоэвтрофных водоемов.
Как отмечалось и в предыдущие годы, наиболее продуктивными являются участки
открытого мелководья, а так же заливы и балки, где создается благоприятный
гидробиологический режим для развития фитопланктона.
Список литературы
Винберг Г.Г.
Первичная продукция водоемов // Изд. АН БССР. 1960.
Калинина С.Г. Структурные и продукционные
характеристики фитопланктона Цимлянского водохранилища // Сборник научных
трудов ГосНИОРХ, вып. 265, Л.1987.
с. 54-62.
Лапицкий И.И. Направленное формирование ихтиофауны и
управление численностью популяций рыб в Цимлянском водохранилище. Волгоград:
Ниж. – Волж. кн. изд. 1970. – 280 с.
РАФИДОФИТОВЫЕ ВОДОРОСЛИ И УСЛОВИЯ ИХ РАЗВИТИЯ
В ВОДОЕМАХ ОХРАНЯЕМЫХ ТЕРРИТОРИЙ САМАРСКОЙ ОБЛАСТИ
Горохова О.Г.,
Номоконова В.И.
Raphidophyta algae and
conditions of their development
in the lakes of the Samara
region protected territories
Gorochova
O.G., Nomokonova V.I.
Институт экологии Волжского бассейна
РАН
445003 г. Тольятти, ул.
Комзина 10, (8482)489199
e-mail: vnpautova@mail.ru
Рафидофитовые
водоросли, систематическое положение которых долгое время оставалось
неопределенным, и их относили к эвгленовым, желто-зеленым или пирофитовым
водорослям в качестве подотдела или класса Chloromonadophyceae, в настоящее время выделены в самостоятельный отдел. Интерес к этой группе водорослей
усилился во второй половине 20-го столетия в связи с массовым развитием в
некоторых озерах Скандинавии ее представителя - Gonyostomum semen (Ehr.) Dies.
Во многих северных озерах умеренной зоны, в течение последних десятилетий этот
вид увеличивает свою численность и
частоту встречаемости, аThe Raphidophycean flagellate, Gonyostomum semen ,
forms mass occurrences that hamper the recreational use of lakes. его обильная вегетация,
вызывающая интенсивное «цветение воды»,
осложняет рекреационное использование озер и может
вызывать токсичные эффекты (Figueroa,
2006). В странах Скандинавии работы по изучению этого
вида были включены в национальные программы (Никулина, 1996).
Первые сведения о
нахождении рафидофитовых в системе Волги и о высокой численности G. semen были получены
при изучении фитопланктона высокоцветных левобережных притоков Волги и Оки
(Ветрова, Охапкин, 1990). Позднее зафиксировано его массовое развитие в
полигумозном слабокислом озере Дарвиновского заповедника в Вологодской области (Корнева, 1994) и
нахождение рафидофитовых в карстовых озерах Пустынского заказника в Нижегородская
области (Охапкин, Юлова, 1996). При обзоре литературы
и по данным собственных исследований озер Южной Карелии В.Н. Никулина (1996) приходит к выводу, что
вид способен развиваться
в широких пределах изменения рН
(5–7) и цветности воды (40-100 градусов), но наиболее благоприятные условия для
массовой вегетации находит в мезогумозных слабокислых озерах. В разнотипных озерах Валаамского архипелага
максимальная вегетация вида зарегистрирована для полигумозного нейтрального
озера (Воякина, Степанова, 2008). Авторы
подчеркивают, что экология рафидофитовых
все еще недостаточно изучена. Таким образом, изучение водорослей
этого отдела и условий их развития представляет
интерес и помогает составить более полное представление об их экологии.
Raphidophyta чаще
встречаются в планктоне небольших стоячих водоемов: прудах, озерах,
старицах, в сфагновых болотах (Водоросли, 1989). G. semen, имеющий большие приспособительные возможности,
развивается и в более крупных озерах (Корнева, 1996).
На территории
Самарской области в период 1998-2006 гг. нами
изучался фитопланктон и условия его развития в 22 малых водоемах (Номоконова,
Горохова и др., 2006, Горохова,
Номоконова, 2006). Они находятся в пределах Национального парка «Самарская
Лука» и Жигулевского Государственного
заповедника, разнообразны по происхождению и расположены в ландшафтах
разного типа. Наиболее крупные из них – пойменные, другие представлены небольшими
озерами, расположенными на надпойменной террасе, карстовыми озерами, различными
прудами и водоемами, возникшими в карьерах и заполнившимися водой атмосферных
осадков (Паутова, 2000).
Сфагновые болота
являются редкими гидробиоценозами для
лесостепной зоны Поволжья и для Самарской области (Голубая книга
Самарской области, 2007). Они встречаются здесь практически у южной границы
распространения водоемов болотного типа. В 2008 г. были проведены исследования и на трех болотах, которые расположены
в Сызранском районе, являются реликтами ледниковой
эпохи, два из них имеют статус памятников природы (Зеленая книга Самарской области,
1995).
В большинстве
водоемов было проведено 2 цикла наблюдений: в первый год пробы отбирали
ежемесячно в период открытой воды с апреля по октябрь – ноябрь, во второй год –
в основные биологические сезоны – весной, летом и осенью. Отбор проб проводили
в поверхностном слое воды и по глубине через один метр; в болотах - в небольших
и неглубоких пространствах открытой воды в поверхностном и придонном горизонтах
и с глубин 0,5 или 1 м.
Пробы, собранные с целью более полного изучения
качественного состава альгофлоры, обрабатывали живыми.
По результатам
десятилетних исследований таксономического состава альгофлоры планктона этих
водоемов были получены и сведения о встречаемости, составе и условиях развития Raphidophyta. Этот отдел водорослей представлен очень малым числом видов,
изучение и идентификация которых должна проводиться на живом материале,
так как они плохо переносят не только фиксацию и фильтрацию, но и просто
хранение живых проб более суток (рис. 1).
Рис. 1. Живой Gonyostomum semen (слева), вид клетки в фиксированной пробе
(справа)
Все встреченные
экземпляры определены и измерены в живом состоянии; а в пробах 2006-2008 гг. по
микрофотографиям, сделанным при увеличении
в 400 – 1600 раз с помощью микроскопа Leica DM 4000.
Из представителей
этого отдела в изучаемых водоемах нами были зарегистрированы 3 вида: Vacuolaria virescens Cienk., V. viridis
(Dang.) Sann и Gonyostomum semen. В таблице приведены гидрохимические
характеристики этих водоемов - для дат, когда в них были обнаружены
рафидофитовые водоросли, а так же численность, биомасса видов и частота
встречаемости.
Таблица
Дата регистрации вида,
встречаемость*, численность (млн кл./л), биомасса (г/м3),
температура (t 0С),
рН и
цветность** (цв.) воды
|
Водоемы
|
Виды
|
Численность / биомасса /
|
Регистрация вида, встречаемость,
|
температура, рН,
цветность воды
|
|
Озера:
Лизинка
|
Vacuolaria
virescens
|
0,01 / 0,21
|
V
1999 г.;
1 (15)
|
t –18;
рН – 6,6; цв.– 344
|
|
Харовое
|
V. viridis
|
0,01 / 0,19
|
VIII 2006
г.;
1 (16)
|
t –19,1;
рН – 7,4 ; цв. – 80
|
|
Гудронное 4
|
V.virescens
Gonyostomum
semen
|
0,01 / 0,2
0,01 / 0,26
|
VII 2005 г.;
1 (14)
то же
То же
|
t –19,6;
рН –5,5; цв. – 285
то же
|
|
Стрельное 6
|
Vacuolaria
virescens
|
0,01 / 0,22
|
VII 2005 г.;
1 (14)
|
t – 19,4;
рН – 7,4; цв. – 20
|
|
Болота:
Узилово
|
Gonyostomum semen
|
0,01 / 0, 275
|
V 2008 г.;
1 (14)
|
t – 17;
рН – 6,7; цв. – 100
|
|
Моховое
|
Vacuolaria
virescens
Gonyostomum
semen
|
0,01 / 0,24
0,01 / 0,22-0,25
|
VI 2008 г.;
1 (13)
IV, VII, VIII 2008 г.;
3 (13)
|
t – 21;
рН – 5,4 цв. – 112
t – 8, 26, 21;
рН – 5,3-6,4;
цв. – 170-243
|
|
Журавлиное
|
Vacuolaria
virescens
Gonyostomum semen
|
0,01 / 0,196
0,01 – 0,59 /
0,16 – 1,59
|
Х
2008 г.;
1
(21)
IV-X 2008 г.;
21 (21)
|
t –7,5;
рН -6,1; цв. -198
t –7-30;
рН –5,7-6,5;
цв. – 184-223
|
Примечание. *Приведено
число проб, в которых встречался вид, в скобках – общее число просмотренных
проб. **По платиново-кобальтовой шкале.
Vacuolaria viridis
обнаружена нами только в маленьком лесном озере Харовое, макрофитном, с
глубинами не более 1,8 м; прозрачностью воды по диску Секки от 0,6 м до дна, олигогумозного типа, с реакцией среды близкой к нейтральной,
средней минерализации. По содержанию общего
фосфора озеро – олиготрофное.
V. virescens встречена в озере Лизинка, которое расположено на
надпойменной террасе Волги, в лесу у подножья Жигулевских гор. Его глубина не
превышает 1 м,
прозрачность – до дна; летом оно мелеет и зарастает высшей водной и околоводной
растительностью. Озеро эвтрофное, с маломинерализованной
водой, полигумозного типа, и слабокислой реакцией среды.
Этот же вид отмечен
в озеро Стрельное 6 представляющем собой карьер, после выемки глины
заполнившийся водой атмосферных осадков. Водоем находится в лесу на плато в Жигулевских горах. Он неглубокий (до 1,5 м), заросший макрофитами;
вода прозрачностью от 0,5 до 1 м,
со средней минерализацией, олигогумозного типа, с реакцией среды – близкой к
нейтральной, по содержанию общего фосфора водоем олиготрофный.
Гудронное озеро 4
также образовалось в карьере после добычи битумозного песчаника, позднее карьер
был частично засыпан опилками - отходами работавшей здесь лесосеки. Расположено
в лесу на территории Жигулевского заповедника. Водоем глубиной до 1 м, прозрачность воды всего до
0,2 м,
маломинерализованный, полигумозный, слабокислый,
эвтрофного типа. Фитопланктон озера отличается от других крайней бедностью
видового состава (представлены в основном жгутиковые разных отделов) и низкими
количественными характеристиками. Здесь встречены Vacuolaria virescens и
Gonyostomum semen.
В болотах, наиболее
типичных местах обитания рафидофитовых (Водоросли, 1989), найдены Vacuolaria virescens и
Gonyostomum semen. Вода всех
болот маломинерализованная, цветностью от мезо- до полигумозной, слабокислой
реакции, в Узиловом - до щелочной. По содержанию общего фосфора условия
развития водорослей в пространствах
открытой воды болот характеризуются как эвтрофные, в Узиловом – гиперэвтрофные.
В Журавлином болоте мы наблюдали устойчивое развитие G. semen. Отдельными экземплярами он встречался уже в
апреле при температуре воды 7 о С.
С мая по сентябрь
его количество колебалось в пределах от 0,1 до 0,59 млн кл./л (биомасса 0,16 – 1,59 г /м3), а в октябре снизилось
до минимума (рис. 2). Нередко он присутствовал в комплексе доминирующих
по биомассе видов фитопланктона.
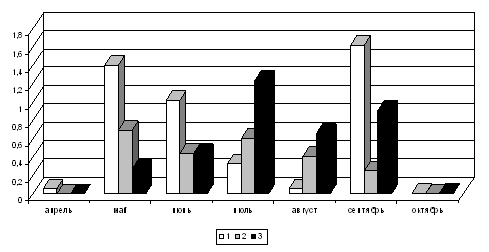
Рис. 2. Динамика биомассы (г/м3) Gonyostomum semen в болоте Журавлиное.
1 – 0 м; 2 – промежуточный
горизонт, 3 – у дна
Распределение
G. semen по
вертикали не носило той закономерности, которая нередко приводится для него в
литературе: сосредоточение большей части популяции на некоторой глубине от поверхности
и у дна. По нашим наблюдениям распределение клеток могло быть разным, и нередко
наибольшие концентрации регистрировались на поверхности и у дна; возможно,
трудно проследить четкую закономерность при отборе проб раз в месяц.
Таким образом, в водоемах охраняемых территорий
Самарской области зарегистрировано 3 вида рафидофитовых водорослей. В таблице
указаны даты их обнаружения, свидетельствующие о том, что в результате
исследований в конце 19 – начале 20 столетия южная
граница распространения водорослей этого отдела продвинулась в Поволжье от
лесной зоны до южной части лесостепной. Чаще других встречается Vacuolaria virescens (в 6 водоемах); Gonyostomum semen отмечен
в 4, Vacuolaria viridis -
в одном озере. Из 25 водоемов рафидофитовые найдены в семи, причем во всех,
за исключением болота Журавлиное, они отмечались очень редко, единичными
экземплярами и заметной роли в фитопланктонном сообществе не играли. B Журавлином болоте Gonyostomum semen развивался
в течении всего периода открытой воды, численность
его достигала 0,59 млн кл./л, биомасса –
1,59 г/м3 , он входил в число доминантов по биомассе.
Вертикальное распределение фитопланктона
в небольших карстовых озёрах Центральной
России
Гусев Е.С.
Vertical distribution
of phytoplankton
in the small karst lakes of Central Russia
Gusev E.S.
Институт биологии
внутренних вод им. И.Д. Папанина РАН
пос. Борок,
Россия, факс (485)4724042
e-mail: evsergus@yahoo.com
В 2003-2004 гг. ежемесячно с мая по октябрь изучали
вертикальное распределение фитопланктона в семи разнотипных карстовых озерах,
расположенных в Вязниковском районе Владимирской области: Кщара, Санхар, Юхор,
Большое Поридово, Светленькое, Большие и Малые Гаравы. Они относятся к
категории малых, мягководных, слабоминерализованных (за исключением оз. Юхор),
димиктических водоёмов. В летний период в озёрах наблюдалась температурная и
кислородная стратификация. Оз. Кщара, Санхар, Юхор принадлежат к категории
нейтрально-щелочных водоемов, остальные – слабозакисленные. Согласно величинам
интенсивности фотосинтеза и содержанию хлорофилла а оз. Юхор и Поридово относятся
к эвтрофному типу, а остальные водоёмы – мезотрофные (Гусев, 2008).
В вертикальном распределении биомассы и структуры
сообществ планктонных водорослей в исследованных озерах наблюдалась
значительная неоднородность в течение всего вегетационного периода. В оз. Кщара
весной и осенью максимумы биомассы фитопланктона отмечались в поверхностном
слое, причем значительное развитие водорослей прослеживалось до границы с металимнионом:
в мае до глубины 2 м,
в сентябре – до 6 м.
Структура сообществ не претерпевала серьезных изменений от поверхности до дна.
Весной 2004 г.
доминировали Cryptomonas curvata Ehr., Mallomonas sp. (1) и Glenodinium sp. (1). Осенью
2003 г.
преобладали Cryptomonas curvata, Ceratium hirundinella (O.F.Müller) Schrank, Trachelomonas volvocina Ehr., Mallomonas caudata (Ivanov)
Willi & Krieger и Anabaena scheremetievi Elenk., а через год
- Gonyostomum semen (Ehr.)
Diesing, Oscillatoria agardhii Gom.
и Rhizosolenia longiseta Zachar. В летнее время наиболее интенсивное развитие
водорослей обычно наблюдалось либо над металимнионом, либо в верхней части слоя
температурного скачка (3-5 м).
При этом в июне формировались монодоминантные сообщества с преобладанием Cyclotella radiosa (Grun.)
Lemm. в 2003 г.
и Cryptomonas curvata в 2004
г. В последующие летние месяцы в оба года исследований
основную долю биомассы в эпилимнионе составляли синезеленые из рода Anabaena: A. spiroides Kleb., A. hassalii (Kütz.) Wittr. или диатомовые Cyclotella radiosa, Asterionella formosa Hass. и Fragilaria crotonensis Kitt., а в слое скачка температуры преобладали Oscillatoria agardhii, Ceratium hirundinella,
Mallomonas caudata, Cryptomonas curvata и Trachelomonas volvocina.
В оз. Санхар водоросли концентрировались либо
непосредственно над металимнионом и в его верхней части (4-6 м), либо в средней части
эпилимниона (2-3 м).
Только в мае 2004 г.
зафиксировано их скопление в поверхностном слое. Как и в оз. Кщара, весной
преобладали криптофитовые (Cryptomonas curvata),
динофитовые (Peridinium willei Huitf.-Kaas) и
золотистые (Mallomonas sp.). В мета- и гиполимнионе среди доминантов также
отмечались синезеленые (Oscillatoria agardhii) и
диатомовые (Aulacosira ambigua (Grun.) Sim.). Июнь 2003 г. характеризовался
монодоминантым сообществом Cyclotella radiosa во
всей толще воды. В том же месяце в 2004 г. преобладали, преимущественно, золотистые
(Dinobryon divergens Imhof и Chromulina sp.) в
сопровождении Cryptomonas curvata и Peridinium willei. В мета-
и гиполимнионе, где биомасса была очень незначительной, лидировали Oscillatoria agardhii, Trachelomonas volvocina и Cyclotella radiosa. В июле обоих лет наибольший вклад в биомассу
фитопланктона вносили, в среднем, Cyclotella radiosa и Cryptomonas curvata, только в 2003 г. помимо этих таксонов было отмечено интенсивное
развитие Gonyostomum semen и Ceratium hirundinella
в верхней части слоя температурного скачка. В августе 2004 г. в структуре
сообществ наблюдались четкие различия по вертикали: в верхнем четырехметровом
слое массовыми видами были Cyclotella radiosa, Ceratium hirundinella, Anabaena lemmermannii P. Richt. и A. scheremetievi, а в нижележащих слоях лидировали Oscillatoria agardhii, Trachelomonas volvocina и
в меньшем количестве C. hirundinella. В сентябре отличительной чертой фитопланктона было
преобладание Gonyostomum semen, который в 2003 г. концентрировался на глубине 4 м, а в 2004 г. в поверхностном слое
и на глубине 6 м.
В оз. Юхор максимальные значения биомассы
фитопланктона обычно фиксировались в поверхностном слое воды. Однако в июле 2003 г. пик водорослей был
зарегистрирован на глубине 2 м,
а в мае и сентябре 2004 г.
– на глубинах 3 м
и 1 м
соответственно. Поверхностные максимумы были обусловлены, в основном, развитием
синезеленых водорослей, прежде всего из рода Anabaena: A. lemmermannii, A.
hassalii (Kütz.) Wittr., A. sphaerica
Born. et Flah. f. conoidea Elenk. и A. flos-aquae
(Lingb.) Breb. В ряде случаев вместе с этими таксонами в доминирующий комплекс
входили Dactylosphaerium
jurisii Hind. (июнь-июль 2004 г.), Glenodinium sp. (июль 2004
г.) и Microcystis aeruginosa Kütz. emend. Elenk. (август 2004 г.). В июле 2003 г., когда наибольшие
значения биомассы фитопланктона наблюдались в пограничном слое между эпи- и
металимнионом, доминировал Ceratium hirundinella
в сопровождении Cryptomonas curvata и Monoraphidium minutum. В
мае и сентябре 2004 г.
структуру сообществ определяли зеленые и криптофитовые водоросли с небольшим
участием синезеленых. Весной преобладали Dactylosphaerium jurisii, Cryptomonas curvata и Chroomonas acuta Uterm.,
а осенью – Monoraphidium minutum (Näg.) Kom.-Legn., Cryptomonas obovata Skuja и Microcystis aeruginosa. В гиполимнионе озера практически во все сроки
наблюдений наибольшей долей в суммарной биомассе характеризовалась Oscillatoria lauterbornii Schmidle.
В мелководном оз. Поридово (максимальная глубина 4,5 м) только в июне 2004 г. фитопланктон
распределялся равномерно в толще воды, в остальные сроки водоросли
концентрировались в поверхностном слое воды и с возрастанием глубины их
количество резко уменьшалось. Весной превалировали Cryptomonas curvata и, в меньшей степени, Peridinium umbonatum Stein, а в летние месяцы доминировал Gonyostomum semen.
В оз. Светленькое вертикальное распределение
фитопланктона было наиболее сложным. В июне 2003 г. его максимальная
биомасса были зафиксирована в эпилимнионе, в слое 0-2 м, которая определялась
преимущественным развитием Dinobryon pediforme (Lemm.) Steinecke. В
нижележащих слоях в доминирующий комплекс встраивались Mallomonas caudata и Gonyostomum semen и Peridinium willei. В июле того же года отмечено два пика в вертикальном
распределении биомассы: меньший в металимнионе, сформированный за счет Gonyostomum semen и Peridinium willei, и
максимум в гиполимнионе, на глубине 9
м, при доминировании Mallomonas caudata. В сентябре 2003 г., как и в июне, фитопланктон концентрировался
в эпилимнионе, на этот раз в слое воды 0-4 м с максимумом на глубине 2 м. Структуру сообществ
определяли Dinobryon pediforme и Cryptomonas curvata. В мае 2004
г. биомасса фитопланктона была невысокой и слабо
изменялась по глубинам. В июне основная часть водорослей была сосредоточена в
металимнионе и наблюдались четкие изменения в структуре сообществ с глубиной. В
эпилимнионе преобладали Gonyostomum semen и Cryptomonas curvata. На глубине 4 м зафиксировано значительное возрастание
биомассы, вызванное еще более интенсивной вегетацией Gonyostomum semen вместе
с Peridinium willei. На глубине 6 м доминировал Dinobryon bavaricum. Начиная с глубины 7 м, наблюдалось значительное
снижение количественного развития водорослей и увеличение доли криптофитовых,
динофитовых и рафидофитовых. В июле того же года водоросли также концентрировались
в металимнионе, и выделялось два пика биомассы. Первый, на глубине 3 м, был вызван вегетацией Gonyostomum semen, второй, в слое воды 6-7 м – развитием Dinobryon bavaricum. В августе и сентябре структура сообществ была более
однородной и отличалась преобладанием Gonyostomum semen, Cryptomonas curvata, Eutetramorus fottii (Hind.) Kom. во всей
толще воды с максимумом развития в верхней части металимниона и присутствием в
доминирующих комплексах гиполимниона C. obovata,
Dinobryon bavaricum и Peridinium willei.
В оз. Б. Гаравы в 2003 г. наибольшие значения
биомассы фитопланктона зафиксированы на границе эпи- и металимниона, как и в
июле 2004 г.
В июне и августе 2004 г.
максимумы развития водорослей находились в поверхностном слое, в мае – на
глубине 1 м,
а в сентябре фитопланктон распределялся равномерно в пределах эпилимниона. В
летние и осенние месяцы структуру сообществ определяли, в основном, Gonyostomum semen и Cryptomonas curvata. В ряде случаев к ним в качестве доминантов
присоединялись Peridinium willei, Merismopedia tenuissima Lemm., Dinobryon bavaricum и Chromulina sp. В мае 2004
г. наблюдалось монодоминантное сообщество за счет
активной вегетации Peridinium umbonatum.
В оз. М. Гаравы весной и осенью фитопланктон
концентрировался в верхних горизонтах эпилимниона, в летние же месяцы он был
сосредоточен над металимнионом или в верхней его части. В 2003 г. во все сроки
наблюдений преобладали Peridinium willei, Gonyostomum semen и Cryptomonas curvata. В
целом, такой же состав структурообразующих видов наблюдался и в 2004 г., за исключением
июня, когда основную часть биомассы в эпилимнионе создавали Dinobryon bavaricum и D. pediforme, в металимнионе, где лидировал D. bavaricum, а в гиполимнионе - Mallomonas caudata.
Таким образом, в эвтрофных озерах водоросли обычно
формировали максимум в поверхностном слое воды, а в мезотрофных – в зоне металимниона
или в нижней части эпилимниона.
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ВИДОВОГО РАЗНООБРАЗИЯ ФИТОПЛАНКТОНА РЕК БАССЕЙНА ИВАНЬКОВСКОГО ВОДОХРАНИЛИЩА
Дмитриева А.Н.,
Анисимова О.В.
Comparative analyses
of phytoplankton species diversity
in the rivers of the Ivankovo reservoir basin
Dmitrieva A., Anissimova O.
Московский
государственный университет им. М.В. Ломоносова, Биологический факультет,
119992, Россия, Москва, Ленинские горы, д. 1, стр. 12, тел. 8-916-818-48-55
e-mail: anyutka-dm@mail.ru
Значительное внимание уделяется исследованиям
альгофлор водохранилищ, однако флоры малых рек, питающих водохранилища,
практически не изучены. Важное место занимают альгофлористические исследования
и в плане постановки регионального экологического мониторинга.
Иваньковское водохранилище – участок Верхней Волги
длиной 145 километров,
Оно образовано в 1937 г.
и является первым звеном Волжской ветви Волжско-Камского каскада. Площадь водосбора
водохранилища составляет 41 000 квадратных километров. Основные малые
реки, питающие Шошинский плес Иваньковского водохранилища, - Шоша, Лама и
Инюха.
Для проведения сравнительного анализа видового
разнообразия фитопланктона четырех водных объектов (рек Шоши, Ламы, Инюхи и
Шошинского плеса) нами использованы результаты обработки проб с 38 постоянных
станций, расположенных на этих объектах, на которых материал отбирали несколько
раз за сезон исследования. Следует отметить, что разделение бассейна Шошинского
плеса произведено с физико-географической точки зрения: 3 реки и плес, в
который они впадают.
В фитопланктоне р. Шоши идентифицирован 51 вид и
разновидность водорослей из 8 классов (Bacillariophyceae – 17 таксонов, Chlorophyceae
– 13, Coscinodiscophyceae – 8, Fragilariophyceae – 5, Euglenophyceae
и Cyanophyceae по 3, Conjugatophyceae и Chrysophyceae по 1
виду), из них 12 таксонов встречается только в этом водотоке (11 диатомовых: Cyclotella
bodanica Grunow in Schneider, Gomphonema lanceolatum Ehrenberg, Navicula capitatoradiata Germain и др., а
также Phacus pleuronectes (Ehrenberg) Dujardin из
отдела Euglenophyta).
В фитопланктоне р. Шоши обнаружено 44
таксона-индикатора. Алкалифилы (18 индикаторов) представлены диатомовыми
водорослями: Aulacoseira granulata (Ehrenberg)
Simonsen, Gomphonema lanceolatum, Stephanodiscus hantzschii Grunow
(in Cleve and Grunow), Surirella ovalis Brébisson и
др. Индифференты (12), кроме диатомовых, содержат таксоны из отделов Chlorophyta (Coelastrum microporum Nägeli,
Pediastrum boryanum (Turp.) Menegh. и др.)
и Euglenophyta (Phacus
orbicularis Hubner, Phacus pleuronectes). По отношению к галобности водоросли фитопланктона распределены следующим образом: индифферентов - 31 таксон, в большинстве своем это диатомовые водоросли (Navicula capitatoradiata, Pinnularia gibba Ehrenberg, Cymatopleura
solea (Brébisson) W. Smith и др.);
мезогалобы - 2 таксона - Surirella ovalis и Navicymbula pusilla (Grunow) Krammer); галофилов 4 - Aphanizomenon flos-aquae (L.) Ralfs и 3 таксона диатомовых (среди них Fragilaria crotonensis Kitton); галофобы представлены 2 таксонами - Diatoma hyemalis (Roth) Heiberg и Staurastrum vestitum Ralfs.
Таким образом, фитопланктон р. Шоши образован
преимущественно диатомовыми и зелеными типично пресноводными водорослями,
приуроченными к слабощелочным водам.
В фитопланктоне р. Ламы выявлено 74 таксона из 10
классов: Chlorophyceae – 23 вида и разновидности, Bacillariophyceae –
20, Cyanophyceae и Coscinodiscophyceae - по 6, Fragilariophyceae и
Euglenophyceae - по 5 таксонов, Synurophyceae и Dinophyceae по 3,
Conjugatophyceae – 2 и Chrysophyceae – 1 вид. Только в р. Ламе найдено 25 видов
водорослей, из которых 12 таксонов - диатомовые водоросли (Amphora ovalis (Kützing)
Kützing, Cocconeis pediculus Ehrenberg, Cymbella affinis Kützing, Eunotia bilunaris (Ehrenberg) Mills,
Gomphonema truncatum Ehrenberg и
др.); 9 – зеленые (Actinastrum fluviatile (Schröder) Fott,
Crucigenia fenestrata
(Schmidle) Schmidle,
Eudorina cylindrica Korsch. и др.); 2 вида эвгленовых - Phacus
longicauda (Ehrenberg) Dujardin и Trachelomonas hispida (Perty) Stein emend.
Delf.; а также по одному виду золотистых (Mallomonas elongata Reverd.) и синезеленых
водорослей (Synechocystis crassa Woronichin).
Рассмотрение экологической приуроченности выявило
преобладание алкалифилов (19 таксонов-индикаторов), все из которых диатомовые
водоросли (Amphora ovalis, Cocconeis placentula Ehrenberg,
Cymatopleura solea и др.). Индифференты по отношению рН среды представлены
14 таксонами (Fragilaria ulna (Nitzsch) Lange-Bertalot, 3 вида из рода Pediastrum,
Scenedesmus quadricauda (Turp.) Brébisson и др.). По отношению к
галобности в фитопланктоне преобладают индифференты (41 индикаторный таксон),
представленные 5 отделами (виды Oscillatoria nitida Schkorb.,
Epithemia adnata (Kützing) Brébisson, Pediastrum tetras (Ehrenberg)
Ralfs, Trachelomonas hispida, Ceratium hirundinella (O.F. Müller) Dujardin и др.). Галофилы насчитывают 5
таксонов: Aphanizomenon flos-aquae, Fragilaria crotonensis, Cyclotella
meneghiniana Kützing, Melosira varians Agardh
и Epithemia turgida (Ehrenberg) Kützing var. granulata (Ehrenberg)
Brun. В отличие от фитопланктона р. Шоши в р. Ламе встречено 5
галофобных видов (Mallomonas elongata, Synura echinulata Korsch.,
S. petersenii Korsch., Staurastrum vestitum и Volvox polychlamys
Korsch.).
В результате можно охарактеризовать фитопланктон р.
Ламы как типично пресноводный, составленный диатомовыми и зелеными водорослями
с участием эвгленовых, приуроченный к слабощелочным водам.
В фитопланктоне р. Инюхи найдено 38 видовых и
внутривидовых таксонов из 8 классов: Chlorophyceae – 9, Bacillariophyceae – 8,
Cyanophyceae – 6, Euglenophyceae – 5, Coscinodiscophyceae – 4, Synurophyceae –
3, Fragilariophyceae – 2, Dinophyceae – 1 вид. Как характерные только для этого
водотока идентифицированы 11 таксонов (Cylindrospermum stagnale (Kützing)
Born. Et Flah.,
Mallomonas caudata Iwan., Rhopalodia gibba (Ehrenberg) O. F. Müller, Nodularia spumigena Mert., Trachelomonas volvocina Ehrenberg и др.).
По отношению к рН среды в фитопланктоне р. Инюхи выявлено
20 индикаторов, из которых 10 – индифференты (Navicula tripunctata (O. F. Müller) Bory, Coelastrum microporum, Pediastrum boryanum и др.),
9 – алкалифилов (такие как Aulacoseira granulata, Cymatopleura solea) и 1 представитель алкалибионтов - Rhopalodia gibba. С точки зрения приуроченности к наличию в воде хлоридов,
преобладают индифференты (21 таксон-индикатор), представители из разных отделов
водорослей (Cylindrospermum stagnale, Epithemia adnata, Mallomonas caudata, Trachelomonas volvocina,
Peridinium cinctum (O. F. Müller) Ehrenberg и др.).
Группу галофилов составляют Cyclotella meneghiniana, Melosira varians и
Aphanizomenon flos-aquae. Synura echinulata и S. petersenii – представители галофобов.
Таким образом, фитопланктон р. Инюхи составлен
преимущественно диатомовыми водорослями с участием зеленых, и приурочен к
слабощелочным водам с низким содержанием хлоридов.
В фитопланктоне Шошинского плеса водохранилища
встречено 58 видов и разновидностей водорослей из 9 классов: Chlorophyceae – 18
видов, Bacillariophyceae – 15,
Cyanophyceae – 6, Coscinodiscophyceae – 5, Fragilariophyceae и
Euglenophyceae – по 4, Dinophyceae – 3,
Conjugatophyceae – 2, Chrysophyceae – 1 вид. Уникальные для плеса – 12
таксонов: по 5 видов Ochrophyta и Chlorophyta (таких как Rhoicosphenia
abbreviata (C. Agardh) Lange-Bertalot, Cymbella cistula (Ehrenberg)
Kirchner, Pediastrum simplex Meyen и
Dictyosphaerium granulatum
Hindak) и 2 таксона Euglenophyta (Trachelomonas
bacillifera Playf. и Phacus longicauda f. cordatus (Pochm.)
Popova).
Из 25 таксонов-индикаторов рН среды, обнаруженных в
фитопланктоне Шошинского плеса, 16 – алкалифилы (все представители диатомовых
водорослей). Индифференты представлены 9 таксонами (диатомовые, зеленые и эвгленовые
водоросли): Asterionella formosa Hassal, Cyclotella
meneghiniana, Epithemia adnata, Stephanodiscus hantzschii, Navicula tripunctata,
виды рода Pediastrum, Scenedesmus quadricauda, Trachelomonas planctonica Swir.
и др. Из 36 индикаторов наличия хлоридов в воде 31 – индифференты из разных
таксономических групп (Anabaena spiroides Kleb.,
Stephanodiscus hantzschii, Pandorina morum (O. F. Müller)
Bory, Scenedesmus quadricauda, Ceratium hirundinella, Dinobryon sertularia
Ehrenberg и др.).
Можно заключить, что фитопланктон Шошинского плеса
Иваньковского водохранилища составлен диатомовыми и зелеными водорослями, и
приурочен к пресным, щелочным водам.
В целом в фитопланктоне сравниваемых водных объектов
обнаружено 117 таксонов водорослей. Наибольшее видовое богатство обнаружено в
фитопланктоне р. Ламы (74 видовых и внутривидовых таксона), наименьшее – в р.
Инюхе (38).
Сравнительный анализ видового состава фитопланктона
рек Шоши, Ламы, Инюхи и Шошинского плеса показал, что общими для рассмотренных
водных объектов являются 15 видов водорослей, что составляет 12,82%. Из них 7
видов диатомовых (Asterionella formosa, Cyclotella meneghiniana, Stephanodiscus hantzschii и
др.), 5 таксонов зеленых (Pediastrum biradiatum Meyen,
Scenedesmus quadricauda и др.), 3 цианофитовых (Anabaena contorta Bachm., Anabaena planctonica Brunnth.,
Aphanizomenon flos-aquae).
В фитопланктоне сравниваемых водных объектов
преобладает отдел Ochrophyta. Однако при рассмотрении на уровне классов в рр.
Лама, Инюха и в Шошинском плесе преобладают представители Chlorophyceae, в то
время как в р. Шоше – Bacillariophyceae.
Сравнение экологической приуроченности водорослей
фитопланктона сопоставляемых водных объектов показало, что все они тяготеют к
водам с невысоким содержанием хлоридов. Несколько более выражена галофильность
в фитопланктоне р. Шоша, что показано наличием галофильных и мезогалобных
таксонов. По отношению к активной реакции воды (рН) водоросли фитопланктона рек
Шоши, Ламы и Инюхи, а также Шошинского плеса предпочитают слабощелочную среду
обитания.
продукция микроцистина
цианобактериями
шершневского
водохранилища
Духовная
Н.И.*, Гаврилова Е.В.*, Савочкина А.Ю.**, Мезенцева Е.А.**, Пряхин Е.А.*
Cyanobacteria microcystine production
in the Shershnevskoe reservoir
Dukhovnaya N.I.*, Gavrilova E.V.*, Savochkina A.Y.**, Mezenceva E.A.**,
Pryakhin E.A.*
* ФГУН «Уральский
научно-практический центр радиационной медицины» ФМБА РФ
г. Челябинск,
Воровского 68а, 454076. Тел. (351) 232 79 25, факс (351) 232 79 13
e-mail dukhovnaya@urcrm.chel.su
** ГОУ ВПО «Челябинская Государственная Медицинская Академия», г.
Челябинск
Шершневское водохранилище является единственным
источником хозяйственно-питьевого водоснабжения г. Челябинска и городов
спутников и активно используется в рекреационных целях. Ежегодно в водоеме регистрируется
массовое развитие цианобактерий, в том числе видов, синтезирующих микроцистин,
представляющий опасность для здоровья человека.
В настоящем исследовании
проводили определение массовой концентрации микроцистина, токсина цианобактерий
родов Microcystis, Oscillatoria, Anabaena, в воде Шершневского водохранилища с июня по сентябрь
2006-2007 гг. Содержание
микроцистина в воде оценивали методом иммуносорбентного анализа с
использованием стандартного набора для определения микроцистина (Microcystin plate kit, Beacon). Также для каждой пробы
проводили определение видового состава и численности фитопланктона по
общепринятым методикам [2].
Согласно
рекомендациям ВОЗ, ПДК микроцистина в питьевой воде составляет 1 мкг/л [1].
Концентрация микроцистина в воде Шершневского водохранилища за исследованный
период оказалась в пределах 0,007-8,2 мкг/л.
Содержание микроцистина летом 2006-2007 гг. отличалось значительной
неравномерностью. В июне-августе 2006 года среди представителей фитопланктона доминировали
цианобактерии родов Anabaena и Aphanizomenon, при этом концентрация микроцистина в воде не
превышала 1 мкг/л. Осенью 2006
г. (конец сентября – начало октября) на фоне развития Oscillatoria agardhii
концентрация микроцистина превысила этот пороговый уровень. Максимальная
концентрация микроцистина в 2006
г. была зарегистрирована 28.09.2006 и составила 2,3
мкг/л. Имеются литературные данные о том, что Aphanizomenon flos-aquae не синтезирует микроцистин, однако, цианобактерии
рода Anabaena, а также достигающая массового развития Oscillatoria agardhii обладает способностью к его
продукции [1].
Таблица 1
Содержание микроцистина в воде
Шершневского водохранилища летом 2006-2007 гг.
|
Дата
|
Mcst, мкг/л
|
Дата
|
Mcst, мкг/л
|
Дата
|
Mcst, мкг/л
|
|
22.06.2006
|
0,009
|
05.09.2006
|
0,395
|
09.08.2007
|
0,998
|
|
28.06.2006
|
0,007
|
28.09.2006
|
2,320
|
16.08.2007
|
0,037
|
|
05.07.2006
|
0,052
|
05.10.2006
|
1,164
|
22.08.2007
|
1,324
|
|
12.07.2006
|
0,057
|
21.06.2007
|
5,350*
|
30.08.2007
|
4,540
|
|
18.07.2006
|
0,142
|
28.06.2007
|
4,200*
|
06.09.2007
|
5,490
|
|
26.07.2006
|
0,120
|
28.06.2007
|
0,060
|
13.09.2007
|
8,220
|
|
02.08.2006
|
0,214
|
12.07.2007
|
0,077
|
27.09.2007
|
4,418
|
|
09.08.2006
|
1,100
|
19.07.2007
|
0,211
|
04.10.2007
|
0,648
|
|
16.08.2006
|
0,212
|
26.07.2007
|
0,225
|
|
|
Примечание:
* - проба воды из сгона (места концентрации большого количества цианобактерий,
возникающей в результате неблагоприятных метеорологических условий).
При
рассмотрении динамики содержания микроцистина в воде в 2007 г. выявлены похожие
тенденции. В июне 2007 г.
на фоне доминирования Anabaena flos-aquae концентрация микроцистина в воде в целом не превышала
1 мкг/л. Исключением являлись случаи возникновения нагонных явлений
цианобактерий рода Anabaena 21 и 28 июня 2007 г., когда локальные концентрации микроцистина
достигали 4-5 мкг/л. В июле 2007
г. на фоне доминирования цианобактерий Aphanizomenon flos-aquae концентрация микроцистина в воде ни разу не превысила
порог 1 мкг/л. В августе начинается постепенное увеличение содержания
микроцистина, которое достигает своего пика в середине сентября. Первый случай
достижения концентрации микроцистина в 1 мкг/л зарегистрирован 09.08.2007. Эта
дата совпадает с появлением среди доминантов Oscillatoria agardhii,
которая составила 48% от общей численности цианобактерий. Весь сентябрь 2007 г. характеризовался
стойким превышением уровня микроцистина более 1 мкг/л на фоне массового
развития Oscillatoria agardhii.
Методом регрессионного
анализа была проведена оценка зависимости содержания микроцистина в воде от
концентрации клеток цианобактерий разных родов. Выявлено наличие сильной связи
между анализируемыми показателями (R=0,94; R2=0,88; F=39,9; p<0.001).
Уравнение регрессии статистической модели имеет
следующий вид:
Mcn = 0,1+0,1×NMcst+0,047×NOsc ,
где Mcn – концентрация микроцистина в
воде, мкг/л; NMcst - концентрация
клеток цианобактерий рода Microcystis в воде, млн.кл./л; NOsc - концентрация клеток Oscillatoria agardhii в
воде, млн.кл./л.
Как
показал статистический анализ, концентрация клеток цианобактерий родов Aphanizomenon и
Anabaena
не оказывает достоверного влияния на содержание микроцистина (р=0,65 и р=0,71
соответственно). Кроме статистических данных, в пользу этой гипотезы говорит и
тот факт, что в периоды доминирования этих цианобактерий в фитопланктоне
концентрация микроцистина в воде не превышала рекомендуемый допустимый уровень.
Соответственно можно предположить, что цианобактерии родов Anabaena и Aphanizomenon
Шершневского водохранилища не синтезируют микроцистин, а их токсичность
определяется наличием в клетках других токсинов.
Из полученной
модели также были математически рассчитаны пороговые концентрации клеток, при
которых будет достигнуто содержание микроцистина в воде в 1 мкг/л отдельно для
цианобактерий рода Microcystis и Oscillatoria agardhii (9
млн.кл./л и 19 млн.кл./л. соответственно). В некоторых пробах отмечалась
высокая степень доминирования Oscillatoria agardhii, до
80-92%. Для этих проб также была рассчитана пороговая концентрация цианобактерий,
при которой содержание микроцистина в воде достигнет 1 мкг/л (составила 6-22
млн.кл./л).
Безусловно, содержание микроцистина в клетках
цианобактерий варьирует в зависимости от физиологического состояния, фазы
роста, различных факторов внешней среды. Минимальная концентрация
микроцистинсинтезурующих цианобактерий Шершневского водохранилища, при которой
содержание микроцистина превышает допустимую норму для питьевой воды,
составляет 6 млн.кл/л. Эта концентрация цианобактерий, обозначенная ВОЗ как
«первый аварийный уровень» [1], может служить отправной точкой для создания
системы мониторинга токсического «цветения» водоема.
Список литературы
1. Toxic
Cyanobacteria in Water: A guide to their public health consequences, monitoring
and management / Edited by I. Chorus and J. Bartram. WHO, 1999. 400 p.
2. Методические рекомендации по сбору и обработке
материалов при гидробиологических исследованиях на пресноводных водоемах:
Фитопланктон и его продукция / под ред. Г. Г. Винберга. Л., 1984. 31 с.
ВОДОРОСЛИ И ИХ
РОЛЬ В ЭКОСИСТЕМЕ ВОДОЕМОВ
Ермолаев В.И.
Significance and
functions of algae in water ecosystems
Ermolaev V.I.
Центральный
сибирский ботанический сад СО РАН
630090 Новосибирск,
ул. Золотодолинская, 101, тел. 334-44-07, тел. код 383, факс 330-19-86
е-mail: root@botgard.nsk.su
В научной литературе до настоящего времени при
разработке вопросов, связанных с охраной, воспроизводством и реконструкцией
ихтиофауны водоемов, в первую очередь имелась и имеется в виду конечная
продукция – рыба, а состояние первичной и вторичной продукции нередко считается
второстепенной и откладывается на второй план. Между тем жизнедеятельность
водорослей имеет большую роль в биологических процессах водоемов. Их значение
заключается прежде всего в том, что водоросли являются основными созидателями
органического вещества: в результате фотосинтеза они обогащают воду кислородом,
являясь основными продуцентами первичной продукции. Установлена прямая
корреляционная зависимость между первичной продукцией фитопланктона и рыбопродуктивностью
закрытых водоемов (Винберг, 1960, 1962). Выявлена определенная связь между биомассой
фитопланктона и биомассой зоопланктона (Ермолаев, Прусевич, 1995). Трофические
связи в закрытых водоемах в настоящее время представляются таким образом:
биогенные элементы – фитопланктон и фитобентос – вторичная продукция
(зоопланктон и зообентос) – рыбы. Установление взаимосвязи и взаимозависимости
между этими звеньями – одна из важнейших задач современной гидробиологической
науки по управлению процессов, протекающих в водоемах.
Роль водорослей в жизни водоемов трудно переоценить.
Очень большое значение они имеют в решении проблемы охраны окружающей среды.
Здесь водорослям принадлежит двоякая роль. С одной стороны, они широко используются
как показательные (индикаторные) организмы при экологическом мониторинге. С
другой стороны, непосредственно сами водоросли являются активными агентами
процессов самоочищения загрязненных естественных вод. Выдерживая присутствие
органики, солей тяжелых металлов, радионуклидов и других веществ в дозах, токсичных
для других организмов, многие виды водорослей не теряют при этом способности к
фотосинтезу с выделением кислорода, необходимого для бактериального окисления
загрязняющих веществ, дыхания всех аэробных организмов, утилизирующих токсические
инградиенты загрязненной среды. Из других свойств водорослей заслуживает
внимания также их способность избирательно поглощать и накапливать ряд
химических элементов из воды. Особенно это
относится к редким и рассеянным элементам, находящимся в воде в
небольшом количестве. Биофизические процессы обмена элементов между водорослями
и водой представляют большой теоретический и практический интерес.
Водоросли являются основополагающими
в решении пока еще недостаточно разработанной для Западной Сибири центральной
проблемы гидробиологии – продуктивности водных экосистем, что позволяет
установить их трофический статус, а также оценить реальную биологическую продуктивность
и возможность рационального использования в хозяйственной сфере (Ермолаев,
1982,1989,1991; Сафонова, Ермолаев, 1983). Изучение биологической продуктивности
водоемов, кроме того, имеет прикладное значение: учитывая, что фитопланктон
является показателем ихтиомассы и промысловой рыбопродукции озер, величины его
биомассы позволяют определить их сырьевые рыбные ресурсы и потенциальные
возможности (Китаев, 1984; Ермолаев, Прусевич, 1989).
Одним из основных значений
водорослей в жизни водоемов является их участие в цепи питания рыб. Так, с
одной стороны, зоопланктеры – ракообразные с фильтрационным типом питания,
входящие в основной рацион рыб – потребляют свыше 130 видов водорослей, в том
числе и многих массовых представителей фитопланктона (Гутельмахер, 1974). С
другой стороны, непосредственно сами водоросли употребляются в пищу рыбами:
рацион большинства карповых рыб-аборигенов (язь, плотва, елец, карась и др.) на
10-15% состоит из водорослей (Н.А. Прусевич, Л.С. Прусевич,1973), а такие
растительноядные рыбы-интродуценты как белый амур и толстолобик,
акклиматизированные на юге Западной Сибири, питаются преимущественно
фитопланктоном, нитчатыми водорослями и высшими водными растениями.
Наряду с положительной ролью
водорослей вполне возможны отрицательные последствия их массового развития, что
отмечалось в Новосибирском водохранилище, Чано-Барабинских озерах, водоемах
бассейна р. Карасук и т.д. (Ермолаев, 1982,1989; Сафонова, Ермолаев, 1983). В
этих водоемах в отдельные годы было выявлено интенсивное развитие синезеленых
водорослей из родов Aphanizomenon, Anabaena, Microcystis, которые достигали очень высоких показателей численности
и биомассы, нередко вызывая сильное «цветение» воды. Так, в оз. Малые Чаны
среднее за 1978 г.
количество водорослей составляло 2385 млн. кл/л и 1,0 млн. кол/л (биомасса 170
мг/л), в оз. Сартланиомассы, нередко
вызывая сильное " из родов массового развития, что отмечается в Новос
в среднем за 1981-1982 гг. – 70 млн. кл/л и 1,0 млн. кол/л (биомасса 34 мг/л).
Установлено чрезвычайно высокое развитие фитопланктона в оз. Малый Сартлан.
Особенностью его является массовая численность синезеленой водоросли Aphanizomenon flos-aquae,
которая в 1983-1984 гг. достигала 43700 млн. кл/л и биомассы 5700 мг/л, что
было вызвано внесением большого количества удобрений в этот питомный водоем.
Это привело к угнетению зоопланктона и молоди рыб, а во время отмирания водорослей
– и к гибели их в результате дефицита кислорода.
Высокий уровень развития
фитопланктона этих водоемов – результат повышенной обеспеченности их вод биогенными
элементами, а «цветение» воды водорослями является наиболее ярким проявлением
эвтрофирования, приводящим к их загрязнению. Известно, что до определенной степени
развития водоросли в водоемах имеют положительную роль – фитопланктон с
биомассой до 40 мг/л (соответствует умеренному «цветению») еще способствует самоочищению
воды; при более высокой биомассе роль водорослей становится резко
отрицательной. На стадии интенсивного «цветения» при биомассе водорослей свыше
500 мг/л наступает явное ухудшение всех санитарно-биологических показателей
водоемов. В результате массового отмирания и разложения водорослей вода в них
становится почти непригодной для хозяйственного использования и жизни
гидробионтов. Выделение в воду некоторыми синезелеными токсических веществ – в
водоемах юга Западной Сибири их обнаружено 10 видов, из которых наиболее широко
распространены Microcystis aeruginosa, Aphanizomenon flos-aquae, Anabaena flos-aquae – может представлять реальную опасность и для человека.
Массовое развитие синезеленых
водорослей ведет к загрязнению водоемов. Скопление отмирающих водорослей, их
разложение с выделением ядовитых продуктов распада отрицательно влияет на
санитарно-биологическое состояние водоемов, делает невозможным использование их
в рекреационных целях. Отмирание водорослей приводит к биологическому
загрязнению водоемов, сопоставимому по вредности с загрязнением сточными водами
промышленности. Эти и другие биологические помехи (обрастание судов,
гидротехнических сооружений и водопроводов, появление привкусов и запахов в
питьевой воде, засорение фильтров в местах водозаборов, летние заморы рыбы,
токсическое влияние на рыб синезеленых водорослей и т.д.), вызываемые массовым
развитием водорослей, приносят значительный материальный ущерб и требуют
постоянного контроля специалистов – альгологов. Однако несмотря на это, в целом
следует рассматривать водоросли как мощный фактор в самоочищении водоемов и
формировании качества их вод, обеспечивающий стабильность водных экосистем в
условиях все возрастающей антропогенной нагрузки.
АЛЬГОЭПИФИТОН РДЕСТА БЛЕСТЯЩЕГО
(POTAMOGETON LUCENS L.) ОЗЕРА ВЕЛИКОГО (НИЖЕГОРОДСКАЯ ОБЛАСТЬ)
Журавлева
О.В., Юлова Г.А.
Algal
epiphyton of Potamogeton lucens L.
in the Velikoe Lake
(Nizhny Novgorod Region)
Zhuravleva O.V., Julova G.A.
Нижегородский
государственный университет им. Н.И. Лобачевского,
биологический
факультет, кафедра ботаники,
603950, Нижний
Новгород, пр. Гагарина, 23, тел. (831)
4654027
e-mail: kbot@bio.unn.ru
В целом перифитон одна из наименее изученных
группировок гидробионтов. Структура перифитона отражает особенности
естественно-исторического развития, позволяет установить специфику влияния
основных абиотических факторов на водоросли и проследить последовательность отдельных
стадий эволюции водных экосистем (Трифонова, 1990). Особую группу образуют
водоросли обрастаний высших водных растений – эпифитон (Голлербах, Полянский,
1951) или альгоэпифитон (Шарипова, 1998).
В зарастающих озерах перифитон наряду с высшей водной
растительностью является важным компонентом автотрофного звена в водоеме и
служит естественным биофильтром между водосбором и водоемом, является показателем
антропогенных нарушений его режима (Костикова, 1988). Биомасса фитообрастаний
нередко не уступает биомассе фитопланктона или даже превосходит ее (Горбунов,
1976). Водоросли перифитона многократно возобновляют свою биомассу в течение
вегетационного периода (Костикова, 1979) и по величине эффективной продукции
значительно уступают лишь высшей водной растительности (Костикова, 1989). На
разных видах водных макрофитов нередко вегетируют одни и те же водоросли (Саут,
Уиттик, 1990). Некоторые авторы полагают, что ведущим фактором, определяющим
видовое разнообразие и численность населения на некоторых видах погруженных
растений, является степень расчлененности их листовой поверхности (Гаевская,
1966; Krecker, 1968). Растения не являются простым механическим
субстратом для эпифитов, так как выделяют в окружающую среду органические
вещества, количество которых зависит от видовых особенностей макрофитов (Лукина,
1990) и оказывают определенное, хотя и не решающее влияние на заселение и
развитие эпифитов (Кузько, 1988).
Озеро Великое – верхнее озеро в системе восьми
Пустынских озер Арзамаского района Нижегородской области, расположенных на
территории Пустынского заказника. По происхождению карстовое, общей площадью 91,25 га и глубиной около 5,5 м, овальной формы, длиной
до 1600 м,
шириной до 780 м,
образует 5 заливов, на нем имеются 3 острова.
Озеро относится к озерно-камышово-нимфейно-рдестовому
типу (Лукина, Никитина, 1977). Наибольших глубин (до 3,5 м) достигают заросли
рдеста блестящего, образующие полосу шириной до 25 м.
Фитопланктон изучали К.И. Мейер (1935), А.А. Коршиков
(1938), В.И. Есырева, Г.А. Юлова (1974), А.Г. Охапкин (1981), А.Г. Охапкин,
Г.А. Юлова (1989). Фитопланктон и эпифитон карстовых воронок Пустынского заказника
охарактеризован В.И. Есыревой (1978).
Материалом для данной работы послужили 164 пробы
эпифитона рдеста блестящего, собранные на 2 станциях в озере Великом в
июне-июле 1998–2000 годов по общепринятой методике. В альгоэпифитоне рдеста
блестящего выявлено 256 видов, 23 разновидности, 4 формы и 11 водорослей,
идентифицированных до рода из 7 отделов, 13 классов, 20 порядков, 52 семейств,
96 родов. По богатству видов выделялись Chlorophyta (116) и Bacillariophyta (113) при сопутствии Cyanophyta (35
таксонов). Среди зеленых наибольгим числом видов представлены порядки Chlorococcales (66) и Desmidiales (37
таксонов); среди диатомовых – Raphales (78) и Araphales (26); среди синезеленых - Chroococcales и Nostocales (по 13 таксонов). Из Chrysophyta и Euglenophyta
выявлено по 10 видов, из Dinophyta – 6,
из Xanthophyta – 4 вида.
Ведущие семейства: Naviculaceae 52 вида (в том числе 9 разновидностей и 2 идентифицированы
до рода); Desmidiaceae (27 видов и 1
разновидность), Scenedesmaceae (19 видов и 1
разносидность), Fragilariaceae (15 видов, 4
разновидности, 1 форма), Bacillariaceae
(12 видов, 1 разновидность, 1 – до рода), Selenastraceae, Closteriaceae (по 8 видов), Characiaceae,
Oscillatoriaceae (по 7 видов).
Эпифитные (58), бентосные (43) и литоральные (38) виды
составляли 42%, отмечены 155 планктонных водорослей (58%). Преобладали космополиты (257
таксонов), установлено 11 бореальных и 10 аркто-альпийских видов. 16 водорослей
мало изучены в фитогеографическом отношении и составить представление об их
ареале невозможно. По отношению к солености 182 вида индифференты, олигогалобов
– 35, галлофобов – 22, галлофилов – 18, мезогалобов – 3 вида. Для 34 видовых и
внутривидовых таксонов данные отсутствуют. 205 видов недостаточно изучены по
отношению к реакции среды, обнаружено 43 алкалифила, 42 индифферента, 3 вида из
диатомовых и 1 вид из золотистых водорослей являются ацидофилами.
Оценено сходство альгоэпифитона в протоке в озеро
Свято и у острова Салило по индексу Сёренсена, в 1999 – 0,5, в 2000 – 0,47, что
свидетельствует о различиях в видовом составе этих станций. На листьях и
стеблях индекс составил 0,7, что свидетельствует о сходстве видового состава водорослей.
Индекс видового богатства Менхиника достоверно выше
для листа (0,0126), чем для стебля (0,0085) с уровнем значимости 0,016. Это
подтверждается также непараметрическими тестами Вилколсона (p=0,007) и Ван дер Вардена (р=0,009). Подобное явление
связано с характером субстрата.
Индекс видового разнообразия Шеннона по биомассе
колебался в пределах от 2,5 до 4,9. Видовое разнообразие возрастало к середине
лета, в конце второй – начале третьей декады июля отмечались наибольшие
значения индекса Шеннона. Индекс разнообразия для листа и для стебля достоверно
не отличался и составил в среднем 3,8. Высокий показатель индекса Шеннона
свидетельствует о стабильности среды обитания альгоэпифитона. Значения выравненности
в летний сезон были достаточно высоки. Индекс Пиелу по биомассе составил 0,7.
Число видов, входящих в альгофитоценоз, в среднем составляло 39.
В начале июня средняя численность колебалась от 9,75 до 15,25 млн. кл/м2, биомасса
от 56 до 95 г/м2. Вегетировали диатомовые из родов Navicula, Tabellaria, Fragilaria, Cymbella, Synedra.
С середины июня до конца июля численность колебалась от 14,75 до 21 млн. кл/м2,
а биомасса от 59,33 до 109,73 г/м2, с максимальными значения во
вторую декаду июля, за счет развития видов зеленых водорослей из родов Oedogonium, Mougeotia, Coleochaete. В конце июля
возрастает роль синезеленых (виды родов Anabaena, Rivularia, Microcystis). Средняя
численность колебалась от 18,33 до 18,87 млн. кл/м2., а средняя
биомасса от 70,83 до 100,2 г/м2.
До начала июля в протоке по количественному развитию
доминируют диатомовые, а у острова Салило уже в 1 декаду июля преобладают
зеленые и синезеленые водоросли. Это обусловлено мелководностью станции и
насыщенностью воды биогенными элементами из донных отложений.
Максимальные разнообразие и обилие водорослей
обрастаний рдеста блестящего отмечены на глубине 1,5 метра, минимальные –
на глубине 3 метра.
По коэффициентам частоты встречаемости, частоты доминирования установлено, что
фон эпифитона от поверхности 0,5
м до 3
метров составляли 9 видов водорослей: Rivularia aquatica (Wild.) Geitl., Aphanizomenon flos-aquae (L.) Ralfs из
синезеленых, Aulacoseira granulatа (Ehr.) Ralfs, Tabellaria fenestrata (Lyngb.)
Kütz., Cocconeis placentula Ehr., Epithemia adnata
(Kütz.) Bréb., Navicula radiosa Kütz. из диатомовых, Oedogonium
sp. ster., Coelastrum sphaericum Näg. из зеленых.
Среди 140 видов-индикаторов сапробности преобладают
β-мезосапробы (73) и 28 – близкие к ним β-о и о-β-мезосапробы,
16 – олигосапробов, 1 ксеносапробный и 2 ксено-олигосапроба. Вместе с тем
присутствуют 9 α-мезосапробов; 8 – β-α-мезосапробов, 3 –
α-β-мезосапроба, что свидетельствует о повышении трофии водоема.
Показатель сапробности, оцененный индексом Пантле и
Бука, составил 1,67, что характеризует озеро Великое как β-мезосапробный
водоем с III классом качества воды, воды
умеренно загрязненные.
Список литературы
Гаевская Н.С. Роль высших водных растений в питании
животных пресных водоёмов. М.: Наука, 1966. 328 с.
Голлербах М.М., Полянский В.И. Определитель
пресноводных водорослей СССР: в 14 т. Т.1: Пресноводные водоросли СССР. М.:
Советская Наука, 1951. 200 с.
Горбунов К.В. Влияние зарегулирования Волги на
биологические процессы в её дельте и биосток. М.: Наука, 1976. 219 с.
Есырёва В.И. К изучению водорослей карстовых воронок
Горьковской области // Новости систематики низших растений. Л.: Наука, 1978.
Т.15. С. 14-22.
Есырёва В.И., Юлова Г.А. Современное состояние
альгофлоры Пустынских озёр // Охрана природы Горьковской области и рациональное
использование её ресурсов. Горький, 1977. Т.106. С. 44-45.
Коршиков А.А. Материалы к флоре водорослей Горьковского
края // Тр. ин-та ботаники Харьковского университета, 1938. Вып. 3. С.15-27.
Костикова Л.Е. Некоторые черты перифитона высших
водных растений // Мелководья Кременчугского водохранилища. Киев: Наукова
Думка, 1979. С.104-121.
Костикова Л.Е. Перифитон Каховского водохранилища //
Гидробиол. журнал, 1988. Т.24. № 2. С. 16-19.
Костикова Л.Е. Первичная продукция перифитона и его
роль в экосистемах литорали // Гидробиол. журнал, 1989. Т.25. № 3. С.3-8.
Кузько О.А. Эпифитные группировки водорослей в каналах
и их значение для формирования качества воды // Гидробиол. журнал, 1988. Т. 24.
№ 6. С. 24-28.
Лукина Е.В., Никитина И.Г. Охрана озёр и водной
растительности Горьковской области // Охрана природы Горьковской области и её
ресурсов. Горький, 1977. С. 106-109.
1Лукина Г.А. Выделение аминокислот макрофитами //
Флора и продуктивность пелагических и литоральных фитоценозов бассейна Волги.
Л.: Наука, 1990. 272 с.
Мейер К.И. Заметка о половом процессе у Eudorina и Pandorina //
Учёные записки Горьковского ун-та. Горький, 1935. Вып. 4. С. 8-12.
Охапкин А.Г. Фитопланктон системы Пустынских озёр
Горьковской области // Биологические основы повышения продуктивности и охраны
растительных сообществ Поволжья. Горький, 1981. С. 1065-109.
Охапкин А.Г., Юлова Г.А. Видовой состав планктонных
водорослей системы Пустынского заказника (Горьковская область) //
Гидробиологич. исследования в заповедниках СССР. М., 1989. С. 150-151.
Саут Р., Уиттик А. Основы альгологии. М.: Мир, 1990.
597 с.
Трифонова И.С. Экология и сукцессия озёрного фитопланктона.
Л.: Наука, 1990. 180 с.
Шарипова М.Ю. Состав и распределение эпифитных
водорослей некоторых макрофитов // Проблемы ботаники на рубеже XX-XXI веков. Тез. докл. II (X) съезда РБО. СПб., 1988. Т. 2. С. 124.
Krecker F.H. A
comparative study of the animal population of certain submerged aquatic plants
// Ecology, 1968. V. 20. № 4. P. 7-10.
Изменение структуры микрофитобентоса
вдоль градиента освещенности
Зубишина А.А.,
Бабаназарова О.В., Сахарова Е.
Change of the
microphytobenthos structure along light gradient
Zubishina A. А., Babanazarova O.V., Saharova E.
Ярославский
Государственный университет им. П.Г. Демидова
г. Ярославль, пр-д
Матросова, 9. тел/факс 8(4852)478298
e-mail: alla@bio.uniyar.ac.ru
Озеро Плещеево –
типичный димиктический, довольно глубокий, со значительной площадью литорали и
сублиторали. Пробы микрофитобентоса в оз. Плещеево отбирались стратометром С-1
по трем трансектам в течение периода открытой воды 2001 г. Станции наблюдений
были выбраны на входе устья р. Трубеж, ст. «Симак около типичного побережья на
юго-западе и на выходе из озера р. Вексы. Пробу смешивали из трех образцов
поверхностного грунта. Глубины отбора проб исчислялись от величины прозрачности
(0.2Z, 0.5Z, 1Z, 2Z, 3Z, где Z - прозрачность) и охватывали всю фотическую
зону. Во время наших исследований величины прозрачности изменялись
незначительно в пределах 4м, таким образом, были охвачены зоны литорали и
сублиторали до изобаты 12 м.
Целью работы было проследить изменение структуры сообщества микрофитобентоса
вдоль градиента освещенности.
Согласно результатам исследования, распределение количественных
характеристик микрофитобентоса по градиенту глубины носило характер непрямой
зависимости. Динамика обилия по глубинам показала, что, в целом, наибольшим
таксономическим богатством и обилием отличались глубины равные 1Z, иногда 0,5,
2Z. Здесь же наблюдались наибольшие показатели индекса Шеннона.
Структурные изменения в составе
микрофитобентоса оз. Плещеево
вдоль трансект были выявлены на уровне
отделов и видов. Зеленые нитчатые водоросли (в основном р. Cladophora) занимали только эулиторальную, прибрежную зону
озера. Диатомовые водоросли были встречены на всех глубинах, увеличивая
показатели обилия на глубинах равных 0,5 – 1 Z, а в некоторых случаях давая пик биомассы на глубине
2 Z. Статистический анализ данных показал, что с глубиной
на всех станциях происходит достоверное (p<0.05) увеличение относительной
численности синезеленых, и уменьшение - диатомовых в сообществе (табл. 1).
Таблица 1
Коэффициенты корреляции Спирмена между вкладом отделов
в численность и глубиной
|
Станция
|
Пляж
|
Симак
|
Векса
|
|
Cyanophyta
|
0.6448
|
0.5135
|
0.4608
|
|
Bacillariophyta
|
-0.6766
|
-0.5247
|
-0.4907
|
Увеличение вклада синезеленых водорослей с
глубиной на всех станциях за сезон отражает коэффициент регрессии r2= 0,486 (р=0,002) аппроксимированный степенным уравнением (рис. 1).
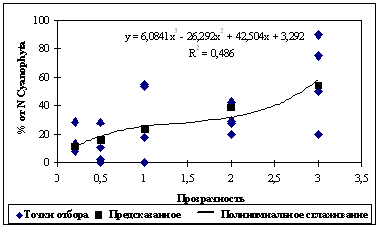
Рис. 1. График
подбора с полиномиальным сглаживанием для регрессионной зависимости вклада
Cyanophyta
в численность микрофитобентоса оз. Плещеево
Серия кривых относительной скорости фотосинтеза
фитопланктона при различной освещенности, полученная на Волжской акватории и, в
частности, на оз. Плещеево, показала их зависимость от состава доминирующих
групп водорослей. Для фитопланктона с преобладанием зеленых кривая была смещена
в сторону большей облученности, а для диатомовых и, особенно, синезеленых водорослей
– в сторону пониженных значений (Пырина, 1967, 1995). Для бентосных экосистем известно,
что в условиях высокой инсоляции (в верхней литорали, у уреза воды) часто
обитают нитчатые зеленые водоросли (рр. Cladophora, Ulothrix, Zignema) (Hill, 1996; Pillsbury, Lowe, 1999; Bourassa, Cattaneo, 2000; Nozaki, 2001; Donahue
et al,
2003). Они имеют специальные протекторные вещества (микоспоринподобные аминокислоты),
для защиты от высокой инсоляции и поражающего действия UV-В радиации (Dodds, Gudder, 1992; Donahue
et al,
2003). Это подтверждается изменением таксономического состава бентосных
водорослей при изменении светового климата в водоеме. Так, при инвазии активных
моллюсков-фильтраторов (например, р. Dreissena) и, соответственном увеличении доступности света,
происходит увеличение количества бентосных нитчатых водорослей (Lowe, Pillsbury, 1995;
Vaughn, Hakenkamp,
2001).
У диатомовых водорослей селективность к уровню
освещенности часто проявляется на уровне видов (Hoagland, Peterson, 1990).
Некоторые виды адаптированы к высокому уровню освещенности, многие диатомовые
обильнее развиваются в местах с пониженной освещенностью и UV-B радиацией, и
могут проявлять симптомы фотоингибиции (Blanchard, 2004) , кроме того, бентосные диатомеи толерантны к
временному отсутствию света (Moss, 1977; Stevenson et al, 1991; Hill, 1996; Peterson, 1996; Tuji, 2000; Donahue
et al,
2003).
Увеличение вклада синезеленых водорослей с глубиной
отмечено и в других исследованиях (Дуплаков, 1933; Девяткин, 1978; Зубишина,
Бабаназарова, 2004; Bourassa, Cattaneo, 2000; Vinocur, Pizzaro, 2000). Это определяется наличием у данной группы
водорослей хроматической адаптации (дополнительного пигмента фикоэритрина) (Steinberg, Hartmann, 1988; Falkowski, LaRoche, 1991),
а также возможностью переходить на гетеротрофное питание (Tuchman, 1996).
Одним из ответов на уменьшение световой интенсивности
с глубиной может быть изменение линейных параметров клеток. Анализ изменения размеров клеток различных видов
микрофитобентоса оз. Плещеево с глубиной показал увеличение осевых
линейных характеристик (длина, ширина) (рис. 3), объема и площади поверхности
клетки, и уменьшение отношения площади поверхности клеток к объему на 1-2 Z (рис. 2). Таким образом, с глубиной происходило
увеличение вклада крупных видов водорослей.
Причем увеличение объема происходило за счет удлинения
организмов, что хорошо видно из графиков и определяется, по-видимому, биологией
микрофитобентических организмов.
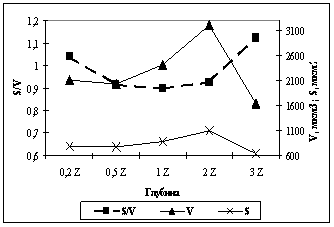
Рис. 2. Изменение объема (V), площади поверхности (S) и их отношения (S/V)
клеток микрофитобентоса оз. Плещеево
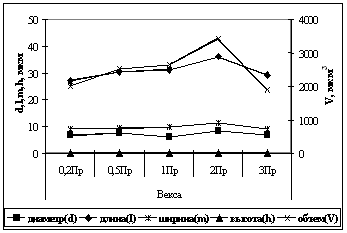
Рис. 3. Динамика линейных характеристик
клеток микрофитобентоса по глубинам
на ст. Векса в оз. Плещеево
В условиях лимитирования светом более адаптивным
признаком является уплощение и увеличение плоскости поверхности клетки для
увеличения площади фотосинтетической поверхности. Резкое уменьшение клеточного
объема видов на глубине 3Z вызвано слабым
развитием типичного микрофитобентоса на этой глубине и влиянием фитопланктона.
Интересно отметить, что средние размеры отдельных
видов микрофитобентоса оставались относительно постоянными в течение сезона,
особенно, для часто встречаемых, но необильных видов. Подобная
морфологическая стабильность была отмечена в фитопланктоне (Lewis, Riehl, 1982) и у
диатомей (Edlund, Stoermer, 1997). Во время подъема обилия до уровня доминанта у
отдельных видов отмечали появление нескольких размерных классов. Диапазон
линейных характеристик увеличивался, возрастало количество крупных клеток вида.
Часто, это были виды, выделенные в качестве ценозообразущих. Подобное изменение
линейных характеристик свойственно диатомовым водорослям, находящимся в периоде быстрого размножения, с переходом через
фазу ауксоспорообразования.
Работы по изучению размерных характеристик водорослей
(диатомей) в анализе бентосного сообщества немногочисленны (Hillebrand, 1999; Raven, 2002; Snoeijs, Busse, Potapova, 2002). Гораздо больше работ для фитопланктона, в
частности, по влиянию линейных размеров на уровень метаболизма в зависимости от
освещенности (Гуттельмахер, 1986; Raven, Kubler, 2002). Существует две основных стратегии
фотоакклимации – изменение размера или числа фотосинтетических единиц. Обе эти
стратегии возможны для диатомовых водорослей (Falkowski, LaRoche, 1991).
В работе Ф. Раунда (Round, 1981) отмечается, что для
морского диатомового эпипелона одним из ответов на изменение световой
интенсивности с глубиной может быть увеличение вклада «крупных» клеток. При этом отмечено сильное увеличение количества пигментов,
вплоть до физиологических изменений в клетке и редуцирования некоторых органелл.
Также отмечено присутствие таких крупных видов, как Campylodiscus и Surirella
для больших глубин между 30 и 75
м в Plante-Cuny (Round, 1981). В
наших исследованиях также отмечалось увеличение вклада крупных видов с
глубиной, а виды Surirella ovata и Campylodiscus noricus были
отмечены только на глубине 2 и 3 Z. Однако, есть
и исключения, например, мелкоклеточный вид Achnanthes kryophyla, встречался только на больших глубинах. В экологической
характеристике данный вид отмечен как глубоководный. Тем не менее,
мелкоклеточные виды чаще обитают на мелководных участках и представляют целую
экологическую группу эпипсаммона.
Анализ структуры сообщества микрофитобентоса на
видовом уровне затруднен в силу значительной гетерогенности видового состава
сообщества, как в пространстве, так и во времени. Тем не менее, на основании
кластерного анализа видов-доминантов по точкам отбора были выделены следующие
особенности. Точки отбора кластеризовались в большей степени по глубинам, чем
по станциям по всем датам наблюдений. Это свидетельствует о большей
однородности распределения обилия видов доминантов на одной глубине разных
станций. По-видимому, сходство условий освещенности на одной глубине имеет
большее значение, чем различия других экологических факторов. Так, в мае-июле
всегда хорошо вычленялись глубины максимального обилия 0,5Z и 1Z, что совпадает
в целом с тенденцией заглубления максимумов развития микрофитобентоса и
свидетельствует о формировании наиболее развитого сообщества на глубинах
оптимальной освещенности.
Глубоководные станции и мелководные, как правило,
отделялись в более близкие кластеры, благодаря невысоким обилиям видов
доминантов, хотя условия освещенности на них значительно отличались. В сентябре
разделение по глубинам при общем снижении развития микрофитобентоса было
выявлено не столь четко, как в другие даты. Скорее всего, при снижении
освещенности усиливалось воздействие других факторов, что приводило к большей
гетерогенности сообщества.
Выводы. Структурные
изменения в составе микрофитобентоса оз. Плещеево вдоль трансект
были выявлены на уровне отделов и видов. Зеленые нитчатые водоросли занимали
прибрежную зону озера. Диатомовые водоросли были встречены на всех глубинах,
увеличивая показатели обилия на глубинах равных 0,5–1 Z, а в некоторых случаях давая пик биомассы на глубине
2 Z. Статистический анализ показал достоверное
относительное увеличение численности синезеленых, и уменьшение - диатомовых в
сообществе с глубиной на всех станциях.
Уменьшение количества света с глубиной
приводило к увеличению вклада «крупных»
видов водорослей. Причем, увеличение объема
происходило за счет удлинения организмов. По-видимому, в условиях лимитирования
светом более адаптивным признаком является уплощение и увеличение поверхности
клетки для увеличения площади фотосинтетической поверхности. В сезонной
динамике микрофитобентоса происходило увеличение средневзвешенных объемов
клеток. Во время подъема обилия до уровня доминанта у отдельных видов отмечали
увеличение диапазона линейных характеристик и количества крупных клеток,
особенно для ценозообразующих видов. По-видимому, водоросли находились в периоде быстрого размножения, с переходом через фазу ауксоспорообразования.
Кластерный анализ обилия видов доминантов показал, что
точки отбора за одну дату кластеризовались в большей степени по глубинам, чем
по станциям. Это свидетельствует о большей однородности распределения обилия
видов доминантов на одной глубине разных станций. По-видимому, сходство условий
освещенности на одной глубине имеют большее значение, чем различия других
экологических факторов.
На различных глубинах были отмечены различные по
составу и численности сообщества бентосных водорослей. Изменения были выражены
на уровне экологических (метафитон, эпипсаммон, эпипелон), таксономических и размерных
группировок.
СОСТАВ И СТРУКТУРА
АЛЬГОЦЕНОЗОВ МАКРОФИТОВ
НА ПОБЕРЕЖЬЕ
БЕЛОГО МОРЯ
Иевлева Н.А.
Composition and
structure of macrovegetation algal coenoses
in the White Sea
coast
Ievleva N.A.
Институт
экологических проблем Севера УрО РАН
163000 Архангельск, наб. Северной Двины, 23,тел.:
(8182) 28–70–01, факс: (8182) 28–76–36
e-mail: ievleva_n@mail.ru; natal-ievleva@yandex.ru
Исследование эколого–фитоценотических закономерностей
распределения растительного покрова является одним из актуальных направлений
современной экологии растений.
Гидроботанические исследования в России сейчас
достаточно интенсивно развиваются и охватывают все большее число таксонов
растений. Определенный интерес для таких работ представляют макроводоросли,
играющие значимую роль в морских прибрежных экосистемах и обеспечивающие
жизнедеятельность других биотических компонентов литоральной зоны, которая
играет значительную роль в экологии моря. Она является границей между берегом и
морем и испытывает постоянное воздействие течений, штормов, льдов, пресных
стоков. Высокопродуктивные литоральные сообщества морских
водорослей–макрофитов, доминирующими элементами которых являются фукусовые
водоросли, служат убежищем, кормовой базой и естественным нерестилищем для
многих видов рыб и других гидробионтов. Кроме того, запасы фукоидов позволяют
осуществлять их добычу для коммерческого применения, что также оказывает
влияние на экономический потенциал Архангельской области, связанный помимо
лесной промышленности с хозяйственным использованием морских биоресурсов Белого
моря.
Все это делает тему по изучению растительности
литорали Белого моря чрезвычайно актуальной в плане сохранения видового
разнообразия и устойчивости ресурсов промысловых видов.
Материалом послужили наблюдения, выполненные автором
на литорали Кандалакшского (гб. Палкина), Онежского (Онежский берег,
о. Кий) и Двинского (Зимний берег) заливов. Кроме того, работы были
выполнены на побережье Соловецкого архипелага (о. Б. Соловецкий:
м. Печак, м. Белужий, гб. Долгая, гб. Сосновая;
о. Б. Муксалма, о. Б. Заяцкий).
Макроскопические водоросли, несмотря на хорошую
прозрачность и другие подходящие для них условия, отсутствуют там, где им
препятствуют другие виды и где в массе находятся фитофаги. Слабо развиваются
макрофиты в местах, где нет постоянного течения или прибоя. Интенсивно водоросли
развиваются в прибойных местах с пологим уклоном дна, а также в местах с
постоянными течениями. В таких местах они могут расти, несмотря на низкую прозрачность
воды. Как отмечал Ю.Е. Петров, места произрастания морских
водорослей–макрофитов можно характеризовать:
1) положением по вертикали, что показывает отношение к
свету и действию волн;
2) степенью прибойности берега;
3) уклоном дна;
4) грунтом;
5) опреснением.
В зависимости от характера грунта согласно
классификации А.А. Калугиной мы выделили шесть биономических типов
литорали в Белом море: илистая, илисто–песчаная, песчано–галечная,
каменисто–песчаная, песчано–каменистая, каменистая.
Таким образом, количественное распределение водорослей
тесно связано с наличием тех или иных грунтов.
Флора водорослей–макрофитов районов исследования
насчитывает 47 видов, относящихся к 33 родам, 21 семейству, 15 порядкам и 3
отделам. Доля участия Chlorophyta во
флоре данных районов составляет 23,4 %. Это связано с тем, что здесь
наиболее представлена группа вторичноморских родов, имеющих довольно крупную
тонконитчатую и тонколистовидную формы (Enteromorpha, Acrosiphonia,
Spongomorpha, Monostroma, Ulvaria), связанных своим происхождением и преимущественным
распространением с водами умеренных и холодных широт. Доля участия Phaeophyta и Rhodophyta во флоре
данных районов составляет по 38,3 %. Порядки Rhodophyta характеризуются наибольшим флористическим разнообразием,
тогда как Phaeophyta составляет основу фитоценозов на литорали по проективному
покрытию и биомассе. Флора
водорослей–макрофитов на литорали Белого моря различается по районам, что
обусловлено рядом факторов, в основном характером грунта, степенью защищенности
берега, прозрачностью воды, течениями, глубиной, соленостью воды и иными
факторами. Характерными местами, где наиболее разнообразен видовой состав
макрофитов на литорали являются Кандалакшский залив, Соловецкие о-ва и Онежский
залив. Для этих местообитаний характерны менее защищенные участки прибрежий с
хорошей аэрацией, сильные течения, каменистые грунты, мелководья, малый уклон
дна, малая опресненность и меньшая взмученность воды. Вместе с тем Двинской
залив, в частности Зимний берег, с его мягкими и подвижными грунтами, большей
взмученностью и большой опресненностью в
меньшей степени способствуют развитию зарослей макрофитов.
Распределение водорослей по вертикали относительно
друг друга носит довольно однородный характер почти на всем побережье Белого
моря. Самыми существенными факторами, влияющими на жизнедеятельность водорослей
на литорали, являются периодическое обсыхание на воздухе, прибойность и
освещенность:
1. Водорослевые растительные сообщества на литорали
Кандалакшского залива представлены фитоценозами:
ü закрытый и полузакрытый берег – с участием Ascophyllum
nodosum и Fucus vesiculosus,
ü открытый берег – сообществами с Ascophyllum nodosum.
2. Водорослевые растительные сообщества на литорали
Онежского залива (открытый берег) представлены фитоценозами с участием Ascophyllum
nodosum и Fucus vesiculosus.
3. Водорослевые растительные сообщества на литорали
Соловецкого архипелага представлены фитоценозами:
ü закрытый берег – с участием Fucus vesiculosus,
ü полузакрытый и открытый берег – Fucus vesiculosus
и Ascophyllum nodosum.
4. Водорослевые растительные сообщества на литорали
Двинского залива (открытый берег) представлены фитоценозами:
ü на мелком подвижном грунте сообществом Enteromorpha
prolifera и Rhizoclonium riparum,
ü на крупном устойчивом – Fucus distichus.
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ФИТПОПЛАНКТОНА
РЕК-ПРИТОКОВ ВЕРХНЕЙ ВОЛГИ
Комиссаров А. Б.
Comparative description of the Volga
upstream tributaries phytoplankton
Komissarov A.
Иваньковская Научно-исследовательская Станция
Учреждения Российской Академии Наук Института Водных Проблем РАН
Тверская обл., г. Конаково. Тел.: 8 (48242) 367-33, 367-34
е-mail: a_b_komissarov@mail.ru
Данные о видовом составе и структуре фитопланктона
Верхней Волги и её притоков весьма отрывочны. Из альгологических работ можно
отметить исследования Строганова Н. С. И Захарова Н.Г., проводившиеся в 20-х
г.г. XX века,
Кузьмина Г. В., проводившиеся в 60-70-х г.г. XX века, и сотрудников Института Биологии Внутренних Вод
Митропольской И. В., Девяткина В. Г. и Метелёвой Н. Ю., проводившие наблюдения
в 1998 г.
Стоит отметить работы сотрудников Дубнинской
экоаналитической лаборатории ФГВУ «Центррегионводхоз» (Московская обл., г.
Дубна), которые проводили регулярные наблюдения за фитопланктоном р. Волги на
участке от Бейшлота до г. Твери с 2003 по 2008
г.г.
Эти работы были направлены в основном на определение
видового состава, подсчёта биомассы, индекса сапробности, индекса
биологического разнообразия, определение хлорофилла «а».
С 2008 г.
сотрудниками Иваньковской НИС были начаты регулярные гидрохимические и альгологические
исследования рек-притоков Верхней Волги. Были отобраны пробы фитопланктона в
реках Селижаровка, Большая Коша, Малая Коша и Итомля в летнюю межень 2008
г. (рис. 1).
Эти водотоки относятся к восточно-европейскому типу
рек. Для них характерны низкая летняя и зимняя межень, высокое половодье и
осенние паводки. Питание осуществляется в основном за счёт снега и атмосферных
осадков. Питание реки Селижаровка осуществляется также за счёт вод из озера Селигер.
Доля грунтовых вод в питании невелика. Краткая морфологическая характеристика
рек представлена в таблице 1.
По химическому составу реки относятся к
гидрокарбонатному классу кальциевой группы с мягкой (у реки Селижаровка) и
умеренной (у остальных рек) жёсткостью воды, по степени минерализации – к
категории ультрапресных (река Селижаровка) и пресных (остальные реки) вод.
Величина рН в течение года изменялась незначительно (табл. 2).
Рис. 1. Карта-схема исследуемых рек
Таблица 1
Краткая морфологическая характеристика исследуемых рек
|
Река
|
Характеристика истока
|
Длина, км
|
Площадь водосбора, км2
|
|
Селижаровка
|
оз. Селигер
|
36
|
2950
|
|
Б. Коша
|
Болотно-лесной массив
|
88
|
763
|
|
М. Коша
|
64
|
431
|
|
Итомля
|
57
|
321
|
Таблица 2
Краткая гидрохимическая характеристика рек (2008
г.)
|
Река
|
Жёсткость, мг-экв/дм3
|
Минерализация, мг/дм3
|
Величина рН
|
|
min
|
max
|
min
|
max
|
min
|
max
|
|
Селижаровка
|
1,4
|
1,7
|
131,7
|
152,1
|
7,27
|
8,1
|
|
Большая Коша
|
1,8
|
2,9
|
156,3
|
239,4
|
7,37
|
7,72
|
|
Малая Коша
|
2,5
|
3,6
|
217,6
|
300,9
|
7,53
|
7,84
|
|
Итомля
|
2,1
|
3,7
|
186,9
|
303,8
|
7,53
|
7,88
|
Антропогенная нагрузка складывается в основном за счёт
стоков, поступающих с водосбора, с сельскохозяйственных полей и
животноводческих ферм. Организованных источников загрязнения на водосборах рек
Селижаровка, Большая Коша и Малая Коша нет. Река Итомля в среднем течении
принимает недостаточно очищенные сточные воды колхоза «Итомля».
Альгологические пробы на реках отбирались в июле 2008
г. в приустьевой части. Отбор проб
и обработка материалов проводились по стандартным методикам.
Всего в исследуемых реках в общей сложности было
обнаружено 139 таксонов водорослей рангом ниже рода. При этом по наибольшему
разнообразию выделяются диатомовые и зелёные. Однако для разных рек характерна
разная структура распределения таксонов по отделам (табл. 3).
В спектре ведущих семейств максимальное число ранговых
мест принадлежит Chlorophyta (15 семейств) и Bacillariophyta (12 семейств), в меньшей степени Cyanophyta (5 семейств) и Chrysophyta (4 семейства), отдел Xanthophyta представлен 2 семействами, а Cryptophyta и Eiglenophyta представлены
1 семейством каждый.
Таблица 3
Таксономический состав фитопланктона исследуемых рек в
июле 2008 г.
|
Отдел
|
Селижаровка
|
Б. Коша
|
М. Коша
|
Итомля
|
Всего
|
|
Cyanophyta
|
13
|
1
|
1
|
6
|
15
|
|
Chrysophyta
|
2
|
0
|
1
|
3
|
5
|
|
Bacillariophyta
|
24
|
22
|
36
|
30
|
61
|
|
Xanthophyta
|
3
|
0
|
0
|
1
|
4
|
|
Cryptophyta
|
6
|
6
|
6
|
6
|
6
|
|
Euglenophyta
|
0
|
0
|
1
|
1
|
2
|
|
Chlorophyta
|
35
|
8
|
7
|
20
|
47
|
|
Всего
|
83
|
37
|
52
|
67
|
139
|
Среди зелёных водорослей ведущими по видовому
разнообразию являются семейства Chlorellaceae и Scenedesmaceae, которые представлены 10 таксонами каждое. Среди
диатомовых ведущим является семейство Naviculaceae, которое представлено 11 таксонами (табл. 4).
Таблица 4
Число таксонов среди семейств
|
Отдел
|
Семейство
|
Количество
таксонов
|
Отдел
|
Семейство
|
Количество таксонов
|
|
Cyanophyta
|
Microcystidaceae
|
5
|
|
Rhoicospheniaceae
|
1
|
|
Oscillatoriaceae
|
5
|
Rhopalodiaceae
|
1
|
|
Anabaenaceae
|
2
|
Xanthophyta
|
Pleurochloridaceae
|
2
|
|
Gloeocapsaceae
|
2
|
Tribinemataceae
|
2
|
|
Merismopediaceae
|
1
|
Cryptophyta
|
Cryptomanadaceae
|
6
|
|
Chrysophyta
|
Dinobrinacaea
|
2
|
Euglenophyta
|
Euglenaceae
|
2
|
|
Chrysocapsaceae
|
1
|
Chlorophyta
|
Chlorellaceae
|
10
|
|
Euchromulinaceae
|
1
|
Scenedesmaceae
|
10
|
|
Rhizochrysidaceae
|
1
|
Botryococcaceae
|
6
|
|
Bacillariophyta
|
Naviculaceae
|
11
|
Hydrodictyaceae
|
3
|
|
Cymbellaceae
|
9
|
Oocystaceae
|
3
|
|
Fragilariaceae
|
8
|
Characiaceae
|
2
|
|
Stephanodiscaceae
|
7
|
Coelastraceae
|
2
|
|
Achnanthaceae
|
6
|
Chlamidomonadaceae
|
2
|
|
Nitzschiaceae
|
6
|
Closteriaceae
|
2
|
|
Diatomaceae
|
5
|
Desmidiaceae
|
2
|
|
Gomphonemaceae
|
4
|
Treubariaceae
|
1
|
|
Aulacosiraceae
|
2
|
Ulothrichaceae
|
1
|
|
Melosiraceae
|
1
|
Radiococcaceae
|
1
|
Чмсленность фитопланктона в общем изменялась от 454 до
32,668 тыс. кл./дм3. Биомасса изменялась от 0,185 до 0,461 мг/дм3
(табл. 5).
Таблица 5
Численность и биомасса фитопланктона в исследуемых
реках в июле 2008 г.
|
Река
|
Численность клеток, тыс. кл./дм3
|
Доминанты по
численности
|
Биомасса, мг/дм3
|
Доминианты
по биомассе
|
|
Селижаровка
|
32,668
|
Microcystis pulverea
Microcystis incerta
|
0,370
|
Cocconeis placentula
Aulacoseira islandica
|
|
Большая Коша
|
454
|
Cocconeis placentula
Achnanthes minutissima
Chroomonas acuta
|
0,185
|
Cocconeis placentula
Cymbella ventricosa
|
|
Малая Коша
|
736
|
Cocconeis placentula
Achnanthes minutissima
Lingbia limnetica
|
0,401
|
Cocconeis placentula
Aulacoseira islandica
|
|
Итомля
|
2,560
|
Cocconeis placentula
Achnanthes minutissima
Nitzschia acicularis
Chlorella vulgaris
|
0,461
|
Diatoma vulgaris
Cymbella aspera
Caloneis amphisbaena
|
Коэффициент Сёренсена указывает на сходство
биологического разнообразия у рек Селижаровка и Итомля, Большая Коша и Малая
Коша, а также Малая Коша и Итомля (табл. 6).
Таблица 6
Коэффициент Сёренсена между исследуемыми реками, %
|
|
Селижаровка
|
Большая Коша
|
Малая Коша
|
Итомля
|
|
Селижаровка
|
-
|
30,8
|
28,8
|
44,7
|
|
Большая Коша
|
|
-
|
57,5
|
33,6
|
|
Малая Коша
|
|
|
-
|
42,6
|
|
Итомля
|
|
|
|
-
|
Автор выражает благодарность И.Л. Григорьевой
(Иваньковская НИС УРАН ИВП РАН, г. Конаково), Н.Г. Тарасовой (УРАН ИЭВБ РАН, г.
Тольятти) и Л.П. Чермных (Дубнинская ЭАЛ ФГВУ «Центррегионводхоз», г. Дубна).
Работа выполнена при финансовой поддержке гранта РФФИ
(проект № 07-05-96414).
Список литературы
Алёкин О. А. Общая гидрохимия. – Л.: Гидрометеоиздат.
1970. – 444 с.
Методы биоиндикации и биотестирования природных вод.
Вып. 2. Ростов-на-Дону, 1989 г.
– 277 с.
Оксиюк О. П. и др. Комплексная экологическая
классификация качества поверхностных вод суши. Гидробиологический журнал, т.
29, № 4. – 1993 г.
С. 62-76.
Структура и функционирование геосистемы озера Селигер
в современных условиях. Ред. В. П. Беляков, С. И. Шапоренко. – Спб.: Наука,
2004. – 253 с.
Труды Пресноводного Исследования. Том 1. Отчёт об
экспедиции по Верхней Волге (2005). Ред. В. В. Кузовлев, М. Шлеттерер. – Тверь,
Москва, Инсбрук. – DER ANDERE VERLAG,
2006. – 140 с.
ЭКОЛОГИЧЕСКИЕ Группировки водорослей в водных
экосистемах
Комулайнен С.Ф.
Ecological groups of algae in water ecosystem
Komulaynen S.F.
Институт Биологии Карельский НЦ РАН, г. Петрозаводск, Карелия, Россия
e-mail: Komsf@mail.ru
Приспосабливаясь к
разнообразным внешним условиям, водоросли обеспечили себе повсеместное распространение.
Они встречаются повсюду: в морях, океанах, пресноводных водоемах, в снегу и в
горячих источниках, в почве, на коре деревьев, на скалах и т. д. Расселяясь по
земному шару, водоросли образуют различные экологические группировки —
сообщества, или ценозы.
Расширение и углубление гидробиологических
исследований в конце 19 - начале 20 веков привело ученых к важному этапу -
дифференциации отдельных специфических группировок гидробионтов с топическими,
структурными, функциональными и морфологическими особенностями (Протасов, 1994).
В результате формирования
такого аналитического подхода; единая гидробиота дифференцируется. Возникает
несколько схем экологической классификации группировок водной микрофлоры.
Согласно первой, исторически сложившейся, выделяются две группы: фитопланктон и
фитобентос. Причем до 1885 г.
все сообщества водных организмов, обитающих на твердых субстратах, также
включались гидробиологами в группу «бентос». В некоторых случаях эта
тенденция сохранилась до настоящего времени и термины «фитобентос»,
«микрофитобентос», «algal benthos»,
«benthic algal communities» используются для обозначения всех
альгоценозов дна, как это делает Стивенсон (Stevenson. 1996), независимо от
характера субстрата и способности организмов прикрепляться, укореняться или
проникать внутрь субстрата. Несколько позже выделяется нейстон (Naumann.
1919), который делятся на «эпинейстон» и «гипонейстон». Первые
существуют над пленкой воды, вторые - под пленкой.
Вторая схема (Hutchinson,
1967) выделяет среди бентоса специфическую группу организмов, обитающих на
твердом субстрате. Выделение планктона и бентоса, а затем нейстона и перифитона
стало одним из первых шагов гидробиологии как особой отрасли знаний о развитии
жизни в водоемах (Алеев. 1990). Варминг (цит. по Roll, 1939) ввел для водных
прикрепленных макроскопических и микроскопических растений термин «nireiden».
В 1905 г. Селиго (цит. по
Дуплакову, 1933) выделил в составе бентоса группу организмов под термином
«Aufwchs – нарост». Этим термином он обозначил комплекс микроскопических
растений и простейших организмов, обитающих на растениях, камнях и древесине на
мелководье, даже если они не прикреплены к субстрату. Хентшель (Hentschel,
1916) предложил для данного комплекса
организмов термин «bewchs» (обрастание или оброст),
при этом он несколько расширил объем понятия, присоединив к ним и
макроскопические водоросли. По его мнению, субстрат является лишь основой и не
имеет большого значения для обрастания. Хентшель первым отметил, что обрастания
в отличие от бентоса, характеризуют не почву (или грунт) и поэтому дают
возможность судить о качестве воды. Виллер (цит. по Дуплакову, 1933) выделил
среди прикрепленных организмов две группы в зависимости от типа субстрата
(живой и мертвый). Для первого он применяет термин «aufwchs», для второго «bewchs».
А. Л. Бенинг (Бенинг, 1924)
впервые в гидробиологии вводит термин «перифитон», понимая под ним сообщества
организмов на субстратах антропогенного характера. Для сообществ на естественных
субстратах он предлагает использовать термин «Bewchs». Г.С. Корзинкин (Карзинкин,
1925), а позже С. Н. Дуплаков (Дуплаков, 1933) отождествили понятия «перифитон»
и «обрастание» и дал определение понятия: «Под перифитоном я понимаю
все сообщества, обитающие на твердом субстрате за пределами специфического
придонного слоя воды. Сюда войдут сообщества на предметах, внесенных в воду
человеком, сообщества на макрофитах, сообщества на крупных камнях и корягах
мелководья». В американской литературе термин «periphyton» впервые появился
в середине 30-х годов для обозначения бактерий, собранных с погруженных
стеклянных пластинок (Johnson, Miller, 1935). Определение
перифитона, позднее данное Янгом (Young, 1945) и Уетселем (Wetzel,
Westlake, 1969)
идентично определению Дуплакова.
В дальнейшем предпринимались
неоднократные попытки объединить все прикрепленные организмы под одним
термином, либо использовать различные термины для обрастаний на живом и неживом
субстратах, а также для группировок с разной степенью контакта с субстратом.
Формирование целостной
научной классификации экологических группировок сообществ водных организмов
сопровождалось разработкой терминологии, история которой достаточно детально
описана. Однако неразработанность общих представлений приводит к тому, что
«почти каждое сообщение, посвященное изучению данного сообщества, предваряется
оригинальными определениями» (Протасов. 1994). Поэтому мне понятно замечание,
сделанное Стивенсоном (Stevenson. 1996): «Мое определение
термина не предполагает быть окончательным, потому что постоянное (неизменное)
определение препятствует творчеству. Новое определение потребуется, когда появится
новая информация и разовьются новые идеи об организации системы, ее частей и
характере объединения последних».
В любой научной дисциплине
вопросы классификации занимают важное место. Функции классификации отнюдь не
сводятся к тому, чтобы помочь внести определенную систему в научное описание
или облегчить составление библиографических указателей. Разработка
классификации заставляет теоретически осмыслить и обобщить весь накопленный
данной наукой «багаж», в классификации находят свое выражение основные
закономерности, присущие изучаемым предметам и явлениям.
Список
литературы
Алеев Ю.Г. 1990.
Топологические категории и экоморфы гидробионтов. Гидробиол. журн., 26(1). С.
3–7.
Бенинг А.Л. К изучению
придонной жизни реки Волга. Монографии Волжской Биологической Станции. Саратовского
Общества Естествоиспытателей. №1. Саратов. 1924. 398 с.
Дуплаков С.Н. Материалы к
изучению перифитона. Тр. Лимнологической ст. в Косине. 1933. 16. С. 3-160.
Карзинкин Г. С. Попытка практического
решения понятия «биоценоз» Предварительное сообщение. Тр. Гидроб. станции на
Глубоком озере. 1925. 6(2/3). С. 1–14.
Протасов А.А. 1994.
Пресноводный перифитон. Киев. 307 с.
Hentschel E. Biologische Untersuchungen über die
tierischen Pflanzlichen Bewchs im Hamburger Hafen. Mitt.
Zool. Hamb. 1916. 33: 1-176.
Hutchinson G. E. 1967. A
treatise of limnology. I, II, III. Wiley, N.Y.
Johnson M. W., Miller R. C. 1935. The seasonal settlement of shipworms,
barnacles, and other whart-pile organisms at Friday Harbor, Washington
// Univ. Wash. Publ. Oceanogr. 2 (1): P. 1-18.
Naumann C.L. 1919. Eine einfache Methode zum Wachevies bezn. Einsammelin
der Eisenbakterian // Ber. Dtsch. Bot. Ges.- 37. 76-78.
Roll, 1939 Roll H. Zur Terminologie des periphyton. Arch. Hydrobiol. 35:
59-69.
Stevenson R. J. 1996. An introduction of benthic algae ecology in
freshwater benthic habitats // Algal ecology. Freshwater benthic ecosystems. P.
3–30.
Wetzel, R. G., Westlake
D.F. 1969. Periphyton. A manual methods for maeasuring primary production in
aquatic environments // IBP. Handbook, 1969. N12, 33-40.-[39]
Young O.W. 1945. A
limnological investigation of periphyton in Doglas Lake, Michigan.
Trans. Am. Microskop.
Soc. 64(1): 9-21.
СТРУКТУРА АЛЬГОЦЕНОЗОВ В ВОДОЕМАХ
ОЗЕРНО–РЕЧНОЙ СИСТЕМЫ РЕКИ КЕНТИ, РЕСПУБЛИКА КАРЕЛИЯ
Комулайнен С.Ф.1, Чекрыжева Т.А.2
Algacoenosis
structure in some waterbodies of the Kentri river lake-river system, Karelia
Komulaynen S.F.1, Chekryzheva T.A.2
1Институт Биологии КарНЦ РАН,
185910, Петрозаводск, ул. Пушкинская,11, Республика Карелия, Россия
Тел.
(8142) 561679,
Факс (8142) 769810
e-mail: Komsf@mail.ru
2 Институт Водных Проблем Севера КарНЦ РАН,
185003, Петрозаводск, пр. А. Невского, 50, Республика Карелия, Россия
Тел.
57 65 20 Факс 8 (814 2) 57 84 64
e-mail: Tchekryzheva@mail.ru
Освоение Костомукшского железорудного месторождения и
строительство горно-обогатительного комбината (ГОК), привело к прямому
антропогенному воздействию на водоемы региона. В озерно-речную систему р. Кенти
поступают высокоминерализованные техногенные воды с высоким содержанием
минеральных компонентов и аномальным по сравнению с природным соотношением
ионов, что характеризует новый вид антропогенной нагрузки на водоемы Карелии.
Бассейн р. Кенти (63˚–66˚с.ш.) с площадью
949 км2 является частным водосбором р. Кеми (приток Белого моря).
Река Кенти, протяженностью 75 км, протекает
через десять озер и впадает в оз. Среднее Куйто. Верхнее озеро системы
(Костомукшское), преобразованное в хвостохранилище ГОКа, отделено от
нижележащих озер дамбой. Озера верхнего участка системы (Окунево, Поппалиярви)
высокопроточные, с небольшой площадью (0,3–1,6 км2). Нижерасположенные
озера (Койвас, Кенто) имеют наибольшие размеры (21,4–30,8 км2) и
замедленный водообмен.
За длительный период функционирования (1982 г.)
Костомукшского ГОКа негативное воздействие техногенных вод комбината на
экосистемы русловых озер связано с возрастанием уровня минерализации,
увеличением концентрации калия, нитратов, сульфатов, смещением активной реакции
среды в сторону щелочности (Лозовик и др., 2001; Лозовик, Калмыков, 2007).
Оценка загрязненности водных объектов системы р. Кенти по региональным предельно-допустимым
концентрациям (ПДК), учитывающим геохимический фон элемента и его токсичность
(Лозовик, 2007), характеризует воды оз. Окунево и Поппалиярви как загрязненные,
а Ковас и Кенто как умеренно загрязненные.
Изучение альгоценозов русловых озер системы и участков
реки, соединяющих эти озера, проводились с 1987 г.
по 2008 г.
(Комулайнен, 1995; Комулайнен, Морозов, 2007; Чекрыжева, 1995). Пробы
фитопланктона, отобранные в летний сезон (июль–август) 1987, 1994, 1996, 1999,
2003, 2008 гг. в пелагиали озер Окунево, Поппалиярви, Койвас, Кенто,
обрабатывали в соответствии с общепринятыми методами (Кузьмин, 1975, 1984;
Федоров, 1979; Tikkanen, 1986). Отобранные в
период летней межени (июль-август) 1993, 1994, 1995, 2007, 2008 гг.
на порожистых участках реки Кенти пробы фитоперифитона обрабатывали по
стандартной методике (Комулайнен 2003).
Флористический список фитопланктона озер системы р.
Кенти насчитывает 177 таксонов из 8 систематических отделов: Bacillariophyta –
68 (38%), Chlorophyta – 41 (23%),
Chrysophyta – 28 (16%), Cyanophyta – 12 (7%), Cryptophyta – 8 (5%),
Euglenophyta – 11 (6%), Dinophyta – 8 (5%), Xanthophyta – 2 (1%) таксонов.
Наиболее разнообразны в озерах диатомовые, зеленые, золотистые и синезеленые
водоросли (85% от общего числа видов), что является характерной особенностью альгофлоры
планктона озер и рек Карелии (Комулайнен и др., 2006). Сравнительный анализ
видового состава водорослей озер системы р. Кенти показал достаточно высокую
степень (50–75%) сходства (по коэффициентам Серенсена) общих флористических
списков.
Анализ экологических характеристик видов фитопланктона
озер системы р. Кенти за длительный период наблюдений обнаружил их типичность
для водоемов севера Европейской части России. Для альгофлоры озер характерно
преобладание широко распространенных космополитных форм (85%), что свойственно
фитопланктонным сообществам водоемов таежной зоны. Холодолюбивый характер флоры
озер подчеркивается заметным процентом арктоальпийских (8,5%) и бореальных
(6,5%) видов, а также малым разнообразием синезеленых водорослей. По отношению
к pH среды выделены виды–индифференты (76%), алкалифильные
(18%) и ацидофильные (6%) формы, присутствие последних считается следствием поступления
в водоемы болотных вод с водосбора. До 85% найденных видов водорослей
относилось к пелагическим и литоральным формам планктона. Процент донных видов
и видов из обрастаний составлял 15%. Доля видов-индикаторов сапробности
достигала 62% от всего состава водорослей. Большинство из них (70%) относились
к олигосапробным, олиго–β–мезосапробным и β–мезосапробным формам.
Среди показателей высокой степени сапробности (26% от всего состава видов
индикаторов сапробности) присутствуют β–α–сапробные, α–сапробные
и ρ–α–сапробные виды, развивающиеся в озерах, испытывающих влияние органического
загрязнения (Pseudanabaena catenata
Laut., Oscillatoria tenuis Ag., Cryptomonas
erosa Ehr., Cryptomonas ovata Ehr., Stephanodiscus hantzschia Grun., Nitzschia acicularis (Kütz.) W.
Sm., Nitzschia palea (Kütz.) W.
Sm. Nitzschia sigma (Kütz.) W. Sm.).
В озерах системы обнаружено постепенное снижение
значений индекса сапробности (Sladecek, 1973).
В верхних озерах системы (Окунево и Поппалиярви), которые испытывают наибольшую
антропогенную нагрузку в связи с более близким расположением к источнику
загрязнения, были отмечены самые высокие значения индексов сапробности (S=2,1–2,3), соответствующие b–мезосапробным условиям. В нижерасположенных озерах
(Койвас, Кенто) значения индекса колебались от 1,5 до 1,7, характеризуя воды,
как содержащие умеренное количество органических веществ (Макрушин, 1974). В
обоих случаях, согласно эколого-санитарной классификации поверхностных вод суши
(Оксиюк, Жукинский, 1983), вода всех озер относится к классу качества вод
удовлетворительной чистоты. Различия относятся к разряду качества вод, так в
оз. Койвас и оз. Кенто вода достаточно чистая, а в озерах Окунево и Поппалиярви
она слабо загрязненная.
Согласно шкалам галобности (Прошкина-Лавренко, 1953;
Давыдова, 1985), по отношению к минерализации, помимо большого количества
видов–индифферентов (82%), разнообразно представлены галофобы и галофилы (18%),
что в целом характерно для пресных вод всех климатических зон. Наибольшее число
галофильных форм (Diatoma elongatum (Lyngb.) Ag., Nitzschia palea (Kütz.) W. Sm., Nitzschia sigma (Kütz.) W. Sm., Navicula radiosa Kütz.), характерных для высокоминерализованных вод, и,
следовательно, предпочитающих повышенный уровень минерализации, наблюдали в
планктоне оз. Окунево, где в результате воздействия техногенных вод
хвостохранилища минерализация воды была наибольшей из всех озер системы.
Влияние техногенных вод, поступающих в систему р.
Кенти, сказывается на таксономическом составе фитопланктона озер. Число видов
водорослей за все годы наблюдений возрастает от верхних, наиболее подверженных
антропогенному влиянию, озер (Окуневое, Поппалиярви – 65–82 таксона) к водоемам
(Койвас, Кенто – 91–104 таксон), наиболее удаленным от источника загрязнения
(Феоктистов и др., 1992; Чекрыжева, 1995; Вислянская, 2007), для которых
характерны большие глубины и размеры и, следовательно, большее разнообразие
биотопов обитания. Такая же тенденция
увеличения видового разнообразия (индекс Шеннона) фитопланктонных
сообществ наблюдается от верхних озер системы к нижерасположенным водоемам: оз.
Окунево 2,87±0,28, оз. Поппалиярви 2,59±0,62, оз. Койвас 2,99±0,18, оз. Кенто
3,24±0,29.
Трансформация условий водной среды при минеральном
загрязнении влечет за собой изменения в составе экологических группировок
водорослей. Так, влияние загрязняющего фактора на экосистемы обследованных озер
системы р. Кенти сказывается на вегетации индикаторных видов фитопланктона, в
том числе, видов-индикаторов сапробности вод. Наиболее показательными в системе
оценки качества воды являются диатомовые водоросли (Стенина, 1993), чаще вид Nitzschia acicularis (Kütz.)
W. Sm., интенсивная
вегетация которого характерна для вод с повышенным уровнем трофии и для
загрязняемых озер (Трифонова, 1990). В течение длительного периода исследований
(1987–2008 гг.) наблюдали уменьшение количественных показателей популяции Nitzschia acicularis
от верхнего оз. Окунево, в наибольшей степени подверженного антропогенному
влиянию, к ниже расположенным озерам системы.
В перифитоне реки Кенти определено 136 таксонов
водорослей: Bacillariophyta – 89 (65%), Chlorophyta – 23 (17%), Cyanophyta –22 (16%), Dinophyta
– 1(1%), Rhodophyta –1(%). Наиболее разнообразны диатомовые, зеленые,
золотистые и синезеленые водоросли, что является характерной особенностью
альгофлоры планктона озер и рек Карелии (Комулайнен и др., 2006).
Видовое богатство альгофлоры перифитона реки в целом,
а также отдельных участков определяют диатомовые водоросли, среди которых
наиболее постоянными в альгоценозах обрастаний были евперифитонные формы родов Tabellaria, Eunotia, Synedra, Achnanthes,
Gomphonema – комплекс доминирующих видов, как правило, определяющий
структуру водорослевых обрастаний в реках региона.
Наибольшее разнообразие отмечено для родов Eunotia, Cymbella, Gomphonema,
которые содержат, соответственно, 13, 12 и 10 таксонов, что составляет более
25% от всех определенных водорослей. Ведущими среди диатомовых водорослей
являются представители высокоорганизованного порядка Diraphales – 50 разновидностей и форм. Среди зеленых водорослей
основным ценозообразователями были Bulbochaete
sp. Zygnema sp.,
и Mougeothia sp.
Красные водоросли представлены только одним таксоном (Batrachospermum
moniliforme Roth.),
однако в 1994 г. именно
на долю этого вида приходилось более 90% биомассы прикрепленных сообществ в
верхнем течении реки Кенти .
Достаточно разнообразно в перифитоне представлены
синезеленые водоросли, четыре вида (Stigonema mamilosum (Lyngb.) Ag., Tolypothrix saviczii Kossinsk., T. tenuis Kütz., Calothrix gypsophila (Kütz.) Thur.) доминировали
в перифитоне.
Большая часть определенных видов – эпилиты и эпифиты.
Вместе с тем отмечено высокое разнообразие планктонных форм (36 видов). Кроме
центрических диатомей в обрастаниях, встречены зеленые, главным образом,
десмидиевые, и синезеленые водоросли. Они имеют ограниченное распространение, и
их численность, как правило, не превышает 10% от суммарной. Только на участке,
расположенном непосредственно ниже истока из озера Койвас, Fragilaria capucina Desm. входила в состав доминирующего
комплекса.
Положение на шкале галобности известно для 82 таксонов
водорослей, подавляющее большинство которых относятся к олигогалобам. Из них
78,1 % составляют индифференты, 18,5% – галофилы и 11,0% – галофобы. Лишь два
вида являются мезогалобами, это Synedra
pulchella (Ralfs.) Kütz. и Rhopalodia musculus Kütz..
Из 82 видов и разновидностей, являющихся индикаторами
рН среды, в перифитоне также преобладают индифференты – 69,5% таксонов.
Алкалифилы и ацидофилы составляют соответственно 14,6 и 15,9%. Среди
алкалифилов наиболее постоянно в обрастаниях присутствует Synedra ulna (Nitzsch.) Ehr. и Cymbella pussila Grun., из ацидофилов характерны типичные для альгофлоры
водоемов, имеющих заболоченные водосборы, диатомеи родов Eunotia и Tabellaria,
разнообразно хотя и единичными экземплярами представлены десмидиевые водоросли.
Сведения о географическом распространении имеются для
82 видов, разновидностей и форм, из них 53,9% – космополиты, 31,7% – бореальные
и 13,4% – арктоальпийские виды.
Структуру альгоценозов обрастаний, как и в большинстве
ранее исследованных рек европейского Севера, определяют евперифитонные формы
родов Tabellaria, Ceratoneis, Synedra,
Fragilaria, Achnanthes, Oedogonium, Mougeotia, объединенные П. П. Ширшовым
(Ширшов 1933) в «северный» тип. Отмечена и другая, характерная для многих
северных регионов, особенность таксономического состава водорослевых
обрастаний: сочетание «северного» и «южного» типов альгофлоры. «Южный» тип
альгофлоры в перифитоне р. Кенти представлен диатомовыми водорослями родов Cymbella и Gomphonema.
Таким образом, за двадцатилетний период наблюдений
видовой состав фитопланктона озер системы р. Кенти принципиальных изменений не
претерпел, основу флористического списка, как и в прежние годы, составляют
диатомовые, зеленые и золотистые водоросли. Отмеченные изменения в соотношениях
количественных показателей развития разных систематических групп фитопланктона
свидетельствуют о начавшейся перестройке в фитопланктонных сообществах озер, вызванной
усилением антропогенного воздействия на экосистему водоемов, в частности,
вследствие повышения содержания калия, общего фосфора и азота в воде, а также
общего уровня минерализации.
Сравнение видового состава перифитона р. Кенти в
разные годы показало, что состав доминирующего комплекса,
эколого-географические спектры, характеризующие структурные особенности
альгофлоры перифитона, остались практически без изменений. В то же время,
значительно изменялось количество видов, слагающих альгофлору прикрепленных
сообществ, что нашло отражение в уменьшении видового разнообразия альгоценозов
и увеличении индексов доминирования. При этом плотность формируемых группировок
осталась практически на прежнем уровне.
Экологические классификации планктонных
водорослей
Корнева Л.Г.
Ecological classifications of planktonic algae
Korneva L.G.
Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 п. Борок, Ярославская область, Некоузский район, тел./факс
(48547)24-042
е-mail: korneva@ibiw.yaroslavl.ru
Фитопланктон – это совокупность различных
таксономических групп микроскопических водорослей, обитающих в толще воды. Они отличаются
морфологически, жизненными формами, физиологическими потребностями в разнообразных
физико-химических условиях водной среды, способами питания, т.е. жизненными
стратегиями.
Жизненные
формы. Различают эупланктонные виды (истинно–планктонные
или голопланктонные), ведущие планктонное существование на протяжении всей
жизни, и тихопланктонные (или меропланктонные, факультативно–планктонные, семи–планктонные),
которые проводят в планктоне лишь часть своего развития. Большинство гидробионтов
– гетеротопны (Николаев, 1968), т.е. различные фазы их жизненного цикла проходят
в разных местообитаниях. Например, синезеленые водоросли из рода Microcystis
перезимовывают в поверхностном слое иловых отложений в виде ослизненных
колоний, живые клетки которых утилизируют органические и биогенные вещества
ила. При благоприятных световых условиях они всплывают в толщу воды и в период открытой
воды пребывают в планктоне, переходя на основной автотрофный тип питания. В
донных отложениях в значительном количестве присутствуют цисты золотистых,
акинеты синезеленых водорослей. При определении преимущественного местообитания
вида (в ходе его жизненного цикла) водорослей в водоеме авторы чаще всего
ориентируются на основное местонахождение популяции по литературным источникам,
придавая ему статус планктонный, бентосный, литоральный и т.п.
Стратегии
метаболизма. Основная функция,
которую выполняют водоросли в водоемах – синтез первичного органического
вещества, осуществляемый за счет фотолиза воды и сопровождающийся
высвобождением молекулярного кислорода. Однако многие синезеленые водоросли способны
к прямой фотоассимиляции органических соединений, некоторые из них – к
фотоокислению соединений серы без выделения кислорода, а отдельные – к фиксации
молекулярного азота. Синезеленые – единственная группа водорослей, обладающая
перечисленными признаками, свойственными и отдельным группам бактерий, что
позволяет говорить об их физиологической близости. Но в отличие от бактерий эта
древнейшая группа прокариотических организмов приобрела способность к освобождению
молекулярного кислорода из воды (фотолитическому расщеплению воды),
осуществляющегося за счет появления второй фотохимической реакции (ФР), которая
отсутствует у бактерий, обладающих только одной ФР, отвечающей за восстановление
(Федоров, 2004). Это предопределяет промежуточное положение синезеленых в
филогететическом древе живых организмов между бактериями и растениями. Поэтому
в современной таксономии их называют как цианобактерии. Кроме автотрофного типа
питания, как усвоение углерода из углекислого газа и восстановление его до
органических соединений, многие водоросли способны переключаться на гетеротрофный
(ассимиляцию различных органических соединений) или используют оба способа
питания (миксотрофный тип). Выделяют фотогетеротрофные водоросли, которые сочетают
использование света, как источник энергии, и органические соединения, как
источник углерода (Горбунов, 2005). По-видимому, к этой группе можно отнести
некоторые виды «осцилляториевых» синезеленых, в частности Planktothrix agardhii (Gom.) Anag. et
Komárek. Увеличение обилия этого вида в лимнопланктоне связывают
с высокой степенью антропогенного эвтрофирования и увеличением содержания
органического азота (Трифонова, 1990), а также с увеличением поступления сточных
вод (Skulberg, 1980). Многие другие представители рода Oscillatoria эффективно развиваются в
условиях высокого содержания органических веществ, в сточных водах и способны к
гетеротрофному питанию (Кузьменко, 1981). По этой причине они адаптированы к
обитанию в гиполимниальных слоях водоемов (Корнева, 1993; Hindak, Trifonova, 1989).
Гетеротрофный тип питания может осуществляться через
осмотрофию (как у Planktothrix agardhii)
и фаготрофию. К фототрофным миксотрофам относят все группы фитофлагеллат
(Olrik, 1998). В олиготрофных светловодных озерах при
снижении способности фитопланктона поглощать взвешенные ортофосфаты они могут переходить
на фаготрофное питание бактериями, которые при низкой численности в таких водоемах
обладают более высоким содержанием фосфора и являются дополнительным его
источником. В олиготрофных гумозных озерах, где бактерии активно используют
растворимый аллохтонный углерод, наблюдается конкуренция между бактериями и
водорослями за неорганические биогенные вещества. Мобильность фитофлагеллат
позволяет им оставаться в фотической зоне для нахождения пищи. Питание
бактериями, использующими аллохтонные вещества, – гетеротрофный путь увеличения
продукции и эффективности экосистемы. Миксотрофию рассматривают как адаптивную
стратегию к низкой солнечной активности или низкому содержанию биогенов (Pålsson, Graneli, 2004). В эвтрофных водоемах миксотрофы развиваются в
условиях лимитирования светом подо льдом (Wiedner, Nixdorf, 1998)
или после пика развития других групп водорослей (Sommer et al., 1986). В последнем случае наблюдается низкая
биомасса у хищников и достаточно высокая у бактерий за счет значительного
присутствия растворенных органических веществ, поступающих из разлагающихся
водорослей. Соотношение фотоавтотрофной и гетеротрофной составляющей в динамике
фитопланктона можно использовать, как критерий неблагополучной экологической
ситуации в водоеме, обусловленной повышенным содержанием РОВ (Ильяш и др.,
1997). Многолетнее (на протяжении 30-ти лет) снижение удельной активности
фитопланктона Рыбинского водохранилища (Корнева, 1996) свидетельствует об
увеличении гетеротрофии, что подкрепляется и его структурными преобразованиями:
увеличением обилия фототрофных миксотрофов – криптомонад и золотистых
водорослей (Корнева, 1999). Различные стратегии метаболизма способствуют разнообразию
способов поступления вещества и энергии в клетки водорослей (Ильяш, 2002).
Для исследования функционирования водных экосистем
особое внимание уделяется изучению размерной
структуры планктонных сообществ. Классификация фитопланктона по размерным
фракциям зависит от выбора способа разделения авторами фракционирования
(Михеева, 1988). Наиболее часто используется размерная классификация Sieburth et al. (1978): макропланктон – >
200 мкм в диаметре, микропланктон – 20–200 мкм, наннопланктон – 2–20 мкм,
пикопланктон – 0.2–2 мкм. Согласно обобщенной схеме Дж. Стокнера (Stockner, 1991) численность пикопланктона увеличивается в
градиенте концентрации общего фосфора: от ультраолиготофных водоемов к
эвтрофным. Показано, что обилие пикофитопланктона в оз. Байкал нарастает в
периоды снижения биомассы основных компонентов планктона, т.е. в «неурожайные»
годы (Бондаренко, 1997), создавая первичную продукцию, сопоставимую с ее величинами
в высокопродуктивные годы, что выравнивает ее межгодовые флюктуации в озере.
При увеличении уровня трофии озер и водохранилищ наблюдается изменение баланса
крупно–и мелкоклеточных видов в сторону увеличения участия последних (Михеева,
1992; Корнева, 1994, 1999).
Разнообразные методы и подходы биоиндикации для оценки
состояния водных экосистем используют принцип индивидуального отношения
отдельных видов водорослей к различным факторам среды. Они базируются на аутэкологических классификацях водорослей.
По отношению к солености воды известна шкала Van der Werff – Huls
(1957-1974), в которой выделены 14 категорий диатомовых водорослей: от морских
до пресноводных. При разделении видов по классам галобности часто используют шкалу R. Kolbe (1927) с
дополнениями А.И. Прошкиной-Лавренко (1953). Шкала R. Kolbe была
трансформирована в систему Ф. Хустедта (Hustedt, 1953, 1957). Simonsen R. (1962),
уточняя систему Кольбе – Хустедта, разработал новую шкалу галотолерантности
видов, в которой выделены олиго-мезо-и полигалобы. Основной индикации по pH
показателю стала классификация Ф. Хустедта (Hustedt, 1939), которая предусматривает строгое соотношение
между распределением экологических категорий водорослей и pH воды. Одним из ключевых показателей степени
закисления вод является структура комплексов диатомовых водорослей. Список индикаторных
таксонов Ф. Хустедта по-прежнему продолжает совершенствоваться (Foged, 1960; Порк, 1970; Van Dam, 1988; Round, 1990 и др.). Для оценки степени ацидности вод по
диатомовым применяют различные индексы, для расчета которых учитывают
соотношение участия их отдельных экологических групп (Nygaard, 1956; Meriläinen, 1967; Renberg, Hellberg, 1982). Наиболее широко используется индекс а (Nygaard, 1956). Прогностические уравнения для оценки pH могут быть получены путем множественного регрессионного
анализа измеренных в воде pH и вычисленных
по процентному соотношению различных групп индикаторных таксонов (Charles, 1985; Davis, Anderson, 1985). В основе адаптации отдельных видов водорослей
к солености (содержанию NaCl) и рН (карбонат-бикарбонат-карбон
диоксидному равновесию) лежит механизм внутриклеточной осморегуляции, который
пока еще слабо изучен.
В шкале индикаторных организмов органического
загрязнения (сапробности), впервые
разработанной Р. Кольквитцем и М. Марссоном (Kolkwitz, Marsson, 1909),
водорослям отводится отдельное место. Она неоднократно подвергалась ревизии и
совершенствовалась. В основе современных наиболее распространенных методов
оценки сапробности вод по индикаторным видам водорослей лежит система,
предложенная В. Сладечеком (Sladecek, 1973 и
др.). В дополнение к ней используют списки индикаторов, предложенных Р. Веглом
(Wegl, 1983). Для оценки органического загрязнения рек
разработан диатомовый индекс DAIpo,
основанный на относительном обилии сапрофилов и эврисапробов (Watanabe et al.,
1986). Разработаны классификации водорослей по типам метаболизма потребления органического азота, в котором заложены
принципы автотрофии и гетеротрофии (Cholnoky, 1968; Van Dam, 1975), по степени требовательности к кислородному насыщению (Cholnoky,
1968; Hustedt, 1938-1939, 1957; Van Dam, 1975), а
также качественные шкалы, в которых отражено преимущественное обитание
отдельных видов в водах того или иного трофического
типа (Naumann, 1921; Van Dam, 1994
и др.).
Эколого-ценотические системы. В экологии и эволюционной биологии для
описания способов выживания популяций и их роли в сообществе в условиях
совместного использования необходимых ресурсов получили широкое распространение
два типа репродуктивных стратегий, связанные с энергетическими затратами на
поддержание продолжительности жизни и на процессы размножения: r– и k–стратегии. R–стратегия осуществляется
мелкоразмерными популяциями, адаптированными к нестабильным условиям и к слабой
конкуренции, характеризующимися высокой скоростью размножения. K–стратегия – противоположная
r–стратегии, как способ выживания в стабильных условиях. Представители этой
стратегии достигают больших размеров, характеризуются низкой скоростью
размножения, приспособлены к острой конкуренции. Первоначально разработанная
система стратегий Макартуром и Вильсоном (MacArthur, Wilson, 1967) нашла свое применение и в
планктонологии (Margalef, 1978; Kilham, Kilham, 1980; Sommer, 1981). Согласно схеме Маргалефа (1978) с увеличением
питательных веществ и гидрофизических флюктуаций увеличивается r–стратегия. Последовательная смена r– и k–стратегий прослежена при описании
стадий сукцессии озерного фитопланктона (Sommer, 1981). Уменьшение среднеценотических
объемов клеток планктонных водорослей в крупных равнинных водохранилищах при
увеличении трофии их вод свидетельствует об увеличении r–стратегии, а в
олиготрофных ацидных озерах, где доминируют крупноклеточные виды и межвидовая
конкуренция за незначительные (малодоступные) питательные ресурсы обостряется,
преобладает k–стратегия (Корнева, 2001). Позднее К. Рейнольдс (Reynolds, 1984) ввел новую категорию (w) в стратегии адаптаций фитопланктона,
свойственную видам, приспособленным к вертикальному перемешиванию толщи воды в
период осенней циркуляции. Исходя из того, что к тем или иным условиям среды
функционально хорошо адаптирована группа видов, сходных по толерантности к
определенному (ым) фактору (ам), чем и объясняется их общее местообитание, К.
Рейнольдс (Reynolds, 2002) предложил функциональную классификацию, состоящую из
31 группы фитопланктона. В ее основе лежит идея создания системы экологических
категорий фитопланктона, предложенная Хатчинсоном (Hutchinson, 1967), или создания ценосистемы планктонных
водорослей по аналогии с синтаксонами, выделяемыми для классификации
растительности в фитоценологии. По способам выживания видов в различных
условиях среды, как совокупности абиотических и биотических факторов, и их конкурентных
отношений Л.Г. Раменским (1938) для наземных сообществ высших растений
предложены три основных ценотипа: виоленты, патиенты и экспреленты. При оценке
проявления их в сезонной динамике фитопланктона Белого моря (Ильяш и др., 1999)
показано, что разные популяции планктонных водорослей могут принимать черты
всех трех типов. Например, пиководоросли и миксотрофы характеризуются
адаптивной стратегией экспрелентов и постоянно присутствуют в фитопланктоне.
Работа выполнена при частичной
поддержке гранта РФФИ № 07-04-00370.
ЦЕНОТИЧЕСКАЯ РОЛЬ
ПОЧВЕННЫХ ВОДОРОСЛЕЙ В АГРОЭКОСИСТЕМАХ
Кузяхметов Г. Г.
Coenotic role of soil
algae in agroecosystems
Kuzyakhmetov G.G.
Башкирский
государственный университет,
г. Уфа, ул. Заки
Валиди,32. Тел. (3472)- 73-66-56; факс (3472)33-16-77
е-mail: kuzyakhmetovgg39@mail.ru
Агроэкосистемы представлены флористически
ненасыщенными сообществами, в них жизненные ресурсы используются далеко не
полностью. Они характеризуются наличием свободных экологических ниш и согласно стратегии биоценозов обладают потенциальной
способностью принять в свой состав новые виды. Свободные ниши частично
захватываются почвенными водорослями. Занимая недоступные для растений места и
в промежутках между ними, водоросли осуществляют в полном смысле слова
«растекание живого вещества» (по. Вернадскому, 1926) по поверхности Земли,
увеличивают тем самым количество аккумулированной зеленым веществом солнечной
энергии.
Почвенные водоросли как автотрофные организмы являются
структурной частью агрофитоценоза, его синузией, отграниченной в пространстве и
во времени. Альгосинузии занимают определенные экологические ниши, отличаются в
морфологическом, экологическом и
ценотическом отношениях. Почвенные водоросли могут рассматриваться как самостоятельные
сообщества - альгоценозы.
Как показали наши исследования, их состав, численность
и биомасса зависят от типа почвы, от режима увлажнения и т. д. Наиболее
флористически насыщенные альгоценозы выявлены нами в серых лесных почвах с
относительно благоприятным для водорослей режимом увлажнения. Число видов
достигает 40-60 на 1 м2.
На яровых и озимых полях в летне-осенние месяцы наблюдалось «цветение» почвы,
при этом численность достигала до 2,7 млн. клеток на м2, биомасса -
712-955 кг/га. Макроскопические разрастания образуют азотфиксирующие формы –
представители родов Cylindrospermum и Nostoc, которые в
условиях Башкортостана способны накапливать до 10-70 кг/га азота за
вегетационный период, что сравнимо с практикуемым в республике дозами внесения
в почву минерального азота.
Диаспоры водорослей постоянно присутствуют в почве и в
воздухе. Локальные альгоценозы относительно постоянны и защищены от
«пришельцев». Механизмами защиты могут быть почвенные условия, высшие растения
не влияют на прорастание диаспор водорослей, влияет комплекс эдафических
факторов, среди которых важное, если не главное, место занимают микробиоценотический
отбор (влияние бактерий, простейших, грибов). Отбор видов происходит и под
влиянием человеческого фактора (агротехника, удобрения, пестициды и др.).
Многие виды водорослей, способные существовать в том или ином экотопе при
отсутствии взаимоотношений с другими видами, не могут входить в состав
альгосинузий сформировавшихся агрофитоценозов вследствие совпадения ниш,
захвата ниши более конкурентоспособными видами.
Не все почвенные водоросли являются эксплерентами, как
считают многие, а патиентами. Они в силу своей выносливости к крайне суровым
условиям и часто менее благоприятным для их существования условиям развиваются
почти во всех агроэкосистемах, занимая подчиненное положение.
Альгосинузии приурочены к поверхностным слоям почвы,
но в агроэкосистемах наблюдается более или менее равномерное распределение
водорослей в профиле пахотного горизонта. Биомасса до 9-11 ц/га, продукция, скорость возобновления
биомассы в течение 1-4 суток указывают на исключительный динамизм альгосинузий
агрофитоценозов.
Альгосинузии тесно связаны с другими компонентами
фитоценозов, а именно с высшими растениями. Доказательством прямых связей
является альгоризосферный эффект – накопление водорослей в прикорневой зоне
почвы, влияние продуктов метаболизма водорослей на прорастание семян. Косвенное
действие водорослей на высшие растения проявляется через эдафоэкотоп (изменение
физико-химических свойств почвы, выделяемых в окружающую среду хелатов, закрепление
трофических элементов в верхних слоях почвы, обогащение среды азотом за счет
деятельности водорослей-фиксаторов атмосферного азаота). Высшие растения
оказывают действие на водоросли через создаваемую ими фитосреду, через
растительный опад и т. д. На характер взаимоотношений между компонентами
агрофитоценозов влияют агрогенные факторы.
Почвенные водоросли тесно связаны с микробными
ценозами, являются детерминантами эдафических консорций. Ценотические
взаимоотношения в этих системах носят самый разнообразный характер – от
нейтрального до антагонизма и анабиоза. Альсинузии должны рассматриваться как
суммарное разнообразие микроальгоценозов, приуроченных к почвенным микрозонам.
Микроальгоценозы являются одним из типов микробоценозов, где в качестве
эдификатора выступают водоросли. Взаимоотношения водорослей внутри синузий,
межсинузиальные отношения в литературе освещены слабо. Культуральными методами
было установлено наличие разнообразных типов взаимодействий между водорослями.
ФИТОПЛАНКТОН РЕКИ МИАСС В ЧЕРТЕ Г. ЧЕЛЯБИНСКА
Лихачёв С.Ф.,
Артёменко Б.А.
Phytoplankton of the Miass
River within the
outskirts
of Chelyabinsk
Lilhachov S.F., Artyomenko B.A.
Челябинский государственный педагогический университет,
454080, г. Челябинск, пр. Ленина, 69, тел. (351)
772-05-44, факс (351) 264-77-53
e-mail: boris_chpu@mail.ru
Водоросли – первое звено трофической цепи, основной
продуцент органического вещества в водоёмах и наиболее перспективный объект для
оценки состояния водных экосистем. Инвентаризация альгофлоры актуальна потому,
что экосистемы водоёмов чрезвычайно быстро реагируют на изменения климатических
и других физико-географических условий, а также на последствия хозяйственной
деятельности человека. Качественные и количественные исследования водорослевых
сообществ – основной этап открывающий возможность для всех последующих работ
[8].
Альгофлора реки Миасс в черте г. Челябинска изучена до
настоящего времени недостаточно. Чаще всего работы по инвентаризации флоры
водорослей реки Миасс велись разово (в течение 1-2 сезонов, летом), разными
исследователями с различными прикладными целями, в основном, работы, проводимые
на этом участке реки, были посвящены изучению её физико-химического (Сухарев, Ходарковская
и др., 2002) и гидрохимического состава (Захаров, Пономарёва, 2007), т.е. с
целью исследования качества вод и использования водоёма для питьевого
водоснабжения города. Что касается непосредственного изучения планктона реки в
г. Челябинске, то такие сведения приводятся только по отделу Euglenophyta (Серебренникова, Лихачёв, 2008).
Река Миасс правый приток реки Исеть (бассейн Тобола);
основная и наиболее протяженная водная артерия Челябинской области. В пределах
Челябинской области протяженность реки 384 км, площадь водосбора 6830 км2.
Миасс является источником питьевого и технического водоснабжения. Воды Миасса
относятся к гидрокарбонатному классу. Исключение составляет участок реки ниже
г. Челябинска, где происходит смена класса воды на сульфатный. Естественный
сток регулируется спуском вод из Аргазинского и Шершнёвского водохранилищ [1].
Длина реки в пределах г. Челябинска составляет 36 км. На этом участке она
имеет извилистое русло с многочисленными островами; глубина меняется от 1–3 м
на плёсах до 0,5–1 м на перекатах; средняя ширина русла 30–50 м, местами до 150 м. Берега Миасса
невысокие, лишь в отдельных местах имеют высоту до 5 м. В центре города берега
укреплены бетонными стенками, речное русло здесь искусственно расширено. Для
водоснабжения промышленных предприятий в черте города были построены плотины,
организовано 3 пруда. Воды Миасса на территории г. Челябинска сильно загрязнены.
В них отмечается повышенное содержание азота аммонийного (до 30 ПДК), фосфатов
(до 8 ПДК), железа (до 11 ПДК), нефтепродуктов (до 7 ПДК), наблюдается дефицит
растворенного кислорода, содержится сероводород. Участок реки ниже Челябинска
соответствует статусу зоны экологического бедствия. Свыше 20 предприятий и
организаций города сбрасывают в Миасс промышленные и хозяйственно-бытовые
сточные воды. Качество воды соответствует 4-му классу, вода характеризуется как
«очень грязная». На этом участке река утратила свое культурно-бытовое и
рыбохозяйственное значение [5].
Таким образом, на всём своём протяжении река Миасс
испытывает значительное антропогенное давление и большая часть её стока
используется в хозяйственных целях, поэтому оценка качества её воды имеет
большое значение. Кроме того, необходимы систематические наблюдения за состоянием
альгофлоры реки с целью выяснения мест наибольшего загрязнения и
прогнозирования состояния реки в будущем.
В основу работы положены пробы фитопланктона,
собранные нами в заводях реки Миасс в пределах г. Челябинска в 2007–2008 гг.
Сбор, обработка, фиксация и очистка материала проводились по стандартным
методикам (Киселёв, 1956; Вассер и др., 1989). Отбор проб осуществляли батометрами,
сетью Апштейна (газ № 73) и планктонным сачком.
В обследованном водоёме обнаружено 28 видов
водорослей, относящихся к 22 родам, 14 семействам, 11 порядкам, 4 отделам
(табл. 1).
Таблица 1
Видовой состав водорослей реки Миасс в черте г.
Челябинска
|
Вид
|
№ станции
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Отдел CYANOphYta
|
|
Dactylococcopsis irregularis Lemm.
|
–
|
+
|
–
|
+
|
–
|
+
|
|
Отдел EUGLENOPHYTA
|
|
Anisonema
ovale Duj.
|
–
|
–
|
–
|
–
|
+
|
–
|
|
A.
acinus Duj.
|
+
|
–
|
–
|
+
|
+
|
–
|
|
Astasia
dangeardii Lemm.
|
–
|
–
|
–
|
+
|
+
|
–
|
|
Dinema
griseolum Perty
|
–
|
–
|
–
|
–
|
+
|
–
|
|
Euglena
mutabilis Schmitz
|
–
|
–
|
–
|
+
|
–
|
–
|
|
E.
velata Klebs
|
–
|
–
|
–
|
+
|
–
|
–
|
|
Heteronema
acus (Ehr.) Stein
|
–
|
–
|
–
|
+
|
+
|
–
|
|
Notosolenus
apocamptus Stokes
|
–
|
–
|
–
|
–
|
+
|
–
|
|
Peranema
trichophorum (Ehr.) Stein
|
–
|
–
|
–
|
+
|
+
|
–
|
|
Petalomonas
mediocanellata Stein
|
–
|
–
|
–
|
+
|
–
|
–
|
|
Trachelomonas
hispida (Perty) Stein
|
–
|
–
|
–
|
+
|
–
|
–
|
|
T.
cylindrica Ehr.
|
–
|
–
|
–
|
–
|
+
|
–
|
|
Отдел BACILLARIOPHYTA
|
|
Cyclotella
radiosa (Grun.) Lemm. (= Cyclotella comta (Ehr.) Kütz.)
|
+
|
–
|
–
|
–
|
–
|
–
|
|
Cymatopleura
solea (Bréb.) W. Sm. var. solea
|
–
|
–
|
–
|
–
|
+
|
–
|
|
Cymbella
ventricosa Kütz.
|
+
|
–
|
–
|
–
|
–
|
–
|
|
Fragilaria
crotonensis
Kitt.
|
+
|
+
|
–
|
–
|
+
|
–
|
|
F.
vaucheria (Kütz.) Boye-Pet. var. vaucheria (= Synedra vaucheria
Kütz.; Fragilaria intermedia
Grun. in V.H.; Fragilaria capucina
var. vaucheria (Kütz.)
Lange-Bertalot)
|
+
|
–
|
–
|
–
|
–
|
–
|
|
Gomphonema
acuminatum Ehr.
|
–
|
–
|
–
|
–
|
–
|
+
|
|
Hanzschia
sp.
|
–
|
+
|
–
|
+
|
–
|
–
|
|
Melosira varians Ag.
|
–
|
–
|
–
|
–
|
+
|
+
|
|
Navicula cryptocephala Kütz.
|
+
|
+
|
+
|
+
|
+
|
+
|
|
N. diluviana Krasske
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Nitzschia
sp.
|
+
|
–
|
–
|
–
|
–
|
–
|
|
Surirella
ovata Ehr.
|
–
|
+
|
–
|
–
|
–
|
+
|
|
Surirella
sp.
|
–
|
+
|
–
|
–
|
+
|
+
|
|
Rhoicosphenia
curvata (Kütz.) Grun. (= Rh. fracta (Schum.) Rabenh.)
|
–
|
+
|
–
|
–
|
–
|
–
|
|
Отдел Chlorophita
|
|
Staurastrum
paradoxum Meyen
|
–
|
–
|
–
|
–
|
–
|
+
|
Анализируя
полученные данные, можно сделать следующее заключение: основу фитопланктона
реки составляют факультативные планктеры. Большая часть видов – космополиты.
Незначительное таксономическое разнообразие, обедненный видовой состав и
избирательная встречаемость некоторых видов в выбранных станциях в черте Челябинска,
свидетельствует о воздействии на фитопланктон промышленных сбросов.
Список литературы
1. Андреева, М.А. Реки Челябинской области: Учебное
пособие по спецкурсу [Текст] / М.А. Андреева, В.Б. Калишев. – Челябинск, ЧГПИ,
1991. – 104 с.
2. Вассер, С.П. Водоросли. Справочник. [Текст] / С.П.
Вассер, Н.В. Кондратьева, Н.П. Масюк и др. – Киев: Наукова Думка, 1989. – 608
с.
3. Захаров, С.Г. Миасс в Челябинске [Текст] / С.Г.
Захаров, К. Пономарёва. Природное и культурное наследие Урала: мат. V регион. науч.-практ. конф. 21 мая 2007 года. Челябинск:
Изд-во ЧГАКИ, 2007. – С. 33–35.
4. Киселёв, И.А. Методика исследования планктона / И.А
Киселёв // В кн.: Жизнь пресных вод. – М.; Л.: изд-во АН СССР, 1956а. Т. 4. Ч.
1. – С. 183–256.
5. Природа Челябинской области. [Текст] – Челябинск:
Изд-во ЧГПУ, 2000. – 269 с.
6. Серебренникова, Ю.А. Эвгленофауна реки Миасс [Текст] /
Ю.А. Серебренникова, С.Ф. Лихачёв // Экосистемы малых рек: биоразнообразие,
экология, охрана. Лекции и мат. докл. Всерос. шк.-конф. Институт биологии внутренних
вод им. И.Д. Папанина. 18–21 ноября 2008 г. Изд-во ООО «Принтхаус», 2008. – С.
272–273.
7. Сухарев, Ю.И. Исследование трофического состояния
водохранилищ [Текст] / Ю.И. Сухарев, Н.И. Ходоровская, С.Г. Ницкая, О.М.
Викулова, Ю.В. Дубницкая // Химия и химическая технология: Известия Челяб.
науч. центра. Вып. 4 (17). – 2002. – С. 99–103.
8. Тумбинская, Л.В. Альгофлора реки Москвы в черте города
[Текст]: автореф. дис. … канд. биол. наук / Л.В. Тумбинская. – М.: МГУ, 2006. –
23 с.
ДИНАМИКА
ФИТОПЛАНКТОНА ОЗЕРА МАНЫЧ-ГУДИЛО
В
РАЗНЫЕ СЕЗОНЫ ГОДА
Лужняк О.Л., Горлачева Г.Ю.
Южный
научный центр РАН
344006
пр. Чехова, 41, г. Ростов-на-Дону,
Россия
e-mail: olga_lujniak@mmbi.krinc.ru
Dynamics of
the Manych-Gudilo lake
phytoplankton
in different
seasons
Lugniak O.L.,
Gorlacheva G.Y.
Southern scientific centre RAS
3440006 Chekhova, 41, Rostov-on-Don, Russia
e-mail: olga_lujniak@mmbi.krinc.ru
Целью данного исследования является изучение структуры и функционирования фитопланктонного сообщества оз. Маныч-Гудило в разные сезоны года.
В годовом цикле вегетации
микроводорослей наименее изученным остается зимний период. Поэтому рассмотрение
сезонной динамики фитопланктона оз. Маныч-Гудило следует начать именно с
этого периода. К сожалению, литературные данные об этой фазе существования
альгоценоза изучаемого водоёма отсутствуют. Нами впервые были проведены
исследования зимнего планктонного фитоценоза, развивающегося при низких
температурах.
В зимний период 2008 г. в результате обработки подледных проб
фитопланктона (температура воздуха в среднем составляла –10 0С,
температура воды была равной 0 0С) удалось выяснить, что видовое
разнообразие фитопланктона оз. Маныч-Гудило было низким. Всего в
альгоценозе было обнаружено 12 видов микроводорослей, относящихся к 4 отделам: Chlorophyta, Cryptophyta, Bacillariophyta и Chrysophyta.
Наиболее часто встречаемым в пробах был вид Cryptomonas erosa Ehr. (Cryptophyta). Реже встречали виды, относящиеся к роду Clamydomonas Ehr. из отдела Chlorophyta. В среднем биомасса фитопланктона оз. Маныч-Гудило
зимой 2008 г
составляла 0,02 мг/л, а средняя численность – 78737 тыс.кл./л.
Зима предыдущего года, которая характеризуется как
«теплая» (температура воды была 1- 30С, ледовый покров не
образовывался) (Матишов, 2008), по видовому разнообразию фитопланктона не
отличалась (10 видов). Фитокомплекс оз. Маныч-Гудило в 2007 г. был
представлен в основном мелкими жгутиковыми из отделов Chrysophyta и Chlorophyta.
Наряду с ними единично встречались водоросли отдела Bacillariophyta (Navicula sp., Cyclotella sp.). Однако
средние значения биомассы были значительно выше – 2,56 мг/л, а значения
численности минимальны – 878 тыс.кл./л.
Биологическая весна на водоёме начинается обычно в
марте, в период освобождения водоёма ото льда. В мартовском фитопланктоне 2008 г. продолжал
вегетировать вид Cryptomonas erosa Ehr. (Cryptophyta). В составе фитокоплекса появились представители
отдела Cyanophyta. Всего в фитопланктоне оз. Маныч-Гудило в марте 2008 г. было
обнаружено 19 видов микроводорослей, относящихся к 4 отделам. Наибольшее
видовое разнообразие принадлежало отделу Bacillariophyta – 8 видов. Частая встречаемость в пробах была
отмечена для видов Chlorella vulgaris Beijerinck., Oocystis submarina Lagerh, Dictyospharium simplex Korschik. (Chlorophyta). Средняя биомасса фитопланктона оз. Маныч-Гудило
составляла 1,49 мг/л, а средняя численность – 44037 тыс.кл./л. Состав доминирующих
комплексов в марте 2008 г.
был таким же, как в марте 2007 г.,
но изменились количественные показатели. Так средняя биомасса фитопланктона оз. Маныч-Гудило
в марте 2007 г.
была 9,37 мг/л, а средняя численность 96642 тыс.кл./л. Вероятно, такая разница
в значениях биомасс связана с ранним наступлением биологической весны на
водоеме вследствие теплой зимы 2007 г.
В мае 2008 г. температура воздуха в среднем
составляла 210С, а температура воды 170С. Состав доминирующих
по встречаемости видов не изменился. Также как и в марте 2008 г. продолжали
развиваться в массе виды рода Oocystis
A.Braun.
Альгоценоз в мае был представлен микроводорослями, относящимися к 5 отделам: Chlorophyta, Cyanophyta, Bacillariophyta, Dinophyta, Euglenophyta. Доминантами в видовом разнообразии были отделы Chlorophyta, Dinophyta по 5
видов. Видовое разнообразие отдела Bacillariophyta в мае было снижено (4 вида), по сравнению с мартом. Средняя биомасса
фитопланктона в мае 2008 г.
составляла 3,б мг/л, а средняя численность 18904 тыс. кл./л. Состав фитоценоза
в мае 2008 г.
в целом не изменился по сравнению с фитокомплексом мая 2007 г. Средняя
биомасса фитопланктона в мае 2007 г. была несколько выше, чем в 2008 г. и составила
5,15 мг/л, а средняя численность – 96643 тыс.кл/л.
В июне температура воздуха в районе исследований
повысилась до 380С, а температура воды оз. Маныч-Гудило до 250С.
Данные гидрологические условия не привели к существенным перестройкам в
структуре альгоценоза. Также как и в марте-мае 2008 г.
доминирующими видами в июне были Chlorella vulgaris Beijerinck., Oocystis submarina Lagerh. Наряду с ними довольно часто в пробах встречали вид Prorocentrum scutellum Srod (Dinophyta) – представитель
летне-осеннего комплекса фитопланктона оз. Маныч-Гудило. Средняя биомасса
июня 2008 г.
была 2,18 мг/л, а средняя биомасса июня 2007 г. – 19,9 мг/л. Такое высокое значение
биомассы в 2007 г
было получено из-за присутствия в пробах крупноклеточного вида Prorocentrum scutellum (Dinophyta).
Средняя численность фитопланктона в июне 2007 г., в сравнении с весной 2007 г.,
уменьшилась и составила 21066 тыс.кл./л.; в июне 2008 г. также наблюдали
уменьшение значений – 4194 тыс.кл./л.
На данном этапе исследований общую тенденцию развития
микроводорослей оз. Маныч-Гудило трудно проследить. Дальнейшие
исследования для выявления внутригодовой сезонной динамики фитопланктона
требуют более тщательного рассмотрения и дополнения сведений.
ПРОДУКЦИОННО-ДЕСТРУКЦИОННЫЕ
ХАРАКТЕРИСТИКИ ПЕРИФИТОНА НА РАКОВИНАХ Dreissena
polymorpha PallAs В
МЕЗОТРОФНОМ ОЗЕРЕ
Макаревич1
Т.А., Мастицкий2 С.Э., Савич1 И.В.
Production-destruction parameters of periphyton on
Dreissena
polymorpha Pallas shells in a mesotrophic lake
Tamara
A. Makarevich1, Sergey E. Mastitsky2
and Iryna V. Savich1
1Белорусский
государственный университет, г. Минск, проспект Независимости, 4,
Fax: 375 (17) 209-58-14
е-mail: makarta@tut.by
2Great Lakes
Center, Buffalo
State College, Buffalo NY, USA
Двустворчатый моллюск D. polymorpha – один из наиболее
«агрессивных» инвазивных видов. Вселение дрейссены зачастую вызывает серьезные
преобразования в структуре и функционировании водных экосистем [1]. Итогом этих
преобразований является смещение значительной части потоков вещества и энергии
из толщи воды ко дну водоема, т.е. «бентификация» экосистемы. Механизмы
бентификации изучены достаточно хорошо. Однако вне внимания исследователей остается
тот факт, что за счет раковин моллюска создаются значительные дополнительные
твердые поверхности, пригодные для развития перифитона, который также участвует
в перераспределении энергетических потоков между планктонными и донными
сообществами. В 2006-2008 гг. на примере оз. Нарочь (Беларусь) нами выполнены
исследования, направленные на оценку роли перифитона раковин D. polymorpha в формировании биологического разнообразия и трансформации вещества и
энергии в озерных экосистемах. В настоящем сообщении представлены результаты
изучения продукционно-деструкционных характеристик перифитона.
Оз. Нарочь – мезотрофный полимиктический водоем.
Площадь водного зеркала 79,6 км2, средняя глубина 8,9 м, максимальная 24,8 м; по всему периметру
большие площади заняты мелководьями [2]. Озеро характеризуется высокой прозрачностью
воды – среднесезонная величина прозрачности в 2005 г. составила 6,7±0,6 м [3]. Дрейссена вселилась
в оз. Нарочь в середине 80-х годов прошлого века. В настоящее время популяция
моллюска находится в стабилизировавшемся состоянии при средневзвешенной
плотности около 1500 особей/ м2 (данные 2005 г.) [4]. Дрейссена
встречается в озере до глубины 8
м, максимальная плотность зарегистрирована в зоне глубин
2 – 4 м.
Исследование продукционно-деструкционных характеристик
перифитона дрейссены выполнены в июне-августе 2007 г. Использован метод
склянок в кислородной модификации. Оптимальный объем склянок (500 мл),
плотность посадки моллюсков (по 2 особи в каждую склянку) и экспозицию склянок
с моллюсками в озере (8-10 часов) определили экспериментальным путем. Схема
постановки экспериментов была следующей. Собирали дрейссену с глубин 0,8 м и 4,0 м. Для экспериментов из
пробы отбирали моллюсков доминирующего размера (с мелководья: 16-17 мм, с глубины 4,0 м: 13-15 мм), обрастание
раковин которых, согласно визуальной оценке, было близким. Склянки заполняли
озерной водой, отобранной в месте сбора моллюсков. В 10 склянок (пять «светлых»
и пять «темных») помещали по два моллюска с ненарушенным обрастанием раковин, а
в 10 аналогичных склянок – по 2 моллюска с предварительно удаленным
обрастанием. Экспонировали склянки в озере на глубине, на которой были собраны
моллюски. После экспозиции из каждой склянки с моллюсками сифоном отбирали воду
и заполняли ею по 2 стандартные кислородные склянки для определения содержания
кислорода по методу Винклера. Предварительно воду в склянках с моллюсками
перемешивали для того, чтобы разрушить образовавшийся градиент концентрации
кислорода. Доставали из склянок дрейссену с ненарушенным обрастанием и смывали
его в оставшуюся в склянке воду. Полученную суспензию отфильтровывали на
ядерные фильтры с диаметром пор 2,3 мкм для определения сухой массы перифитона
и содержания в ней хлорофилла. Погрешности оценки концентрации кислорода,
обусловленные, в основном, вариабельностью размеров моллюсков в склянках и количества перифитона на их раковинах, не
превышали 10%.
Результаты экспериментов (таблица) свидетельствуют,
что для перифитона дрейссены характерны высокие скорости продуцирования
органического вещества. В течение всего периода наблюдения продукция преобладала
над деструкцией; отношение валовой первичной продукции к деструкции изменялось
в пределах от 1,8 до 18.
Установлено, что удельные величины валовой первичной
продукции и деструкции выше в сообществах обрастания раковин дрейссены,
обитающей на глубине 4,0 м,
а ассимиляционные числа, напротив, выше в обрастаниях дрейссены на мелководье.
Различия удельных величин валовой первичной продукции и
деструкции перифитона на глубинах 0,8 и 4,0 м, вероятно, являются следствием разницы в
«возрасте» перифитона. Понятие «возраста» и связь структурно-функциональных
характеристик перифитона с его «возрастом» обсуждались нами в ряде работ [5-8].
Экспериментально было доказано, что продукционные возможности перифитона
снижаются по мере его старения [5]. Результаты исследования структурной организации
сообществ показали, что перифитон на раковинах дрейссены с глубины 4 м «моложе», чем на раковинах
моллюсков с мелководья. На это указывает, в частности, более низкое содержание
минеральной фракции в сухом веществе перифитона с глубины 4 м. Так, по данным для
вегетационного сезона 2006 г.,
величины зольности перифитона на глубине 4 м укладывались в пределы 49,1-62,3%, а на
глубине 0,8 м
– 60,1-70,3%. В перифитоне с глубины 4,0 м существенно более высокой, чем на мелководье,
была доля автотрофной компоненты в общей массе (11,9-13,1 % против 3,0-4,1 %),
что также свидетельствует о более «молодом возрасте» перифитона. Таким образом,
несмотря на снижение освещенности, удельная активность перифитона на глубине 4 м выше, чем на мелководье.
Снижение с увеличением глубины ассимиляционных чисел
мы объясняем существенным возрастанием относительного содержания хлорофилла в
сухом веществе перифитона. Содержание хлорофилла в перифитоне на глубине 4 м более чем в 3 раза превышает
соответствующие величины, характерные для мелководья (1,78-1,97 мкг/мг сух.
массы против 0,45-0,61 мкг/мг сух. массы).
Следует также иметь в виду, что поселения дрейссены на
разных глубинах как субстрат для перифитона заметно различаются. Так, на
мелководье дрейссена обитает на дне и образует друзы, а на глубинах свыше 2 м одиночные особи моллюска
прикреплены к макрофитам. Перифитон раковин дрейссены на мелководье
представляет собой, по сути дела, переходное сообщество между эпибентосом и
перифитоном.
Таблица
Величины продукции и деструкции сообществ перифитона
на раковинах дрейссены
|
Дата
|
h, м
|
ВВП
|
ЧПП
|
Д
|
ВПП
|
ЧПП
|
Д
|
АЧ,
мг О2 / мг хл-а
|
|
мг О2 /г сух. массы перифитона за 1 час
|
мг О2 /м2 поверхности раковин
за 1 час
|
|
28.6.07
|
0,8
|
1,47
|
0,67
|
0,80
|
43,11
|
19,77
|
23,34
|
3,3
|
|
28.6.07
|
0,8
|
0,91
|
0,79
|
0,12
|
42,15
|
36,46
|
5,70
|
1,5
|
|
28.6.07
|
0,8
|
0,68
|
0,43
|
0,25
|
27,32
|
17,36
|
9,96
|
-
|
|
17.7.07
|
0,8
|
1,34
|
1,23
|
0,11
|
34,86
|
32,03
|
2,83
|
-
|
|
19.7.07
|
4,0
|
3,59
|
2,75
|
0,83
|
53,14
|
40,80
|
12,34
|
-
|
|
23.7.07
|
0,8
|
1,30
|
1,23
|
0,07
|
51,61
|
48,84
|
2,78
|
2,5
|
|
25.7.07
|
4,0
|
1,67
|
0,76
|
0,91
|
13,11
|
5,99
|
7,12
|
0,8
|
|
10.8.07
|
4,0
|
1,73
|
0,91
|
0,82
|
38,19
|
20,13
|
18,06
|
1,0
|
|
13.8.07
|
0,8
|
1,19
|
-
|
-
|
74,19
|
-
|
-
|
2,3
|
|
Примечание: ВПП – валовая первичная продукция; ЧПП – чистая
первичная продукция; Д – деструкция; АЧ – ассимиляционное число.
Сухая
масса перифитона – суммарная масса всего комплекса, включающего автотрофные
(водоросли, цианобактерии) и гетеротрофные (бактерии, грибы, беспозвоночные)
организмы, а также органическое вещество разного происхождения и разной
степени переработки (детрит).
|
На основании полученных данных по скорости
новообразования органического вещества перифитоном на раковинах дрейссены и
рассчитанной величины суммарной твердой поверхности, создаваемой популяцией
моллюска в озере [9], мы попытались дать приближенную оценку вклада перифитона
дрейссены в общую первичную продукцию в оз. Нарочь.
Средняя для периода
наблюдения величина валовой первичной продукции перифитона в расчете на 1 м2 поверхности
раковин моллюска за сутки составила 0,3 г, а чистой первичной продукции – 0,2 г органического вещества.
При пересчете величины первичной продукции, полученной в кислородных единицах,
на органическое вещество приняли, что 1 г выделяемого при фотосинтезе кислорода
эквивалентен 0,65 г
синтезируемого органического вещества [10]. Суммарная поверхность раковин
дрейссены оценена в 8,36 км2, исходя из чего валовая первичная
продукция перифитона на раковинах дрейссены в оз. Нарочь составляет 2,5 т
органического вещества за сутки, а чистой первичной продукции – 1,7 т. Общая
валовая первичная продукция, создаваемая планктоном, макрофитами, перифитоном
на макрофитах и микрофитобентосом, в настоящее время оценивается в 124,8 т
органического вещества за сутки [11]. Валовая первичная продукция перифитона
дрейссены составляет примерно 2 % от этой величины. Таким образом, результаты
наших исследований дают основание утверждать, что перифитон раковин D. polymorpha вносит заметный
вклад в «бентификацию» экосистемы заселяемого моллюском водоема.
Список литературы
1. Karatayev A.Y, Burlakova L.E., Padilla D.K. Impacts of zebra mussels on aquatic communities and their role as ecosystem engineers // Leppäkoski, E., S. Gollasch, S. Olenin (eds). Invasive
aquatic species of Europe: Distribution,
impacts and management. – Kluwer Academic Publishers, Dordrecht,
The Netherlands,
2002. – Р. 433-446.
2. Экологическая система Нарочанских озер / Под ред.
Г. Г. Винберга. – Мн.: Университетское, 1985. – 303 с.
3. Бюллетень экологического состояния озер Нарочь,
Мястро, Баторино (2005 год) / Т. В. Жукова,
Р. З. Ковалевская, Т. М. Михеева и др.; Под общ. ред. А.П. Остапени. – Мн.: ООО
«Белсэнс», 2007. – 62 с.
4. Мастицкий С.Э., Верес Ю.К., Наярович О.А.,
Кондобаров С.Ю. Роль дрейссены (Dreissena polymorpha) в структуре
малакологического комплекса озера Нарочь // Материалы 6-ой международ. науч.
конф. «Сахаровские чтения 2006 года: экологические проблемы XXI века», 18-19
мая 2006 г.,
Минск, Республика Беларусь – Мн.: МГЭУ им. А. Д. Сахарова. – Ч. 1. – 2006. – С.
322-324.
5. Макаревич Т. А., Остапеня А. П., Михеева Т. М.
Экспресс-метод оценки скорости роста и продукционных характеристик перифитона
// Гидробиол. журн. – 1987. – Т. 23(4). – С. 76-80.
6. Макаревич Т. А. Первичная продукция перифитона:
проблемы, задачи// Материалы Международной научн. конф. по озерным экосистемам
«Озерные экосистемы: биологические процессы, антропогенная трансформация, качество
воды». Мн.: БГУ, 2000.― С. 219-225.
7. Макаревич Т. А., Деренговская Р. А., Никитина Л.
В., Лукьянова Е. В. Компонентный состав эпифитона в водоемах и водотоках
Беларуси // Мат. междунар. науч.-практ. конф. «Стратегия развития аквакультуры
в условиях XXI века», 23-27 августа 2004 г., Минск. – Мн.: ОДО «Тонпик», 2004. – С.
216-220.
8. Макаревич Т.А., Мастицкий С.Э.
Обилие перифитона на раковинах моллюска Dreissena polymorpha Pallas в оз. Нарочь // Вопросы
рыбного хозяйства: Сб. науч. трудов, 2008. – Вып. 24. – С. 303-305.
9. Mastitsky S. E., Makarevich T. A. The zebra mussel shells as a substrate for periphyton // Abstracts of the 15th International Conference on Aquatic Invasive Species, 23-27 September 2007, Nijmegen. – 2007. – Thieme Print4U, The Netherlands. – P. 121.
10. Алимов А.Ф. Введение в продукционную
гидробиологию. – Л: Гидрометеоиздат, 1989. –
151 с.
11. Жукова А. А., Остапеня А. П., Жукова Т. В. Оценка
значимости различных автотрофных компонентов в формировании продуктивности
мезотрофного озера // Озерные экосистемы: биологические процессы, антропогенная
трансформация, качество воды: Мат. III Междунар. науч. конф., 17-22 сент. 2007 г., Минск-Нарочь. – Мн.:
БГУ, 2007. – С. 55-56.
Водоросли планктона горных
водотоков (на примере водотоков бассейна Телецкого озера, Россия)
Митрофанова Е.Ю.
Plankton algae of mountain streams case study
in the Lake Teletskoye basin,
Russia
Mitrofanova E.Yu.
Институт водных и экологических проблем СО РАН
1, ул. Молодежная, г. Барнаул 656038, Россия, тел. (3852)364681,
факс (3852)240396
e-mail: emit@iwep.asu.ru
Большая часть площади водосбора (20400 тыс. км2)
глубокого Телецкого озера на юге Западной Сибири расположена выше 1500 м ур. моря (Селегей,
Селегей, 1978), поэтому реки и ручьи имеют как большие уклоны и, вследствие
этого, высокие скорости течения воды, так и низкую температуру, которая в
период максимального прогрева в большинстве случаев не превышает 15 0С.
Кроме того, для рек характерна слабо кислая реакция воды вследствие
заболоченности территории бассейна и невысокая общая минерализация
(Загороднева, 1950). Все это не способствует развитию собственно фитопланктона
в реках и ручьях исследованной части бассейна Телецкого озера. Он в основном
представлен оторвавшимися от субстрата водорослями фитоперифитона и бентоса.
Цель работы - изучение особенностей таксономического
состава, пространственного распределения, обилия фитопланктона различных водотоков
бассейна Телецкого озера. Для этого были исследованы водотоки бассейна рек
Чульча и Кыга, являющихся притоками первого порядка р. Чулышмана и Телецкого
озера; р. Чулышман в его нижнем течении в августе 2007 г. и реки Баскон и Чири
в августе 2006 г.
(рис.) Для анализа привлечены данные по фитопланктону р. Чулышман в районе
устьев рек Чульча и Башкаус за июль 2001 г. Пробы отбирали с поверхности, фильтровали
через мембранные фильтры с диаметром пор около 1 мкм, фиксировали 40%-ным
формалином, количество
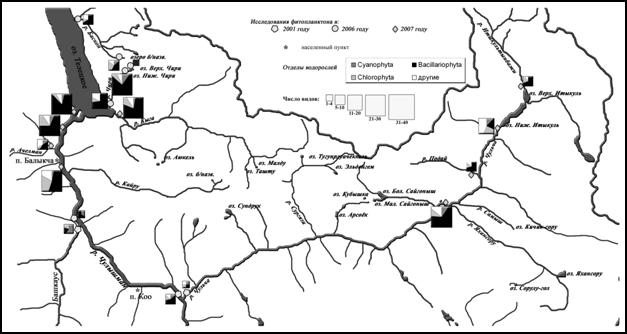
Рис. Гидрографическая схема части бассейна Телецкого
озера
(бассейн рек Чульча, Чулышман, Кыга, Чири и Баскон) с
указанием типов и числа видов
водорослей в фитопланктоне по результатам исследований
в 2001, 2006 и 2007 гг.
клеток
подсчитывали в камере Нажотта объемом 0,05 мм, биомассу рассчитывали объемно-весовым методом.
Пробы фитопланктона рек Чульча и Башкаус
(в районе устья) и р. Чулышман (после впадения этих рек) в июле 2001 г. были отобраны сетным
методом (размер ячеи 12х12 мкм).
Ввиду труднодоступности района исследований альгофлора
водоемов и водотоков бассейна р. Чульчи до настоящего времени изучена слабо. Ранее,
в 1946 г.,
основное внимание было уделено исследованию водорослей озер данного бассейна (Попова,
1950). Как отмечала автор, в реках бассейна и собственно р. Чульче наблюдается
почти полное отсутствие форм фитопланктона и довольно развитый фитобентос, из
которых ряд форм характерен для текучих чистых холодных вод. При общей
малочисленности водорослей преобладающее значение в планктоне водоемов и
водотоков имели виды с большим развитием желтых и бурых пигментов в
хроматофорах, что, по ее мнению, характерно для высокогорных областей Алтая.
На современном этапе в фитопланктоне водотоков
выявлено 86 видов водорослей из восьми отделов с преобладанием диатомовых и
зеленых водорослей: Cyanophyta – 12 видов, Chrysophyta – 3, Bacillariophyta
– 41, Cryptophyta – 4, Dinophyta – 0
(не определен до вида), Euglenophyta –
2, Chlorophyta – 20, Xanthophyta – 4
вида. В целом число выявленных в реках видов водорослей составляет 46,2% от
общего числа видов в водоемах и водотоках исследованной части бассейна Телецкого
озера (186 видов). В реках флора беднее, чем в озерах (154 вида), наблюдается
большее преобладание диатомовых водорослей (см. рис.). Абсолютное число видов
зеленых водорослей (20 видов) в реках ниже, чем аналогичная величина в озерах
(53 вида). Число видов водорослей с желтыми и бурыми пигментами в хроматофорах
(Chrysophyta, Bacillariophyta
и Xanthophyta) в исследованных нами водотоках составляет 55,8% от
общего числа видов в фитопланктоне, в то время как в озерах – 46,1, а в целом в
озерах и реках региона – 46,5%. Отмечено также, что в реках число одновременно
вегетирующих видов в фитопланктоне составляет в среднем 18,5±3,3, для озер этот
показатель, соответственно, выше – 23,1±2,9. Небольшие притоки р. Чульчи и река
до оз. Итыкуль бедны по составу фитопланктона – 6-9 одновременно вегетирующих
видов. Исследование сетных проб фитопланктона р. Чульчи и Башкауса в нижнем
течении и в районе устья показало наличие столь же бедного фитопланктона –
всего 2-7 видов. Разнообразие потамофитопланктона увеличивается в р. Чульче сразу
после оз. Нижний Итыкуль и ее среднем течении – до 15-21 видов, и значительно
повышается в низовьях р. Чулышман за счет увеличения разнообразия биотопов –
25-31 вид. Это сравнимо с разнообразием фитопланктона в Телецком озере в районе
впадения рек Чулышман и Кыга – 26 и 29 одновременно вегетирующих видов, т.е.
нижние участки притоков оказывают влияние на состав и обилие фитопланктона
озера, особенно в литорали.
Для рек и ручьев исследуемого района бассейна
Телецкого озера характерно наличие в фитопланктоне большого количества случайно
планктических форм, которые принадлежат к бентосным формам и обрастателям (43 вида).
Присутствие в фитопланктоне водотоков истинных планктеров (28 видов)
свидетельствует о сносе этих форм из озер. Большинство выявленных в
фитопланктоне видов являются космополитами (52 вида и разновидности). Аркто-альпийцев,
характерных видов для холодных вод и высокогорных районов, отмечено всего 11
видов и разновидностей, бореальных – 18. Из видов с известным отношением к
минерализации воды в фитопланктоне исследованных водотоков выделено 3 вида
олигогалобов, преобладают в основном олигогалобы-индифференты – 53 вида,
разновидности и формы, олигогалобы-галлофобы представлены 11 видами и
разновидностями, олигогалобы-галлофилы – 15. По отношению к рН среды отмечено 22
вида и разновидности алкалифилов, в то время как ацидофилов – 6 видов и разновидностей,
индифферентов – 19 видов. Кроме того, отмечена небольшая группа видов-алкалибионтов
(3). Среди обнаруженных видов выявлено 69 видов и разновидностей индикаторов
сапробности, сапробный индекс которых находится в пределах 0,1-4,00, т.е. в
планктоне водотоков бассейна присутствуют индикаторы всех зон сапробности. Самая
многочисленная группа – бетамезосапробы (15 видов и разновидностей), которые
вместе с ксено- и олигосапробами составляют 62 вида, или 89,9%. Индекс
сапробности по численности для проб не превышал 2,19, что также соответствует
олиго-бетамезосапрбной зоне. Виды-индикаторы более высоких зон сапробности
имели в основном низкую численность.
Численность и биомасса фитопланктона за исследованный
период были отмечены в широких пределах: 6,1-269,1 тыс.кл./л и 6,1-285,9 мг/м3,
средняя численность составила 110,2±43,7 тыс.кл./л, средняя биомасса –
120,9±36,9 мг/м3. Для озер средние численность и биомасса
фитопланктона были значительно выше (234,3±68,6 тыс.кл./л и 199,6±58,3 мг/м3),
что является свидетельством неблагоприятных условий для водорослей в горных
бурных потоках. Причем наименьшие количественные показатели развития фитопланктона
характерны для небольших рек и ручьев, где нет затишных мест, благоприятных для
скопления водорослей (р. Подай). Реки, берущие начало из крупных озер, имеют
довольно разнообразный и обильный фитопланктон. Так, например, в фитопланктоне
р. Чульчи, вытекающей из оз. Нижний Итыкуль, по составу преобладают зеленые
водоросли, наиболее обильные в озере. Численность фитопланктона небольшая,
водоросли сносятся только с поверхностного слоя воды озера ввиду наличия
каменного порога на выходе, а основная масса водорослей сосредоточена в более
глубоких горизонтах. Биомасса, напротив – значительная ввиду наличия крупных
форм – 26,1 тыс.кл./л и 107,9 мг/м3, соответственно. Максимальные
значения численности отмечены в низовьях р. Чулышман, биомассы – в среднем
течении р. Чульчи, в долине, где река приобретает более спокойный характер.
Наличие в 8 км
от устья реки водопада «Неприступный» (150 м) значительно влияет на состав и количество
фитопланктона данной реки, приводя к снижению как его разнообразия, так и обилия
(см. рис.).
В целом для рек и ручьев исследуемой
части бассейна Телецкого озера, характерно невысокое разнообразие и обилие
фитопланктона с преобладанием диатомовых водорослей. Потамофитопланктон,
возможно, оказывает влияние на состав и обилие фитопланктона Телецкого озера,
но только из нижних участков его притоков.
Список литературы
Загороднева Д.С. К гидрологии водоемов бассейна реки
Чульчи // Тр. Томского гос. ун-та. – 1950. – Т. 111. – С. 59-64.
Попова Т.Г. Фитопланктон водоемов бассейна реки Чульчи
// Тр. Томского гос. ун-та. – 1950. – Т. 111. – С. 93-104.
Селегей В.В., Селегей Т.С. Телецкое озеро. – Л.:
Гидрометеоиздат, 1978. – 142 с.
Флуоресценция хлорофилла в малых водоемах
Самарской области
Номоконова
В.И.
Chlorophyll
fluorescence in small
lakes of the Samara
region
Nomokonova V.I.
Институт экологии Волжского бассейна РАН
445003
г. Тольятти, ул. Комзина 10, (8482)489199
e-mail: vnomokonova@mail.ru
В 2007 и 2008 гг. флуоресценцию хлорофилла «а» определяли в
ряде малых водоемов Самарской области. В настоящем сообщении представлены
результаты исследований вертикального профиля его флуоресценции в оз.
Главном Рыбоводном – 2007 г.
и болоте Журавлином – 2008 г.
Оз. Г. Рыбоводное находится в цепочке
Васильевских озер, расположенных на окраине г. Тольятти. Глубина станции 4 м. Вода в озере средней
минерализации, с нейтральной или слабощелочной реакцией, по содержанию общего
фосфора это водоем гиперевтрофного типа
(Номоконова и др., 2001). Журавлиное болото расположено в Сызранском районе
области. Уровень воды от весны к осени
понижался, и глубина на станции отбора проб снижалась от 1,5 м до 1м. Вода малой
минерализации, полигумозного типа, по величине рН слабокислая. Станции
наблюдения располагались в центральной части водоемов.
Измерение флуоресценции хлорофилла «а» осуществляли с
помощью флуориметра The bbe FluoroProbe фирмы bbe MOLDAENKE (Германия). Флуориметр представляет зонд высотой 45 см и диаметром 14 см, с встроенным аккумулятором. Зарядка аккумулятора и соединение с компьютером осуществляется с помощью соединяющего измеряющего
кабеля.
Флуориметром определяется общее и дифференцированное по
группам содержание хлорофилла «а». Производится измерение температуры воды и
регистрируется глубина. Кроме того, прибор рассчитан на обнаружение «желтых
веществ» не связанных с водорослями, а определяющих цветность воды. Расчет
общего и дифференцированного по группам водорослей содержания хлорофилла «а» проводили
по программе, поставленной в комплекте с флуориметром, с использованием
прилагаемых коэффициентов для преобразования сигнала флуоресценции в
концентрацию хлорофилла «а», полученных по измерению флуоресценции чистых
культур водорослей. Концентрация общего содержания хлорофилла «а» и по каждой
группе водорослей дается в мкг/л.
Как известно, водоросли разных систематических групп
содержат специфический набор фотосинтетических пигментов. Соответственно, они
различаются по спектру возбуждения
флюоресценции (с установленной длиной волны эмиссии в 680 нм, соответствующей
хлорофиллу «а»). Во флуориметре для дифференцирования водорослей возбуждение флуоресценции
осуществляется светом длиной волн: 370, 470, 525, 570, 590 и 610 нм. Их спектры
показаны на рис. 1.
Зеленые водоросли имеют максимум флуоресценции при
поглощении света длиной волны 470 нм,
который вызван наличием в их клетках хлорофилла а и b. Максимум
флуоресценции синие-зеленых водорослей связан с присутствием в составе
светособирающего комплекса пигмента фикоцианина, который обуславливает поглощение
света длиной волны 610 нм. Они содержат также хлорофилл а, но из-за
эффекта маскировки фикоцианином наблюдается низкая интенсивность флуоресценции
при поглощении света на 470 нм. Высокий пик флуоресценции диатомовых и динофитовых
при возбуждении светом 525 нм обусловлен присутствием фукоксантина,
ксантофилла, а в последних - и перидинина. Максимумы в 470 нм вызваны хлорофиллом
а и c. У криптофитовых максимум в 570 нм связан с наличием
фикоэритрина.
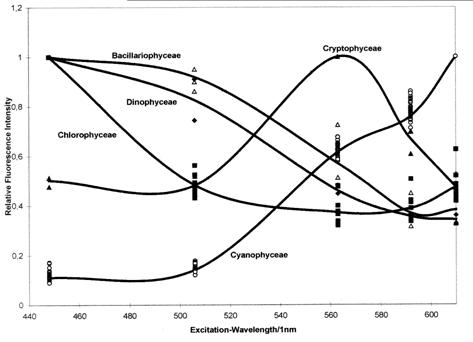
Рис. 1. Интенсивность флуоресценции водорослей разных систематических отделов,
нормализованная по максимальной ее интенсивности в каждой группе
Результаты исследований представлены на рис. 2. По
содержанию хлорофилла «а» оз. Г. Рыбоводное и открытое пространство воды в
Журавлином болоте по классификации Г.Г. Винберга (1960) относятся к евтрофному
типу водоемов. Оз. Г. Рыбоводное по его концентрации было отнесено к евтрофным
водоемам и по данным ежемесячных исследований в 1991 г. (Номоконова и др.,
2001).
В августе 2007
г. в оз. Г. Рыбоводном с глубины 3 м начиналась анаэробная зона,
откуда наблюдалось и незначительное понижение температуры воды (рис. 2).
Содержание хлорофилла «а» достаточно плавно увеличивалось к придонному слою
воды. Также изменялось по вертикали обилие синезеленых и диатомовых+динофитовых водорослей –
в оценке по концентрации хлорофилла «а». В фитопланктоне лидировали синезеленые
водоросли.
В болоте Журавлином при значительно меньшей его глубине
термическая стратификация, вероятно, по причине влияния холодных подземных вод,
четко выражена (рис. 2). В придонных слоях воды в мае и июне 2008 г. наблюдался дефицит
кислорода (0,8-1,7 мг/л), в августе – от глубины, равной 0,5 м. При всех наблюдениях
регистрировался глубинный максимум содержания хлорофилла «а». В мае и июне наблюдалось совпадение
зон залегания глубинных максимумов развития основных групп – зеленых, синезеленых и диатомовых+динофитовых
водорослей. В августе – только у зеленых и синезеленых водорослей. В
фитопланктоне в мае, июне и августе лидировали зеленые водоросли. Вклад криптофитовых
водорослей, как и в Г. Рыбоводном озере, был крайне низок.

Рис.
2. Вертикальное распределение температуры воды (2), общего содержания
хлорофилла "а" (1) и дифференцированно по группам водорослей: Chlorophyta+Euglenophyta (3),
Cyanophyta (4) и Bacillariophyta+Dinophyta (5) в озере Г. Рыбоводном (А), в болоте Журавлином
(Б-Г).
А
- 30 августа, Б - 27 мая, В -26 июня, Г - 20 августа. Приведены сглаженные
кривые.
Как видно, полученные результаты не противоречат известной
зависимости распределения фитопланктона по вертикали в водоеме от термической
стратификации водной массы и подтверждают необходимость ее зондирования в целях
определения вертикального распределения флюоресценции хлорофилла «а» для выбора горизонтов при определении
видового состава, численности и биомассы фитопланктона. Вероятно, что такой
подход особенно важен при изучении фитопланктона малых водоемов, суммарная
водная поверхность которых в 200 раз выше, чем крупных озер.
Работа
выполнялась в рамках проекта РФФИ № 08-04-00384.
ИССЛЕДОВАНИЯ
ДИАТОМОВЫХ ВОДОРОСЛЕЙ СОВРЕМЕННЫХ ДОННЫХ ОТЛОЖЕНИЙ ВОДОЕМОВ СИБИРСКОЙ АРКТИКИ
Палагушкина О.В.1,
Назарова Л.Б.1,2, Веттерих С.2
Investigations of diatoms in modern sediments
in Siberian
arctic lakes
Palagushkina O.V.1, Nazarova L.B.1,2, Wetterich
S.2
1Казанский
государственный университет, факультет географии и экологии
420008, г.
Казань, ул. Кремлевская, 18, (843)2927672
e-mail: opalagushkina@mail.ru
2Институт
морских и полярных исследований Альфреда Вегенера
14473, Германия,
Потсдам, Телеграфенберг, 43
Арктические регионы
являются наиболее чувствительными в отношении глобальных изменений климата, а
арктические водоемы - отличными индикаторами происходящего повышения температуры
воздуха на планете. Водоемы полигональной тундры - наиболее характерные типы
водных экосистем для Севера Сибири, они отличаются небольшими глубинами (до 3 м), специфическим термальным
и химическим режимом, что делает их крайне чувствительными к климатическим
изменениям. Среди многих организмов, сохраняющихся в донных отложениях, диатомовые
водоросли часто используются для определения температурных или гидрохимических
изменений. Представители этого отдела обитают во всех поверхностных водах Земли,
а их кремниевые панцири хорошо сохраняются в ископаемом состоянии.
В июле-сентябре 2007
был произведен отбор проб современных донных отложений в трех регионах Северной
Якутии – с 15 водоемов южной части острова Большой Ляховский (73°N, 141°E), с
16 водоемов побережья Ойгосский Яр напротив пролива у острова Большой Ляховский
(72°N, 143°E) и с 3 водоемов в долине р. Лена в районе Тикси (71°N, 128°E). Донные
отложения были представлены илистым или песчаным материалом с большей или
меньшей долей растительного детрита. Дно изучаемых водоемов, в основном,
покрывалось мхами Sphagnum,
Arctophila, Arctagrostis и другими водно-болотными растениями (Carex, Eriophorum). Климат исследуемой
территории характеризуется холодной зимой (средняя температура воздуха в январе
-32.2 °C),
прохладным летом (средняя июльская температура воздуха 2.8 °C) и низким годовым количеством осадков (253 мм).
В отобранных пробах
современных донных отложений 34 водоемов исследовались диатомовые водоросли,
кладоцеры, хирономиды и остракоды. В тезисах приводятся результаты диатомового
анализа.
Исследования, проведенные по общепринятой методике,
позволили выявить 161 таксон диатомовых водорослей. Среди обнаруженных диатомей
преобладали бентосные космополитные олигогалобы-индифференты, по отношению к рН
воды преобладали индифференты и виды-обитатели вод с щелочной реакцией среды.
Анализ полученных данных показывает наименьшее видовое
богатство диатомей в устье р.Лены (р-н Тикси) – 63 вида, для озер этой
территории отмечены самый высокий процент бентосных и планктонных видов (для
этих водоемов были свойственны большие глубины из всех исследуемых водоемов),
отсутствие мезогалобов и самый высокий процент галлофобов и ацидофилов, а также
наибольший процент аркто-альпийских, бореальных и голарктических видов.
Для водоемов острова Большой Ляховский было отмечено
87 видов диатомовых. Для этих водоемов характерным является отсутствие
планктонных видов, что может быть связано с коротким вегетационным периодом в
этих озерах из-за высокой широты и низких температур воздуха, а также
небольшими глубинами водоемов (от 0,1 до 0,6 м). Также этой группе озер по сравнению с
озерами устья Лены в районе Тикси и Ойгосского Яра свойственен самый высокий
процент галофильных и мезогалобных видов, по отношению к рН среды – самый
высокий процент алкалифильных и индифферентных видов.
В водоемах Ойгосского Яра было обнаружено наибольшее
количество диатомовых – 109 видов. Из характерных особенностей этого региона можно
отметить самый высокий процент индифферентных видов по фактору солености. В
целом, диатомеи водоемов Ойгосского Яра по своим характеристикам занимают
промежуточное положение между диатомовыми водоемов устья р.Лена и о.Большой
Ляховский.
Факторный анализ, основанный на коэффициенте
корреляции Спирмана с использованием физико-химических показателей и диатомей,
дающих более или 10% от общего числа створок в пробе, позволил выявить два комплекса
видов диатомовых. Один из них представлен видами, способными существовать в
водоемах высоких широт с нейтрально-слабощелочной реакцией воды с большими
значениями кондуктивности – это Navicula contenta Grun., Nitzschia paleacea Grun., Caloneis baccilum (Grun.) Cleve, Achnanthes minutissima Kütz (подтверждается положительными коэффициентами
корреляциями). Приуроченность ряда видов к высоким широтам подтверждается также
отрицательными коэффициентами корреляции с температурой воздуха – это Cymbella angustata (W.
Sm.) Cleve,
Achnanthes minutissima Kütz, Navicula contenta Grun. Вышеперечисленные
виды также предпочитают для своего развития водоемы с большими концентрациями
ионов кальция, магния, натрия, стронция, а также хлоридов, нитратов и гидрокарбонатов
и меньшие концентрации ионов алюминия и железа.
Другой комплекс видов приспособлен к существованию в
водоемах с небольшими значениями кондуктивности, нейтральной – слабокислой
реакцией воды, расположенных в более низких широтах при больших температурах
воздуха (положительный корреляции). Это виды Eunotia septentrionalis Oest., Eunotia
praerupta Ehr., Eunotia tenella (Grun) Hust, Gomphonema parvulum
Kutz., Tabellaria flocculosa (Roth.) Kutz. Перечисленные виды хуже
развиваются в водоемах с высокой концентрацией
ионов кальция, магния, натрия, фосфора, стронция, хлоридов, сульфатов, нитратов,
фосфатов, гидрокарбонатов, но предпочитают воды с более высокими концентрациями
калия, алюминия и железа.
По полученным результатам такие виды как Cymbella
angustata (W. Sm.) Cleve, Eunotia naegelii Migula, Pinnularia
viridis (Nitzsch.) Ehr. способны хорошо развиваться в мелководных водоемах
(отрицательная корреляция с глубиной), а Tabellaria flocculosa (Roth.)
наоборот, предпочитает более глубокие водоемы (положительный коэффициент
корреляции с глубиной).
Проведенные исследования показали разнообразие
арктической флоры исследуемого региона и определяющую роль физико-химических
показателей воды для большей части диатомей. Также был выделен комплекс видов,
приуроченных к обитанию в водоемах высоких широт.
ФИТОЦЕНОТИЧЕКИЕ
ОСОБЕННОСТИ ОРГАНИЗАЦИИ ПОЧВЕННЫХ
ВОДОРОСЛЕЙ ОЛИГОТРОФНОГО ОСУШЕННОГО БОЛОТА
(ПЛЕСЕЦКОГО
РАЙОНА АРХАНГЕЛЬСКОЙ ОБЛАСТИ)
Пивоварова
Ж.Ф., Благодатнова А.Г.
Phytocenological features of soil algae
organization
in the oligotrophic drained bog
(the Plesetsk area, the Arkhangelsk Region)
Pivovarova J.F., Blagodatnova
A.G.
ГОУ
ВПО Новосибирский государственный педагогический университет
В настоящее время существует острая необходимость
комплексного исследования болотных экосистем. Изучение и мониторинг болот -
одно из приоритетных направлений, частью которого являются исследования почвенных
водорослей – неотъемлемой составляющей почвы и биогеоценоза в целом.
Олиготрофное болото, находящееся на территории
Плесецкого района Архангельской области, было осушено в 1980 году с целью
обеспечения лесного питомника торфом. В пределах исследованного болота
формируется достаточно специфичная структура почвенных водорослей, что связано с особенностями условий обитания.
Можно выделить три основные синузии: первая тяготеет к осушительным канавам и
представлена Carex gracilis Curt., Pinus sylvestris L., Betula nana L., Betula pendula Roth, Vaccinium uliginosum L.; вторая, располагаясь между рвов образована подушками
Polytrichum juniperinum Hedw.,
площадью от 1 до 4м2, одиночными экземпляры Picea obovata (L.) Ledeb.; третья представляет собой открытое торфяное пространство, пока
еще не освоенное высшими растениями.
На территории верхового осушенного
болота было зарегистрировано 111 видов водорослей, принадлежащих к 5 отделам, 8
классам, 15 порядкам, 31 семействам, 53 родам. Из них Chlorophyta- 54, Cyanophyta
-25, Bacillariophyta – 20, Xantophyta – 11 и Euglenophyta
1 вид (З54С25Д20Ж11Э1).
Семейственный спектр водорослей представлен 31 семейством, из которых девять
ведущих семейств включают 60 видов, что составляет 54,1% от всей альгофлоры и диагностирует
флору как бореальную (Толмачев,1974). Лидирующую позицию занимает семейство Chlamydomonadaceae с наибольшим числом родов и
видов, что является характерным для болотных экосистем, в частности осушенных
(Штина и др,1981). В родовом спектре 11 ведущих родов объединяют 51 вид
(49,5% видового состава). Лидирующие позиции занимают рода Chlamydomonas и Eunotia, находясь в
связанных рангах. Одновидовые рода составляют более половины спектра
(62,5%). Семейственная и родовая наполняемость отделов альгофлоры экосистемы
указывает на аллохтонный характер образования флоры (Толмачев,1974).
Для каждой синузии характерны свои
альгогруппировки. Так, в пределах осушительных рвов выявлена группа доминантных
видов Chlorococcum humicola, Cosmarium abbreviatum, Chlorella vulgaris; для
синузии Polytrichum juniperinum -
Characium ovatum f. minus,
Eunotia lunaris, E. еxigua. На
открытом пространстве группировка водорослей полидоминантна - Gloeocystis
polydermatica, Phormidium autumnale,
Oscillatoria formosa, Chlamydomonas atactogama, Scenedesmus bijugatus.
Фитоценотическая структура достаточно
многогранна, но в пределах исследованных биотопов наиболее ярко проявляются два
показателя: жизненные формы и экологические группы. Совокупность жизненных форм
и экологических групп почвенных водорослей представляют собой биологический
спектр видов по отношения к разнообразным параметрам среды, например,
влажности, засоленности, кислотности. Традиционно используется классификация,
разработанная Э.А. Штиной и М.М. Голлербахом (1976). При всех положительных
сторонах, широком использовании данной классификации, есть определенные
трудности: наряду с жизненными формами в спектр включены и экологические
группы. Hydr-. и
amph.–формы имеют свои определенные морфотипы и жизненные формы. Основные жизненные формы отражают
экологическую индивидуальность вида, но в тоже время, можно найти среди
представителей, например, Х и Н –формы, виды с большей выраженностью
ксероморфных черт (Pseudanabaena bipes, Characiopsis acuta, Microspora quadrata ). Среди видов Ch-формы имеются как
представители, тяготеющие к засушливым почвам (Chlorosarcina
stigmatica), так и предпочитающие перманентно
увлажненные почвы (Muriella magna, Coccomyxa dispar).
Учитывая вышеизложенное, считаем
необходимым выделить, непосредственно для исследованного болота, следующие
жизненные формы и экологические группы. Спектр жизненных форм почвенных
водорослей данной олиготрофной системы: С25Ch21В20 Х20H14Р7CF4 .
Наибольшее долевое участие имеют С-,Ch-,В- и
Х -формы (около 20 % на каждую).Это виды рода Chlamydomonas, в частности
характерные для болот Chlamydomonas atactogama, Ch. globosa, Gloeocapsa
minor и Cylindrocystis brebissonii. Эти виды неоднократно
встречались в перманентно увлажненных гумидных почвах и в исследованиях И.Е. Дубовик (1998),
Е.Н. Патовой (2004). Mesotaenium endlicherianum, обнаруженный нами,
рассматривается, как типичный для торфяных болот (Штина и др.,1981; Закиева,2007). Chlorococcum humicola, Ch.
infusionum были встречены только вдоль осушенных канав. По мнению ряда ученых
эти виды диагностируют переувлажненные
почвы (Штина, 1981). Представители рода Chlorella –типичные убиквисты,
при этом Chlorella vulgaris определена в пределах разнообразных
ассоциаций растений, кроме мест, не занятой растительностью. Для этого вида
характерно обильное развитие в ризосферной зоне растений (Штина, 1981). Bracteacoccus
minor, Dictyococcus mucosus, типичны для осушенного болота, что
подтверждают исследования К.А. Некрасовой, Е.А. Бусыгиной (1979), Э.А. Штиной
(1981). Представители Radiococcaceae: Coccomyxa dispar, Tetracoccus natans,
определенные нами на открытом торфяном пространстве, характерны для северных
переувлажненных почв (Штина и др. 1981; Райда, 2005). На долю В-формы,
представленной видами отдела Bacillariophyta, приходится около 18%. Это
типичные эдафофильные водоросли, предпочитающие увлажненные почвы, а именно их
верхние слои (Закиева,2007; Куликовский,2007).
Eunotia lunaris, E. exigua найдены под дернинками Polytrichum
juniperinum , что совпадает с данными других
авторов (Штина и др.,1981). Х-форма
(18,0 %) представлена Pleurochloris lobata, P. polychloris, Characium ovatum f. minus, причем последний может считаться
верным видом для болотных экосистем (Штина и др., 1981). Присутствие видов этой
жизненной формы может рассматриваться как признак начала окультуривания
осушенной болотной экосистемы (Дубовик, Ишбирдин, Хусаинов,1991). Н-форма
(12,6%) представлена видами родов Tribonema и Bumilleria,
предпочитающими гумидные болотные почвы и являющимися типичным для болотных
систем видами, на что указывает в своих
работах Э.А. Штина (1981).
Экологические группы водорослей в пределах данных биотопов олиготрофной
осушенной системы целесообразно выделять по отношения к фактору влажности,
который является лимитирующим в пределах исследуемого участка. Можно выделить
мезофильные (М), ксерофильные (К), hyd.r и amph.-
экологические группы водорослей. Основываясь на литературных данных об
экологических особенностях видов и собственных исследованиях, касающихся
местообитания отдельных видов, соотношение групп представлено следующим
образом: M78 hydr18 K8 amph.7 Лидирующие позиции занимают виды
мезоморфной природы (около 70%), что отражает особенность экологических условий
болота, сложившиеся в результате осушения. В то же время на долю гидроморфных
видов приходится лишь 16 %: Eunotia crista-galli, E.
fallax, Frustulia rhomboides var. saxonica обнаружены
только в пределах осушительных канав. Гидрофильная группа также составляет немалую
часть отдела Chlorophyta. Здесь
представлены типичные для болот виды рода Closterium (Closterium
moniliferum, С. venus, С. gracile, С. lunula) и Cosmarium (Cosmarium abbreviatum,
С. blyttii, C. quadratem), причем эти виды были обнаружены
как в пределах осушительных канав, так и под кочками Carex sp. Ксероморфная группа образована водорослями отдела Cyanophyta: Plectonema nostocorum, Phormidium autumnale, Ph. uncinatum, Oscillatoria formosa. Присутствие этих групп свидетельствует о гетерогенности
экологических условий, где наряду с перманентным гиперувлажнением имеются участки
поверхности торфа с минимальной влажностью. Таким образом, создается
разнообразие экологического пространства и, соответственно, экологических ниш.
Кислотность почвенной среды так же
является лимитирующим фактором формирования альгофлоры, поскольку далеко не
каждый вид даже с достаточно широкой экологической валентностью, может
развиваться при показателях ph в интервале
3,5- 3,7. Ацидофильные виды составляют большую часть альгофлоры (64%), сюда
входят практически все представители Bacillariophyta. Наряду с
ацидофилами во флоре присутствуют индиффернтные виды (около 30 %). Нет сведений
для 6% видового состава.
Картина соотношения экологических
групп водорослей исследованного болота дает информацию о благоприятствовании
среды для видов мезоморфной природы. Cнижение
доли гидрофильных форм и некоторое увеличение числа видов ксероморфной природы
указывает на изменение экологических условий болотной экосистемы, где
происходит трансформация экологических ниш, а значит, для их освоения и
укомплектовки требуются или виды с более широкой экологической валентностью (Chlamydomonas
atactogama, Ch. elliptica, Chlorococcum infusionum, Chlorella vulgaris),
или менее требовательные к фактору увлажнения (Oscillatoria formosa, O. tenuis, Phormidium autumnale).
Виды водорослей осушенной олиготрофной
экосистемы различных жизненных форм и экологических групп представлены
разнообразными морфотипами: коккоидным, монадным, пальмеллоидным, нитчатым,
гетеротрихальным и другими. Разнообразие морфотипов указывает на всевозможные
адаптационные процессы, происходящие внутри экосистемы, связанные с
особенностями исследованных биотопов болотной экосистемы. В то же время,
наиболее показательным является соотношение коккоидных и нитчатых типов, что
указывает на степень экстремальности среды (Новичкова-Иванова,1980). Так, на
долю коккоидных типов приходится более 56%, в то время, как трихальные
морфотипы составляют около 30%. Такое соотношение указывает на экстримальность
среды, выраженной в снижении влажности и высокой кислотности среды. Доказано,
что сферическая форма является наиболее выгодной и оптимальной для
существования в среде с кислой реакцией (Меньщикова и др., 2006), что является
одним из важных факторов превалирования коккоидных морфотипов в пределах данной
болотной экосистемы.
Таким образом, несмотря на сильнейший
антропогенный прессинг, выраженный в осушении болота, почва «сохранила»
типичные для данной экосистемы жизненные формы, экологические группы почвенных
водорослей и морфотипы, способные адаптироваться к неблагоприятным условиям
среды. Болотные экосистемы сами по себе являются гетерогенными образованиями, в
данном же случае эта гетерогенность усиливается последствиями осушения, что
отразилось на составе, соотношениии таких показателей, как жизненные формы,
экологические группы и морфотипы водорослей.
Произошло встраивание в фитоценотическую организация новых, не
характерных жизненных форм и экогрупп при сохранении характерных для данных
биотопов пропорций внутри этих групп. Все это есть не что иное, как проявление
«памяти почвы», о чем писали В.О. Таргульян и И.А.Соколов (Соколов,2004).
Экосистема в целом «делает упор» на сохранение и запас информации, но в то же
время, достаточно быстро реагирует на изменения экологических условий, чему
способствует пойкилоксерофитная природа почвенных водорослей и достаточно
широкая экологическая валентность большого числа видов (Зенова, Штина,1990).
Список литературы
Штина Э.А., Голлербах М.М. Экология почвенных
водорослей. М.: Наука, 1976. - 143 с.
Штина Э.А., Антипина Г.С., Козловская
Л.С. Альгофлора болот Карелии и ее динамика под воздействием естественных и
антропогенных факторов. Л.: Наука, 1981. 269 с.
Толмачев А.И. Введение в географию растений. Л.:
изд-во Ленингрд. ун-та, 1974. – 244 с.
Дубовик И. Е. Водоросли эродированных
почв и альгологическая оценка почвозащитных мероприятий : Автореф. дис. ... докт. биол. наук. Сыктывкар, 1998. 48 с.
Патова Е.Н. Cyanophyta в водоемах и
почвах восточно-европейских тундр // Ботан. журн. 2004. Т. 89, № 9. С.
1403-1419.
Закиева Г. Ф. Альгофлора низинных болот степной зоны
:на примере Стерлибашевского района Республики Башкортостан: Автореф. дис. ... канд. биол. наук. Уфа, 2007.
32с.
Дубовик И. Е. , Ишбирдин А. Р., Хусаинов А.Ф. Антропогенной
воздействие на почвенную альгофлору
тундры месторождения «Медвежье» (Западная Сибирь» // Биологические
науки. - 1992. - №2. - С.80-86.
Зенова Г.М., Штина Э.А. Почвенные водоросли. М.:
Изд-во МГУ, 1990. 80 с.
Соколов И.А.
Теоретические проблемы генетического почвоведения.- Новосибирск: «Гуманитарные
технологии», 2004 – 288с.
Куликовский М.С. Диатомовые водоросли
некоторых сфагновых болот европейской части России: Автореф. дис. ... канд.
биол. наук. СПб., 2007. 24 с.
Новичкова-Иванова
Л.Н. Почвенные водоросли фитоценозов Сахаро-Гобийской пустынной области.
Л.: Наука. - 1980. 255 с.
Некрасова К.А., Бусыгина Е.А. Неравномерность
пространственного распределения водорослей
в почвах.- Почвоведение, 1979, № 10. С. 83-91.
Е.Б. Меньщикова, Н.К. Зенков, В.З. Ланкин, И.А.
Бондарь, В.А. Труфакин, Н.Ф. Круговых. Окислительный стресс. Москва, 2006.-
556с.
Динамика развития альгокомплексов
Pineta vacciniosum
Пивоварова Ж. Ф., Илюшенко А. Е.
The Pineta vacciniosum
algocomplexes development dynamics
Pivovarova Z. P.,
Ilychenko A. E.
ГОУ ВПО Новосибирский государственный педагогический университет
Почвенные водоросли
играют значительную роль в функционировании лесных биогеоценозов. Организация
водорослевых группировок является ответной реакцией этих представителей низших
растений на сезонность года и условия среды, созданные высшими растениями. При
ценотической характеристике альгогруппировок наряду с основными показателями
(видовой состав, доминанты, биологический спектр) использованы встречаемость и
сопряженность. Учитывая самые высокие показатели сопряженности для каждого из
видов и внутривидовых таксонов водорослей, а также число устойчивых
положительных связей между ними выделены альгокомплексы (Илюшенко, 2003).
Альгокомплексы
подзолистых почв Pineta vacciniosum изучены на территории Белоярского лесничества
Дубровинского лесхоза Новосибирской области. Древесный ярус представлен эдификатором
Pinus
sylvestris L., травяно-кустарничковый
- доминантами Vaccinium vitis-idaea L., Lycopodium clavatum L.
Основными строителями моховых синузий являются Dicranum undulatum Ehrh. ex Web и Pleurozium schreberi (Brid.) Mit., лишайниковый покров образуют кустистые виды Cladina rangiferina (L.) Harm., C. arbuscula (Wallr.) Hale et W. Culb.. Подстилка 12-16 см.
Материалом
для исследований послужили 120 усредненных почвенных образцов, состоящих из 10
индивидуальных проб объемом 5 см3 каждый. Пробы отбирались в течение
четырех лет по трем вегетационным сезонам (май, июль, сентябрь) в подстилке и
из слоя 0-5 см.
С целью выявления особенностей распределения водорослей, пробы брали в околокронной
зоне Pinus sylvestris,
с открытых участков почв, под доминантными видами травяно-кустарничкого и
мохово-лишайникого ярусов.
Культивирование
вели почвенно-альгологическим методом чашечных культур со “стеклами
обрастания”. Почву увлажняли средой Кнопа. Просмотр проводили в течение 3-5
месяцев.
Фитоценотический
анализ альгогруппировок бора-брусничника выполнен с помощью метода межвидовых сопряженностей
(Cole, 1957). Из 133 видов и внутривидовых таксонов
водорослей, обнаруженных в подстилке и почве бора-брусничника, в обработку
сопряженностей выбрано только от 15 до 23 достоверно значимых, встречаемость которых
выше 16%. Наличие достоверно значимых связей между видами и внутривидовыми
таксонами водорослей позволяет выделить альгокомплексы.
Для Pineta vacciniosum, учитывая сезонную динамику
водорослей, выделено 6 альгокомплексов (рис. 1). Сложность ценотических
взаимоотношений между видами и внутривидовыми таксонами водорослей обязана не
только специфике экологических ярусов бора-брусничника. Для водорослей этого
фитоценоза установлена определенная сезонность в их развитии, которая
способствует перегруппировке в составе и структуре альгокомплексов.
Весной наиболее
массовыми из зеленых водорослей являются монадные и коккоидные морфотипы из р.р.
Chlamydomonas, Coccomyxa, Coelastrella.
Им сопутствуют нитчатые морфотипы из Ulotrichales (Chlorhormidium flaccidum var. flaccidum, Stichococcus bacillaris), коккоидные из желтозеленых – Botryochloris cumulata, Ellipsoidion regulare, Monodus dactylococcoides.
Такое разнообразие видов формирует весенние
хламидомонадово-стихококково-коккомиксовый подстилочный и плеврастрово-хламидомонадово-коккомиксовый почвенный (рис.2) комплексы.
Наиболее
существенные колебания в развитии водорослей происходят в подстилке, что обязано
резким изменениям ее влажности и температуры. Эколого-биологические особенности
отдельных видов водорослей обусловливают их различное отношение к экологическим
факторам, что приводит к формированию разных типов альгокомплексов. В разные
вегетационные сроки изменяется и их структура. Оформленность усиливается в
летний период (из 21 вида в нее включены 18 видов водорослей) (рис. 3) и
ослабевает, образуя «рассыпчатость» альгокомплекса (из 23 видов включены
только12) во влажный весенний период (рис. 2).
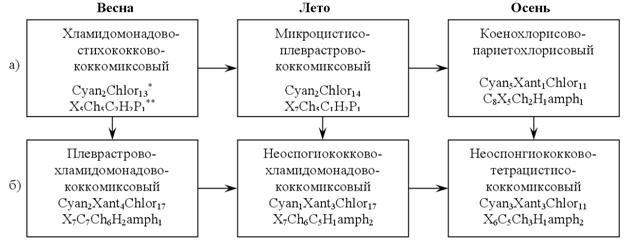
Рис. 1. Динамика развития
альгокомплексов в подстилке и почве бора-брусничника
а) – подстилка, б) –
почвенный слой 0-5 см;
* – таксономическая структура, ** –
биологическая структура
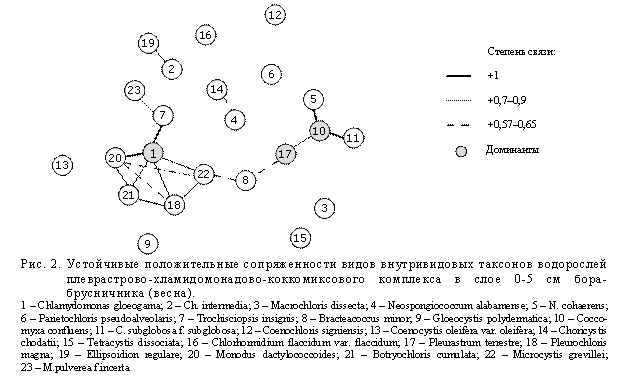
Наиболее
существенные колебания в развитии водорослей происходят в подстилке, что обязано
резким изменениям ее влажности и температуры. Эколого-биологические особенности
отдельных видов водорослей обусловливают их различное отношение к экологическим
факторам, что приводит к формированию разных типов альгокомплексов. В разные
вегетационные сроки изменяется и их структура. Оформленность усиливается в
летний период (из 21 вида в нее включены 18 видов водорослей) (рис. 3) и
ослабевает, образуя «рассыпчатость» альгокомплекса (из 23 видов включены только12)
во влажный весенний период (рис. 2).
Биологические спектры видов водорослей также отражают
специфику условий среды в разные сезоны года. В альгокомплексах исследуемого соснового
фитоценоза в весенне-летний период ведущие позиции занимает X-форма. Основные строители моховых синузий Dicranum undulatum и Pleurozium schreberi создают собственный микроклимат и способствуют
развитию жизненных форм водорослей мезоморфной природы, характерных для лесов.
В осенний период Х-форма в слое 0-5
см занимает 1-е место, а в подстилке уступает место
С-форме. Именно к С-форме относятся хламидомонады, наиболее требовательные к
влаге. Важным компонентом биологического спектра является Ch-форма, занимающая 2-е место в летний и 3-е место в
весенне-осенний периоды. Почвенные убиквисты – «выносливцы» (Coccomyxa confluense, Chlorella vulgaris var. vulgaris) способны противостоять резким колебаниям температуры
и влажности в период вегетации, что объясняется морфологическими и физиологическими
особенностями этих организмов. Мелкие размеры клеток обеспечивают водоудерживающую
способность и устойчивость против засухи. Важную роль в засухоустойчивости
коккомиксы и хлореллы играет способность к ослизнению клеточных покровов.
Особенностью спектров жизненных форм водорослей бора-брусничника является
меньший видовой состав нитчатых водорослей H-формы (Chlorhormidium flaccidum var. flaccidum, Pleurastrum
terrestre) во все сезоны года. Встречаются
отдельные представители Р-формы в весенне-летний период. Такое распределение почвенных
водорослей зависит от степени гетерогенности условий среды, создаваемых высшими
растениями.
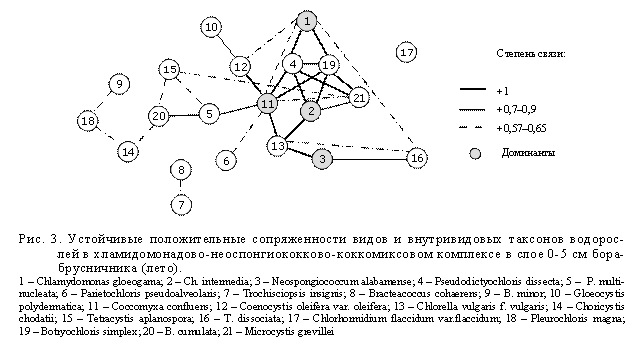
Таким образом, в хорошо оструктуренном Pineta
vacciniosum формируются подстилочные и почвенные альгокомплексы, характерные
для лесных зональных экосистем. Об этом свидетельствует преобладание зеленых
водорослей как в подстилке (весна 13 из 15 видов и внутривидовых таксонов
альгокомплекса; лето 14 из 16; осень 11 из 17), так и в почве (весна 17 из 23;
лето 17 из 21; осень 11 из 17). В разные вегетационные сроки изменяется таксономическая
и биологическая структуры альгокомплексов. Однако первые три места в
биологических спектрах занимают представители водорослей X-, Ch- и C-форм. Видовая насыщенность водорослей и
неравномерность их пространственного распределения в бору-брусничнике обязана
ценотической организации. Основными принципами этой организации являются с
одной стороны, создание высшими растениями «биомелиорированной среды» для
почвенных водорослей (Пивоварова, 1988). С другой стороны, способность самих
водорослей-доминантов к изменению микросреды в благоприятную сторону для себя и
сопутствующих видов и внутривидовых таксонов.
Список литературы
Илюшенко А.Е. Группировки почвенных водорослей
сосновых фитоценозов в режиме рекреационной нагрузки: Автореф. дис. … канд.
биол. наук. – Новосибирск., 2003. – 17 с.
Пивоварова Ж.Ф. Почвенные водоросли горных степей Азиатской
части СССР: Автореф. дис. … д-ра биол. наук. – Л., 1988. – 32 с.
Cole LaMont C. The
measurement of partial interspecific associacion // Ecology. – 1957. – Vol. 38,
№ 2. – P. 226-233.
РЕПРЕЗЕНТАТИВНОСТЬ ТАКСОНОМИЧЕСКОГО СОСТАВА
РЕЧНОГО ФИТОПЛАНКТОНА РАЗНЫХ ГИДРОЛОГИЧЕСКИХ СЕЗОНОВ
(НА ПРИМЕРЕ МАЛЫХ РАВНИННЫХ РЕК
БАССЕЙНА ВЕРХНЕЙ ОБИ)
Романов Р.Е.
The representativeness of river
phytoplankton taxonomic
structure in different hydrological seasons
(by example of small lowland river
in the Ob River upstream)
Romanov R.E.
Центральный
сибирский ботанический сад СО РАН
630090, г. Новосибирск, ул. Золотодолинская, 101,
тел. (383) 334-44-07
e-mail: romanov_r_e@mail.ru
Короткий жизненный цикл водорослей и цианобактерий
обуславливает характерную существенную временную неоднородность состава,
структуры и обилия фитопланктона. Это обстоятельство позволяет предположить
ограниченную репрезентативность результатов немногих эпизодов наблюдений по
отношению к этим характеристикам водной экосистемы за год.
Цель данной работы – оценить, насколько отражает
потамофитопланктон разных гидрологических сезонов таксономическое разнообразие
водорослей и цианобактерий планктона всего года, а также насколько отдельные эпизоды
наблюдений отражают фитопланктон отдельных сезонов и года в целом. Это позволит
приблизительно оценить репрезентативность данных о таксономическом составе
фитопланктона многих равнинных рек, которые являются результатом распространенной
практики наблюдений только в период открытой воды или в летне-осеннюю межень. Результаты
данной работы могут способствовать оптимизации сбора первичных данных по
таксономическому составу потамофитопланктона.
В 2002
г. были исследованы притоки Верхней Оби – малые
равнинные реки Барнаулка и Большая Лосиха (далее – Б. Лосиха) в их нижнем
течении, т.е. на участках, где процессы формирования фитопланктона как ценоза в
водотоках такого размерного класса уже завершились (Охапкин, 1997). Длина р.
Барнаулки ~200 км, площадь водосборного бассейна – 5,7 тыс. км2
(Ресурсы..., 1962). Длина р. Б. Лосихи – 150 км, площадь водосборного
бассейна – 1,5 тыс. км2.
Пробы отбирали в нижнем течении рек Барнаулка (1,0 км от устья),
Б. Лосиха (6,5 км
от устья) во все гидрологические сезоны с интервалом 10-15 суток, обрабатывали
в «живом» и фиксированном состоянии. Всего обработаны 31 проба фитопланктона
р. Барнаулки, 27 проб фитопланктона р. Б. Лосихи. Для оценки
репрезентативности таксономического состава водорослей и цианобактерий водной
толщи использованы данные за идентичные периоды наблюдений (28 и 26 проб соответственно).
При этом не учитывали несопоставимые таксоны, идентифицированные только до
родов. Поскольку водоросли и цианобактерии перифитона и бентоса являются
характерным компонентом речного фитопланктона, в данной работе была оценена
репрезентативность таксономического состава планктонного комплекса,
объединяющего облигатно и факультативно планктонные таксоны водорослей и
цианобактерий, которые способны развиваться в водной толще без связи с
субстратом. Планктонный комплекс в данном случае в значительной степени
соответствует объему фитопланктона в понимании А.П. Скабичевского (1960).
Сравнение проводили на основе мер включения (Андреев, 1980) на уровне видов,
разновидностей и форм.
В планктоне р. Барнаулки обнаружены 383 вида (436
видов, разновидностей и форм, далее – ВРФ) водорослей и цианобактерий. Близкое
таксономическое разнообразие фитопланктона выявлено в р. Б. Лосихе –
362 вида (409 ВРФ). Для оценки репрезентативности были использованы данные о
временной неоднородности 347 и 358 ВРФ водорослей и цианобактерий планктона
рек Барнаулка и Б. Лосиха соответственно, в том числе планктонный
комплекс 295 и 281 ВРФ соответственно.
Репрезентативность
отдельных эпизодов наблюдений в отношении всех гидрологических сезонов по
таксономическому составу фитопланктона и планктонного комплекса была различной
и не превышала 23 % и 34 % для рек Барнаулка и Б. Лосиха
соответственно (табл. 1, 2).
Отдельные эпизоды
наблюдений отражали состав фитопланктона и планктонного комплекса разных гидрологических
сезонов в подавляющем большинстве случаев не более чем на 44 % (табл. 1,
2). По сравнению с р. Барнаулкой, для р.
Б. Лосихи отмечена немного большая амплитуда колебаний значений этого
показателя.
Таблица 1
Репрезентативность
отдельных эпизодов наблюдений в отношении таксономического состава речного фитопланктона
разных гидрологических сезонов и за год в целом
|
Сезоны
|
Минимальные и максимальные
значения, %
|
Среднее арифметическое,
%
|
Количество эпизодов
наблюдений
|
|
Р. Барнаулка
|
|
Зимняя межень
|
10,7 – 25,4
|
20,4±4,7
|
11
|
|
Половодье
|
10,4 – 34,8
|
23,9±8,1
|
9
|
|
Летне-осенняя межень
|
24,4 – 37,6
|
29,4±4,8
|
8
|
|
В целом за год
|
5,5 – 22,1
|
13,3±4,3
|
28
|
|
Р. Б. Лосиха
|
|
Зимняя межень
|
5,8 – 33,7
|
18,2±8,4
|
11
|
|
Половодье
|
5,0 – 51,0
|
27,5±19,0
|
5
|
|
Летне-осенняя межень
|
20,9 – 43,6
|
33,0±7,6
|
10
|
|
В целом за год
|
1,4 – 33,2
|
14,9±9,6
|
26
|
В р. Барнаулке все гидрологические сезоны в большинстве
случаев отражали друг друга и год в целом не менее чем на 48 % по
таксономическому составу фитопланктона и планктонного комплекса (рис. 1а, 2а).
Примечательно, что значения мер сходства этих множеств варьируют в узких пределах
(48-59 %) по сравнению с аналогичными данными по р. Б. Лосихе
(24-81 %). Летне-осенняя межень в наибольшей степени отражает
таксономический состав водорослей и цианобактерий планктона последней реки за
год в целом (76-81 %) и других гидрологических сезонов (64-75 %),
репрезентативность этого сезона по составу планктонного комплекса выше по
сравнению с фитопланктоном в целом (рис. 1б, 2б). Период половодья в этом
водотоке характеризуется наименьшей репрезентативностью.
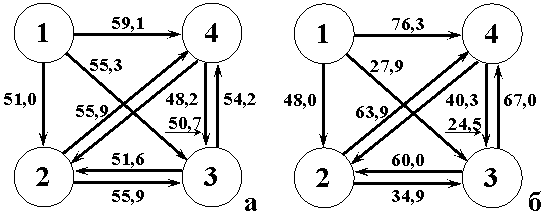
Рис. 1. Ориентированные мультиграфы на множестве мер
включения таксономического состава
фитопланктона рек Барнаулка (а) и Б. Лосиха (б)
разных гидрологических сезонов:
1 – год в целом, 2 – зимняя межень, 3 – половодье, 4 –
летне-осенняя межень.
Входящие ребра вершины 1 не показаны, цифры у ребер –
значения мер включения, %
Примечательно, что в подавляющем большинстве случаев
значения репрезентативности фитопланктона, планктонного комплекса отдельных
эпизодов наблюдений и гидрологических сезонов существенно не различались в каждой
исследованной реке. Меньшая по сравнению с р. Б. Лосихой амплитуда колебаний
репрезентативности отдельных эпизодов наблюдений, также как и количества
одновременно вегетирующих ВРФ, численности клеток, индивидов и биомассы фитопланктона
в течение года в р. Барнаулке, близкие значения репрезентативности разных гидрологических
сезонов могут отражать особенности гидрологического режима последней реки,
связанные с наличием системы проточных в период половодья озер в верхнем ее
течении.

Рис. 2. Ориентированные мультиграфы на множестве мер
включения таксономического состава планктонного комплекса рек Барнаулка (а) и
Б. Лосиха (б) в разные гидрологические сезоны:
усл. обозначения см. на рис. 1
Таблица 2
Репрезентативность
отдельных эпизодов наблюдений в отношении таксономического состава речного планктонного
комплекса разных гидрологических сезонов и за год в целом
|
Сезоны
|
Минимальные и максимальные
значения, %
|
Среднее арифметическое,
%
|
Количество эпизодов
наблюдений
|
|
Р. Барнаулка
|
|
Зимняя межень
|
8,7– 26,7
|
20,5±5,7
|
11
|
|
Половодье
|
7,3 – 38,8
|
24,2±10,3
|
9
|
|
Летне-осенняя межень
|
24,1 – 36,2
|
29,3±4,6
|
8
|
|
В целом за год
|
4,1 – 21,8
|
13,5±4,8
|
28
|
|
Р. Б. Лосиха
|
|
Зимняя межень
|
6,8-32,3
|
18,9±9,0
|
11
|
|
Половодье
|
5,3-51,3
|
29,2±20,6
|
5
|
|
Летне-осенняя межень
|
23,2-48,7
|
36,5±9,1
|
10
|
|
В целом за год
|
1,4-39,5
|
16,7±11,9
|
26
|
Отдельные эпизоды наблюдений на малых равнинных реках
бассейна Верхней Оби могут отражать таксономический состав фитопланктона и
планктонного комплекса разных гидрологических сезонов на 5-52 %, года в
целом – на 1-40 % (табл. 1, 2); отдельные сезоны – год в целом на
27-81 %. Следовательно, оценка таксономического разнообразия
потамофитопланктона за год в целом по результатам немногих эпизодов наблюдений
в течение периода открытой воды или в летне-осеннюю межень может быть
некорректной в разной степени.
Список
литературы
Андреев, В.Л. Классификационные построения в экологии
и систематике / В.Л. Андреев. – М.: Наука, 1980. – 142 с.
Охапкин, А.Г. Структура и сукцессия фитопланктона при
зарегулировании речного стока (на примере р. Волги и ее притоков): Автореф.
дисс. ... д.б.н. / А.Г. Охапкин. – СПб., 1997. – 48 с.
Ресурсы поверхностных вод районов освоения ресурсных и
залежных земель: Вып. 6: Равнины Алтайского края и южной части Новосибирской
области / ред. В.А. Урываев. – Л.: Гидрометеоиздат, 1962. – 978 с.
Скабичевский, А.П. Планктонные диатомовые водоросли
пресных вод СССР. Систематика, экология и распространение / А.П. Скабичевский.
– М.: Изд-во МГУ, 1960. – 352 с.
Фитопланктон малого озера
Юрьевское
(Нижегородская область)
Рябова А. А., Старцева
Н.А.
Phytoplankton
of the small lake
Yuryevskoe
(Nyzhny Novgorod Region)
Ryabova A.A., Startseva N.А.
Нижегородский
государственный университет им. Н.И. Лобачевского,
биологический
факультет, каф. ботаники,
603950,
Нижний Новгород, пр. Гагарина, 23, тел.
(831) 4654027
e-mail: kbot@bio.unn.ru
Фитопланктону
принадлежит основная роль в образовании органического вещества в водных
объектах, и именно развитие фитопланктона в конечном итоге определяет их
биологическую продуктивность и качество воды. Являясь первичным звеном
трофической цепи, фитопланктон наиболее быстро реагирует на изменение условий
среды, а многие водоросли являются хорошими показателями экологического
состояния водоёмов. В левобережной части Нижегородской области находится множество
малых водоёмов, которые в гидробиологическом плане практически не изучены. Их
большая часть активно используется населением в хозяйственных и рекреационных
целях. В данной ситуации качество воды таких озёр становится предметом
тщательного изучения, особенно с точки зрения «цветения» воды синезелеными
водорослями. В связи с этим цель данной работы – оценить видовое богатство и
разнообразие фитопланктона и дать оценку качества воды малого водоёма,
расположенного на территории Семёновского района Нижегородской области.
Озеро Юрьевское расположено в центральной
части Семеновского района, в 22
км на северо-восток от г. Семенова, в долине р.
Керженец. Основные морфометрические характеристики озера Юрьевское отражены в
таблице. На юго-восточном и южном берегах водоёма находится деревня Озеро, на
северо-западном берегу озера расположена турбаза «Заозерье». Северный берег
сохранил участки пойменной дубравы и смешанного леса. Озеро
ледниково-суффозионного происхождения, относиться к группе эрозионных, типу
пойменных (подтипу – пойменно-заливных) озер (Баканина и др., 2001). Оно
проточное: имеет 1 приток – ручей, впадающий в водоём в северо-восточной его
части, и поверхностный сток в северо-западной части, идущий в р. Керженец. В
настоящее время сток из озер перекрыт искусственной дамбой со стороны турбазы
«Заозерье», что является причиной подтопления и заболачивания западного и
северо-западного берегов. Мелководная литораль и сублитораль занимают
значительную часть акватории (40%), и покрыта куртинами погруженной и
полупогруженной водной растительности.
Пробы фитопланктона отбирались с
поверхностного горизонта на двух станциях, установленных в литоральной и
пелагиальной зонах водоёма. Отбор альгологического материала проводился в
период с мая по сентябрь 2007 года с периодичностью раз в месяц, а в летний
сезон – раз в 7-10 дней. Обработку материалов проводили по общепринятой в
альгологии методике.
Таблица
Морфометрические показатели котловины оз.
Юрьевского
|
Характеристики озера
|
Значения
|
|
Длина
озера, м
|
1089
|
|
Объём воды,
м 3
|
2200964
|
|
Площадь
озера, м2
|
831513
|
|
Площадь
озера, га
|
83,15
|
|
Глубина
средняя, м
|
2,6
|
|
Глубина
максимальная, м
|
8,24
|
|
Средняя
ширина, м
|
763,7
|
|
Длина
береговой линии, м
|
2543
|
|
Коэффициент
развития береговой линии
|
0,79
|
|
Развитие
объёма (форма котловины)
|
0,96 (конусовидная)
|
Сводный список водорослей,
обнаруженных в озере Юрьевское, небогат
и насчитывает 82 вида, с учетом внутривидовых таксонов и водорослей,
определенных только до рода – 106. Альгофлора рассматриваемого водного объекта
сформирована водорослями из 6 отделов, 10 классов, 14 порядков и 28 семейств,
принадлежащих к 48 родам, 82 видам. Ведущей группой по видовому богатству являются
представители отдела Chlorophyta, которые составили 51% от всех встреченных
видов. В спектре альгофлоры озера Юрьевское преобладают представители порядка Chlorococcales, из них род Scenedesmus – 17
видов, Monoraphidium – 5 видов, Didymocystis – 4 вида. На втором
месте по видовому богатству находятся диатомовые – 18 %. Наибольшим числом
видов выделяются семейства – Fragilariaceae, Stephanodiscaceae, остальные представлены одним-двумя
видами. Синезеленые водоросли в фитопланктоне озера Юрьевского насчитывают 12
видов из 3 порядков, 6 семейств, 6 родов. Этот отдел в основном представлен
порядками Chroococcales (5 видов), Nostоcales (4 вида), Oscillatoriales
(3 вида). Остальные отделы водорослей значительно уступают перечисленным по видовому богатству.
Таким образом, по совокупности
таксономических показателей альгофлора озера Юрьевского характеризуется как
зелено-диатомово-синезеленая, что типично для водоёмов замедленного водообмена,
расположенных в данной природной зоне. В эколого-географическом плане состав
водорослей озера в основном образован широко распространенными пелагическими и
литоральными видами, обитающими в пресных, нейтрально-слабощелочных водах
β-мезосапробной степени органического загрязнения.
Сезонная динамика биомассы водорослей
представлена многовершинной кривой с резкими подъемами и спадами. В течение
вегетационного периода в исследуемом водном объекте происходило массовое
развитие синезеленых водорослей. Из них Limnothrix redekei (Van Goor) Meffert имел 100 % встречаемость и почти такую же частоту доминирования
(95%) по численности (по биомассе – 82%). Его максимальная численность была
зарегистрирована в конце весны - начале лета и составила более 45 млн кл./л, а
биомасса 2,8 г/м 3 в пелагиали, в литорали его количественные показатели
оказались более чем в 2 раза ниже. Это широко распространенный в Европе
пресноводный вид, индикатор гипертрофного состояния водоемов, вегетирующий в
эпи- и металимнионе в условиях низких температур, дефицита кислорода и низкой
интенсивности света (Водоросли, вызывающие…, 2006). Кроме Limnothrix redekei в составе планктона озера Юрьевского в
качестве доминанта со 100% встречаемостью присутствовал другой вид синезеленых
водорослей – Planktothrix agardhii (Gom.) Anagn. et Kom.,
интенсивное развитие которого
наблюдалось только в середине июля и конце августа. В этот период его численность
достигала 67 % от общей величины. Этот пресноводно-солоноватый вид,
β-мезосапроб обладает широкой экологической амплитудой, и встречается в
водоёмах умеренной и тропической зон. Исследования в Норвегии показали, что,
населяя пруды и мелкие эвтрофные водоемы, Planktothrix agardhii продуцирует гепатотоксин, оказывающий
токсическое действие на мышечные клетки и гепатоциты печени. В водоемах
Северо-Запада России токсигенные штаммы этого вида обнаружены в южной части оз.
Ладожского и в Невской губе Финского залива (Водоросли, вызывающие…, 2006).
В первой декаде июля наблюдалась вспышка
развития Anabaena spiroides Kleb., биомасса которой составляла 39,3 % (0,
25 г/м3) от общей биомассы видов планктона. Это сопутствующий «цветению»
воды вид, о-β-мезосапроб, широко распространенный в планктоне прудов,
озер, водохранилищ. В качестве субдоминантов регистрировались и другие представители Cyanophyta, в особенности Microcystis aeruginosa (Kütz.) Kütz, Anabaena scheremetievii Elenk, а также Oscillatoria limnetica Lemm. В августе Aphanizomenon flos-aquae (L.) Ralfs
занял лидирующее положение в
комплексе доминирующих видов и периоды доминирования
Planktothrix agardhii чередовались с периодами доминирования Aphanizomenon flos-aquae.
Наряду с массовым развитием синезелёных
водорослей в июне заметную роль в сложении численности, а особенно биомассы
фитопланктона играли диатомеи. Среди них в качестве доминантов и субоминантов
присутствовали широко распростаннённые Aulacoseira granulata (Ehrb.) Simons, Fragilaria crotonensis Kitt, а также Melosira varians Agardh. Кроме того, в течение всего вегетационного
периода в планктоне озера Юрьевского присутствовали такие представители динофитовых,
как Ceratium hirundinella (O. F. M.) Schrank и Peridinium cinctum (O. F. M.) Ehr. Из зелёных водорослей наибольшую биомассу (до 0,56 г/м3)
формировал Staurastrum tetracerum Ralfs. Летом состав доминирующих и
сопутствующих видов фитопланктона обогащался также представителями отдела Euglenophyta – Phacus caudatus Hübn, Euglena viridis Ehr., Trachelomonas hispida Delf, создавая от 10 до 48% от общей биомассы
фитопланктона.
Таким образом, в озере Юрьевском на
протяжении весенне-летнего сезона доминирующий комплекс был сформирован в
основном синезелёными водорослями. Летом происходила быстрая смена одних
доминирующих видов данного отдела другими на фоне их высокой численности и
низкой биомассы, обусловленной мелкоклеточностью представителей.
В течение всего весенне-летнего сезона
динамика индексов видового разнообразия характеризовалась несколькими подъёмами
и спадами, сменяющими друг друга. Видовое разнообразие сообщества
фитопланктона, оценённое индексом Шеннона-Уивера, оставалось достаточно
высоким. Его значения, рассчитанные по численности фитопланктона (НN),
изменялись от 0,15 до 3,47, по биомассе (НB) – от 0,47 до 3,84. Наименьшие величины
на обеих станциях приходились на период весеннего доминирования Limnothrix redekei. Максимальные значения индекса по численности
фитопланктона отмечены в середине августа, когда в планктоне присутствовало
несколько доминирующих видов с почти одинаковой численностью. Минимальные
величины НB и НN (средние по водоёму) наблюдались в первой декаде
мая и составили 0,62 и 0,21 соответственно.
Индекс
сапробности за исследованный период изменялся незначительно и находился в пределах
от 1,7 до 2,1. Исключением является значение индекса сапробности по биомассе,
зарегистрированное в середине августа на 2 станции, где в планктоне в качестве
доминанта появился α-мезасапроб Euglena viridis. По
средневегетационным индексам сапробности исследованный водоём оценивается как
умеренно загрязненный с III классом качества воды, а его экологическое состояние характеризуется
как «относительно удовлетворительное». Средние значения биомассы фитопланктона
(чуть более 1 г/м3) характеризуют озеро Юрьевское как
слабомезотрофный водоём. Однако быстрая смена доминирующих видов водорослей из
разных отделов, массовое развитие обладающих токсическим эффектом представителей
синезеленых водорослей, степень «цветения» воды которыми определялась как «слабая»,
могут свидетельствовать о происходящих неблагоприятных изменениях в состоянии
водных масс данного водного объекта.
Список литературы
Баканина Ф.М.,
Воротников В.П., Лукина Е.В., Фридман Б.И. Озёра Нижегородской области. Нижний
Новгород: Издание ВООП, 2001. 165 с.
Водоросли,
вызывающие «цветение» водоёмов Северо-запада России. М.: Товарищество научных
изданий КМК, 2006. 367 с.
Фитобентос
у побережья ботанического заказника "Канака" (Крым, Чёрное море)
Садогурский С.Е., Белич Т.В., Садогурская С.А.
Phytobenthos at the coast of the botanical
preserve "Kanaka" (Crimea,
Black Sea)
Sadogursky S.E., Belich T.V., Sadogurskaya S.A.
Никитский
ботанический сад – Национальный научный центр УААН (НБС-ННЦ)
г. Ялта,
АР Крым, Украина 98648, (0654) 33-55-21
e-mail: ssadogurskij@yandex.ru
Заповедные объекты Южного берега Крыма,
являющиеся ключевыми элементами формирующейся региональной (как части
Национальной) экосети, всегда привлекали внимание гидроботаников. Но если
проанализировать все имеющиеся публикации, посвящённые фитобентосу – важнейшей
составляющей прибрежных экосистем, то становится очевидным, что соответствующие
исследования в этом флористически богатом регионе, до сих пор достаточно
фрагментарны. Типична ситуация, когда территориально-аквальный комплекс признан
приоритетным для сохранения биологического разнообразия или уже получил
заповедный статус, а уровень его биоты не изучен, либо сведения устарели. В
особенности это касается аквальной части таких комплексов. К ним следует
отнести и акваторию, прилегающую к ботаническому заказнику общегосударственного
значения "Канака" (160
га, зап. пост. № 2 СМ УССР от 07.01.1987), который расположен в
границах одноимённого участка (958
га), имеющего I-й уровень приоритетности для сохранения
биологического разнообразия Крыма [1, 3]. Морская акватория до настоящего
времени заповедным статусом не защищена и гидроботанические исследования здесь
не проводились.
Балка Канака (и
одноимённое урочище), имеющая длину 2,6 км, берёт начало на юго-восточных склонах
горного массива Караби-яйла и открывается в Чёрное море в четырёх километрах
северо-восточнее пос. Рыбачье. На относительно труднодоступном западном склоне
балки сохранилась уникальная роща реликтового можжевелово-дубового редколесья с
фисташкой туполистной [4, 7]. Отдельные экземпляры можжевельника высокого имеют
возраст около семисот лет. Сегодня правобережный мелко-горно-балочный склон
долины реки Канака, а также пологие склоны и водораздел горы Янтуру занимает
ботанический заказник "Канака". В устье балки располагается обширная
бухта шириной около 3 км.
Она окаймлена песчано-гравийно-галечным пляжем, который питается твёрдым материалом,
поступающим во время паводков из русла балки. К пляжу спускаются оползневые, размываемые
поверхностным стоком крутые склоны – отроги горных гряд. Суглинки подстилаются
таврической толщей переслаивающихся песчаников и глинистых сланцев. Морское дно
у берега в вершине бухты покрывают валунно-галечные отложения, ближе к мысам их
сменяют валунно-глыбовые отложения, которые местами чередуются со сплошными
выходами песчаника и сланцев в виде крупных плоских плит. Глубже доминируют
грунты, где в различной пропорции представлены валунная и глыбовая фракции.
Материал отбирался в июле 2006 г. по общепринятой
гидроботанической методике [5]. Предварительное визуальное обследование
прибрежной акватории (общая протяжённость побережья в районе ботанического
заказника более 2 км)
показало, что растительный покров достаточно однороден и результаты
исследования вполне репрезентативны для всего указанного участка. В центральной
его части был заложен гидроботанический профиль с шестью станциями (I-VI): одна
в супра- (СПЛ), одна в псевдо- (ПСЛ) и четыре в сублиторали (СБЛ).
Супралиторальная станция I расположена на высоте h»+0,5-0,75 м
н.у.м. и ограничена высотой валунного субстрата, псевдолиторальная станция II –
непосредственно в зоне прибоя: высота н.у.м. – глубина h»±0,25 м. Сублиторальные станции имеют такие параметры: III –
расстояние от берега l»3-5 м
и глубина h»–0,5 м; IV – l»15-20
м и h»–1 м; V – l»60-80 м
и h»–3 м; VI – l»150-200(300) м и h»–5-8 м.
Объект исследования – альгофлора и растительный
покров прибрежной зоны моря. Номенклатура Cyanophyta (супралитораль) и
макроводорослей отделов Chlorophyta, Phaeophyta и Rhodophyta (псевдо-
и сублитораль) дана по [8].
В результате
проведённых исследований в СПЛ на твёрдом субстрате (станция I) зарегистрировано 22 вида и формы Cyanophyta. Наибольшую встречаемость (100%)
имеют Calothrix scopulorum и
Gloecapsa crepidinum,
для других видов значения показателя колеблются в пределах 20-80%. Классы Chroococcophyceae и Hormogoniophyceae
представлены практически поровну: 50 и 46% соответственно. Ведущими семействами
являются Gloeocapsaceae (36%), Oscillatoriaceae и Homoeotrichaceae (по 14%). В ПСЛ и СБЛ (станции II-VI) на всём
спектре обследованных глубин от зоны прибоя до h»-8 м,
l»300 (визуально до h»-15-20
м, l»500-600
м) водорослевая растительность, представленная сообществами
Phaeophyta и Rhodophyta, развивается на твёрдом субстрате. Биомасса
растительности колеблется в пределах 0,5-10,7 кг•м-2, при этом
минимальные значения показателя регистрируются в прибрежной части СБЛ (чуть
более 0,5 кг•м-2), в то время как в ПСЛ они достаточно велики (более
1,6 кг•м-2) (рис. 1) и превышают значения полученные для большинства
участков в пределах Южного берега Крыма (ЮБК). На мелководье (0-0,5 м) сообщества
одноярусные, глубже – двухъярусные. На глубинах до 3 м по биомассе доминируют
Phaeophyta (6-98%), образующие верхний (на мелководье единственный) ярус
сообществ: в ПСЛ и наиболее мелководных участках СБЛ сообщества с доминированием
Dilophus fasciola, глубже – Cystoseira crinita. От 5 м и глубже на фоне
изреживания верхнего яруса (наблюдаемого уже с 3 м глубины) доминирование
переходит к Rhodophyta нижнего яруса, в первую очередь за счёт массового
развития Phyllophora nervosa и Polysiphonia subulifera (от 2-20% на
мелководье, до 65% – на 5 м
и глубже). Биомасса Chlorophyta незначительна на всём спектре глубин (0-8%).
Всего в альгофлоре
обследованного участка зарегистрировано 64 вида макроводорослей: Chlorophyta –
12 видов (19 %), Phaeophyta – 13 (20 %), Rhodophyta – 39 (61 %). В ПСЛ отмечен
31 вид, в СБЛ – 61 вид. Количество видов с ростом глубины увеличивается на всём
спектре глубин в основном за счёт водорослей нижнего яруса, что обусловлено
высокой прозрачностью воды и уменьшением лимитирующего влияния со стороны
доминантов верхнего яруса сообществ. В этом же направлении в общем количестве
видов возрастает доля Chlorophyta (до 21%), а доли Phaeophyta и Rhodophyta не
проявляют определённой тенденции к изменению (до 22 и 74% соотв.). По количеству
видов (62-73%) и биомассе (91-100%) на всём спектре глубин, включая и наиболее
мелководные участки, доминируют олигосапробные водоросли, что наиболее
показательно при анализе биомассы сапробиологических группировок.
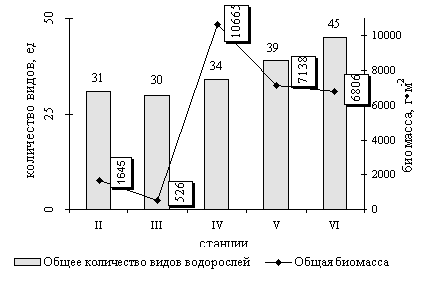
Рис. 1. Изменение количества видов и биомассы макрофитов
в ПСЛ и СБЛ с глубиной
у побережья ботанического заказника "Канака"
Многолетние и коротковегетирующие
водоросли в обследованной акватории по количеству видов представлены примерно
поровну (45 и 56% соотв.), при этом с глубиной доля многолетних видов
возрастает в два раза (от 26 до 53%). В ПСЛ и наиболее мелководной части СБЛ
практически вся биомасса образована коротковегетирующими водорослями (99%), но
глубже картина изменяется на противоположную и доминирование переходит к
многолетним видам (67-99%).
Таким образом,
проведённое исследование показало, что общий характер растительного покрова
обследованной акватории определяется типом субстрата. Особенности
пространственной структуры, качественного и количественного состава сообществ
макрофитобентоса обусловлены степенью эвтрофикации и гидродинамическим
фактором, оказывающим механическое воздействие на растительность. Результаты
настоящего исследования свидетельствуют, что прибрежная акватория Чёрного моря
в районе урочища Канака характеризуется высоким уровнем фиторазнообразия, а значения
биомассы макроводорослей ставят её в ряд наиболее продуктивных участков ЮБК.
Эти обстоятельства, а также соотношение эколого-флористических группировок по
количеству видов и по биомассе свидетельствует, что на сегодня это одна из
наименее эвтрофированных и трансформированных прибрежных акваторий в регионе. В
составе фитобентоса участка отмечены: Laurencia
coronopus – эндемик, Laurencia
hybrida – внесенная в Красную книгу Украины [11], Gloecapsa lithophila и Lyngbya gardnerii – виды новые для территории Украины, а также ряд
таксонов, относящихся к категории редких. Эти обстоятельства, учитывая
относительно низкий для ЮБК уровень рекреационной нагрузки, свидетельствуют о
высокой созологической ценности акватории, а с учётом заповедного статуса и
приоритетности прилегающей суши – всего территориально-аквального комплекса.
Ранее мы указывали,
что наиболее прогрессивной концепцией охраны биологического разнообразия
крупных регионов, характеризующихся, с одной стороны, высоким ландшафтным и
биотопическим разнообразием, с другой – широким спектром форм и интенсивности
антропогенного влияния (от полного заповедания, до масштабного хозяйственного
использования) является создание крупных национальных природных парков [9, 10].
Для Южнобережья этот подход разработан в ряде специальных публикаций [2].
Однако следует добавить, что до настоящего времени морские акватории в составе
заповедных объектов чаще всего играют роль буфера по их периферии (шириной не
более 50-100 м),
либо акватория и прилегающая суша представляют собой два отдельных заповедных
объекта, как правило, низкого ранга и с неясными границами (Ена и др. 1999).
Поэтому считаем, что в перспективе единый территориально-аквальный комплекс,
включающий урочище Канака и прилегающий участок Чёрного моря целесообразно было
бы включить в перечень заповедных ядер национального природного парка. Сегодня
же, учитывая темпы хозяйственного освоения региона, обследованную акваторию
необходимо включить в состав существующего заказника, расширив его границы в
море на расстояние не менее 500-600
м от берега.
Список литературы
1. Выработка
приоритетов: новый подход к сохранению биоразнообразия в Крыму. Результаты программы
"Оценка необходимости сохранения биоразнообразия в Крыму". – Вашингтон:
BSP, 1999. – 257 с.
2. Ена В.Г., Ена Ал.В., Ена Ан.В., Ефимов
С.А., Слепокуров А.С. Научно-прикладные основы создания природного национального
парка "Таврида" и Большой Эколого-этнографической тропы в Крыму. –
Симферополь: Сонат, 2000. – 104 с.
3. Ена В.Г., Ена Ал.В., Ена Ан.В., Новосад
В.В., Поповчук Е.С., Тарасюк Е.Е., Чепурко М.Л. Ныне существующие особо
охраняемые территории // Вопросы развития Крыма. Биологическое и ландшафтное
разнообразие Крыма: проблемы и перспективы. – Симферополь: Сонат, 1999. – Вып.
11. – С. 145-154.
4. Иванов С.П., Кобечинская В.Г., Иванов
С.П., Попов В.Н., Дулицкий А.И., Киселева Г.А. Приоритетная территория 11:
Канака. – Симферополь, 2000. – 21 с.
5. Калугина А.А. Исследование донной
растительности Чёрного моря с применением легководолазной техники // Морские подводные
исследования. – М., 1969. – С. 105-113.
6. Калугина-Гутник А.А. Фитобентос Чёрного
моря. – К.: Наук. думка, 1975. – 248 с.
7. Кобечинская В.Г., Отурина И.П. Роль
заказника "Канака" в сохранении Растительности Крыма // Заповедники
Крыма на рубеже тысячелетий: Мат-лы республиканской конф., 27 апреля 2001 г., Симферополь, Крым.
– Симферополь, 2001. – С. 54-56.
8. Разнообразие водорослей Украины / Под.
ред. С.П. Вассера, П.М. Царенко // Альгология. – 2000. – 10, №4. – 295 c.
9. Садогурский С.Е., Садогурская С.А.,
Белич Т.В. Морской фитобентос у берегов Керченского полуострова: современное
состояние и пути сохранения // Мат-ли ХІІ з’їзду УБТ (Одеса, 15-18 травня 2006 р.) –
Одеса, 2006. – С. 161.
10. Садогурский С.Е., Садогурская С.А., Белич Т.В. О
стратегии охраны территориально-аквальных комплексов Междунар. науч. конф.
"Проблемы биологической океанографии ХХI века", посв. 135 – летию
ИнБЮМ (19-21 сентября 2006 г.,
Севастополь). – Севастополь, 2006. – С. 81.
11. Червона
Книга України. Рослинний світ / Редкол. Ю.Р. Шеляг-Сосонко (відп. ред.) та ін.
– К.: Укр. енциклопедія, 1996. – 608 с.
МНОГОЛЕТНЯЯ ДИНАМИКА
ФИТОПЛАНКТОНА ВОДОЕМА-ОХЛАДИТЕЛЯ
ЛУКОМЛЬСКОЙ ТЭС
Свирид А.А., Самойленко В.М.*, Митрахович П.А.*
Phytoplankton
long-term dynamics in water reservoir-cooler
of the thermal power
station Lukomolskaya
Svirid
A.A., Samoylenko V.M.*, Mitrakhovich P.A.*
БГПУ им. М. Танка, ул.
Советская, 18; 200-69-23
e-mail: sviridanna.61@mail.ru
*Белгосуниверситет, г. Минск, пр. Независимости, 4. тел.209-54-88
Озеро Лукомское –
один из наиболее эксплуатируемых человеком водоемов Беларуси. Почти 40 лет оно
служит водоемом-охладителем электростанции, является крупным рыбохозяйственным
и рекреационным водоемом, на его северо-восточном берегу построен город
энергетиков и т.д. Наиболее сильное отрицательное воздействие на водоем
оказывает садковый комплекс по выращиванию товарного карпа, построенный на
сбросном («теплом») канале ТЭС.
В 1930-е годы до
строительства электростанции озеро характеризовалось как эвтрофное, в отдельные
годы наблюдалось «цветение» воды синезелеными водорослями. Летняя численность
фитопланктона колебалась в пределах 23,5 – 43,2 млн. экз/л, биомасса достигала
10-11 г/м3. Фон сообщества создавали, наряду с синезелеными, планктонные
диатомеи Aulacoseira granulata (Ehr.) Simonsen, Asterionella gracillima (Hantzch.) Heib., Fragilaria crotonensis Kitt. и динофлагеллята
Ceratium hirundinella (O. F. M.) Schrank.
Ожидалось, что повышение
температуры водной массы с введением в эксплуатацию электростанции будет
стимулировать развитие водорослей, особенно теплолюбивых синезеленых. Однако
этого не произошло. За несколько лет до пуска ГРЭС в водоем вселилась
дрейссена, популяция которой достигла максимального развития к середине 1970-х
годов. Благодаря высокой фильтрационной способности дрейссены в течение
нескольких лет в водоеме наблюдался процесс деэвтрофирования. Для этого этапа было
характерно преобладание диатомовых водорослей практически на протяжении всего
вегетационного сезона, их средне-вегетационная биомасса составляла 63 % от
общего показателя. Синезеленые развивались слабо, даже летом их численность
лежала в пределах 0,01-3,21 млн. кл/л, биомасса – 0,02-0,48 г/м3.
Криптофитовые и динофитовые водоросли, имея невысокую численность (0,04-1,36
млн. кл/л), формировали в сумме 17 % всей биомассы. “Цветение” воды в
летнее время в озере не отмечалось. Летняя численность и биомасса фитопланктона
были довольно низкими и колебались от 2,03 до 7,00 млн. кл/л и от 1,44 до 5,35
г/м3 соответственно, за исключением 1979 г., когда в
августе была отмечена вспышка диатомей Asterionella formosa Hass. и Fragilaria crotonensis. По своему трофическому статусу озеро
характеризовалось как мезотрофное.
К началу 1980-х
годов популяция дрейссены прошла этап бурного развития и стабилизировалась на
более низком уровне, что привело к снижению интенсивности фильтрации взвеси и,
соответственно, усилению вегетации водорослей. В это же время был введен в
эксплуатацию садковый комплекс, который явился мощным дополнительным источником
биогенных элементов в экосистеме водоема. Летний максимум все чаще определяли
синезеленые водоросли. Если в 1970-е годы летом они составляли в среднем 21 %
общей численности и 3 % общей биомассы, то в 1980-1990-е годы на их долю
приходилось уже соответственно 89 % и 53 %. Ежегодно в конце июля – августе отмечалось
“цветение” воды, вызываемое представителями этого отдела Microcystis aeruginosa (Kütz.) Elenk., M. pulverea (Wood) Elenk., изредка
– Gloeotrichia echinulata (J. S. Smith) P. Richt.. Рост
количества мелкоклеточных цианей привел к значительному увеличению общей численности,
которая в этот период находилась в пределах 16,50–24,61 млн. кл/л.
Максимального значения (51,75 млн.кл/л) она достигла в 1992 г.
Среднемноголетняя численность сообщества, составлявшая в 1970-е годы
4,9 млн.кл/л, в 1980-е годы возросла в 4 раза. Столь существенного роста общей
биомассы не произошло – она увеличилась лишь в 1,7 раза из-за небольшого
индивидуального веса синезеленых водорослей. Относительная среднемноголетняя
численность диатомей уменьшилась с 59 до 7 %, биомасса – соответственно с
73 % до 31 % .
В последние годы
интенсивность развития фитопланктона продолжает нарастать более высокими
темпами, чем в предыдущие десятилетия. В период летней стагнации 2003-2004
годов были зарегистрированы максимальные численность (87 и 90 млн.кл/л) и
биомасса (34 и 32 г/м3) водорослей, уровень значения которых
соответствует озерам гипертрофного типа. Столь резкое усиление вегетации
водорослей обусловлено рядом причин:
o
резко увеличилась
концентрация фосфора в воде, что связано с интенсивным поступлением его из
внешних источников;
o
существенно снизилась
фильтрационная роль дрейссены, популяция которой в настоящее время находится в
угнетенном состоянии,
o
устанавливались
длительные периоды жаркой штилевой погоды,
o
снижение уровня
воды.
Ситуация, вероятно,
могла быть еще критичнее, если бы продолжало функционировать садковое хозяйство,
обогащающее водоем биогенными веществами. Рост суммарных численности и биомассы
определяли синезеленые и диатомовые водоросли. По сравнению с 1990-ми годами
среднемноголетняя численность и биомасса синезеленых возросли в 1,5 и 1,8 раза,
диатомей – соответственно в 8,5 и 10 раз. Состав доминирующего комплекса стал
значительно варьировать. Максимального развития в августе 2003 г. достигал Microcystis aeruginosa (41 млн.кл/л), в 2004 г. – Aphanizomenon flos-aquae (L.) Ralfs. (36 млн. кл/л), в 2005 г. – Oscillatoria
limnetica Lemm. (16 млн. кл/л). В состав субдоминантов из цианей все чаще входят
осциллятории, что свидетельствует об усилении процессов эвтрофирования экосистемы.
Летний диатомовый комплекс формируют аулакозиры и Fragilaria crotonensis. Максимумы их развития характеризуются более высокими
значениями, достигающими 16,97 млн. кл/л
– Aulacoseira granulata,
9,98 млн.кл/л – Aulacoseira islandica (O.Müll.) Simonsen,
3,5 млн.кл/л – Fragilaria crotonensis. В количестве от 0,2 до 0,4 млн.кл/л стала вновь
обнаруживаться крупная динофлагеллята Ceratium hirundinella. Все
вышеизложенное свидетельствует о значительных нарушениях функционирования
экосистемы.
ОЦЕНКА РОЛИ
ФИТОПЛАНКТОНА В ФОРМИРОВАНИИ ПРОДУКТИВНОСТИ ДОННЫХ ОТЛОЖЕНИЙ В ГОРЬКОВСКОМ
ВОДОХРАНИЛИЩЕ
ПО РАСТИТЕЛЬНЫМ
ПИГМЕНТАМ
Сигарева Л.Е.*,
Тимофеева Н.А.**
Estimation of phytoplankton role in formation of bottom
sediment productivity in the Gorky reservoir using plant pigments
Sigareva L.E.*, Timofeeva N.A.**
Учреждение РАН
Институт биологии внутренних вод им. И.Д. Папанина
152742, п. Борок,
Ярославская обл., Некоузский р-н, тел. 8 (48547) 24110
*e-mail: sigareva@ibiw.yaroslavl.ru,
**e-mail: timof@ibiw.yaroslavl.ru
Гидробиологические исследования растительных пигментов
были начаты с определений хлорофилла как показателя продуктивности водорослей в
морском планктоне. На пресных водоемах наиболее масштабные исследования выполнялись
после выхода в свет монографии Г.Г. Винберга, в которой была предложена шкала
для оценки трофии вод по содержанию хлорофилла в планктоне. С тех пор хлорофилл
а входит в число показателей продуктивности водорослей. Преимущество
хлорофилла по сравнению с другими показателями продуктивности (интенсивность
фотосинтеза, биомасса) состоит в том, что пигменты измеряются инструментально.
В настоящее время для оценки концентрации растительных пигментов применяются
различные методы, среди которых достойное место продолжает занимать
традиционный спектрофотометрический метод. Сравнительная простота, доступность
и экспрессность процедуры спектрофотометрического определения по сравнению со
счетно-объемным методом оценки биомассы водорослей с использованием микроскопа
являются преимуществом при мониторинге продуктивности водоемов. Кроме того, спектрофотометрический
метод используется для калибровки других контактных и дистанционных методов
определения пигментов. Многие аспекты использования растительных пигментов в
изучении продуктивности планктонных водорослей были раскрыты в ряде публикаций,
но вопросы, касающиеся донного яруса
экосистемы, остаются нерешенными.
Донные отложения относятся к наименее изученным
компонентам экосистемы, а определение растительных пигментов в них до сих пор
не входит в число обязательных показателей для мониторинга состояния водоемов.
Все это связано с недостаточной разработкой методологии применения сведений о
растительных пигментах для изучения продуктивности водоемов. Авторами выполнен
ряд исследований, позволивших раскрыть индикаторную роль показателей содержания
растительных пигментов в донных отложениях [4,5]. Ориентировочные расчеты
показали, что между содержанием растительных пигментов в водной толще и донных
отложениях существует положительная связь. Было показано, что среднее для водоема
содержание хлорофилла в объеме воды сопоставимо с содержанием пигментов
(хлорофилл+феопигменты) в среднегодовом слое осадконакопления [3]. Однако
закономерности варьирования этого соотношения в конкретных экологических
условиях изучены недостаточно, что создает трудности в интерпретации соответствующих
данных. В настоящем сообщении дается анализ соотношения между содержанием
хлорофилла в воде и донных отложениях Горьковского водохранилища. В задачу
исследований входила оценка пигментного соотношения в связи с типом донных
отложений по продольному и поперечному профилю водохранилища.
Пробы донных отложений (верхний 5-сантиметровый слой)
отбирали дночерпателем на станциях Горьковского водохранилища с 31 июля по 14
августа 2001 г.
Концентрации хлорофилла и феопигментов определяли спектрофотометрическим
методом и рассчитывали по модифицированным уравнениям Лоренцена, используемым
обычно для фитопланктона. В работе использованы разработанные на верхневолжских
водохранилищах подходы и способы, включая уравнения для расчета концентрации
пигментов в различных единицах, схему расчета содержания пигментов в поверхностном
слое донных отложений толщиной 1
мм, а также оригинальный способ расчета воздушно-сухой
объемной массы грунтов на основе их влажности. Концентрации хлорофилла в воде,
определяемые синхронно с содержанием пигментов в донных отложениях, взяты из
статьи [2].
Концентрация хлорофилла в воде изменялась от 6 до 28
и в среднем составила 14 мкг/л, что
позволяет считать Горьковское водохранилище водоемом эвтрофного типа [2]. Концентрации
хлорофилла в воде на станциях, сгруппированных по типу грунта, достоверно не различаются (табл.).
Таблица
Содержание и соотношение растительных пигментов в
водной толще и донных отложениях
на станциях с разным типом грунта в Горьковском
водохранилище
|
|
Тип грунта на станциях
|
|
Показатель
|
Песок
|
Илистый песок
|
Песчанистый ил
|
Серый ил
|
|
Глубина, м
|
7.1 ± 0.7
|
9.3 ± 2.5
|
8.6 ± 1.3
|
10.0 ± 1.4
|
|
Хл в воде, мкг/л
|
15.0 ± 2.6
|
12.0 ± 2.5
|
13.7 ± 2.2
|
13.1 ± 1.1
|
|
Хл в воде, мг/м2
|
113.6 ± 27.4
|
104.2 ± 6.7
|
105.5 ± 13.5
|
127.2 ± 20.0
|
|
Хл+Ф в ДО, мкг/г сухого осадка
|
0.8 ± 0.4
|
12.5 ± 1.6
|
38.2 ± 6.5
|
106.9 ± 14.4
|
|
Хл+Ф в ДО, мг/м2 в
1 мм
слое сырого грунта
|
1.4 ± 0.7
|
14.8 ± 1.0
|
27.1 ± 3.2
|
30.7 ± 2.2
|
|
Хл+Ф в ДО/Хл в воде , %*
|
1.3 ± 0.7
|
14.3 ± 0.9
|
28.4 ± 5.5
|
28.5 ± 4.6
|
|
Хл в воде/Хл+Ф в ДО*
|
171.9 ± 45.2
|
7.1 ± 0.4
|
4.1 ± 0.5
|
4.1 ± 0.6
|
Примечание: * - отношение пигментов, рассчитанных в мг/м2
Содержание растительных пигментов в донных отложениях существенно варьирует в связи с их типологической
принадлежностью: в расчете на сухой осадок небольшие концентрации характерны для песков, и более значительные – для илов. То же
характерно для распределения осадочных
пигментов по поперечным разрезам и продольному профилю водохранилища. Так, на
основных участках Горьковского водохранилища, выделяемых при районировании,
концентрация пигментов в отложениях составила 6, 47 и 133 мкг/г сухого осадка,
соответственно, на участках выклинивания подпора, переходном и предплотинном.
Соотношение пигментов в воде и грунтах, рассчитанное
как отношение их концентрации во всем столбе воды к таковой в 1-миллиметровом
слое отложений, варьирует сильно. На станциях с песчаными отложениями этот
показатель достигает 373, на участках с илами уменьшается до 2-8.
Следовательно, данные по пигментам подтверждают представление о том, что роль фитопланктона
в формировании продукционных свойств донных
отложений невелика в местах залегания песков и возрастает в зонах,
благоприятных для илонакопления. Среднее содержание пигментов в столбе
воды близко к таковому в среднегодовом
слое илистых отложений, толщина которого в Горьковском водохранилище составляет
4.5 мм
[1].
Таким образом, новые данные полевых наблюдений в
Горьковском водохранилище позволили
установить количественное соответствие между содержанием растительных пигментов
в планктоне и донных отложениях в зависимости от типа грунта, что подтверждает
существование закономерной связи продуктивности фитопланктона, продукционных
свойств донных отложений и условий формирования грунтового комплекса.
Работа выполнена при финансовой поддержке Российского
фонда фундаментальных исследований по проекту 08-04-00384.
Список литературы
1. Законнов В.В. Происхождение и трансформация грунтов
водохранилищ Волги // Природно-ресурсные, экологические и
социально-экономические проблемы окружающей среды в крупных речных бассейнах.
М.; Медия-Пресс, 205. С. 2-94.
2. Минеева Н.М., Литвинов А.С., Степанова И.Э.,
Кочеткова М.Ю. Содержание хлорофилла и факторы его пространственного
распределения в водохранилищах Средней Волги // Биология внутр. вод. 2008, № 1
С. 68-77.
3. Сигарева Л.Е. Растительные пигменты как показатели
состояния пресноводных экосистем (на примере Верхневолжского бассейна) //
Биоиндикация в мониторинге пресноводных экосистем: Сб. матер. Международ. конф.
СПб.: ЛЕМА, 2007. С. 138-142.
4. Сигарева Л.Е. Методология использования
растительных пигментов в изучении пресноводных экосистем // Водные экосистемы:
трофические уровни и проблемы поддержания биоразнообразия. Материалы
Всероссийской конф. с международным участием «Водные и наземные экосистемы:
проблемы и перспективы исследований». Вологда, ООО «Центр оперативной
полиграфии «Коперник», 2008. С. 99-102.
5. Сигарева Л.Е., Тимофеева Н.А. Изучение связи
содержания растительных пигментов в донных отложениях с показателями
трофического состояния Горьковского водохранилища // Водные ресурсы. 2001. № 6.
С. 742-757.
ЭКОЛОГИЯ И
СУКЦЕССИЯ ФИТОПЛАНКТОНА МЕЛКОВОДНЫХ
ВЫСОКОЭВТРОФНЫХ
ОЗЕР ПЛАНКТОТРИХЕТОВОГО ТИПА
(НА ПРИМЕРЕ ОЗ.
НЕРО, ЯРОСЛАВСКАЯ ОБЛАСТЬ, РОССИЯ)
Сиделев С.И.,
Бабаназарова О.В.
Phytoplankton
ecology and succession in a shallow,
highly
eutrophyc, planktotrichetic
lakes
(case
study, the Lake Nero,
the Yaroslavl region, Russia)
Sidelev S.I., Babanazarova O.V.
Ярославский
государственный университет им. П.Г. Демидова,
г.
Ярославль, пр-д Матросова, 9
e-mail: Sidelev@mail.ru
В
30-х годах 20 века Wundsch H. (1940), изучая мелководные полимиктические озера в
районе восточного Бранденбурга (Германия), обнаружил обильное развитие в них
водорослей рода Oscillatoria и предложил для таких
озер термин “сероводородный осцилляториевый тип” озер (H2S-Oscillatoria-type). Подобные
озера характеризовались преобладанием в фитопланктоне нитчатых безгетероцистных
синезеленых водорослей (Oscillatoria agardhii,
Oscillatoria redekei) с весны до осени, прозрачностью по диску Секки
меньше 1 метра
и образованием сероводорода в нижних слоях воды. Данное состояние озер было
связано с их интенсивным антропогенным эвтрофированием. Сzensny R. (1938)
и Schaperclaus W. (1941)
описали последствия такого эвтрофирования как “осцилляториевую болезнь” озер
данного региона. В России Трифонова И.С. (1990) при исследовании основной (олиготрофно-эвтрофной)
сукцессии озерного фитопланктона также выделила
особый тип эвтрофных озер с круглогодичной вегетацией фитопланктона и
преобладанием видов рода Oscillatoria. В западной литературе в настоящее время
“осцилляториевые” озера называются “планктотрихетовыми” в связи с выделением из
рода Oscillatoria нескольких новых родов (Anagnostidis, Komarek, 1988). Reynolds C.
(2002), отмечая своеобразие озер с преобладанием видов Planktothrix agardhii (=Oscillatoria agardhii),
Limnothrix redekei (=Oscillatoria redekei),
Pseudanabaena limnetica (=Oscillatoria limnetica), обозначил комплекс этих доминантов как S1-тип.
Цель
данного сообщения – на основе собственных исследований оз. Неро и литературных
данных синтезировать имеющуюся информацию об особенностях функционирования
фитопланктона в мелководных высокоэвтрофных озерах планктотрихетового типа.
Мелководные
эвтрофно-гипертрофные полимиктические озера очень многочисленны во многих регионах
мира и значительно превышают число глубоководных стратифицированных озер (Dokulil, Teubner, 2003; Padisak, Reynolds, 2003).
Особый интерес к изучению мелководных озер планктотрихетового типа появился у
зарубежных исследователей последние 10-15 лет в связи с их значимостью для
разработки некоторых теоретических проблем лимнологии и
хозяйственно-экономической ролью на определенных территориях (Padisak, Reynolds, 2003).
В тоже время, подобные озера - источник повышенной экологической опасности
из-за токсичности развивающихся водорослей (в частности Planktothrix agardhii). Во многих странах Европы предпринимаются попытки оздоровления
этих озер разными методами (Dokulil, Teubner, 2003).
Практически отсутствуют данные по озерам
планктотрихетового типа в России. В этом отношении оз. Неро можно считать
модельным водоемом для изучения особенностей функционирования фитопланктона
планктотрихетовых озер в переходный период эвтрофно-гипертрофной сукцессии (Babanazarova, Lyashenko, 2007;
Сиделев, Бабаназарова, 2008).
Оз. Неро - типичный мелководный (Нср.=1.6 м) полимиктический водоем с
большими запасами сапропеля на дне. Ежемесячные исследования (март,
апрель-октябрь) фитопланктона и ряда биотических и абиотических показателей
озера проводятся с 1999 года по настоящее время.
Установлено,
что экосистема оз. Неро характеризуется в течение вегетационного периода повышенными
концентрациями биогенных элементов (N и Р),
пониженной прозрачностью воды (SD=0,2-0,4 м), высокими значениями
рН >8-9 и постоянным ветровым перемешиванием. Сравнительный анализ с другими
планктотрихетовыми озерами показал, что это типичные характеристики,
способствующие массовому развитию синезеленых водорослей S1- типа.
Подобные
специфические условия существования, которые могут создаваться в результате
массового развития самих водорослей, определяют своеобразие сезонной динамики,
состава и сукцессии фитопланктона в озерах планктотрихетового типа.
Многолетние
исследования сезонной динамики фитопланктона в оз. Неро свидетельствуют о
высоких количественных показателях развития не только летому, но и поздней осенью. В отдельные годы подъемы в
обилии фитопланктона отмечались также весной и в подледный период. Подобный
флуктуирующий характер сезонной динамики обилия фитопланктона характерен и для
многих европейских озер планктотрихетового типа.
Сравнительный
анализ собственных и литературных данных по составу доминирующих видов водорослей
показал, что большинство таксонов, развивающихся в рассматриваемых озерах, относятся
к типичным индикаторам эвтрофно-гипертрофных условий и высокой сапробности
среды. С точки зрения основной сукцессии фитопланктона озера планктотрихетового
типа, таким образом, нужно рассматривать как фактически одну из последних высокотрофных
устойчивых стадий в “эволюции” озера. Ретроспективный анализ имеющихся данных
по составу фитопланктона оз. Неро за последние 100 лет выявил, что ещё в 60-х
гг. 20 века водоросли S1-типа
отмечались лишь случайно, а, начиная с конца 80-х гг., озеро Неро превратилось
в типичный водоём планктотрихетового типа (Babanazarova, Lyashenko,
2007). При этом, как характерную особенность основной сукцессии фитопланктона
озер этого типа необходимо отметить постепенное замещение видов рр. Microcystis, Anabaena,
Aphanizomenon видами S1-типа. Это
может объясняться как избыточным поступлением азота в процессе эвтрофирования,
так и возрастающим недостатком света, что лимитирует развитие азотфиксирующих
видов. Подобная ситуация описана для
многих европейских озер, в которых в настоящее время доминируют водоросли S1-типа.
Сезонная
сукцессия фитопланктона в озерах планктотрихетового типа изучена недостаточно,
поскольку основное внимание зарубежных исследователей сосредоточено на изучение
особенностей функционирования видов S1-типа.
Так наиболее часто сообщается о фактах подледного цветения воды водорослями S1-типа, что свидетельствует о его круглогодичной вегетации во многих озерах
этого типа. В оз. Неро проведены многолетние исследования зимнего фитопланктона
(2002-2008 гг.). Показано, что наиболее часто встречающимися и обильными подо
льдом видами в одни года были Limnothrix redekei и
Pseudanabaena limnetica, а в другие – доминировали различные миксотрофные
фитофлагеллята (криптофитовые, эвгленовые, золотистые водоросли). Это
свидетельствует об устойчивости данных видов водорослей к экстремальным
условиям подледного периода, однако причины “переключения” на доминирование
фитофлагеллятами до конца не выяснены.
В
весенний период по биомассе в оз. Неро преобладают диатомовые водоросли, однако
в некоторых европейских озерах весенний пик обилия диатомей развит слабо и в
течение всех сезонов доминируют водоросли S1-типа. Наибольшее развитие в этот период приобретают
центрические диатомеи – индикаторы высокоэвтрофных условий (виды р. Stephanodiscus (S. hantzschii) и р. Aulacoseira (A. ambigua, A.
italica)) и, в меньшей степени, пеннатные диатомовые водоросли
(р. Synedra). Многолетние исследования на оз. Неро показали
сходные результаты по видам-доминантам диатомового комплекса весной - за период
1999-2004 гг. преобладали Aulacoseira ambigua и
виды р. Stephanodiscus (S. hantzschii, S. minutulus), а с 2005 года произошла смена доминантов с Aulacoseira ambigua на Synedra acus
(Сиделев, Бабаназарова, 2008). Последний вид отмечается в качестве доминанта
некоторых планктотрихетовых озер (оз. Verevi и
оз. Alte Donau).
Некоторые исследователи считают подобную смену доминантов как характерную для
весеннего фитопланктона при переходе озер из эвтрофного в гипертрофное
состояние (Трифонова, 1990). Возможные причины данной смены доминантов в оз.
Неро обсуждаются, исходя из эколого-физиологических характеристик данных видов
диатомей. Часто весной в качестве субдоминантов в европейских озерах отмечаются
криптофитовые водоросли, в оз. Неро в этот период в течение многих лет большую
роль в сложении биомассы играют эвгленовые водоросли (р. Euglena, Phacus, Trachelomonas) – показатели
повышенного содержания органического вещества.
Основную
роль в сложении биомассы и первичной продукции фитопланктона оз. Неро в летне-осенний
период играют синезеленые нитчатые безгетероцистные виды S1-типа (Limnothrix redekei, Pseudanabaena limnetica,
Planktothrix agardhii). Эти 3 вида отмечаются как наиболее характерные для
данных сезонов в мелководных высокоэвтрофных озерах других регионов мира. Как
известно, им присущи следующие экологические особенности: эвритермность,
миксотрофность, олигофотность за счет присутствия дополнительных пигментов,
толерантность к перемешиванию, стратификации, выеданию зоопланктоном,
повышенная потребность в биогенах. Развитие может лимитироваться высокой
проточностью и низкими концентрациями фосфора и азота. В настоящее время среди
исследователей доминирует гипотеза, согласно которой основная причина
преобладания планктотрихетового комплекса водорослей в мелководных озерах
заключается в устойчивости данных видов к низкой освещённости, которую
водоросли S1-типа создают в процессе своего
массового развития. В результате большинство других видов (хлорококковые, синезеленые
азотфиксирующие водоросли), чувствительных к недостатку света, проигрывают в
конкурентной борьбе за данный ресурс. Появление и развитие S1-типа водорослей в озерах также связывается с
избыточным поступлением в них не только фосфора, но и азота (Трифонова, 1990).
Однако, очевидно, что устойчивость водорослей S1-типа не к отдельным факторам, а к целому комплексу
лимитирующих факторов, характерных для мелководных высокоэвтрофных
полимиктических озер и повышенное содержание биогенных элементов в этих водоемах
даёт им конкурентные преимущества перед другими таксонами.
Таким
образом, специфика условий существования в озерах планктотрихетового типа определяет
своеобразие состава, сукцессии и сезонной динамики обилия фитопланктона.
ОСОБЕННОСТИ ВИДОВОЙ
СТРУКТУРЫ И ПИГМЕНТНЫХ ХАРАКТЕРИСТИК ФИТОПЛАНКТОНА РЕКИ ЛИЖМА
Сластина Ю.Л.*, Комулайнен С.Ф.**
Distinctive features
of phytoplankton structure and pigmental characteristics of the Lizhma River
Slastina Y.L.*, Komulainen
S.F.**
*Институт водных
проблем Севера КарНЦ РАН
185030,
Петрозаводск, пр. А. Невского 50, тел. (8142) 578464
**Институт биологии КарНЦ РАН
185910, Петрозаводск, ул. Пушкинская 11, тел.
(8142) 561679, факс (8142) 769810
e-mail: komsf@mail.ru
Изучение фитопланктона
озерно-речной системы р. Лижма (рис. 1) проводилось в связи с вводом в действие
Кедрозерского рыбоводного завода. Водозабор производится из озера Кедрозера.
Инкубационный и административно-хозяйственный центры расположены на берегу оз. Тарасмозера.
Садки для производителей и выростной участок размещаются в Малой Лижемской губе
Онежского озера.
Исследования на водоемах
системы р. Лижма выполнялись в июле 2008 года, на 9 станциях. Проводился анализ
размерно-видовой структуры фитопланктонных сообществ, а также определялось
содержание хлорофиллов a,
b,
c,
каротиноидов, феофитина.
Пробы воды отбирали с поверхности
пластмассовым ведром. Для определения пигментов фитопланктон концентрировали на
мембранных фильтрах (Владипор №5). Фильтры замораживали и обрабатывали в
течение 1-й недели после отбора материала. Определение пигментов проводили в
смешанном 90% ацетоновом экстракте (SCOR-UNESCO, 1966).
Рис. 1. Карта- схема расположения станций
отбора проб в реке Лижме
Концентрации хлорофиллов а, b, c
рассчитывали по уравнениям, приведенным в руководстве ЮНЕСКО и модифицированным
Джефри и Хамфри (Jeffrey, Humphrey, 1975); концентрации феопигментов рассчитали,
используя уравнение Лоренцена (1967). Для расчета каротиноидов взяли формулы из
работы Парсонса и Стрикленда (1963). Также вычисляли соотношение каротиноидов и
хлорофилла а, выраженное через отношение их концентраций (К/хл а) или
оптических плотностей ацетонового экстракта в соответствующих максимумах
поглощения. На всех станциях в фитопланктоне
доминировали диатомеи, в основном за счет планктонных форм родов Cyclotella, Stephanodiscus, Aulacoseira. В озере Кедрозере и реке Кедра были обильны золотистые – Dinobryon divergens Imhof, причем многие из встреченных отдельных клеток и колоний этого вида
содержали гетероцисты. Зеленые представлены в основном хлорококковыми из родов Scenedesmus, Sphaerocystis,
Planctococccus, десмидиевыми рода Staurastrum, вольвоксовыми (Chlamydomonas,
Pandorina). Из динофитовых встречались Ceratium hirundinella (O.F.M.) Bergh.,
Peridinium cinctum (O.F.W.) Ehr.
Концентрация хлорофилла а по станциям отбора проб изменялась
незначительно, составила от 1,4 до 2,8 мг/м3. Максимум пигмента
содержался в мальковом пруду, там же зафиксирован максимум хлорофилла b (0,67 мг/м3). Распределение хлорофилла а и каротиноидов по станциям наблюдения
имеет согласованные максимумы и минимумы (рис. 2).
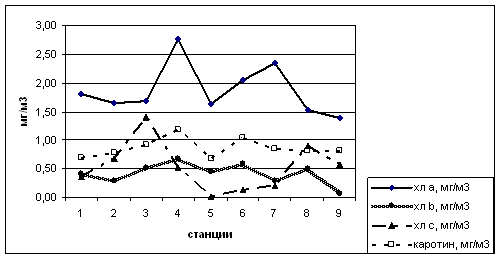
Рис. 2. Распределение основных пигментов фитопланктона
системы р. Лижма в июле 2008
г.
(фотический слой). 1 – исток из Кедрозера; 2 –
середина р. Кедры; 3 – устье р. Кедры;
4 – мальковый пруд; 5 – сток из малькового пруда; 6 –
исток из оз. Тарасмозера;
7 – первый порог р. Лижмы; 8 – плес р. Лижмы; 9 –
малая Лижемская губа Онежского озера
В общем фонде зеленых
пигментов преобладает хлорофилл а,
относительное содержание дополнительных хлорофиллов значительно ниже, что
соответствует составу фитопланктона с преобладанием диатомового планктона.Пигментный
индекс Е430/Е665 (индекс Маргалефа) изменяется в пределах 0,33-3,35. Принятый в
физиологии растений индекс К/Хл (соотношение концентраций каротиноидов и
хлорофилла а) был примерно одинаков
для всех станций, составляя 0,4-0,5, что подтверждает близость видового состава
альгоценозов фитопланктона на различных участках речной системы.
Значения пигментного индекса Е480/664
близки к единице, изменяются в диапазоне 0,99-1,7, показывая, что фитопланктон
функционирует в пределах своей физиологической нормы.
По содержанию хлорофилла а и общего
хлорофилла исследуемые водоемы можно отнести к олиготрофным с малой степенью
мезотрофии согласно шкале, разработанной ОЕСД. В ходе исследования не
обнаружено каких-либо особенностей видового состава, которые бы указывали на
заметное увеличение антропогенной нагрузки на водоемы системы р. Лижма.
Список литературы
Минеева Н.М. Растительные пигменты в воде
волжских водохранилищ, М.: Наука,2004. 156 с.
Сластина Ю.Л., Комулайнен С.Ф. Структура и
видовое разнообразие фитопланктона в р. Лижма //Труды КарНЦ РАН, вып. 12,
Петрозаводск, 2008. с. 146-156.
Jeffrey
S.W., Humphrey G.F. New spectrophotometric equations for determining
chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton
//Biochem. Physiol. Pflanz. 1975. Bd. 167. P. 191-194.
Lorenzen
C.J. Determination of chlorophyll and pheopygments: Spectrophotometric
equations // Limnolog. Okeanogr. 1967. Vol. 12. 䖄 2. P. 343-346.
Parsons
T.R., Strickland J.D.H. Discussion on spectrophotometric determination of
marine-plant pigments with revised equations for ascertaining chlorophylls and
carotenoids // J. Mar. Res. 1963. Vol. 21, N 3. P. 155-168.
SCOR-UNESCO
Working Group # 17. Determination of photosynthetic pigment in sea water // Monographs
on oceanographic methodology. P.: UNESCO,
1966. P. 9-18.
СЕЗОННАЯ ДИНАМИКА СТРУКТУРЫ И УРОВНЯ БИОМАССЫ
ФИТОПЕРИФИТОНА В РАЗНОТИПНЫХ ОЗЕРАХ
Станиславская Е.В.
Seasonal
dynamics of periphyton structure and biomass
in different
types of lakes
Stanislavskaya
E.V.
Институт
озероведения РАН,
Санкт-Петербург,
ул. Севастьянова д. 9, (812)387-80-60, (812)388-73-27
e-mail: stanlen@mail.ru
Многочисленными
исследованиями установлено, что разнообразие
абиотических и биотических факторов в разнотипных водоемах определяют широкий диапазон величин количественного развития фитоперифитона в
них. Показано, что структуру биомассы водорослей перифитона в большинстве
водоемов и водотоков умеренной зоны определяют водоросли 7-8 отделов, но преобладают, как правило,
диатомовые, зеленые и синезеленые водоросли.
В вегетационный сезон 2007 г. было проведено
изучение фитоперифитона 4-х разнотипных озер, расположенных в пределах
Ленинградской области. Наблюдения проводились на мезотрофных с чертами эвтрофии
озерах Красном и Верхнем Суздальском, на эвтрофном оз. Нижнем Суздальском и
макрофитном оз. Свинечном. Озера различались по своим морфологическим,
гидрологическим и гидрохимическим показателям, а также степенью зарастания
высшей водной растительностью. Наблюдения проводили 1-2 раза в месяц с мая-июня
по сентябрь-октябрь. Целью работы было сравнительное изучение сезонной динамики
структуры и уровня биомассы водорослей перифитона в озерах различного
трофического статуса.
Было определено, что
сезонная динамика структуры биомассы различалась во всех озерах (рисунок). Так
в оз. Красном наблюдались весенне-летний и осенний подъемы биомассы, вызываемые
диатомовыми водорослями, развитие зеленых и синезеленых водорослей было
незначительным. В июле отмечалось резкое снижение биомассы водорослей перифитона.
В оз. Верхнем Суздальском структуру биомассы определяли диатомовые, зеленые и
красные водоросли. Наблюдалось отсутствие весеннего пика развития и постепенное
увеличение биомассы к концу вегетационного сезона. В оз. Нижнем Суздальском
также можно было наблюдать 2 подъема биомассы, ее снижение в июне было менее
значительным, чем в оз. Красном. В оз. Свинечном преобладали зеленые водоросли.
Максимальная биомасса перифитона наблюдалась весной, затем она постепенно
снижалась до минимальных величин в конце вегетационного сезона.
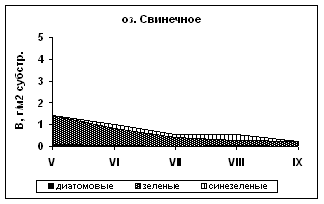
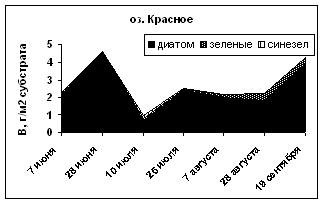
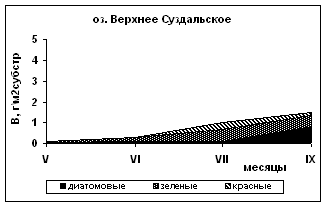
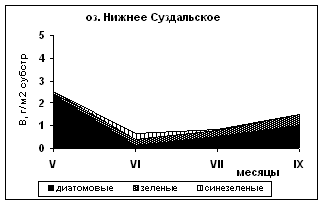
Рисунок. Сезонная динамика структуры и уровня биомассы
водорослей перифитона
в разнотипных озерах в 2007 г.
По уровню биомассы перифитона озера также
различались (таблица). Наиболее высокие количественные показатели развития
перифитона выявлены в мезотрофном оз. Красном. Невысокие величины биомассы в
эвтрофном оз. Н. Суздальском связаны со значительным развитием макрофитов, напротив
слабое развитие зарослей в мезотрофном с чертами эвтрофии оз. Верхнем
Суздальском определяют наиболее низкую биомассу перифитона. Незначительное развитие
перифитона в макрофитном оз. Свинечном вызвано массовым развитием зеленых
нитчатых водорослей.
Таблица
Биомасса (г/м2 субстр.) водорослей перифитона в разнотипных
озерах в 2007 г.
Название
озера
|
Красное
|
Нижнее
Суздальское
|
Верхнее
Суздальское
|
Свинечное
|
|
Биомасса
|
0,96-4,26
2,7
|
0,85-2,55
1,43
|
0,1-1,5
0,73
|
0,3-1,6
0,94
|
над чертой – пределы колебаний.
под чертой – средняя биомасса за период исследования.
Таким образом, разнообразие
условий в озерах различного трофического статуса определяют различия в сезонной
динамике структуры и уровня биомассы водорослей перифитона.
СОСТАВ
МАССОВЫХ ВИДОВ ФИТОПЛАНКТОНА РАЗНОТИПНЫХ
ВОДОЕМОВ
В УСЛОВИЯХ УРБАНИЗИРОВАННОГО И ЗАБОЛОЧЕННОГО ЛАНДШАФТОВ (НИЖЕГОРОДСКАЯ ОБЛАСТЬ)
Старцева Н.А.,
Воденеева Е.Л., Охапкин А.Г.
Composition of
dominant phytoplankton species
of different water
bodies in urban and wetland
territories
(the Nizhni Novgorod Region)
Startseva N.А., Vodeneeva Е.L., Оkhapkin А.G.
Нижегородский
государственный университет им. Н.И. Лобачевского,
биологический
факультет, каф. ботаники,
603950, Нижний
Новгород, пр. Гагарина, 23, тел. (831)
4654027
e-mail: startseva@bio.unn.ru
Состав доминирующих видов и показатели количественного
развития фитопланктона в водоемах разного биолимнологического типа во многом
определяют специфику структуры водных планктонных сообществ, отражают трофический
статус и качество вод (Трифонова, 1990). В период с 1994 по 2002 гг. проведены
исследования фитопланктона малых водоёмов различного происхождения, уровня
загрязнения, трофического и гидрохимического статуса, расположенные на территории
г.Нижнего Новгорода и заповедной зоны ГПБЗ «Керженский» (Нижегородская область).
Изучение альгофлоры водоемов и водотоков Керженского
заповедника и его охранной зоны позволило выявить 947 видов, разновидностей и
форм водорослей из 10 отделов. Флора планктона исследованных водных объектов отличалась
преобладанием зеленых, диатомовых и эвгленовых водорослей с меньшим участием
золотистых и синезеленых. Сводный список водорослей водоемов замедленного
водообмена (озер, прудов, зарегулированных участков малых рек) и малых рек урбанизированной
территории составил 850 видовых и внутривидовых таксонов из 9 отделов характеризовался
таким же соотношением ведущих отделов водорослей.
Массовые виды водорослей в городских водоемах были
представлены 202 видовыми и внутривидовыми таксонами, в водоемах заповедника их
отмечено 181, при этом их доля в альгофлорах исследуемых территорий оказалась
схожей и составила 20-25%. Частая смена доминирующих видов растительного
планктона, установлена для небольших водоёмов, подверженных действию разнонаправленных
факторов среды (Охапкин, Старцева, 2003). Подобный вклад массовых форм водорослей
в формирование общего видового богатства отмечался и в малых реках, а также в верховьях
больших и средних рек бассейна Чебоксарского водохранилища (Охапкин, 1997).
В водоёмах исследуемых территорий в составе доминирующего
комплекса фитопланктона наиболее высокие
значения биомассы регистрировались у
диатомовых, зеленых и динофитовых водорослей. Кроме того, в городских
водоемах заметного количественного развития достигали синезеленые, а в
заповедных – эвгленовые, что связано со
спецификой условий существования водорослей в загрязнённых и эвтрофированных
водных объектах города и гумифицированных
и закисленных водоёмах заповедника.
Среди диатомовых водорослей ведущую роль в организации
планктонных альгоценозов городских водоёмов принадлежит представителям
бесшовных пеннатных диатомей – индикаторам эвтрофных вод – Asterionella formosa Hass., Fragilaria crotonensis Kitt., Synedra ulna
var. ulna (Nitzsch.) Ehr. et var. danica Kütz., S. acus Kütz.. В большинстве
лесных водоемов охраняемой территории круг массовых видов формировался
преимущественно адаптированными к гумозно-ацидным условиям среды обитания
представителями родов Synedra, Meridion, Tabellaria, Eunotia, Achnanthes, Navicula, Pinnularia, Surirella. В отличие от рек и водохранилищ Средней Волги (Охапкин, 1997), вклад
центрических диатомовых водорослей в формирование планктонных альгоценозов
водоемов исследуемых территорий был менее заметным. Так, в городских реках и
озёрах представители родов Stephanodiscus и Cyclotella доминировали
в весенних и осенних альгоценозах в копаных мезотрофных озёрах Светлоярское и
Силикатное и в водоёмах плотинного типа – Верхнем, Среднем и Нижнем Щелоковском.
Однако максимальные значения биомассы представителей этих родов не превышали 1 г/м3. Широко распространённый в эвтрофных водах вид
Aulacosira granulata (Ehr.) Sim. доминировал
в озёрах пойменного типа Лунском и Мещерском. В водоемах заповедника среди
центрических диатомовых водорослей наиболее частым массовым видом (с наибольшей
встречаемостью 80-100% в р. Керженец) фитопланктона являлась Melosira varians Ag. с
максимальными значениями численности и биомассы 0,27 млн кл./л – 2,66 г/м3.
Другие представители центрических диатомовых (виды родов Cyclotella и Stephanodiscus) также встречались, в основном, в водоемах проточного
типа. Их максимальная вегетация была приурочена к концу летнего – началу
осеннего периодов и не превышала 1 г/м3.
В исследованных водных экосистемах зелёные водоросли,
как правило, преобладали по числу клеток, а показатели их биомассы были
низкими. В городских водоёмах самым разнообразным по числу массовых видов среди
зелёных водорослей являлся порядок Chlorococcales. Наиболее высокая встречаемость или биомасса для
представителей этого порядка была зарегистрирована у видов родов Coelastrum, Oocystis и Pediastrum. Так, за три года наблюдений на оз. Силикатном, представляющем собой
водоём искусственного происхождения (затопленный песчаный карьер), Coelastrum reticulatum (Dang.) Senn имел наибольшую встречаемость в пробах (от 83 до
100%), а в июле 1999 г.
его максимальная биомасса достигала 5,67
г/м3. Другой представитель этого рода – C. microporum Näg. был обнаружен во всех исследованных городских
водоёмах и входил в состав доминирующего комплекса в 1-й половине летнего
сезона. Вольвоксовые водоросли встречались в качестве доминантов спорадически: виды
рода Chlamydomonas (биомасса
до 0,33 г/м3), Volvox aureus Ehr. (до 1,91 г/м3), Pandorina morum (O. Müll.) Bory (до 0,79 г/м3)
и Eudorina elegans Bory (до 0,34 г/м3).
Более заметную роль в сложении планктонных фитоценозов эти виды играли в период
максимального прогрева воды в богатых биогенами озёрах – Мещерском, Сормовском
и Среднем Щелоковском. В отдельных водоёмах в качестве структурообразующих
видов регистрировались конъюгаты – зигнемовые (Mougeotia elegantula Wittr.) и
десмидиевые (виды родов Cosmarium,
Staurastrum и Cosmoastrum).
В отличие от городских водоемов, в лесных водных
экосистемах ценотическая роль конъюгат оказалась более заметной. В подавляющем большинстве водоемов и
водотоков были отмечены представители родов Mougeotia и Spirogyra,
представленные в пробах в вегетативном состоянии, что затруднило идентификацию
их видовой принадлежности. Биомасса этих нитчатых водорослей достигала 4.5 г/м3
(в оз. Нижнее Рустайское, 2000
г.). Известно, что виды рода Mougeotia являются
частыми обитателями ацидных светловодных водоемов, что неоднократно
указывалось исследователями (Корнева, 1994; Turner et al., 1995). Круг массовых форм из порядка Desmidiales создавали крупноклеточные представители родов Staurastrum (S.polymorphum Bréb., S.pseudosebaldii Wille) и Closterium
(C.moniliferum (Bory) Ehr., C.lineatum Ehr., C.kuetzingii Bréb.), а
также мелкоклеточные виды, достигавшие высоких значений численности (Cosmarium bioculatum Bréb., Teillingia excavate (Ralfs) Bourr.
Среди вольвоксовых в водоемах заповедника, как и в
городских, наиболее часто в качестве доминирующих и субдоминирующих видов
встречались представители рода Chlamydomonas. Развитие хламидомонад, зарегистрированных практически во всех
исследованных водных объектах, происходило в течение всего вегетационного
периода. Как правило, биомасса видов рода Chlamydomonas не превышала 0.2 г/м3, чаще составляя
0.01–0.05 г/м3, и была ниже таковой в водоемах Средней Волги и
городских озер, подверженных антропогенному воздействию (Охапкин, Старцева,
2003). Роль хламидомонад в сложении планктонных фитоценозов (до 54% от общей
биомассы) становилась более заметной в период низких температур, когда они
образовывали зимне-ранневесенний комплекс с другими вольвоксовыми, а также
криптофитовыми и эвгленовыми водорослями. В р. Керженец среди вольвоксовых в
качестве субдоминанта и доминанта летнего планктона выступала также Pandorina morum (до 0.47 г/м3). В отличие от водоемов городских
территорий зеленые хлорококковые водоросли в водоемах заболоченного ландшафта
редко входили в комплекс доминирующих по биомассе видов. Наибольшее их развитие
отмечалось лишь в нейтральном мезотрофном оз. Нижнее Рустайское, где постоянно
присутствовал в планктоне Tetrastrum triangulare
(Chod.) Kom. с
максимальными значениями обилия 0.52 г/м3. В остальных водных
объектах заповедника «Керженский» хлорококковые водоросли отмечались
спорадически, а их биомасса была низкой (от 0,003 до 0,45 г/м3).
Динофитовые водоросли оказались более приуроченными к
озерным экосистемам независимо от характера их водосбора. Доминантами летних
комплексов чаще выступали Ceratium hirundinella
(O.F. Müll) Duj. (максимальная биомасса – 1,65 г/м3 в
водоемах заповедника и 12,9 г/м3 в городских озерах), Peridinium cinctum Ehr.(от
1,74 до 2,05 г/м3 соответственно), Peridiniopsis quadridens (Stein) Bourr. (от 3,87 до 4,08 г/м3). В озерах
заповедника в весеннем и позднеосеннем планктоне преобладал Peridinium aciculiferum Lemm. (до 1,7
г/м3 в оз. Круглое). Также в качестве доминирующих отмечались виды
рода Gymnodinium и Peridinium umbonatum Stein.,
из которых последний считается наиболее толерантным к низким значениям рН воды
(Lepistö, Rosenstöm, 1998).
В составе доминирующего комплекса планктонных
сообществ городских озёр и некоторых рек часто встречались виды синезелёных
водорослей, тривиальные для водоёмов умеренной зоны: Aphanizomenon flos-aquae (L.) Ralfs, Anabaena scheremetievi P. Richt, Woronichinia naegeliana (Ung.) Elenk., Gomphospaeria lacustris Chod., Anabaena contorta Bachm., A. lemmermanii P. Richt. и Planctothrix agardhii (Gom.) Anagn. et Kom. Aphanizomenon flos-aquae
регистрировался в водоёмах различного уровня трофии (по содержанию общего
фосфора) – от мезотрофного до гипертрофного преимущественно в летний сезон.
Максимальная биомасса этого вида была отмечена для эвтрофно-гипертрофного оз.
Лунского – 36.15 г/м3 при 100% встречаемости. Несмотря на избыток
биогенных веществ в водоёмах города средневегетационная биомасса синезелёных
водорослей была относительно небольшой (от 0,01 до 21 г/м3).
По-видимому, это определяется незначительными морфометрическими
характеристиками водоёмов, частым ветровым перемешиванием водных масс, небольшими
периодами стагнации, и, возможно, сдерживающим влиянием загрязняющих веществ.
В отличие от водоёмов урбанизированных территорий в
водных объектах заповедника синезеленые водоросли как доминанты и субдоминанты
отмечены не были. Вероятно, их развитие здесь лимитировалось особенностями гидрохимического
режима водоемов (низкая минерализация, кислая реакция среды), а в речных
экосистемах также процессами гидродинамики. Отмеченные для некоторых водоемов
(рН>5.7) доминанты были представлены в основном бентосными видами родов Oscillatoria (например, O.limosa, до
0.79 г/м3), Lyngbya и Schizothrix.
Представители эвгленовых водорослей в качестве
массовых форм установлены как в городских, так и лесных водоёмах. Чаще других
как доминирующие виды регистрировались представители рода Trachelomonas, а в водоёмах заповедника также различные Euglena и Phacus.
Таким образом, исследованные водные экосистемы,
расположенные на сравнительно небольших по площади территориях,
характеризовались значительным видовым богатством планктонных растительных
сообществ и почти одинаковым вкладом массовых видов в общий состав их
альгофлор. Возможно, это является характерной чертой небольших по экологической
ёмкости водных объектов, в которых развитие планктонных альгоценозов происходит
под влиянием частой смены факторов среды. Однако состав массовых видов чётко
различался в пределах каждой исследованной территории (коэффициент сходства
Сёренсена для списков доминирующих видов составил 0,29) и отражал специфические
условия формирования альгоценозов, свойственные каждой из них.
Список литературы
Корнева Л.Г. Фитопланктон как показатель ацидных
условий в небольших лесных озерах // Структура и функционирование экосистем
ацидных озер. СПб. 1994. С. 65-98.
Охапкин А.Г. Состав и экология доминирующих видов
фитопланктона водотоков и водоемов бассейна Средней Волги: зеленые, эвгленовые,
криптофитовые, динофитовые, золотистые и синезеленые водоросли // Биол. внутр.
вод. 2001. № 2. С. 70-76.
Охапкин А.Г. Структура и сукцессия фитопланктона при
зарегулировании речного стока (на примере р. Волги и её притоков): Дис….д-ра
биол. наук. СПб. 1997. 280 с.
Охапкин А.Г., Старцева Н.А. Состав и экология массовых
видов фитопланктона малых водоемов городских территорий (диатомовые, зеленые и
синезеленые водоросли) // Бот. журн. 2003. Т. 88. № 9. С. 84-96.
Трифонова И.С. Экология и сукцессия озёрного
фитопланктона. Л., 1990. 184 с.
Lepistö L., Rosenström U. The most typical phytoplankton taxa
in four types of boreal lakes // Hydrobiologia. 1998. V. 369-370. P. 89-97.
Turner M.A.,
Robinson G.G.C., Townsend B.J., Hann J.C., Amaral J.A. Ecological effects of
blooms of filamentous green algae in the littoral zone of an acid lake // Can.
J. Fish. aquat. Sci. 1995. V. 52. P. 2264-2275.
Состав диатомовых водорослей в озерах бассейна
реки Вангыр
(Приполярный Урал)
Стенина А.С.
Diatoms composition in
the lakes of the Vangyr
River basin
(Subpolar Ural)
Stenina A.S.
Институт биологии,
Коми НЦ УрО РАН,
Республика Коми,
г. Сыктывкар, 167982 ул. Коммунистическая, 28
e-mail: stenina@ib.komisc.ru
Водоемы Приполярного Урала остаются слабо изученными в
альгологическом отношении, сведения о составе диатомовых водорослей в них немногочисленны
(Стенина, 2001, 2004; Стенина и др. 2001; Патова, Стенина, 2007; Sterlyagova, Stenina, 2008).
Материалом для исследования диатомовых послужили качественные пробы
фитопланктона, фитоперифитона и фитобентоса, собранные автором в пяти горно-долинных
озерах бассейна реки Вангыр (Атаманские озера). Они расположены на западном
макросклоне Приполярного Урала на территории национального парка «Югыд ва».
Выявлено к настоящему времени 254
таксона диатомовых водорослей, относящихся к 38
родам и 16 семействам. Наиболее разнообразно среди них сем. Naviculaceae, содержащее 87 видов с разновидностями и формами, что
составляет 34% всего состава. Также разнообразны, но с меньшим числом таксонов
семейства Fragilariaceae – 36 (14%), Cymbellaceae – 27 (11%), Achnanthaceae,
Nitzschiaceae – по 21 (8%), Gomphonemataceae – 16 (6%) и Eunotiaceae
– 14 (5.5%), остальные содержат менее 10 таксонов. Среди родов наибольшее число
таксонов приходится на род Navicula,
представленный 47 видами с разновидностями и формами (18.5%). Несколько меньше
таксонов включают роды Fragilaria – 31 (12%), Cymbella – 23 (9%),
Nitzschia – 20 (7.9%), Pinnularia –
19 (7.5%), Achnanthes – 17 (6.7%), Gomphonema – 15 (5.9%), Eunotia – 14 (4%). В остальных – менее 10 таксонов рангом
ниже рода.
Большая часть видового состава (114
таксонов, или 45%) относится к группе донных и литоральных представителей
диатомовых; эпифитов в полтора раза меньше (78, или 31%), а истинные
планктонные виды немногочисленны (14, или 5%). По отношению к содержанию солей
в воде основу состава формируют индифферентные диатомеи (149, или 59%). Среди
индикаторных к этому фактору представителей галофобов несколько больше (51
таксон, или 20%), чем галофилов (44, или 17%). По отношение к активной реакции
водной среды наиболее разнообразны алкалифилы с алкалибионтами (131 таксон, или
51%), которые составляют половину выявленных диатомей. Почти в два раза меньше
число индифферентов (70 таксонов, или 28%), и в 3.5 раза меньше ацидофилов (31,
или 15%).
Биогеографические группы
распределяются по разнообразию следующим образом: космополиты представлены 143
таксонами, что составляет более половины диатомовых (57%), аркто-альпийские –
57 (22%), бореальные – 51 (20%). Часть диатомовых не имеют экологических характеристик
по солености (10 таксонов, или 4%), рН (16, или 6%) и по географическому
распространению (3 таксона). В основном это редкие (по литературным данным) или
ограниченно распространенные виды.
Около 14% выявленных диатомовых
водорослей (35 таксонов) характеризуются 100% частотой встречаемости в обследованных
озерах, где они имеют разное обилие. К ним относятся Stephanodiscus minutulus (Kützing) Cleve
et Möller, Fragilaria construens (Ehrenberg) Grunow
f. construens, F. construens f. venter (Ehrenberg) Hustedt, F. pinnata Ehrenberg,
F. vaucheriae (Kützing) Petersen, Meridion circulare Agardh, Tabellaria flocculosa (Roth) Kützing, Navicula bacillum Ehrenberg,
N. cryptocephala Kützing, N. menisculus Schumann,
N. pupula Kützing, N. radiosa Kützing, Cocconeis placentula Ehrenberg, Achnanthes lanceolata (Brébisson) Grunow, A. laterostrata Hustedt, A. linearis
(W. Smith) Grunow, A. minutissima Kützing, A. peragalli Brun et Heribaud, Eunotia minor (Kützing) Grunow, Cymbella cistula (Ehrenberg) Kirchner, C. gracilis
(Ehrenberg) Kützing, C. microcephala Grunow, C. minuta Hilse, C. sinuata Gregory, Amphora pediculus (Kützing) Grunow, Gomphonema acuminatum Ehrenberg,
G. clavatum Ehrenberg, G. parvulum
(Kützing) Grunow, G. truncatum Ehrenberg,
Epithemia adnata (Kützing) Brébisson, Rhopalodia gibba (Ehrenberg) O. Müller, Nitzschia dissipata (Kützing) Grunow, N. fonticola Grunow, N. frustulum var. perminuta Grunow, N. palea
(Kützing) W. Smith.
Флористическое богатство колеблется
в исследованных водоемах от 72 до 155 таксонов. Сходство озер по составу
диатомовых водорослей большей частью незначительно выше среднего, значение
коэффициента Сёренсена-Чекановского колеблется от 0.52 до 0.61. Сходство
таксономической структуры заключается в преобладании практически во всех
озерах, за исключением одного, семейств Naviculaceae и Fragilariaceae
(1-2 места). В отдельных озерах 3 место в структуре занимают семейства Achnanthaceae, Cymbellaceae и Nitzschiaceae, два водоема
отличаются бедным составом Nitzschiaceae,
а один из них выделяется также более высоким разнообразием сем. Eunotiaceae.
В структуре родового спектра также
прослеживаются как черты сходства по разнообразию родов Navicula и Fragilaria в большинстве озер, так и различия. Они заключаются в
том, что в изолированном заболоченном водоеме на водосборе в большей степени
представлены роды Pinnularia и
Eunotia в
сравнении с остальными озерами.
К группе доминантов (обилие 6
баллов) относятся Achnanthes linearis,
Fragilaria construens f. construens, F. pinnata, Cymbella microcephala
(в трех озерах), A. minutissima, F. construens f. venter (в двух озерах), C. minuta, C. reichardtii
Krammer, Epithemia adnata, Gomphonema acuminatum, Nitzschia amphibia Grunow, Tabellaria
flocculosa (в одном озере). Субдоминантами (обилие 4-5 баллов) являются
A. subatomoides (Hustedt) Lange-Bertalot
et Archibald,
Epithemia adnata var. saxonica (Kützing) Patrick, E.
adnata var. porcellus (Kützing) Patrick, Fragilaria brevistriata Grunow, F. danica (Kützing) Lange-Bertalot, F. pinnata var. lancettula (Schumann) Hustedt, F. vaucheriae, F.
virescens var. oblongella Grunow,
Gomphonema clavatum, Navicula pseudoscutiformis Hustedt, Nitzschia angustata (W. Smith) Grunow, N. fonticola, Rhoicosphenia abbreviata (Agardh) Lange-Bertalot, Stephanodiscus minutulus, Tabellaria fenestrata (Lyngbye) Kützing. Большинство перечисленных таксонов занимают положение
субдоминантов в альгоценозах лишь одного из озер.
В альгофлоре водоемов бассейна р. Вангыр
найдены редкие диатомовые: Achnanthes suchlandtii Hustedt, Eucocconeis ninckei (Guermeur
et Manguin) Lange-Bertalot, Fragilaria bicapitata A. Mayer, Gomphonema acutiusculum
(O. Müller) A. Cleve, G. olivaceum var. fonticola Hustedt, G. pseudotenellum Lange-Bertalot, G. tackei Hustedt, Navicula absoluta Hustedt, N. arvensis var. major Lange-Bertalot, N. digitulus Hustedt, N. interglacialis Hustedt, N. latens Krasske, N. medioconvexa Hustedt, N. schmassmannii Hustedt, N. similis Krasske, Stauroneis kriegerii Patrick, Stenopterobia capitata (Fontell) Lange-Bertalot
et Metzeltin и ряд других.
Список литературы
Патова Е.Н., Стенина А.С.
Водоросли озер в бассейне реки Малый Паток (Приполярный Урал, Россия) //
Озерные экосистемы: биологические процессы, антропогенная трансформация,
качество воды: Тез. III Междунар. науч. конф. (Нарочь, Беларусь, 17–23 сент. 2007 г.). – Нарочь, 2007. – С. 169-170.
Стенина А.С. Диатомовые водоросли Пономаревского озера
(Национальный природный парк «Югыд Ва») // Ботанические исследования на
охраняемых природных территориях Европейского Северо-Востока. – Сыктывкар, 2001. – С. 37-49. – (Тр. Коми науч. центра УрО РАН; № 165).
Стенина
А.С. Диатомовые водоросли в двух уральских притоках реки Печоры // Сибирский
экологический журнал, 2004. – № 6.
– C 849-858.
Стенина А.С., Тетерюк Б.Ю., Патова Е.Н. Растительные
сообщества прибрежных экотонов озера в долине р. Вангыр на Приполярном Урале //
Ботанические исследования на охраняемых природных территориях Европейского
Северо-Востока. – Сыктывкар, 2001. – С.
20-36. – (Тр. Коми науч. центра УрО РАН; № 165).
Sterlyagova Irina
N., Stenina Angelina S. Diatoms as indicators of two mountain streams state in Urals (Russia)
// Abs. of the 20th Intern. Diatom Symp. (Dubrovnik,
7-13 Sept. 2008). – Dubrovnik,
Croatia. – P.
222.
Количественные показатели
развития фитопланктона
в двух разнотипных озерах на
Приполярном Урале
Стерлягова И.Н.,
Патова Е.Н.
Quantitative indicators of phytoplankton
in two different types lakes in the Subpolar Ural
Sterljagova I.N., Patova E.N.
Институт биологии Коми НЦ УрО РАН, г. Сыктывкар
В горных водоемах
фитопланктон обычно слабо развит, что связано с невысоким содержанием
минеральных и органических веществ в воде, суровым термическим режимом,
высокими скоростями течения водотоков, коротким вегетационным сезоном. Среди
разных типов горных водоемов водоросли планктона наиболее хорошо развиваются в
неглубоких, хорошо прогреваемых горно-долинных озерах.
Целью работы было изучение численности фитопланктона в двух разнотипных озерах: ледниковом
(каровом) – Грубепендиты и горно-долинном – Большое Балбанты (Приполярный
Урал).
Количественные показатели
развития фитопланктона различаются как по озерам, так и по разным глубинам в
одном озере. В поверхностном слое (0-50 см) оз. Грубепендиты общая численность
фитопланктона выше по сравнению с придонным слоем. Здесь сообщества
фитопланктона формируют диатомеи, цианопрокариоты, зеленые и золотистые
водоросли. На 20 метровой глубине количество клеток водорослей всех групп
снижается, а золотистых наоборот растет. Присутствие в верхних слоях и увеличение
доли золотистых водорослей в нижних слоях
озера можно объяснить холодолюбивостью водорослей этого отдела, они
формируют зимний фитопланктон равнинных водоемов и являются постоянным
компонентом фитопланктона холодноводных экосистем. Средние значения температуры в момент отбора проб фитопланктона не
превышают 10оС даже в верхнем слое водной толщи.
В оз. Большое Балбанты отбор
водорослей планктона проведен в поверхностном слое (0-50 см) на трех станциях: в
месте впадения реки Балбанъю (ст. 1), середине озера (ст. 2), в точке выхода
реки из озера (ст. 3), а также на глубинах 5 и 10 м в глубоководной части
озера (ст. 2). Количественные показатели фитопланктона поверхностного слоя оз.
Большое Балбанты в 2-3 раза выше таковых оз. Грубепендиты. Сообщества
фитопланктона формируют диатомеи, цианопрокариоты, зеленые и золотистые
водоросли. Численность водорослей фитопланктона поверхностного слоя возрастает
в озере в направлении ст. 3 за счет увеличения доли цианопрокариот и диатомовых
водорослей. В толще воды на глубине около 5-6 м наблюдается максимальное развитие
водорослей фитопланктона за счет резкого увеличения доли цианопрокариот. На
глубине 10 м
численность водорослей существенно
снижается, соотношение отделов, как и в оз. Грубепендиты, изменяется в сторону
золотистых водорослей. На распределение
водорослей фитопланктона в водной толще оз. Большое Балбанты может оказывать
влияние температурный режим, прозрачность воды (до 6 м) и проточность водоема. Гидрохимические показатели воды в
обоих озерах практически не изменялись с глубиной. Измерение суточной динамики
температуры воды на разных глубинах выявило прямую температурную стратификацию,
то есть расслоение водной массы по
температурному режиму с глубиной. В верхнем 0-1 м слое температурный режим в суточном ритме
стабильно более теплый, но при этом численность водорослей невысока, что
связано с проточностью верхнего слоя. На 6 м глубине суточные колебания температуры более заметны, происходит активное
перемешивание воды, что приводит к насыщению воды растворенным
кислородом, суточные колебания
температуры достигают 5 оС.
Хорошая перемешиваемость и прозрачность
воды до глубины 6 м
создают благоприятные условия для развития водорослей, в том числе стимулируют
развитие более теплолюбивых цианопрокариот, а в сочетании со слабой
проточностью приводят к увеличению общей численности водорослей. На глубинах от 9 до 12 м
колебания температуры менее значительны, в отличие от верхних горизонтов вода
холоднее в среднем на 2-6 оС. Стабильно низкие температуры на десятиметровой глубине, снижение
прозрачности приводят к уменьшению общей численности водорослей в планктоне, и
увеличению доли золотистых водорослей как и в оз. Грубепендиты. Стратификация
водоема и активное перемешивание верхнего слоя воды создает благоприятные
условия для развития фитопланктона. Устойчивые низкие температуры на
десятиметровой глубине, также как и в оз. Грубепендиты позволяют объяснить развитие золотистых
водорослей.
ФИТОПЛАНКТОН ВЕТЛАНДА
СОЛОДОВКА (САМАРСКАЯ ОБЛАСТЬ)
Тарасова Н.Г.
Phytoplankton of the
wetland Solodovka (the Samara region)
Tarasova N.G.
Институт экологии
Волжского бассейна РАН
445003 Россия,
Тольятти, Комзина 10, (8482)489205, (8482)489504
e-mail: korolev_dimon@mail.ru
Согласно Рамсарской Конвенции, под ветландами
понимаются районы болот, фенов, торфяных угодий или водоемов – естественных или
искусственных, постоянных или временных, стоячих или проточных, пресных,
солоноватых или соленых, включая морские акватории, глубина которых при отливе
не превышает шести метров. Ветланды поглощают и удерживают дождевой сток и предотвращают
смыв ценных наносов в озера и реки. Они обеспечивают атмосферу влагой, которая
выпадает в виде дождя. Ветданды имеют огромное значение для сохранения биологического
разнообразия.
В Исаклинском районе Самарской области, в правобережной
пойме реки Сургут, в ее среднем течении расположен заболоченный луг с системой
небольших водотоков и их озеровидных расширений, питающихся несколькими
источниками с минерализованной сероводородной водой – водно-болотный комплекс
Солодовка. Вода в источниках и озеровидных расширениях (1, 2 и 4) имеет сильный
запах сероводорода и отличается высокой минерализацией кальций—сульфатного
типа. В третьем расширении сероводород в
воде отсутствует. Глубина водоемов и водотоков ветланда не превышает 0,5 м. Район озеровидных
расширений практически полностью зарос высшими водными растениями: Солодовка-1
и Солодовка-2 - рогозом узколистным (Typha angustifolia L.), Солодовка-3 рогозом узколистным и тростником
обыконовенным (Phragmites australis (Cav.) Trin. ex Steud).
Водно-болотный комплекс Солодовка является памятником
природы областного значения. Вода и грязь в нем были признаны пригодными для
лечебных целей и являются резервными для курорта Сергиевские Минеральные воды.
Изучение фитопланктона ветланда носило эпизодический
характер и проводилось в октябре 2003
г., в мае и июне 2005 г., мае 2007 г. и июле 2008 г. В данной работе
обобщены все полученные данные по развитию фитопланктона в вышеуказанном
районе.
Материал отбирали и обрабатывали по стандартным
гидробиологическим методикам. Помимо изучения водорослей, развивающихся в
пелагической части водоема, изучали их планктонные сообщества, формирующиеся в
зарослях макрофитов. Всего было отобрано и обработано 24 пробы.
В результате проведенных исследований в составе
планктонного сообщества водорослей ветланда Солодовка было зарегистрировано126
таксонов, рангом ниже рода. Они относятся к 7 отделам, 10 классам, 14 порядкам,
27 семействам, 49 родам. В отличие от основной массы пресноводных водоемов, где
набольшим видовым разнообразием отличаются отделы зеленых и диатомовых водорослей, в Солодовке
максимальное число их видовых и внутривидовых таксонов отмечалось в отделе Cyanophyta (Cyanoprokariota),
заключающем в себе 37 % от общего числа видов, разновидностей и форм
водорослей. Затем следовали отделы диатомовых (33 %), зеленых (11 %),
эвгленовых (9 %), криптофитовых (7 %), жетозеленых и золотистых (по 1,5 %)
водорослей.
Наиболее разнообразным оказался фитопланктон
расширения Солодовка-3, в воде которого отсутствует сероводород (табл.).
Наименьшее число видов, разновидностей и форм водорослей было отмечено в
составе фитопланктона расширений Солодовка-1 и Солодовка-2. В расширениях Солодовка-1,
Солодовка-2 и системе водотоков Солодовка-4 самым высоким числом видовых и
внутривидовых таксонов отличались синезеленые водоросли. Причем, в Солодовке-1
и Солодовке-2 водоросли этого отдела составляли соответственно 63-59 % от
общего числа видов, разновидностей и форм водорослей. В Солодовке-4 доля
синезеленых водорослей в формировании общего видового разнообразия несколько
ниже – 38% от общего числа видовых и внутривидовых таксонов, однако и здесь они
наиболее разнообразны. В Солодовке-3 синезеленые водоросли по числу видов,
разновидностей и форм равнозначны отделу диатомовых, и заключают в себе по 40 %
таксонов водорослей, рангом ниже рода. Диатомовые водоросли практически во всех
частях ветланда занимают вторую позицию по числу таксонов водорослей, рангом
ниже рода. Хочется отметить, что в составе этого отдела практически полностью отсутствуют
представители касса Centrophyceae (он представлен
только Aulacoseira granulata (Ehr.) Sim., отмеченным в Солодовке-3). Представители отдела
золотистых водорослей регистрировались только в Солодовке-3.
Таблица
Таксономический состав альгофлоры планктона различных
участков ветланда Солодовка
|
Отдел Район
|
Солодовка-1
|
Солодовка-2
|
Солодовка-3
|
Солодовка-4
|
|
Cyanophyta
|
22
|
23
|
33
|
18
|
|
Chrysophyta
|
0
|
0
|
2
|
0
|
|
Bacillariophyta
|
8
|
5
|
33
|
15
|
|
Xanthophyta
|
0
|
1
|
2
|
1
|
|
Cryptophyta
|
4
|
2
|
5
|
3
|
|
Euglenophyta
|
1
|
2
|
8
|
3
|
|
Chlorophyta
|
0
|
6
|
3
|
7
|
|
Всего
|
35
|
39
|
86
|
47
|
Зеленые водоросли, обеспечивающие разнообразие
альгофлоры планктона основного числа пресноводных водоемов, по числу видов,
разновидностей и форм водорослей, в различных районах Солодовки занимают лишь
3-5 место.
Фитопланктон, формирующийся в отдельных участках
ветланда, отличался достаточно высокой видовой специфичностью: коэффициент
видового сходства Серенсена составлял 30-44%. Наименьшим разнообразием
отличался фитопланктон источников, питающих расширения. Удельное число видов
фитопланктона здесь минимально – 4-5 видов водорослей. В ручьях и источниках,
образующих участок Солодовка-4 высокое видовое разнообразие водорослей
формировалось за счет представителей рода Oscillatoria из
отдела синезеленых, и пеннатных диатомовых водорослей, которые, вероятно
вымываются быстро текущими ручьями из матов, устилающих дно этих источников.
Максимальные показатели численности и биомассы
фитопланктона отмечались в сообществах рогоза расширений Солодовка-1 и
Солодовка-2 в мае 2007 г.
и составляли соответственно 301,65-56,97 млн. кл/л и 10,24-2,17 мг/л. Высокие показатели
биомассы отмечались также в июле 2008
г. в Солодовке-3 (в сообществе рогоза) и ручье Солодовки-4
(8,31-4,75 мг/). В этих случаях решающее значение в ее формировании
принадлежало нитчатым зеленым водорослям рода Spirogyra, клетки которых имеют крупные размеры.
Доминирующий по численности комплекс видов водорослей
ветланда Солодовка за редким исключением практически полностью состоял из
представителей отдела синезеленых (виды родов Oscillatoria, Phormidium, Cyanothece, Microcystis и
др.), не зависимо от биологического сезона. В состав доминирующего по биомассе
комплекса видов, наряду с синезелеными, часто входили водоросли из других
отделов, имеющие более крупные размеры клеток (виды родов Phacus, из отдела эвгленовых; Cryptomonas, из отдела криптофитовых; Spirogyra, из отдела зеленых; Synedra, Cymbella,
Caloneis, Stauroneis, из отдела диатомовых; Tribonema из отдела желтозеленых).
ФИТОПЛАНКТОН И ФИТОПЕРИФИТОН
ПРИБРЕЖНОЙ ЗОНЫ
СЕВЕРО-ЗАПАДНОЙ ЧАСТИ ЧЕРНОГО
МОРЯ (УКРАИНА)
Теренько Л.М.1,
Теренько Г.В.2
Littoral phytoplankton and periphyton
of the Black Sea north-west (Ukraine)
Terenko L.M. 1, Terenko G.V. 2
1Одесский
филиал Института биологии южных морей им. А.О. Ковалевского НАН Украины,
Пушкинская, 37, Одесса 65125, Украина
2Одесский
государственный экологический университет
Львовская, 15, Одесса 65016, Украина
e-mail: galla@paco.net
Фитопланктон и фитоперифитон играют важную роль в
функционировании прибрежных экосистем Черного моря. Многолетние исследования
количественных параметров развития всего фитопланктона, а также отдельно взятых
индикаторных видов микроводорослей показало, что в целом прибрежная зона
Одесского залива в последние годы характеризуется как эвтрофная, однако имеет
устойчивые тенденции к стабилизации и снижению трофности (Теренько, Теренько, 2006).
Работ по изучению видового состава и количественных
показателей обрастаний макрофитов прибрежной зоны достаточно мало (Теренько,
2006, 2007). Данная работа представляет собой продолжение мониторинговых
исследований развития микроводорослей планктона и перифитона в прибрежной зоне,
в частности в районе «Биостанции» (Одесский залив).
В данной работе
проанализированы пробы фитопланктона и фитоперифитона, отобранные с 2006 по 2008
гг. В фитопланктоне отмечено 236 видов и внутривидовых таксонов микроводорослей
из восьми отделов: Bacillariophyta (85), Dinophyta (78), Cryptophyta (8), Chrysophyta (12), Chlorophyta (32), Cyanophyta (18), Raphidophyta (1) и Euglenophyta (2). Преобладали диатомовые (36 %) и динофитовые (33
% общего числа видов) водоросли. Среди диатомовых водорослей наиболее богат
видами род Chaetoceros (32 % общего числа видов), среди динофитовых – род Gymnodinium (22 %) и Protoperidinium (14 %). В фитопланктоне отмечено 14 доминирующих
видов, из них диатомовых – 7, синезеленых – 5, и по одному виду – зеленых и
золотистых микроводорослей. Виды-доминанты имели характерный тип динамики
численности с одним для большинства видов или двумя максимумами (Skeletonema costatum и
S. subsalsum). Степень доминирования видов составляла 20 – 90 % общей
численности фитопланктона.
Отмечено три пика численности
фитопланктона: зимний, весенний и летний. Первый максимум численности (зимний)
в разные годы в зависимости от гидрологических и гидрохимических условий
отмечался как в декабре (2006
г.), так и в январе (2008 г.). Доминирующее
положение в этот период занимали Skeletonema
costatum и S. subsalsum. Максимальное развитие S. costatum наблюдалось в
январе 2008 г.
(3,1 · 106 кл/л), что составило 88,5 % общей численности
фитопланктона и обусловливало монодоминантность фитопланктонного сообщества. В
качестве субдоминантов выступали Thalassiosira
parva (72,1 · 103 кл/л), Chaetoceros rigidus (55,4 ·
103 кл/л) и Leptocylindrus
minimus (44,3 · 103 кл/л). В мае отмечена новая вспышка развития
фитопланктона (весенний пик), в 2007
г. в этот период доминировали синезеленая Anabaenopsis sp. и зеленая Monoraphidium arcuatum, а в 2008 г. – мелкая
колониальная диатомовая Thalassiosira
pseudonana и синезеленая Merismopedia punctata. Новое увеличение
численности фитопланктона (летний пик) прослеживалось за счет «цветения», вызванного
развитием одного или нескольких видов микроводорослей одновременно. Так в
августе 2007 г.
наблюдалось одновременное доминирование T. pseudonana и Nitzschia tenuirostris, а в июне 2008 г. Merismopedia minima. В 2006 г. этот пик был
растянут на весь летний период, когда доминирование одних видов сменялось
другими, так в июне вызывала «цветение» Nitzschia
closterium, в июле – Pseudonitzschia
delicatissima, а в августе – Emiliania
huxleyi.
Фитоперифитон как
отдельная группа в этом районе исследовался впервые. Обнаружено, что
поверхность всех исследованных макрофитов была заселена микроводорослями. В
сообществе водорослей обрастания Одесского залива всего обнаружено 38 таксонов
микроводорослей, относящихся к 25 родам. Установлено, что по числу таксонов доминируют
Bacillariophyta (35) 92 %, на втором месте – Cyanophyta (2) 5 %, на третьем Chlorophyta – (1) 3 %. Из числа диатомовых, лидирующее место занимали
пеннатные – 86 % (19 родов), среди которых наиболее разнообразно были
представлены роды Achnanthes, Bacillaria, Berkeleya, Cocconeis, Diatoma, Grammatophora,
Licmophora, Navicula, Nitzschia, Rhoicosphenia, Tabularia. Центрические диатомовые составляли 14 % и были
представлены родами Actinocyclus, Hyalodiscus и Melosira. Из синезеленых в эпифитоне отмечены Lyngbya lutea и Spirulina laxissima.
Зелёные были представлены лишь одним видом Scenedesmus acuminatus.
Установлено, что на
протяжении всего периода исследований в эпифитоне макрофитов преобладали диатомовые.
По числу видов-обрастателей первенство принадлежало красным водорослям Ceramium elegans и
C. rubrum (n=8), далее следуют зеленые Bryopsis adriatica и
Cladophora vagabunda (n=7), Enteromorpha intestinalis и E.
linza (n=6). Наименьшее число видов отмечено для Chaetomorpha aerea и Ectocarpus arabicus (n=3) и Porphyra leucosticta (n=2). Степень
заселения макрофитов также различна, слабее обрастали виды с пластинчатым типом
таллома – Enteromorpha, Ulva, Porphyra (50
%), обильному обрастанию были подвержены представители цилиндрического типа
таллома Ceramium, Cladophora, Polysiphonia, Ectocarpus (50–100 %), что связано с формой последних, которые имеют
вид объёмного кустика, в результате чего создаётся зона, защищённая от
воздействия перемешивания воды. Следовательно, форма макроводорослей, трофность
исследуемого района, зависимость от глубины и гидродинамических условий, в
которых они произрастают, в значительной мере определяют их роль, как удобного
или неудобного субстрата для формирования эпифитонного сообщества.
Диатомовые эпифитона макрофитов способны формировать
различные эпифитонные комплексы, имеющие характер би- и полиценозов, реже –
моноценозов, при этом, один и тот же вид может выступать как в качестве доминанта
(Д), так и в качестве субдоминанта (С): I – Rhoicosphenia abbreviatа
(Д) + Tabularia fasciculata
(С); II – T. fasciculata (Д) + R. abbreviata
(С); III – T. fasciculata (Д) + Achnanthes brevipes (С);
IV – T. fasciculata (Д) + Licmophora gracilis (Д)
+ R. abbreviatа
(С) + A. brevipes (С); V – Melosira moniliformis
(Д).
Сезонная динамика плотности диатомей фитоперифитона
характеризовалась 3 максимумами. Максимальные количества диатомовых водорослей
в весенние месяцы зафиксированы в апреле 2006 г. (400 тыс. кл/см2), с доминированием T. fasciculata
на макрофите Ectocarpus arabicus и в мае 2007 г. (650 тыс. кл/см2), с доминированием L. gracilis на Сeramium rubrum. Осенний
максимум в сентябре 2006 г.
(300 тыс. кл./см2) формировала
T. fasciculata
на С. rubrum. Наибольший по величине был зимний максимум – декабрь
2006 г.
(700 тыс. кл/см2), который
характеризовался расцветом крупной колониальной бентосной диатомеи M. moniliformis на С. rubrum. Этот вид развивается в заливах в огромных
количествах среди водорослей макрофитов, на камнях и искусственных субстратах и
составляет более 90 % общего количества диатомовых. В среднем с апреля по
декабрь количество диатомей в эпифитоне увеличилось приблизительно в 2 раза.
Был отмечен весомый вклад (в среднем от 12 до 40 %) в эпифитонное сообщество и
других колониальных форм диатомовых A. brevipes, Bacillaria socialis, Berkeleya rutilans, Grammatophora marina, Licmophora ehrenbergii, Parlibellus delognei,
R. abbreviata. Данные виды следует рассматривать как истинных обрастателей,
имеющих специальные приспособления для прикрепления к таллому макрофита
(студенистая ножка у R. abbreviatа
или слизистые трубки, в которые заключены отдельные клетки B. rutilans и P.
delognei). Реже в обрастаниях
были отмечены виды-спутники, ведущие свободный, неприкрепленный образ жизни Cymbella angusta, Gyrosigma prolongatum, Navicula pennata var. pontica, Pleurosigma angulatum, Plagiotropis lepidoptera.
В открытой части «Биостанции» в эпифитоне красной водоросли Polysiphonia sanguinea, встречающейся в обрастаниях мидий, были отмечены
крупные виды диатомовых Actinocyclus
octonarius var. octonarius и Tabularia gaillonii,
которые избегают замкнутые, непромываемые акватории залива, предпочитают
глубины 8–20 м и часто отмечаются в Тендровском, Джарылгачском заливах, у
берегов Крыма и Кавказа.
Таким образом, в ходе комплексных исследований,
проведенных в прибрежной зоне Черного моря, выявлены закономерности протекания
сезонной сукцессии в планктонном и перифитонном сообществе микроводорослей. В сезонном
аспекте в развитии как планктона (зима, весна, лето), так и перифитона (зима,
весна, осень) существуют три пика максимального развития, не всегда совпадающих
во времени, сформированных разными доминантами микроводорослей, и зависящих от
разных гидрологических и гидрохимических показателей водной среды.
Список литературы
Теренько Л.М., Теренько Г.В. Фитопланктон. Прибрежная зона. / Северо-западная часть Черного моря: биология и
экология. Под ред. Ю.П. Зайцева, Б.Г. Александрова, Г.Г. Миничевой – К, Наук.
думка, 2006. – С. 184–190.
Теренько Г.В. Диатомовые водоросли эпифитона северо-западной части
Черного моря // Тез. докл. 12 съезда
Украинского ботанического общества (Одесса,
15 – 18 мая, 2006). – Одесса, 2006. – С.
265-266.
Теренько
Г.В. Роль датомовых в обрастаниях макрофитов прибрежных экосистем Черного моря
/ Мат. 10-й Междунар. науч. конф. диатомологов стран СНГ (Минск, 9-14 сентября,
2007). – Минск, 2007. – С. 150-153.
Диатомовые водоросли в различных
фитоценозах Главного канала Вилейско-Минской
водной системы
Турская С.А.
Diatoms in different
phytocoenoses of the Vileysko-Minskaya aquatic system main
channel
Turskaja S.A.
УО «Белорусский государственный педагогический университет имени
Максима Танка», Республика Беларусь, Минск, 220050, ул. Советская, 18, тел.
(017)2264024
e-mail: turskaya1@rambler.ru
По Главному каналу Вилейско-Минской водной системы осуществляется водообеспечение промышленности и
коммунального хозяйства Минска перебросом воды из Вилии (бассейн Немана) в
Свислочь (бассейн Днепра). Канал имеет протяженность 62,5 км, проходит в сложных
природных условиях, пересекая крупнохолмистые участки, несколько рек и ручьев.
Воды канала имеют главным образом атмосферное питание (за счет дождя и снега).
Вода поднимается по каналу вверх на высоту 71–73 метра [4].
Для изучения таксономического
разнообразия диатомовой флоры в пяти пунктах на протяжении Главного канала были
взяты пробы перифитона, фитопланктона и микрофитобентоса (рисунок 1). Сбор проб
и их обработку проводили по общепринятым в альгологии методикам [3]. В работе использована система диатомовых
водорослей, предложенная Ф. Раундом с соавторами [13]. Учтены таксономические преобразования, приведенные
во многих монографических сводках [5, 7-12]. Кроме того, использованы данные Интегрированной
таксономической информационной системы [6].
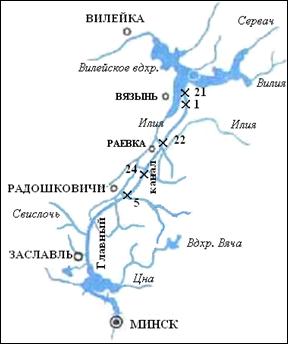
Рис. 1.
Вилейско-Минская водная система (х – пункты сбора проб)
Всего обнаружено
178 видов (203 с учетом внутривидовых таксонов) диатомовых водорослей. Они
принадлежат к 3 классам (Coscinodiscophyceae, Fragilariophyceae, Bacillariophyceae), 13 порядкам, 24 семействам, 50 родам.
Класс Coscinodiscophyceae представлен
12 таксонами диатомовых водорослей рангом ниже рода, что составляет 5,9% от
общего числа таксонов. Они относятся к 4 родам порядка Stephanodiscales (3,9%)
и 1 роду порядка Aulacoseirales (1,8%).
Класс Fragilariophyceae представлен 35 таксонами (17,2%), принадлежащими
к 10 родам одноименного порядка.
Класс Bacillariophyceae играет наиболее значимую роль в формировании
таксономического разнообразия диатомовой флоры: он представлен 156 таксонами
диатомовых водорослей (76,9% от всех встреченных видов, разновидностей и форм),
которые принадлежат к 9 порядкам, 20 семействам, 34 родам. Наибольший вклад
вносит порядок Naviculales, представленный 48 таксонами рангом
ниже рода (23,6%) из 8 семейств. Наиболее богато видами и разновидностями
семейство Naviculaceae (31 таксон, или 15,3%). Существенную роль играет
также порядок Cymbellales, он включает 34 таксона (16,7%) из трех
семейств; доминирующее положение среди них занимают семейства Cymbellaceae
(17 таксонов, или 8,4%) и Gomphonemataceae (16 таксонов, или 7,9%). Порядок
Bacillariales представлен 26 видами и внутривидовыми таксонами
диатомовых водорослей (12,8%) из одноименного семейства.
На уровне родов преобладающими по видовому
разнообразию являются Navicula из семейства Naviculaceae (26
таксонов, или 12,8%), Nitzschia из семейства Bacillariaceae (23
таксонов, или 11,3%), Gomphonema из семейства Gomphonemataceae
(14 таксонов, или 6,9%).
Экологический анализ изученной флоры с
использованием данных экологической картотеки С.С. Бариновой, Л.А. Медведевой,
О.В. Анисимовой [1] показал, что по местообитанию в ней доминируют бентосные виды (83,3%), при этом виды–обрастатели
составляют 37,9%, донные виды 33% от общего числа таксонов. Содержание планктонных
форм – 10,8%. Распределение диатомовых водорослей по шкале галобности позволило
выявить господство олигогалобов. Среди них приоритет имеют индифференты (71,9%
от общего числа видов и разновидностей). Галофилы и галофобы составляют
соответственно 10,3 и 4,9% от общего числа таксонов. Среди индикаторов pH среды ведущими по численности являются алкалифилы
(38,9%). Значительно им уступают виды–индифференты, развивающиеся при кислой и
щелочной реакции среды, и алкалибионты, составляющие соответственно 20,2 и 2,7%
от общего числа таксонов. Доля ацидофилов невелика (1,9%). Основу выявленной
диатомовой флоры Главного канала ВМВС составляют широко распространенные
виды–космополиты (59,1%), содержание бореальных видов достигает 11,3%.
В трех пробах, взятых в пункте № 21,
определены 82 вида и разновидности диатомовых водорослей. К доминантам принадлежат бентосные виды
(76,8%), при этом виды–обрастатели составляют 31,7%, донные виды 39%. Относительно
высокое содержание имеют также планктонные (20,7%). По отношению к
минерализации превалируют виды–индифференты (81,7%), галофилы составляют 12,2%.
По отношению к pH среды преобладают алкалифилы
(50%), значительно им уступают индифферентные виды (18,3%). В составе
фитопланктона обнаружено 20 видов и внутривидовых таксонов диатомовых
водорослей (24,4% от выявленных в данном пункте таксонов), в перифитоне (обрастании
манника большого) – 51 (62,2%), в микрофитобентосе – 64 (78,1%).
Таксономический анализ проб, взятых в
различных биоценозах в пункте № 1, позволил выявить 156 видов и разновидностей
диатомовых водорослей. К доминантам принадлежат бентосные виды (82,1%), при
этом виды–обрастатели составляют 40,4%, донные виды 31,4%. Содержание
планктонных видов 12,8%. По отношению к минерализации превалируют
виды–индифференты (72,4%), галофилы составляют 11,4%. По отношению к pH среды преобладают алкалифилы (55,8%), индифферентные
виды составляют 24,4%. В
фитопланктоне встречено 116 видов и разновидностей диатомовых
водорослей, или 74,4% от общего состава выявленной флоры. В составе перифитона (обрастания камней)
идентифицировано 78 видов и внутривидовых таксонов, или 50% от состава флоры, а
микрофитобентоса – 84 таксона, или 53,9%.
В пробах, взятых на канале в пункте №
22, обнаружено 109 видов, разновидностей и форм диатомовых водорослей. В
фитопланктоне установлен 41 таксон (37,6%), перифитоне 89 (81,7%),
микрофитобентосе 74 (67,9%). По местообитанию большинство идентифицированных
видов относится к бентосным – 83,5% (донные – 31,2% , обрастатели – 43,1%);
планктонные виды составляют 13,8%; по галобности – видам–индифферентам (82,6%),
по отношению к рН – алкалифилам и алкалибионтам (54,2%), по географическому
распространению – космополитам (75,3%).
В пробах фитопланктона и обрастаний
бетона, взятых в пункте № 24, определено 86 видов и разновидностей
диатомовых водорослей. Основу выявленной флоры составляют бентосные виды –
81,4% (донные – 37,2%, обрастатели – 36%); содержание планктонных диатомей
достигает 15,1%. По отношению к минерализации преобладают олигогалобы–индифференты
(75,6%), содержание галофилов не превышает 14%. По отношению к активной реакции
среды приоритет имеют алкалифилы (59,3%), виды–индифференты составляют 23,3%. В
составе фитопланктона обнаружено 47 видов и разновидностей диатомей (54,7%), в
перифитоне (обрастания бетона) – 70 (81,4%).
В составе проб фитопланктона,
перифитона и микрофитобентоса, взятых в пункте № 5, установлен 101 таксон
диатомовых водорослей. Основной фон флоры составляют бентосные виды – 82,2%
(донные – 36,6%, обрастатели – 39,6%), предпочитающие щелочную среду (51,5%) и
индифферентные к солености (79,2%). В составе фитопланктона присутствует 71
таксон (70,3%), в составе перифитона (обрастания камней) идентифицирован 51 вид
и внутривидовой таксон диатомовых водорослей (50,5%), в составе микрофитобентоса определены 76
таксонов рангом ниже рода (75,3%).
На всех пунктах
взятия проб, как и в целом по каналу, наиболее значимую роль в формировании
разнообразия диатомовой флоры играет класс Bacillariophyceae. На уровне родов наибольший
вклад вносят представители родов Navicula, Nitzschia и Gomphonema.
Имеются различия в соотношении видового богатства фитоценозов: в пунктах № 21
(начало канала, Насосная станция первого подъема) и № 5 (в 1 км от г. п. Радошковичи
вверх по течению) гораздо богаче представлен микрофитобентос. В пунктах взятия
проб № 22 (Насосная станция второго подъема) и № 24 (пересечение с рекой
Рыбчанкой) наиболее богат видами перифитон. В пунктах взятия проб № 1 (в 5 км от Насосной станции
первого подъема вверх по течению) и № 5 качественно разнообразен фитопланктон,
поскольку изучался как осадочный, так и сетной планктон.
В исследованных
фитоценозах имеются некоторые различия в составе доминирующих комплексов диатомовых
водорослей. Это обусловлено как гидрохимическими и гидрологическими особенностями
канала (он проходит в сложных природных
условиях), так и отбором проб с разных субстратов
(обрастания камней, бетона, водных растений). При этом в фитопланктоне видовой
состав доминант сходен и включает главным образом алкалифильные виды Aulacoseira granulata (Ehr.) Sim. var. granulata и Diatoma tenuis Ag. По экологическим характеристикам на всех пунктах взятия
фитопланктонных проб приоритет имеют планктонные алкалифильные виды,
индифферентные к солености.
Состав
доминирующих видов перифитона зависит прежде всего от характера субстрата: в обрастании
манника большого типичен Achnanthidium minutissimum Kütz. (Czarn.), камыша
озерного – виды Epithemia, камней и бетона – Staurosirella pinnata (Ehr.) Will. et
Round, Diatoma vulgaris Bory, Navicula radiosa Kütz., Gomphonema clavatum Ehr. и др.
Однако, с точки зрения экологической характеристики таксонов, различий нет
(преобладают бентосные олигогалобные виды, предпочитающие щелочную среду). Лишь
в начале канала высокой численности достигает планктонный вид Aulacoseira granulata (Ehr.) Sim. var. granulata, что может быть связано с влиянием водохранилища.
В микрофитобентосе имеются различия
между доминирующим комплексом диатомовых водорослей на ближайшем к
водохранилищу пункте сбора проб и доминирующими комплексами на остальных
пунктах: в начале канала, наряду с донными, приоритет имеют также планктонные
виды Aulacoseira granulata (Ehr.) Sim. var. granulata и Stephanodiscus hantzschii Grun., в то
время как далее вверх по течению превалируют бентосные Staurosirella, Pseudostaurosira, Planothidium, Navicula и некоторые другие виды.
Различия,
выявленные в составе доминирующих комплексов диатомовых водорослей фитопланктона,
перифитона и микрофитобентоса Главного канала Вилейско-Минской водной системы,
отражают специфику его как водного объекта.
Список литературы
1.
Баринова, С.С., Биоразнообразие водорослей – индикаторов окружающей
среды/ С.С. Баринова, Л.А. Медведева, О.В. Анисимова. – Тель–Авив, 2006. –
498с.
2.
Давыдова, Н.Н.
Диатомовые водоросли – индикаторы природных условий в голоцене/ Н.Н. Давыдова.
– Л.: Наука. Ленингр. отд-ние, 1985. –244 с.
3.
Диатомовые водоросли СССР. Ископаемые и современные. Т.1. – Л.: Наука.
Ленингр. отд-ние, 1974. – 403 с.
4.
Река, текущая в
гору [электронный ресурс]/. – Минск, 2008. – Режим доступа: http://newsvm.com/print/2002/08/27/reka.html – Дата доступа: 03.02.07.
5.
Bukhtiyarova, L. Diatoms of Ukraine Inland waters. –
M. G. Kholodny Institute of Botany, Kyiv. 1999 – 133 p.
6.
Integrated
Taxonomic
Information
System [Electronic resource]/. – 08-Jan-2009. – Mode of access: http://www.itis.gov/index.html. –
Date
of
access:
14.02.2009.
7.
Krammer, K., Lange-Bertalot, H. Bacillariophyceae. 1. Teil: Naviculaceae. – In: ETTL, H., J. Gerloff, H. Heynig & D. Mollenhayer (eds): Süsswasserflora von Mitteleuropa. 2 (1). G. Fischer, Stuttgart
& New York. 1986 – 876 s.
8.
Krammer, K., Lange-Bertalot, H. Bacillariophyceae. 2.
Teil: Bacillariaceae, Epithemiaceae, Surirellaceae. – In: ETTL, H., J. Gerloff,
H. Heynig & D. Mollenhayer (eds): Süsswasserflora von Mitteleuropa. 2 (2). G.
Fischer, Stuttgart & New York. 1988 – 536 s.
9.
Krammer, K., Lange-Bertalot, H. Bacillariophyceae. 3.
Teil: Centrales, Fragilariaceae, Eunotiaceae. – In: ETTL, H., J. Gerloff, H.
Heynig & D. Mollenhayer (eds): Süsswasserflora von Mitteleuropa. 2 (3). G. Fischer,
Stuttgart & Jena. 1991a – 576 s.
10. Krammer, K.,
Lange-Bertalot, H. Bacillariophyceae. 4. Teil: Achnanthaceae. Kritische
Ergänzungen zu Navicula (Lineolatae) and Gomphonema.
Gesamtliteraturverzeichnis. Teil 1-4. – In: ETTL, H., J. Gerloff, H. Heynig
& D. Mollenhayer (eds): Süsswasserflora von Mitteleuropa. 2 (4).
G. Fischer, Stuttgart & Jena. 1991b – 437 s.
11. Lange-Bertalot, H.
Navicula sensu stricto. 10 genera separated from Navicula sensu lato. Frustulia. Diatoms of Europe. 2. A.R.G.
Gantner Verlag K.G. 2001 – 526 p.
12.
Lange-Bertalot, H., Metzeltin, D. Oligotrophie-Indikatoren.
800 taxa repräsentativ für drei diverse Seen-Typen. – Iconogr. Diatomol. 2: 1996. P. 1-390.
13.
Round F.E., Crawford R.M., Mann D.G. The diatoms:
biology and morphology of the genera. – Cambridge: Cambridge University
Press, 1990. – 747 p.
ЭКОЛОГИЧЕСКИЕ
ОСОБЕННОСТИ АЛЬГОЦЕНОЗОВ
РАЗНОТИПНЫХ ОЗЕР
ВОЛЖСКО-КАМСКОГО ЗАПОВЕДНИКА
Унковская Е.Н.1,
Палагушкина О.В.2
Ecological
peculiarities of algae communities in different types of lakes in the
Volzhsko-Kamsky national biosphere reserve
Unkovskaya E.N. 1, Palagushkina O.V. 2
1Волжско-Камский
государственный природный биосферный заповедник
422537, Республика
Татарстан, Зеленодольский район, п/о Раифа, пос. Садовый,
ул. Вехова, дом 1.
Тел.: 8(84371) 3-48-08; факс: 8(84371) 3-47-20
е-mail: l-unka@mail.ru
2Казанский
государственный университет, факультет географии и экологии
420018, г.
Казань, ул. Кремлевская, д.18, тел.:8(843) 2-92-76-72; факс 8(843) 2-92-76-72,
е-mail: opalagushkina@mail.ru
На территории Раифского участка Волжско-Камского
заповедника (Республика Татарстан, Зеленодольский район) находятся 12
разнотипных озер, объединенных в единую гидрологическую систему малыми реками
Сумка и Сер-Булак. Для исследований нами выбраны три модельных озера,
принадлежащих к долинам разных рек, с различными морфометрическими и
гидрологическими характеристиками: оз. Раифское, Линево, Илантово. Самое
крупное из них – оз. Раифское (площадь водного зеркала 0,32 км2,
максимальная глубина 19,1 м,
средняя – 6,2 м,),
карстово-суффузионного происхождения, расположено в месте слияния вышеназванных
рек, проточное, стратифицированное, мезотрофное. Оз. Линево (площадь 0,07 км2,
максимальная глубина 5,2 м,
средняя – 2,0 м),
карстово-суффузионного происхождения, расположено в долине р. Сер-Булак,
проточное, стратифицированное, эвтрофное. Оз. Илантово (площадь 0,05 км2,
максимальная глубина 2,4 м,
средняя – 0,7 м),
суффозионного происхождения, приурочено к долине р.Сумка, бессточное, заболачивающиеся,
хорошо прогреваемое, эвтрофное.
В настоящей работе
анализируются результаты исследований фитопланктона в летние периоды 1995-2005
гг. Отбор проб фитопланктона производился батометром Молчанова по горизонтам
(через 2м) на постоянных станциях, пробы обрабатывались по общепринятым
гидробиологическим методикам. Одновременно выполнялся гидрохимический анализ
воды по ряду химических показателей (содержание растворенного кислорода, рН,
солевой состав, содержание азотных компонентов, фосфора, железа, величины
биохимического и химического потребления кислорода, концентрации АПАВ),
исследования проводились в ЦСИАК Минприроды РТ по аттестованным методикам,
используемых в экоаналитическом контроле поверхностных вод суши. Авторы
выражают благодарность сотрудникам Шагидуллину Р.Р., Тарасову О.Ю.,
Юранец-Лужаевой Р.Ч., Шурминой Н.В. за помощь в анализе проб.
Гидрохимический
режим исследуемых озер был различен. Оз. Раифское в летний период характеризовалось
прозрачностью от 0,60 до 1,63
м и зеленовато-желтым цветом воды. Температурный режим
соответствовал стратифицированным водоемам: поверхностные слои прогревались до
21,2-25,6º С, термоклин отмечался обычно на глубине 6 м (температура 14,5º С)
и у дна температура понижалась до 4,5-5,0º С. Содержание растворенного
кислорода было распределено по глубинам крайне неравномерно: в поверхностных
слоях отмечалось нормальное насыщение или перенасыщение (до 117 %), в придонных
слоях (17 м)
– недостаток О2 (10-47 %). Минерализация воды изменялась от 187,5 до
360,4 мг/дм3. Водородный показатель (рН воды), соответствовал
слабощелочному и находился в пределах 7,5-8,6 ед. рН. Концентрации биогенных
соединений превышали ПДК, в основном, в придонных слоях: содержание ионов аммония
составляло 0,2-1,16 мг/дм3 (2,3 ПДК), нитритов – 0,01-0,190 мг/дм3
(2,4 ПДК), общего железа 0,16-0,6 мг/дм3 (6 ПДК). Величина БПК5
изменялась по годам от 1,4 до 4,3 мгО2/дм3 (2,1 ПДК),
величина ХПК находилась в пределах нормы. Ранговый показатель (по эколого-санитарной классификации
поверхностных вод суши) соответствовал разряду качества «достаточно чистые
воды».
Оз. Линево
характеризовалось прозрачностью от 0,38 до 0,78 м и коричневым цветом
воды. Температурный режим характеризовался прогреванием поверхностных слоев до
21,0-27,2º С, термоклин отмечался обычно на глубине 2-2,5 м и у дна температура
понижалась до 8,7-16,2º С. Содержание растворенного кислорода было
характерно для эвтрофных водоемов: у поверхности отмечалось перенасыщение О2
(до 188 %), у дна – дефицит О2 (10,6-26,6%). При этом концентрация сероводорода
и сульфидов у дна достигала до 0,033 мг/дм3 (6,6 ПДК). Минерализация
воды изменялась от 57,1 до 103,1 мг/дм3. Водородный показатель
изменялся от 6,9 до 9,2 ед. рН. У поверхности воды отмечалось превышение ПДК по
фосфатам (до 6,7 ПДК), фенолам (4,4 ПДК), железу (21,8 ПДК), у дна – по
аммонийному иону (9,6 ПДК), фосфатам (34,4 ПДК), общему железу (120 ПДК),
фенолам (2,8 ПДК). Величина БПК5 изменялась по глубинам и была выше
ПДК в 3,3 раза только у поверхности, при значениях ХПК, в 2,5 раза превышающих
ПДК по всей толще воды, что указывает на загрязнение озера легкоокисляемыми
органическими веществами. Ранговый показатель соответствовал разряду качества
«слабо загрязненные воды».
Оз. Илантово характеризовалось прозрачностью от 0,25
до 0,85 м
и коричневым цветом воды. Температурный режим был характерен для мелководного
озера: поверхностные слои прогревались до 20,1-29,2º С, с глубины 0,5 м отмечалось постепенное
понижение температуры воды до 15-26º С у дна. Содержание кислорода
изменялось по глубинам от 87-119 % насыщения у поверхности до 17-42 % у дна. У
дна отмечалось также присутствие сероводорода и сульфидов, превышающих ПДК в
2,2 раза. Минерализация воды изменялась от 36,3 до 104,6 мг/дм3. рН
воды изменялся от 6,4 до 8,2. Среди биогенных элементов отмечалось в отдельные
годы превышение ПДК по аммонийному азоту (1,3-8,8 ПДК), нитритам (2 ПДК),
фенолам (6,4-7,0 ПДК) и общему железу (4,8-21,6 ПДК). Величина БПК5
составила в среднем 3,9-25,5 мгО2/дм3 (1,8-12,3 ПДК), ХПК
изменялся от 47 до 99,6 мг О2/дм3 (3,3 ПДК). Ранговый показатель
изменялся от разряда качества «достаточно чистые воды» до «слабо загрязненные
воды».
В фитопланктоне исследуемых озер наибольшее
таксономическое разнообразие водорослей выявлено для проточных озер – Раифское
(285) и Линево (209), наименьшее – для заболачивающегося Илантово (199). По
таксономическим показателям планктонная альгофлора проточных, стратифицированных
водоемов систем рек Сумка и Сер-Булак (оз. Раифское, Линево,) характеризовалась
как зелено-диатомово-эвгленовая, при этом зеленые водоросли составляли
35,6-45,6 % от общего числа видов, а диатомовые и эвгленовые водоросли имели
близкое долевое соотношении в исследуемых озерах, составляя от 11,2 до 21,6% от
общего списка видов. Своеобразный комплекс, состоящий из зеленых, золотистых и
эвгленовых водорослей, сформировался в заболачивающемся оз. Илантово.
Летняя биомасса фитопланктона оз. Раифское за
исследуемый период изменялась от 4,4 до 46,08 г/м3 и формировалась, в основном,
диатомовыми, эвгленовыми, зелеными и, реже сине-зелеными водорослями.
Характерно увеличение биомассы с июня (1,3 г/м3) до максимальных величин
в середине июля, составляющее в разные годы от 1,6 до 5,7 г/м3, и
постепенное снижение к августу (0,82 г/м3). Максимальные значения
биомассы в отдельные годы формировались зелеными хлорококковыми водорослями с
доминированием Coelastrum microporum, Scenedesmus bijugatus, Oocystis
lacustris, зелеными вольвоксовыми – с преобладанием Phacotus coccifer,
диатомовыми Synedra ulna, Stephanodiscus hantzscii, эвгленовыми Trachelonomas
planctonica, T. volvocina, сине-зелеными Anabaena flos-aque. В
2000-2003 гг. до 33 % от общей биомассы составляли динофитовые (Peridinium
sp.) и золотистые (Mallomonas acaroides) водоросли.
Летняя биомасса планктонных водорослей оз. Линево изменялась
от 4,5 до 20,4 г/м3 и формировалась за счет различных
отделов. В 1995 г. биомассу формировали
эвгленовые, диатомовые, зеленые водоросли, а в период с 1996 по 1999 гг. -
сине-зеленые (до 95 % от общей биомассы). С 2000 г. стали доминировать
эвгленовые водоросли, составляющие от 31 до 81% от общей биомассы (до
13,88 г/м3), с доминированием Tr. volvocina (до 1,13 г/м3).
Летняя биомасса фитопланктона оз. Илантово изменялась
от 0,16 г/м3 до 20,18 г/м3 и формировалась, чаще всего за
счет водорослей двух отделов: золотистых (10- 77 %) и динофитовых (23-88% от
общей биомассы).
Известно, что структурные особенности фитопланктона
тесно связаны с гидрологическим, гидрохимическим режимами и морфометрическими
показателями озер. Так как исследуемые озера отличаются друг от друга по вышеназванным
показателям, то для каждого водоема выявлены характерные абиотические факторы,
оказывающих влияние на развитие фитопланктона. Факторный анализ, основанный на
коэффициенте корреляции Спирмана с использованием физико-химических показателей,
показал следующие зависимости. Так, в стратифицированном оз. Раифское определяющим
фактором для формирования летней биомассы водорослей четырех отделов является
температура воды: отмечена положительная корреляция температуры воды с биомассой
сине-зеленых (r=0,76), желто-зеленых (r=0,82), эвгленовых (r=0,70) и зеленых
(r=0,64) водорослей. Содержание растворенного кислорода также является значимым
фактором для ряда отделов, что подтверждается его положительной корреляцией с
биомассой сине-зеленых (r=0,78), золотистых (r=0,65), эвгленовых (r=0,64) и
зеленых (r=0,77) водорослей, а также биомассы в целом (r=0,67). Показатель БПК5
является определяющим фактором для биомассы сине-зеленых (r=0,67), для этого же
отдела отмечена положительная корреляция с величиной рангового показателя,
общей биомассой водорослей и биомассой желто-зеленых водорослей. Содержание
сульфидов и сероводорода находится в положительной связи с биомассой
желто-зеленых (r=0,85). Значительную роль в развитии водорослей играют биогенные
элементы. Для оз. Раифское выявлены следующие зависимости: концентрация азота
нитратного положительно коррелирует с биомассой криптофитовых (r=0,9),
эвгленовых и зеленых (r=0,74) водорослей и отрицательно – с биомассой
динофитовых (r = - 0,71). Концентрация азота нитритного отрицательно коррелирует
с биомассой динофитовых водорослей (r= -0,86), а концентрация минерального
фосфора – с биомассой желто-зеленых водорослей (r=-0,86). Получены также и
другие отрицательные корреляции. Так, содержание в воде кальция оказывает
отрицательное влияние на биомассу криптофитовых (r=-0,89), сульфатов – на
биомассу золотистых (r=-0,8) и зеленых (r=-0,75), величина общей минерализации
воды –на биомассу золотистых (r=-0,69) водорослей.
Выявлено влияние некоторых абиотических факторов на
доминирующие виды. Так, динофитовая Peridinium cinctum негативно
реагирует на содержание в воде сероводорода и сульфидов (r=-0,76), Phacotus
coccifer лучше развивается в воде с высокими концентрациями О2
(r=0,66), а Trachelomonas volvocina предпочитает низкие температуры воды
(r=-0,81).
Факторный анализ определил взаимную связь величины
биомассы сине-зеленых и желто-зеленых (r=0,7), криптофитовых и золотистых
(r=0,9), зеленых и золотистых (r=0,76), зеленых и эвгленовых (r=0,77) и общей
биомассы с сине-зелеными, золотистыми, эвгленовыми и зелеными (r=0,64-0,81)
водорослями. Отмечены положительные корреляции биомасс Fragilaria
crotonensis и Peridinium cinctum (r=0,74), Anabaena flos-aquae
и Phacotus coccifer (r=0,74); Peridinium sp. и Synedra
ulna (r=0,64).
Для оз. Линево была отмечена положительная корреляция
содержания взвешенных веществ с биомассой зеленых, золотистых, динофитовых
(r=0,65-0,77). Величина ХПК положительно связана с развитием золотистых и
эвгленовых водорослей (r=0,80-0,61), а БПК5 – с биомассой
динофитовых и диатомовых (r=0,74-0,85). Значение общей жесткости и концентрация кальция положительно коррелируют
с биомассой эвгленовых (r=0,72), в частности, с биомассой Trachelomonas
volvocina (r=0,76). Также положительная корреляция концентрации кальция
отмечалась и с биомассой золотистых водорослей (r=0,65). Биомасса золотистых
водорослей находится в отрицательной зависимости от значения рН (r=-0,71), эта
же тенденция отмечается и для биомассы Trachelomonas volvocina (r=-0,63).Биомасса
сине-зеленых, в частности водоросли Microcystis aeruginosа, находится в
отрицательной зависимости от концентрации ионов кальция и гидрокарбонатов
(r=-0,67). Биомасса желто-зеленых отрицательно коррелирует с сульфатами
(r=-0,67), диатомовых – с хлоридами (r=-0,73). В межвидовых отношениях отмечена
положительная корреляция между биомассами Microcystis aeruginosa и Synedra
ulna (r=0,74).
В оз. Илантово определяющим фактором для развития
динофитовых и желто-зеленых водорослей является прозрачность воды
(r=0,69-0,74). На биомассу золотистых и эвгленовых водорослей оказывает
положительное влияние концентрация железа (r=0,61 и 0,76 соответственно), на
биомассу сине-зеленых и зеленых водорослей – азот аммонийный (r=0,72 и 0,65), а
фосфор минеральный – на биомассу динофитовых (r=0,67), золотистых (r=0,72),
диатомовых (r=0,72). Соотношение азота и фосфора отрицательно коррелирует с
биомассой динофитовых (r=-0,72). Общая жесткость и магний оказывают
положительное влияние на биомассу криптофитовых (r=0,64—0,67), сульфаты – на биомассу
диатомовых (r=0,68), хлориды – на биомассу сине-зеленых (r=0,61).
Взаимное влияние водорослей отмечается и в данном озере: биомасса сине-зеленых
положительно коррелирует с биомассой зеленых (r=0,9), динофитовых с эвгленовыми
(r=0,67). Биомасса доминирующих видов может положительно коррелировать между
собой, как в случае с Trachelomonas volvocina, имеющей положительную
корреляцию с Peridinium sp.
(r=0,69) и Navicula cuspidata (r=0,64). Получены дополнительные
сведения об экологии отдельных видов: так отмечено, что Gymnodinium sp.
и Trachelomonas similis положительно
реагируют на окисляемость воды (r=0,74); Ceratium hirundinella – на
фосфор минеральный (r=0,68) и железо общее (r=0,65), Peridinium sp.
– на фосфор минеральный (r=0,76), сульфаты (r=0,70), хлориды (r=0,64).
Таким образом, гидрологические, гидрохимические и
морфометрические особенности озер, их трофическихй статус определяют развитие различных
отделов водорослей. В проточном и глубоком оз. Раифском выявлена зависимость биомассы водорослей от
температуры воды и содержания кислорода; в проточном, но мелководном и эвтрофном
оз. Линево – от содержания органического вещества (БПК5 и ХПК), в
мелководном заболачивающемся оз. Илантово – от прозрачности и концентрации
биогенных веществ (азота аммонийного, фосфора минерального и железа общего).
ОСОБЕННОСТИ
СТРУКТУРНОЙ ОРГАНИЗАЦИИ ФИТОПЛАНКТОНА
прибрежных мелководий Волжского
и Волжско-Камского плесов Куйбышевского водохранилища
Халиуллина Л.Ю.
Features of structural organization of
littoral phytoplankton in the Volzhskiy
and the Volzhsko-Kamskiy reservoirs
Khaliullina L.Y.
Казанский государственный университет
420008, Казань, ул. Кремлевская, 18
e-mail: liliya-kh@yandex.ru
Для выяснения особенностей формирования структуры
фитопланктона в различных биотопах мелководий Куйбышевского водохранилища
последний изучали в зарослях рогоза узколистного – Typha angustifolia
L., тростника обыкновенного – Phragmites australis (Cav.) Trin. еx Steud.
и на участках открытой воды (без зарослей). Исследования проводили в 2002–2005
гг. в двух мелководных заливах Волжского (участок 1) и Волжско-Камского
(участок 2) плесов Куйбышевского водохранилища, различающихся между собой по
степени антропогенного воздействия, защищенностью от ветрового и волнового
воздействия и другим условиям.
Участок 1, который расположен в н.п. Победилово (южная
часть г. Казани), отличается замедленным
течением и защищенными берегами, а также испытывает на себе влияние
сточных вод очистных сооружений г. Казани и садово-дачных участков. Участок 2
расположен около н.п. Татарские Саралы (Лаишевский р-н) и относится к Саралинскому
участку Волжско-Камского государственного природного биосферного заповедника
(ВКГПБЗ), где наряду с сезонными колебаниями уровня воды существенно влияние
транзитных потоков водных масс, характерных в целом для данной акватории
водохранилища. Этот участок со слабо изрезанной береговой линией и интенсивной
динамикой водных масс расположен в зоне активной ветровой деятельности.
За период наблюдений
в фитопланктоне исследованных участков было обнаружено 336 таксонов, в том
числе 323 вида водорослей, относящихся к 8 отделам. Наибольшее количество таксонов рангом порядок выявлено
в отделах зеленых и диатомовых водорослей. По видовому разнообразию преобладают
диатомовые (26.2%) и хлорококковые (36.8%), водоросли. Другие группы менее
разнообразны: синезеленые – 12.1%, эвгленовые -7.8%, золотистые – 6.9%,
желтозеленые – 4.4%, динофитовые – 3.7% и криптофитовые – 2.2%.
Наиболее высокое видовое разнообразие характерно для родов синезеленых
водорослей Oscillatoria, Merismopedia, Anabaena, криптофитовых Cryptomonas, диатомовых Navicula, Stephanodiscus, Pinnularia, Aulacosira, Nitzschia, Diatoma, динофитовых Peridinium, эвгленовых
Trachelomonas, Euglena, Phacus и зеленых Chlamydomonas, Tetraedron, Scenedesmus, Водоросли исследованных мелководий
представлены несколькими экологическими группами, которые различаются по
видовому составу, условиям произрастания, динамике развития и т. д. и включают
в себя водорослей фитопланктона, эпипелона, эпифитона и свободно плавающие нити
или скопления нитчатых водорослей.
В задачу данных исследований входило, главным образом, изучение
развития фитопланктона в толще воды, который в основном был представлен
метафитоном. В начальный период формирования литорального сообщества преобладали
виды водорослей с широким экологическим спектром, способные обитать также в
составе планктона и бентоса. В основном это виды нитчатых центрических и пеннатных диатомей, зеленые
хлорококковые водоросли. Наиболее высоким видовым разнообразием отличались роды
Aulacosira, Cyclotella, Nitzschia, Navicula,
Scenedesmus.
Однако уже в начале вегетационного сезона
с началом роста макрофитов к ним присоединяются виды эпипелона и эпифитона
(крупные виды, имеющие гетерополярное строение клеток или колоний, часто
способностью к подвижности). Это виды диатомовых Caloneis amphisbaena, Nitzschia sigmoidea, N. vermicularis, Gyrosigma acuminatum, Cymatopleura elliptica, С. solea, Cymbella sp., Cocconeus
placentula, Phoicosphenia abbreviata, синезеленые
водоросли рода Oscillatoria, обрывки
зеленых нитчатых и десмидиевых водорослей.
Наибольшие показатели качественных и
количественных характеристик водорослей фитопланктона наблюдались в районе н.п.
Победилово (участок 1). На этом участке
среди зарослей макрофитов зеленые и диатомовые водоросли
образовывают 37 и 31% от общего количества видов. 9 % от общего числа видов
составляют эвгленовые, 11% - синезеленые. В открытых мелководьях увеличивается
доля синезеленых водорослей до 25%. Зеленые составляют 34% общего числа видов,
диатомовые - 23% и эвгленовые водоросли - 6%. Коэффициент видового сходства на
этом участке между открытым мелководьем и зарослями макрофитов невысока –
42.3-45.7%. Участок 2 (Саралинский) менее благоприятен для развития многих
перифитонных видов. Как в зарослях, так и в открытой части по количеству видов
преобладают диатомовые (32-38% от общего числа) и зеленые (31-33%) водоросли.
Эвгленовые водоросли во всех исследованных станциях этого участка составляют
6%. Коэффициент видового сходства среди зарослей и в открытых мелководий этого
участка равен 59.7% .
Большинство видов фитопланктона обследованных биотопов –
широко распространенные обитатели водоемов умеренных широт. Сравнение сходства
фитопланктонных сообществ между собой по Чекановскому-Съеренсену позволяет заключить, что фитопланктон зарослей макрофитов
1-го и 2-го участков по видовому составу близки (57.3-60.9%). Открытые мелководья
двух участков также схожи по видовому составу (54.8%).
Максимальные количественные показатели фитопланктона
характерны для мелководий загрязненного и слабо
проточного участка 1. Средняя численность и биомасса фитопланктона в
вегетационные сезоны исследованных лет составили 104.5 тыс.кл./л и 58.53 мг/л. Они превышают показатели 2-го участка 1.8 раза по
численности и 3.2 раза по биомассе. Значения общей численности и биомассы
водорослей в зарослях рогоза и тростника, а также участков без высшей водной растительности
на этом участке отличаются мало.
Средняя численность и биомасса фитопланктона на участке 2 (Саралинский) составили
56.35 тыс.кл./л и 18.45 мг/л. Общая биомасса фитопланктона в рогозовых
ассоциациях была в 1.5 раза выше, чем на открытых участках.
Сравнение биотопов между собой показало, что общая продукция
фитопланктона ассоциаций макрофитов с разным составом и открытых мелководий в
условиях Куйбышевского водохранилища отличаются мало. По нашим наблюдениям, состав и обилие водорослей в зарослях макрофитов в
Куйбышевском водохранилище варьирует в зависимости от ландшафтных условий,
проточности и динамики водных масс, степени зарастания, и главным образом, от
содержания биогенных соединений в воде данного участка. Отсутствие интенсивных динамических процессов, также подверженность антропогенному загрязнению участка
1 (Победилово) приводит к избытку в воде органических соединений. Существенных
различий между продукционными характеристиками фитопланктона среди зарослей и открытых
мелководий на этом участке не наблюдается. Участок 2 (Саралинский) по
гидрологическим особенностям и месторасположению менее благоприятен для развития
многих видов водорослей. На этом участке заросли макрофитов - более
благоприятный биотоп для многих фитопланктонных организмов, тем более на этом
участке из-за более интенсивного перемешивания водных масс происходит всплывание
многих крупноклеточных перифитонных водорослей в толщу воды.
Так как главные различия фитопланктонных сообществ рассматриваемых
биотопов наблюдались в структуре доминирования определенных видов и в соотношении количественных показателей разных отделов
водорослей, для оценки сложности структуры
фитопланктонных сообществ были использованы индексы ценотической значимости видов
(ИЦЗ) и полученные на их основе расчетные коэффициенты (Методические…, 1984;
Рогозин, 2000).
Для всех видов были определены частота встречаемости, средняя численность и
биомасса за весь период исследований, а затем вычислены ИЦЗ. После ранжирования
видовых списков по убыванию величины ИЦЗ для каждого исследованного биотопа,
были получены кривые доминирования,
позволяющие в определенной степени судить о роли каждого вида в фитопланктонном
ценозе. Полученные кривые отражают степень доминирования и выравненность
видов сообщества по «значимости» в ценозе, т.е. сложность структуры и разнообразие
сообщества. Они описываются экспоненциальными уравнениями вида у = ае-bx, где константа
«а» определяет
наклон кривой (коэффициент детерминации R2 =
0.87-1.00). Чем резче выражено доминирование, тем круче
наклон кривой, и, следовательно, больше величина константы «а». Ее можно
считать объективным критерием выраженности доминирования в ценозе и показателем
сложности структуры сообщества (Рогозин, 2000; Снитько, Рогозин, 2002).
Прибрежные участки водохранилищ, особенно заросшие высшей водной
растительностью, характеризуются высоким биологическим разнообразием и
интенсивностью процессов продукции и деструкции. В то же время, они наиболее подвержены
антропогенному воздействию, т.к. представляют собой зону контакта двух
природных комплексов - наземного и водного. Построенные нами кривые доминирования позволили
анализировать структуру альгоценозов исследуемых участков прибрежных мелководий
с различной степенью антропогенного загрязнения и сравнить эти участки между
собой.
Ранговое распределение ценотической значимости видов
альгоценоза на участках 1 и 2, рассчитанное по численности, значительно различались.
Максимальные значения ИЦЗ среди зарослей участка 1 в 1.5-2 раза были выше по
сравнению с участком 2, также были высоки значения показателя доминирования и
суммарного ИЦЗ. Кривые распределения ИЦЗ участка 2 показывали более равномерное
распределение видов сообщества фитопланктона, по сравнению с участком 1, что
свидетельствует о значительном усилении степени доминирования в альгоценозе
участка 1 по сравнению со 2-м.
Если сравнивать открытое мелководье и заросшие
участки, то максимальные значения ИЦЗ по численности в 1.5-2 раза были выше на
открытых биотопах по сравнению с зарослями, значения показателя доминирования
при этом были значительно выше для открытых мелководий.
Таким образом, анализ видовой структуры фитопланктонных сообществ
ассоциаций зарослей макрофитов, произрастающих на различных по степени
антропогенного загрязнения участках прибрежных мелководий Куйбышевского водохранилища,
а также участков без высшей водной растительности, показывает, что более
выровненное сообщество фитопланктона развивается на участке 2, где антропогенное
воздействие сведено к минимуму. Наиболее выровненные и с высоким видовым
разнообразием сообщества принадлежат участкам зарослей макрофитов. На открытых
мелководьях Куйбышевского водохранилища условия среды менее стабильны, чем в
зарослях макрофитов, что обусловлено динамикой водных масс в водоеме. В
зарослях макрофитов формируется более сбалансированное и организованное
сообщество фитопланктона.
Выявленные
различия также свидетельствуют о том, что в загрязненных зарослевых сообществах
фитопланктона 1-го участка выявлена тенденция увеличения количественных
показателей гетеротрофных организмов и суммарных показателей численности и
биомассы этих сообществ по сравнению с участками с более высоким качеством воды.
Список
литературы
Методические рекомендации по
сбору и обработке материалов при гидробиологических исследованиях на пресноводных
водоемах. Зоопланктон и его продукция. Л.: ГосНИОРХ, 1984. 34 с.
Рогозин А.Г. Особенности структурной организации
зоопланктонного сообщества в озерах разного трофического статуса. Видовые
популяции. Экология, 2000. № 6, с.
438-443.
Снитько Л. В., Рогозин А.Г. К оценке структурной
организации фитопланктона (озеро Большое Миассово, южный Урал). Экология, 2002. № 6, с. 426-431.
БИОРАЗНООБРАЗИЕ АЛЬГОЦЕНОЗОВ ВОДНО-НАЗЕМНЫХ ЭКОТОНОВ
Шарипова М.Ю.
Algocoenoses biodiversity in aquatic-terrestrial ecotones
Sharipova M. Ju.
Башкирский государственный университет, каф. ботаники
450074, г. Уфа, ул. Заки Валиди, 32, т.
(3472)73-66-34
е-mail: Sharipovamy@mail.ru
Изучение природных
комплексов, развивающихся на границе природных сред “вода - суша” представляет
интерес, поскольку эти переходные территории, или экотоны, включают и
наземные, и аквальные экосистемы, взаимодействующие между собой и способные
частично замещать друг друга в результате колебаний уровня воды в водоеме
и смещений береговой линии. Это так
называемые «маргинальные» или «краевые экотоны» [1].
В частности,
прибрежно-водные (береговые) экосистемы озер и рек являются наиболее разнообразными
и динамичными природными структурами. Известно, что пограничная или экотонная
зона между соседними экосистемами, как правило, более богата жизнью, чем их внутренние территории [2]. По этой
причине изучение структуры и функционирования прибрежно-водных экосистем
является одной из важных задач сохранения биоразнообразия. уязвимы к антропогенному воздействию, при
котором они становятся местом быстрого развития деградационных процессов [1].
Речные поймы являются специфическими интразонально-зональными ландшафтами, для
которых характерна быстрая изменяемость в пространстве и во времени. В
пределах поймы формируются различные формы микро- и мезорельефа с
разнообразными режимами увлажнения.
Нами описаны альгоценозы водно-наземных экотонов, на
границе раздела двух сред. В его составе изучены локальные экотоны бентали,
уреза воды, поймы (включая эколого-генетические зоны поймы). Работа выполнена
на территории Южного Урала, Зауралья и Предуралья. Альгоценозы экотонов
вода-суша изучали в долинах рек и озерных котловинах карстовых и
пойменных озер. В долинах рек трансекты закладывали от рипали через пойму, в
озерных котловинах - через береговую область озерной котловины, которая
включала литораль и береговой склон. В пойме пробы
отбирали в следующих зонах: прирусловой, центральной и притеррасной,
различающихся составом речных наносов, гидрологическим режимом,
растительностью и почвами. Экотоны вода-суша исследованы в лесостепной, степной, горно-лесной зонах на территории
Башкортостана. В данных экотонах собрано и обработано 400 альгологических
проб.
Изученные нами классы водно-наземных экотонов
характеризуются большой неоднородностью экотопов, их формирующих. Это
определяет разнообразие структуры альгофлоры и экологической характеристики
слагающих ее видов. Экотоны на разделе двух сред характеризовались большим
видовым богатством (выявлено 543 таксона водорослей рангом ниже рода), т.к.
здесь наиболее разнородные условия существования, которые благоприятны для развития
и гидрических, и эдафических альгоценозов. Составные части этого экотона –
мезоэкотоны – в свою очередь сами являются экотонами более мелкого масштаба
(т.н. локальными экотонами). Это литораль озер – урез воды – береговой склон
озерной котловины. Или рипаль рек – урез воды – речная пойма. Речная пойма также
неоднородна и делится на эколого-генетические элементы. Таким образом, здесь мы
имеем дело с экотоном как мозаикой «пятен» («patches») разного масштаба, которые вкладываются один в
другой [3].
В локальных экотонах второго порядка
альфа-разнообразие альгоценозов максимально в бентали как рек, так и озер.
Причиной этого является разнообразие донных отложений озер, и, особенно,
русловых фаций рек, которое образует множество
вариантов микроэкотонов, создавая так называемую «карусель» [4]. В зоне бентали
рек велико значение бета-разнообразие, хотя альфа-разнообразия меньше, чем в бентали
озер. Зона уреза воды относится к экотонам, которые характеризуются экстремальными
условиями существования для организмов граничащих экосистем, это так называемый
резкий переход («abrupt transition zone»).
Поэтому альфа-разнообразие альгоценозов здесь минимальное по сравнению с
другими экотонами.
При оценке альфа-разнообразия принимали во внимание
два фактора: видовое богатство и выравненность обилий видов [5]. Разнообразие и
мозаичность экологических условий в зоне экотона по продольному профилю обусловливают самое
высокое видовое разнообразие, оцененное индексом Шеннона, альгоценозов бентали
и прирусловой части центральной поймы в зоне заповедника Шульган-Таш. В целом,
и по другим зонам экотона, максимальное разнообразие видов наблюдали в Уфимском
районе, в зоне лесостепи в среднем течении реки. В этих условиях и местообитания, и альгоценозы наиболее разнообразны:
сочетаются степи, луга различной степени увлажнения, ивняки и тополевая урема.
Именно в этой части экотона в наибольшей степени проявляется экотонный эффект.
Однако степень выравненности альгоценозов экотона в заповеднике и в Гафурийском
районе значительно варьировала (индекс Шеннона составил 2.2-4.45 и 1.75-3.43),
т. е. бета-разнообразие здесь было выше, чем в альгоценозах экотона Уфимского
района, где значения коэффициента изменялись лишь в пределах от 3.56 до 3.92.
Низкие значения индекса Шеннона в некоторых зонах наземно-водного экотона в
Гафурийском районе, вероятно, связаны с высокой степенью пастбищной нагрузки в
пойме и в зоне уреза воды. В заповеднике
значительная степень выравненности характеризует альгоценозы уреза воды,
которые сформировались на галечной отмели. Они характеризуются и небольшим
числом видов. То есть альфа-разнообразие в зоне уреза воды невысокое.
Значения относительного синтетического
альфа-разнообразия [6,7] выше были в альгоценозах заповедника Шульган-Таш,
расположенном в горно-лесной зоне, и изменение этого показателя по продольному
профилю коррелировало с изменением видового богатства (т.е. аналитическим альфа-разнообразием).
Бета-разнообразие характеризует степень различий или сходства ряда местообитаний
или выборок с точки зрения их видового состава, а иногда и обилия видов. Один
из общих подходов к установлению бета-разнообразия – оценка изменений видового
разнообразия вдоль средового градиента. Другой путь его определения – сравнение
видового состава различных сообществ. Чем меньше общих видов в сообществах или
в разных точках градиента, тем выше бета-разнообразие [6]. Бета-разнообразие,
оцененное по средним значениям коэффициентов детерминации было выше в заповеднике и изменялось по продольному профилю следующим
образом: 0.065-0.087-0.089. В целом
низкие значения коэффициентов детерминации свидетельствуют о высоком
бета-разнообразии, который характеризует данные мезоэкотоны. При сравнении
локальных экотонов вода-суша одного района с помощью коэффициента Серенсена
наблюдается закономерность более высокого значения коэффициента сходства между
соседними площадками и его снижения с увеличением расстояния между ними. Эта
закономерность нарушается только при контакте водной и наземной сред обитания –
при сравнении альгоценозов прирусловья и уреза воды.
Значения относительного синтетического
альфа-разнообразия для экотонов рек различных ландшафтных зон колебались от
0,94 (степная пойма реки Ик) до 2,11 (пойма реки Усолки в лесостепной зоне).
Высокие значения разнообразия отмечаются для экотонов с наибольшей гетерогенностью
среды. Самое большое значение относительного синтетического альфа-разнообразия
наземно-водных экотонов озер было установлено для Аслы-куля (2,72).
Список литературы
1. Залетаев B.C. Мировая сеть водно-наземных экотонов, ее функции в
биосфере и роль в глобальных изменениях // Экотоны в биосфере.- М.: РАСХН.,
1997. – С.77-90.
2. Hansen A.J., F. di
Castri, and R.J. Naiman. Ecotones; what and why? A new look at ecotones // Biologically international. -
1988. № 17. Р. 9-46.
3. Hansen A.J.,
B.H. Walker.
The dynamic landscape: Perturbation, biotic response, biotic patterns // S.
African Inst. Ecol. Bull.-1985. - N4. -
P. 5-14.
4.
Van der Maarel E., Sykes M.T. Small-scale plant species turnover in a limestone
grassland: the carousel model and some comments on the niche concept // J.
Veget. Sci. - 1993. - v.4. - N.2. - P.179-188.
5. Лебедева Н.В., Дроздов Н.Н., Криволуцкий Д.А.
Биоразнообразие и методы его оценки.- М.: МГУ, 1999. - 94 с.
6. Миркин Б.М., Наумова Л.Г. Наука о растительности. -
Уфа: Гилем, 1998. - 416с.
7. Мартыненко В.Б. Система формальных критериев оценки
биоразнообразия растений на территории заповедников РБ // Проблемы сохранения
биоразнообразия на Южном Урале. Тез. докл. региональной науч.-практич. конф.,
13-14 мая 2004 г.
-Уфа, 2004.-С. 16-17.
СЕЗОННАЯ ДИНАМИКА РАЗВИТИЯ
ДИНОФИТОВЫХ ВОДОРОСЛЕЙ
В АКВАТОРИИ НОВОРОССИЙСКОЙ БУХТЫ ЧЕРНОГО МОРЯ
Ясакова О.Н.
Seasonal development dynamics of Dinophyta
in water area
of the Novorossiysk
bay of the Black Sea
Yasakova O.N.
Институт аридных зон ЮНЦ РАН
ул.
Чехова, 41, Ростов-на-Дону, 344006, тел/факс 8-8632-665677
e-mail: yasak71@mail.ru
Морской фитопланктон является основой большей части
продукционных процессов Мирового океана. Динофитовые водоросли составляют
существенную часть фитопланктона Черного моря, летом их значение существенно возрастает.
В последние годы динофитовые стали доминирующим компонентом фитопланктона
северо-западной части моря, все чаще становясь причиной наблюдаемых в этом
районе моря «цветений» воды. Так в сентябре 2000 года в акватории
Одесского порта была зафиксирована вспышка развития токсичного вида водорослей Gymnodinium sanguineum Hirasaka. (678,3 тыс.кл/л и 55,3 г/м3), составившего 79%
численности и 96% биомассы всего фитопланктона (Теренько, 2004). В августе
того же года «цветение» вызвал Gymnodinium
simplex (250 млн.кл/л).
В июне и августе 1998 года после «цветения» диатомовых в планктоне Одесского
порта доминировали Gyrodinium cornutum и Polykrikos schwartzii, составившие до 95 %
биомассы фитопланктона. В Днепро-Бургском районе неоднократно наблюдались
«красные приливы», спровоцированные мощной вспышкой развития Prorocentrum cordatum (Ostf.) Dodge
и Prorocentrum compressum (Bailey) Abe ex Dodge. Многие виды
динофитовых являются гетеротрофами. В прибрежной зоне моря они играют важную
роль в потреблении органического вещества и в среднем составляют 37% численности
и 48% биомассы всего отдела.
Нашей задачей было оценить уровень развития и сезонную
динамику динофитовых водорослей в акватории Новороссийской бухты под
воздействием значительного антропогенного влияния. С этой целью были проведены
исследования фитопланктона в различных по уровню загрязнения акваториях
Новороссийской бухты: порт, средняя и открытая части в период с февраля по
декабрь 2007 года. Пробы отбирали с борта судна в дневное время суток
1-2 раза в месяц, фильтровали методом обратной мягкой фильтрации с помощью
фильтрационной воронки Сорокина, применяя нуклеопоровые фильтры с диаметром пор
1-2 мкм (Кольцова и др., 1979). Фиксировали
нейтральным формалином до конечной концентрации 1%. Идентификация видов, подсчет численности и
определение объема клеток фитопланктона производили с помощью микроскопа
МИКМЕД-2 с увеличением х200 и х400. При идентификации видов использовали
общепринятые руководства (Киселев, 1950;
Прошкина–Лавренко, 1963; Коновалова и др., 1989, Dodge, 1982; Carmelo, 1992). Всего было отобрано и обработано 120
проб.
В период исследований
в акватории Новороссийской бухты было обнаружено 36 видов Dinophyta (динофитовые) из общего количества видов фитопланктона равного 95.
Средние значения общей численности и биомассы планктонных водорослей
Новороссийской бухты за исследуемый период составили 943 млн.кл/м3 и 784 мг/м3 соответственно.
В годовой динамике фитопланктона был отмечен
весенний пик (апрель - май) численности (5014 млн.кл/м3) и два пика биомассы; весенний (апрель
- май) и осенний (октябрь) (2139 и 1215 мг/м3). Все три пика были связаны с
развитием диатомовых водорослей.
А
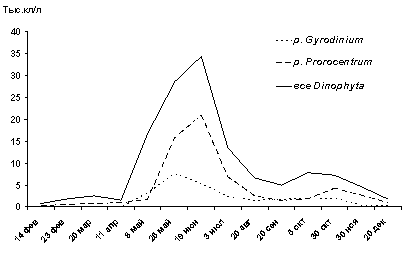
В

Рис. Сезонная динамика
численности (А) и биомассы (В) основных родов динофитовых водорослей
в акватории Новороссийской
бухты в 2007 г.
Среднегодовые
значения численности и биомассы динофитовых водорослей составили 9,5 млн.кл/м3 и 156,32 мг/м3. В период исследований они
формировали не более 1 % общей численности и 20 % биомассы
фитопланктона (рис.). Вспышка численности представителей этого отдела водорослей
(до 34,3 млн.кл/м3) наблюдалась в мае-июле и была
спровоцирована интенсивным развитием
диатомовых водорослей, отмеченным в апреле 2007 года. Динофитовые в этот
период формировали до 20-25 % общей численности фитопланктона. Как
известно, значение Dinophyta в усвоении мертвого органического вещества «угасающего
цветения» очень высоко и сравнимо с ролью планктонных инфузорий (Теренько, 2004).
Наиболее многочисленными видами водорослей в Новороссийской
бухте в период исследований были Prorocentrum cordatum (Ostf.) Dodge (2,63 млн.кл/м3), Gyrodinium fusiforme Kof. Et Sw. (1,31 млн.кл/м3). Виды Prorocentrum compressum (Ostf.) Dodge., Prorocentrum micans
Ehr., Gyrodinium sp., Gymnodinium sp. развивались со средней
численностью каждого 0,52-0,84 млн.кл/м3. Пик численности представителей родов
Gymnodinium, Gyrodinium приходился на период с мая по ноябрь; видов рода Prorocentrum - с мая
по июль.
Вспышка численности
Heterocapsa triquetra (Ehr.) Balech. была отмечена в мае
(7,78 млн.кл/м3), средняя численность ее составила
0,79 млн.кл/м3. Практически круглый год в акватории
бухты в небольшом количестве (со средней численностью каждого - 0,11 млн.кл/м3)
встречались Scrippsiella trochoidea (Stein) Balech, Dinophysis rotundatum Clap. et Lachm и Diplopsalis lenticula Berght.
Максимальная
биомасса динофитовых водорослей (237 мг/м3) приходилась на теплое время года: май – октябрь, в остальные месяцы ее
значения были значительно ниже (17-67 мг/м3). Относительная доля Dinophyta (до 56 %) в
общих значениях биомассы фитопланктона повышалась в летний (май-июль) и зимний
(февраль, декабрь) периоды года. Ведущую
роль в образовании биомассы этого отдела водорослей играли крупноклеточные виды рода Ceratium: C. fusus (Ehr.) Dujard., C. furca (Ehr.) Clap. et Lachm., C. tripos (O.F. Muller) Nitzsch. (85 мг/м3), а
также многочисленные P. сordatum, P. сompressum, P. micans, Prorocentrum sp. и немногочисленные, но
крупные представители рода Protoperidinium: P.crassipes(Kof.) Balech., P. depressum (Kof.) Balech, P. divergens (Ehr.) Balech., P. granii (Ostf.) Balech., P. quinquecorne
Abe, P. steinii
(Jord.) Balech., крупные клетки Gyrodinium sp.,
которые в целом формировали 46 мг/м3.
Надо отметить, что в 2007 году в акватории бухты не было
зафиксировано развитие ихтиотоксичного G.
sanguineum. Вспышка численности
этот вида была отмечена в июне 2006 года (2,5 млн.кл/м3).
В целом максимальное
видовое разнообразие изученной группы водорослей отмечалось в открытых районах
бухты (30 видов), наибольшее количественное развитие – в порту и в зонах
выпуска сточных вод на западном побережье бухты.
Таким образом,
развитие динофитовых водорослей в акватории Новороссийской бухты, как и в целом
в северо-восточной части Черного моря в 2007 году не достигало силы «цветения»
воды и не давало повода для опасений появления ядовитых «красных приливов»,
губительных как для морских обитателей, так и для человека. Однако уже в марте
2008 года в акватории бухты был отмечен
«красный прилив», спровоцированный развитием потенциально токсичного вида динофитовых
S. trochoidea. Произошедший инцидент вызывает
обоснованную тревогу повторения этого явления в будущем (Ясакова, Бердников,
2007).
Список
литературы
Кольцова Т.Н., Лихачева
Н.Е., Федоров В.Д. О количественной обработке проб фитопланктона // Биол.
Науки. 1979. № 6. С. 96-100.
Киселев Н.А. Панцирные
жгутиконосцы. М-Л: АНСССР. 1950. 280 с.
Коновалова Т.В., Орлова
Т.Ю., Паутова Л.А. Атлас фитопланктона Японского моря. Л. Наука, 1989,
160 с.
Нестерова Д.А.Развитие перидинеи Extviaella cordata и явление «красного
прилива» в северо-западной части Черного моря. Биология моря. 1979.
№5.С. 24-29.
Прошкина - Лавренко А.И.
Диатомовые водоросли планктона Черного моря. АНСССР. 1963. 216 с.
Теренько Л.М. Трофическая структура динофлагеллят
прибрежной зоны Черного моря. Тез докл. Межд. научно-практической конференции
«Проблемы динамики экосистем Азовского моря и Керченского пролива». Рост-на-Дону:
Изд. ЮНЦ РАН. 2004. С. 92-94.
Ясакова О.Н.,
Бердников В.С. Необычное цветение воды в результате массового развития динофитовой
водоросли Scrippsiella trochoidea (Stein) Balech
в акватории Новороссийской бухты в марте 2008 года.// Морской экологический журнал. Севастополь. 2008. Т.VII, № 4, С. 98.
Dodge J. D. Marine Dinoflagellates of the British Islend. London: HMSO.1982.
301 р.
Carmelo K. T. Identifying Marine Phytoplankton. Academic Press. Harcourt
Brace Company. 1997. - 821р.
Секция 3
Флоры
водорослей. Редкие виды и малоизученные группы
SOUTHERN AFRICAN DESMIDS:
HISTORY, CURRENT STUDIES AND PERSPECTIVES
Levanets
A., van Rensburg L.
School for Environmental Sciences and Development,
Botany Department, Private Bag X6001, North-West University, Potchefstroom
2520, Republic of South Africa
Tel.:
(072) 135 66 17; Fax: (018) 299 25 03
e-mail: 20868421@nwu.ac.za, levanets@mail.ru
Desmids of Southern
Africa (Republic of South Africa, Namibia, Botswana, Kingdom of Swaziland,
Kingdom of Lesotho) were studied by numerous phycologists: L. Rabenhorst
(1855), P.F. Reinsch (1867), F.E. Fritsch and colleagues (1911-1940), G.
Huber-Pestalozzi (1929-1930), B.J. Cholnoky (1954-1955), M.I. Claassen
(1961-1985), R. Grönblad and H.T. Croasdale (1971), D.B. Williamson (1994-2000),
D.C.J. Wessels and B. Büdel (1995), P.F.M. Coesel and A. van Geest (2008).
According to the
published data (1855-2008) 547 species of saccoderm and placoderm desmids (864
intraspecific taxa including type taxa) were recorded in Southern
Africa. From them 302 taxons were described as new for science
(from water bodies and aerophytic biotopes), including 109 species, 1
subspecies, 162 varieties, 28 forms, 1 new name and 1 new combination (from
genera Cylindrocystis Menegh. ex De
Bary, Netrium (Näg.) Itzigs. et
Rothe, Penium Bréb., Closterium Nitzsch ex Ralfs, Pleurotaenium Näg., Euastrum Ehr. ex Ralfs, Micrasterias Ag. ex Ralfs, Cosmarium Corda, Xanthidium Ehr., Arthrodesmus
Ehr., Staurastrum Meyen, Sphaerozosma Corda ex Ralfs, Desmidium C.A. Agardh).
On the basis of our
recent studies we added to the list nearly 60 species from which more than 20
will be described as new for science (from genera Roya W. et G.S. West, Closterium,
Euastrum, Micrasterias, Cosmarium, Staurastrum). Subtropical regions (Kruger National Park, Swaziland,
Caprivi Strip), mountain countries (Cape mountains, Waterberg, Drakensberg, Kingdom of Lesotho),
Okavango Delta, Karroo and Namib deserts are
the most perspective territories for taxonomical studies of desmid floras
according to our experience.
Created annotated
and illustrated list of desmids known for Southern Africa
can be used as a basis for the future work which must develop in following
direction: annotated and illustrated list - critical taxonomical list - flora -
ecological flora.
Материалы к флоре водорослей Шараповского
болота
(Московская обл.)
Анисимова О.В.,
Дмитриева А.Н.
Materials to algae
flora of the Sharapovskoe
swamp
(the Moscow Region)
Anissimova O.V., Dmitrieva A.N.
Московский государственный университет им. М.В.Ломоносова,
119992, Москва, ул. Ленинские горы, д.1, стр. 12. тел. (495)939-27-64
e-mail: ola@herba.msu.ru
Звенигородская биологическая
станция МГУ им. М.В.Ломоносова расположена в Одинцовском районе Московской
области в 50 км
к западу от Москвы. Шараповское болото находится в 27 квартале Звенигородского
заказника и в 16 квартале Шараповского лесничества. Это болото переходного
типа. Оно имеет сильно вытянутую форму и занимает площадь около 3 га. Водоем расположен в понижении
среди незаболоченного елово-соснового леса. Окраинная часть болота открытая,
лишена древесной растительности; центральная часть облесена. Вся поверхность
болота, кроме открытых зеркал, покрыта сфагнумом Sphagnum magellanicum Brid., Sph. centrale C. Jens. in Arnell & C. Jens., Sph. warnstorffii Russ., Sph. angustifolium (C. Jens. ex Russ.) C.Jens.
Питание болота осуществляется грунтовыми водами и атмосферными
осадками. Температура воды в безледный период (с апреля по октябрь) меняется в
диапазоне от 6,0 до 25,0оС, лед стабильно становится с конца
октября. Значения рН колеблются от 4,6 до 7,1; общая минерализация составляет
менее 0,1 г/л. На данный момент болото состоит из трех озер, разделенных
сплавинами. Среднее озеро имеет соединение с большим под сплавиной. Этот факт
был обнаружен нами при бурении разделяющей сплавины в разных точках. Малое
озеро отделено от среднего плотной сплавиной, перешедшей местами в почву. Пробы
планктона и бентоса отбирали из трех озер в 2003, 2005 и 2006 г.г., обработку и
определение проводили по стандартным методам.
В результате проведенных
исследований нами идентифицировано 51 вид, разновидность и форма из 21 рода зигнемовых водорослей.
Обнаруженные таксоны относятся к 5 семействам (Desmidiaceae, Closteriaceae, Mesotaeniaceae, Zygnemataceae и Peniaceae) порядка Zygnematales.
Семейство Desmidiaceae
отличается наибольшим видовым, а также родовым богатством и насчитывает 37
видов из 15 родов. На уровне родов во флоре лидируют Cosmarium – 10
видов и Closterium – 8 видов. Видовое разнообразие остальных родов
представлено следующим образом: Staurastrum – 7 видов, Cosmoastrum
– 3 вида, Desmidium, Hyalotheca, Micrasterias, Staurodesmus,
Penium и Xanthidium – по 2 вида. Один вид обнаружен в родах Actinotaenium,
Bambusina, Cylindrocystis, Euastrum, Mougeotia, Netrium,
Pachyphorium, Pleurotaenium, Rhaphidiastrum, Spondylosium и Zygnema.
По отношению к типу
местообитания, организмы в изучаемой альгофлоре распределены между тремя группами:
планктонные, бентосные и планктонно-бентосные – 40 таксонов. Группа планктонных
водорослей насчитывает 19 видовых и внутривидовых таксона. Это представители
родов Staurastrum (7 видов), Closterium (3 вида), Hyalotheca
и Staurodesmus (по 2 вида), Bambusina, Cosmarium, Cosmoastrum,
Desmidium, Rhaphidiastrum (по 1 виду). По данным литературы эти виды
приурочены к планктонному образу жизни, однако встречены нами в пробах
обрастаний. Это может быть объяснено тем, что данные водоросли ассоциированы с
водными высшими растениями, но не прикреплены к ним. К бентосным организмам
относятся 12 видов из родов Cosmarium (4 вида), Micrasterias и Penium
(по 2 вида), по одному виду Cylindrocystis, Mougeotia, Spondylosium
и Zygnema. Группа планктонно-бентосных организмов представлена 9
таксонами – Closterium (3 вида), Actinotaenium, Cosmoastrum, Euastrum, Netrium, Xanthidium и Pleurotaenium – одним видом каждый.
Водоросли, обитающие в
болотах мало требовательны к аэрации. В альгофлоре Шараповского болота выявлено
17 таксонов с известной категорией реофильности. Преобладают виды, предпочитающие
стоячую воду (реофобные), с пониженным содержанием кислорода (13 таксонов
видового и внутривидового ранга). Распределение водорослей по категориям
галобности выявило 2 группы таксонов-индикаторов – индифференты и галофобы (24
вида-индикатора). Преобладают представители индифферентных к хлоридам
водорослей – 14 видов-индикаторов. Это виды из родов Closterium, Cosmarium, Cosmoastrum, Desmidium, Micrasterias, Netrium, Pleurotaenium, Staurastrum и Xanthidium. Галофобы
представлены 10 видами-индикаторами из родов Closterium, Cosmarium, Euastrum, Hyalotheca, Spondylosium, Staurastrum и Staurodesmus. Отсутствие во флоре индикаторных видов других групп (галофилов) связано
с низким содержанием хлоридов в воде (менее 1 г/л).
В Шараповском болоте найдено
20 таксонов-индикаторов концентрации протонов (рН воды). Среди индикаторов
преобладают ацидофилы (16 видов) – представители родов Closterium,
Cosmarium, Bambusina, Cosmoastrum, Euastrum, Netrium и Staurastrum,
что обусловлено низкими значениями рН воды в водоеме (рН=4.5-5.5). Индифференты
представлены видами Cosmarium connatum, C. lundelii, C. venustum и Staurastrum
paradoxum.
В результате проведенного
экологического анализа показано, что альгофлора Шараповского болота является
типичной для болот, так как она составлена организмами, предпочитающими воды,
обедненные кислородом, с низкими значениями рН и отсутствием хлоридов.
Для выявления сезонной
динамики видового состава проведен анализ богатства родов водорослей, обнаруженных
в пробах, собранных в водоеме в течение всего исследуемого периода – с апреля
по ноябрь (рис.1). Из 51 обнаруженного в
болоте вида наибольшее число отмечено в июне (45), а наименьшее – в ноябре
(17).
В апреле встречено 19 видов
водорослей из 11 родов, доминировали в этот период нитчатки (из конъюгат –
это Mougeotia sp.) и динофлагелляты. Разнообразие не только
зигнемовых, но и водорослей других групп было низким.
В майских пробах обнаружено
43 вида зигнемовых водорослей из 20 родов. Первое место по числу видов занимает род Cosmarium (10 видов), также богаты видами Closterium (7 видов) и Staurastrum (5 видов). Несмотря на
высокое разнообразие, доминировали Pachyphorium obsoletum и нитчатки из
отдела Chlorophyta (Oedogonium, Ulothrix, Microspora).
В июне встречено 45 видовых
и внутривидовых таксонов из 19 родов. Лидируют роды Cosmarium и Closterium
(9 и 8 видов, соответственно). В доминирующий комплекс входят 6 видов конъюгат
(Actinotaenium perminutum, Bambusina borreri,
Desmidium schwartzii, Pachyphorium obsoletum, Pleurotaenium trabecula и Staurastrum vestitum).
В июльских пробах отмечено
39 таксонов из 19 родов, и также как и в июне, по числу видов преобладают роды Cosmarium
(8 видов) и Closterium (6) и Staurastrum (5). В числе доминант
среди конъюгат отмечены Mougeotia sp.
и Pachyphorium obsoletum.
В августе видовой состав
насчитывает 33 видовых и внутривидовых таксона из 19 родов. Из них Cosmarium представлен 6 видами, Closterium и Staurastrum 4 видами каждый. Массовыми видами
в августе были Mougeotia sp. и Cosmarium portyanum.
В сентябре обнаружено 39
видов из 18 родов. На первом месте – род Cosmarium (8 видов), на втором
– Closterium (6), на третьем – Staurastrum (5 видов).
Доминирующий комплекс в сентябре богат видами из различных групп водорослей.
Среди конъюгат это – (Actinotaenium perminutum, Cosmarium connatum, Cosmarium lundellii, Mougeotia sp.,
Pachyphorium obsoletum, Pleurotaenium trabecula и Staurastrum vestitum).
В октябре видовое
разнообразие зигнемовых водорослей сократилось до 24 таксонов. По числу видов
лидируют роды Cosmarium и Closterium (по 4 представителя), а по
численности – Actinotaenium perminutum и Mougeotia sp.
Ноябрь характеризовался
установлением льда на озерах. Подледную флору конъюгат составляли 17 видов из
13 родов. Некоторого разнообразия достигал только род Cosmarium (4
вида). Доминировали как и прежде Actinotaenium perminutum и Mougeotia sp.,
а оставшаяся часть видов проявляла признаки угнетения численности. В пробах
обнаруживалось большое количество диатомей и цист золотистых водорослей.
Таким образом, в течение
изучаемого периода в Шараповском болоте наблюдается незначительное изменение
видового разнообразия и постоянство лидирующих родов (Cosmarium и Closterium)
зигнемовых водорослей. Если рассматривать динамику видового разнообразия, то в
период от схода льда до начала резкого нагрева воды число видов увеличивается
скачкообразно с 19 до 43 видов.
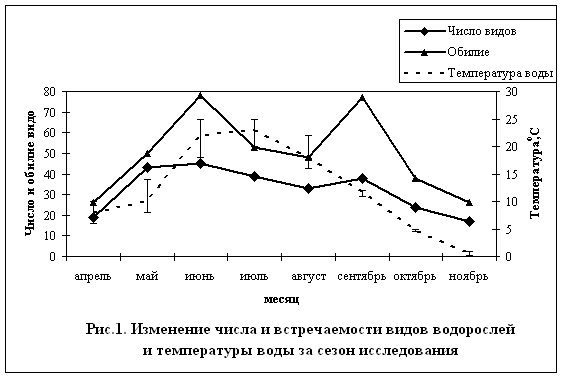
В период биологического лета
(с мая по сентябрь) число видов изменяется незначительно (в пределах 10 таксонов)
в основном за счет единично встречающихся видов. В это время наблюдаются два
пика численности – в июле и в сентябре. В октябре наблюдается резкий спад,
причем это касается как видового разнообразия лидирующих, так и минорных родов.
По сравнению с июнем, в ноябре пропадает 28 таксонов. Этот период можно
охарактеризовать как начало формирования «зимней» флоры. Температура воды ниже
10 оС коррелирует с низким разнообразием и численностью десмидиевых
водорослей (рис. 1).
ТАКСОНОМИЧЕСКИЙ
ОБЗОР АЛЬГОФЛОРЫ СТЕПЕЙ БАЙМАКСКОГО
РАЙОНА РЕСПУБЛИКИ
БАШКОРТОСТАН
Ахмедьянов Д.И.
Taxonomy review of
steppe algal flora of the Baimak Region
of the Bashkortostan Republic
Achmedjanov D.I.
ГОУ ВПО Башкирский
государственный университет,
450074, г. Уфа,
ул. З. Валиди, 32, тел. (347)
273-66-56, факс (347)
273-67-78
e-mail: dhws@mail.ru
Изучение почвенных водорослей в Башкортостане началось
еще в середине прошлого века и продолжает интенсивно развиваться. В настоящее
время альгологическими исследованиями охвачена практически вся территория
республики (Кузяхметов, 2006), однако Зауралье все еще остается слабо изученным
регионом относительно таксономического состава и структуры альгоценозов, а
также роли почвенных водорослей в природных биоценозах региона. Значение
изучения почвенных альгоценозов в последнее время начинает резко возрастать в
связи с усилением антропогенного давления, изменением и загрязнением экосистем.
Местом исследования был выбран Баймакский район,
окрестности города Сибай. Район исследований в альгологическом отношении слабо
изучен и отмечается большими массивами пастбищ с разной степенью деградации растительности
от ковыльных степей с площадью проективного покрытия 70 – 90 % до низкотравных
полынково-типчаковых сообществ. По отношению к водорослям и цианобактериям
влияние процессов дигрессии не было изучено, поэтому целью наших исследований
явилось исследование состава и развития почвенных цианобактерий и водорослей
пастбищ различной степени нарушенности травяного покрова.
Основной почвенный фон района исследования составляют
черноземы обыкновенные, которые вместе с черноземами выщелоченными преобладают
на распаханных степных участках (Хазиев, 1995). Почвенные образцы взяты в 2008
году на площадках 10×10 м, используемых при геоботанических описаниях,
путем усреднения из 10 исходных проб, взятых в слое 0-1 см (Кузяхметов, 2006). Видовой состав изучался в почвенных культурах
со стеклами обрастания (Кузяхметов, 2006). Выделение стадий дигрессии проводили
по флористическому анализу.
Нами были исследованы степные фитоценозы, распределенные
по 5 стадиям дигрессии: 1 стадия – ковыльная степь (Stipa zalesskii Wilensky, S. pennata L.) с проективным покрытием 90%; 2
стадия – тырсовая степь (S. capillata L., Festuca pseudovina Hack. ex Wiesb.) с
проективным покрытием 80%; 3 стадия – типчаковая степь с проективным покрытием
60% (F. valesiaca Gaudin, Artemisia commutate Bess.); 4 стадия – полынково-типчаковая степь с проективным
покрытием 45% (A. austriaca Jacq., F. pseudovina); 5 стадия – стадия однолетников (стадия сбоя) с
проективным покрытием 40-35% (Polygonum aviculare L.) и петрофитные (каменистые)
степи (Orostachys spinosa (L.) C.A. Mey, Dianthus acicularis Fisch. ex Ledeb.).
В результате
исследований обнаружено 73 вида и внутривидовых таксона цианобактерий и
водорослей, относящихся к 4 отделам (Cyanoprokaryota, Bacillariophyta, Xanthophyta, Chlorophyta), 13 порядкам, 28 семействам и 39 родам. Исследованные почвы
характеризуются преобладанием числа видов зеленых водорослей и цианобактерий,
что подтверждается рядом других авторов (Кузяхметов, Юсупова, 2000; Хайбуллина,
2000).
Отдел Cyanoprokaryota включает в
себя 3 порядка с 24 видами. Самым представительным из отдела является порядок Oscillatoriales, превышающий по видовому богатству другие порядки
(58,3%). С высоким постоянством встречаются виды родов Microcoleus и Phormidium. Виды порядка Nostocales образуют основное ядро доминантного комплекса
цианобактерий. Ведущие роды порядка – Nostoc и Cylindrospermum.
Порядок Chroococcales представлен всего тремя видами с низкими баллами
обилия. Доминанты: Nostoc punctiforme (Kütz.) Hariot. f. populorum (Geitl.) Hollerb., Microcoleus vaginatus (Vauch.) Gom., Leptolyngbya foveolarum (Mont. ex Gom.) Anagn. et Kom., Phormidium autumnale (Ag.) Gom., Phormidium breve (Kütz.) Anagn. et Kom.
Отличительным свойством почв степей является небольшое
видовое разнообразие диатомовых водорослей. Отдел Bacillariophyta представлен
14 видами в 3 порядках. Особенностью диатомовых явилось то, что при низком видовом
разнообразии, отдел отличается высокой частотой встречаемости видов порядков Naviculales и Bacillariales, иногда входящих в доминантный комплекс. Наиболее
часто встречаются роды Luticola, Hantzschia и Pinnularia. Доминантный комплекс состоит из Pinnularia
borealis Ehr. var. borealis, Hantzschia amphioxys (Ehr.) Grun. var. amphioxys, Luticola mutica (Kütz.) Mann, Luticola ventricosa (Kütz.) Mann., Luticola cohnii
(Hilse.) Bukht.
Самым меньшим числом видов представлен отдел Xanthophyta –
7 видов с низкими баллами обилия.
Отдел Chlorophyta представлен 28
видами, входящими в состав 4 порядков. Среди них важное место занимает порядок Chlorococcales (57%).
Остальные порядки (Ulotrichales,
Chlorosarcinales и Chlamydomonadales) представлены меньшим разнообразием видов. С высоким
постоянством встречались только 4 вида: Bracteacoccus minor (Chodat.) Petrova, Tetracystis aggregata Brown et Bold, Ulothrix variabilis Kütz., Mychonastes homosphaera
(Skuja) Kalina et Punč. Доминатный
комплекс включает в себя 3 вида: Tetracystis aggregata, Mychonastes homosphaera, Choricystis chodatii (Jagg) Fott.
Таксономический анализ альгофлоры по стадиям дигрессии
показал, что в большинстве исследованных фитоценозах первое место по числу
видов занимает отдел Chlorophyta,
лишь в 1 стадии дигрессии уступая отделу Cyanoprokaryota, третье и четвертое место занимают диатомовые и желтозеленые
водоросли.
Наиболее богатыми видами были семейства: Neochloridaceae, Phormidiaceae, Diadesmidaceae, Pleurochloridaceae. Ведущие семейства состоят в большей степени из
родов, виды которых присутствуют во всех исследованных фитоценозах, то есть
являются сквозными. Это такие виды как: Microcoleus vaginatus, Phormidium autumnale, Phormidium breve, Leptolyngbya foveolarum, Pinnularia
borealis var. borealis, Hantzschia amphioxys var. amphioxys, Luticola mutica, Bracteacoccus minor, Tetracystis aggregata,
Ulothrix variabilis.
Также обнаружены виды, характерные только для одной из стадий дигрессии или
только в петрофитной степи, возможно являющиеся индикаторными: 1 стадия
дигрессии - Lyngbya aestuarii, Schizothrix lardacea (Ces.) Gom., Leptolyngbya hollerbachiana
(Elenk.) Anagn. et Kom., Leptolyngbya gracillima (Zopf. ex Hansg.) Anagn. et Kom., Hantzschia amphioxys (Ehr.) Grun. var. compacta O. Müll., Pleurochloris imitans Pasch., Chlamydomonas oblongella Lund, Chlorosarcinopsis minor Hernd.; 2 стадия дигрессии - Cyanothece aeruginosa (Näg.) Kom., Synechococcus elongatus Näg., Chlamydomonas gloegama Korsh., Oocystis lacustris Chodat; 3 стадия
дигрессии - Cylindrospermum licheniforme f. licheniforme (Bory) Kütz., Navicula sp. 1, Nitzschia palea (Kütz.) W. Sm., Pleurochloris magna Boye-Pet, Fernandinella alpina Chod.; 4 стадия
дигрессии - Chlorsarcina longispinosa Chant. Et Bold, Scotiellopsis levicostata (Hollerb.) Pŭnc. et Kalina, Actinochloris sphaerica Korsch., Heterothrix tribonemoides Pasch., Trichormus variabilis (Kütz. ex Born. et Flah.) Kom. et Anagn. f. variabilis; в 5 стадии дигрессии дифференцирующие виды не обнаружены;
петрофитная степь - Chlorococcum minimum Ettl et Gärtner, Planothidium rostratum
(Östr.) Round
and Bukht.,
Navicula sp.2, Plectonema sp.
При анализе доминантного комплекса получены следующие результаты:
1 стадия дигрессии - Microcoleus vaginatus,
Leptolyngbya foveolarum, Nostoc
punctiforme f. populorum, Luticola mutica, Pinnularia borealis var. borealis, Hantzschia amphioxys var. amphioxys, Phormidium autumnale, Phormidium breve, Bracteacoccus minor, Tetracystis aggregata; 2 стадия дигрессии - Microcoleus vaginatus, Phormidium autumnale, Leptolyngbya foveolarum, Luticola mutica, Luticola cohnii, Pinnularia borealis var. borealis, Hantzschia amphioxys var. amphioxys, Chlorococcum infusionum (Schrank.) Menegh., Bracteacoccus minor, Tetracystis aggregata;
3 стадия дигрессии - Luticola mutica, Luticola cohnii, Luticola ventricosa, Pinnularia borealis var. borealis, Hantzschia amphioxys var. amphioxys, Bracteacoccus minor, Chloranomala palmelloides Mitra., Mychonastes homosphaera;
4 стадия дигрессии - Phormidium autumnale, Luticola mutica,
Luticola cohnii, Pinnularia borealis var. borealis, Hantzschia amphioxys var. amphioxys, Bracteacoccus minor, Mychonastes homosphaera, Tetracystis aggregata;
5 стадия дигрессии - Microcoleus vaginatus; петрофитная
степь - Microcoleus vaginatus, Phormidium autumnale,
Luticola mutica,
Luticola ventricosa, Pinnularia borealis var. borealis, Tetracystis aggregata.
Таким образом, в ходе исследования выявлено 73 вида и
внутривидовых таксона цианобактерий и водорослей, относящихся к 4 отделам, 13
порядкам, 28 семействам и 39 родам. Для исследованных почв характерным является
богатство видов зеленых водорослей и цианобактерий и сравнительно бедный состав
желтозеленых и диатомовых водорослей. Выявлены виды, характерные для стадий
пастбищной дигрессии и петрофитной степи, а также доминанты каждого из фитоценозов.
Список литературы
Кузяхметов Г.Г. Водоросли зональных почв и лесостепи:
Монография. - Уфа: РИО БашГУ, 2006. – 286 с.
Хазиев Ф.Х. и др. Почвы Башкортостана. Т. 1:
Эколого-генетическая и агропроизводственная характеристика. – Уфа: Гилем, 1995.
– 384 с.
АЛЬГОФЛОРА
ОСТРОВОВ ФИНСКОГО ЗАЛИВА БАЛТИЙСКОГО МОРЯ
Балашова Н.Б.
Island algal flora in
the Gulf of Finland, the Baltic Sea
Balashova N.B.
Санкт-Петербургский
государственный университет, Санкт-Петербург
Университетская
набережная 7/9, тел.+7 (812) 328-95-43, факс +7 (812) 328-97-03,
e-mail: balanataliya@yandex.ru
Детальные флористические исследования – фундамент для
рационального природопользования и создания научно обоснованной системы охраны
редких видов и сообществ. Островные экосистемы нуждаются в особой охране и
изучении, поскольку являются хрупкими, уязвимыми, чутко реагирующими на
вмешательство человека. Усиливающееся эвтрофирование вызывает необходимость
детального исследования экологической ситуации в Финском заливе. Вместе с тем
видовой состав некоторых групп организмов, в том числе и водорослей, населяющих
отдельные части Балтийского моря изучен мало.
В восточной части акватории Финского залива – на
западных рубежах России – находятся небольшие острова. Они долгое время
оставались слабо изученными во флористическом отношении из-за труднодоступности
и невозможности свободного посещения территории.
В июле 1993
г. шесть островов: Сескар, Малый, Мощный, Большой
Тютерс, Малый Тютерс, Гогланд (рис.1), посетила экспедиция, организованная при
содействии WWF (World Wide Nature Fund),
состоявшая из специалистов Санкт-Петербургского государственного университета,
Ботанического института РАН, Зоологического института РАН, Института окружающей
среды (Финляндия), Института охоты и рыболовства (Финляндия).
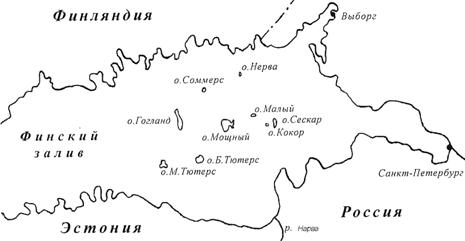
Рис.1 Расположение островов в Финском заливе
Самый большой из островов – Гогланд, его площадь 22 км2,
находится в 220 км
на запад от Санкт-Петербурга. В 20
км на юго-запад от о. Гогланда расположен о. Большой
Тютерс – 9 км2. В 50
км на восток от о. Гогланда лежит о. Мощный площадью 9
км2, следующими по площади идут о. Малый Тютерс – 1,6 км2,
о. Сескар – 1,3 км2 и самый маленький из островов – о. Малый – 0,8 км2.
Острова в основном покрыты сосновыми лесами, на
некоторых есть небольшие озера, болота. Население невелико – пограничники;
персонал, обслуживающий маяк; навигационная служба. Практически 50 лет до
экспедиции острова не посещались научными экспедициями, и, находясь по разным
причинам в зоне отчуждения, они представляют собой уникальную часть Балтийского
моря с эффектом охраняемых территорий.
История альгологических исследований на островах
начинается в 70-х годах XIX столетия, когда Х.Я. Гоби (1873) публикует результаты
своих экспедиций по побережью и островам Финского залива. Он приводит небольшой
список макрофитов о. Гогланд. Однако Х.Я. Гоби замечает, что еще в 1842 г. о. Гогланд посещал
Карл Бэр, «привезший оттуда несколько форм водорослей, взятых из числа прибитых
к берегу моря». Х.Я. Гоби обнаружил те же водоросли, что и К. Бэр. Работы E. Häyren (1928) и Х.А. Кукка (1978) также посвящены
макроводорослям.
Микроводоросли же островов практически неизвестны.
Весьма скудные данные о фитопланкотоне в районе о. Сескар приводит А.И. Крабби
(1913) – 4 вида. Пробы фитопланктона в районе о. Сескар обрабатывает
И.А.Киселев (1948), однако данные весьма расплывчаты и остается неясным, какие
водоросли были встречены в акватории острова. Единственная работа по водорослям
пресноводных озер о. Гогланд была выполнена R. Grönblad (1947). Частично материалы по микроводорослям
островов были опубликованы автором (Балашова, 1996). На этом и исчерпывается
список работ известных по альгофлоре островов.
Во время экспедиции было отобрано 65 проб разного
характера – пробы фитопланктона в водах Финского залива в акватории различных
островов; макрофиты; скопления водорослей в прибрежной части; водоросли в
выбросах на берегу островов; налеты водорослей на дне в самой мелководной прибрежной
части; пробы из небольших озер на острове Гогланд.
В результате камеральной обработки проб в альгофлоре
островов было обнаружено129 видов и внутривидовых таксонов водорослей, из них
60 видов и внутривидовых таксонов диатомовых водорослей, 34 вида и внутривидовых
таксона зеленых водорослей, 27 видов синезеленых водорослей, 3 вида эвгленовых
водорослей, 2 вида динофитовых водорослей, 2 вида бурых водорослей, 1 вид
красных водорослей.
Основу фитопланктона вод, окружающих острова в период
исследований, составляли синезеленые водоросли, доминировал Aphanizomenon flos-aquae (L.) Ralfs. Скопления
трихомов достигали достаточно большого размера и были хорошо заметны в воде
даже без предварительного микроскопирования. Другие виды, играющие заметную
роль в фитопланктоне – Nodularia litorea Kütz. и Anabaena lemmermanii P. Richt.
Макрофиты были представлены в основном Fucus vesiculosus L.,
видами рода Enteromorpha, особенно Enteromorpha intestinalis (L.) Link, скоплениями Cladophora rupestris (L.) Kütz. и Cladophora fracta (O.Müll.) Kütz., заболоченные луга – маршевые луга на островах –
характеризуются массовым развитием Percursaria percursa (C.Ag.) Bory.
В выбросах на берегу различных островов встречаются
талломы Fucus vesiculosus L., многочисленные
кустистые скопления видов Cladophora Kütz.. Очень редко встречаются талломы Ceratium cf. siliquosum (Kütz.) Maggs
et Hommers.
Наибольшее разнообразие видов были зарегистрировано в
пробах, собранных на мелководной литорали. Нежные коричневатые и зеленоватые
налеты на песке, обрастания камней были составлены многочисленными микроскопическими
водорослями – преимущественно зелеными и диатомовыми. Это зеленые хлорококковые
водоросли, виды родов Scenedesmus Meyen, Pediastrum Meyen, Tetraedron Kütz.; среди диатомей выделялись представители родов Achnanthes Bory, Amphora Ehr., Mastogloia Thw., Ctenophora (Grun.) Williams et Round и другие. В скоплениях нитчаток доминировали
стерильные экземпляры конъюгат – Spirogyra Link, Mougeotia Ag.
В небольших озерах на о. Гогланд встречаются
преимущественно диатомеи, особенно Tabellaria flocculosa,
и десмидиевые – различные виды рода Cosmarium Corda.
Своеобразное сообщество водорослей отмечается в
скальных ваннах, на высоте нескольких метров над уровнем воды. В массе
развивается Dictyosphaerium pulchellum Wood, субдоминантом
выступает Scenedesmus quadricauda (Turp.) Bréb., встречаются
единичные ценобии Pediastrum boryanum (Turp.)Menegh. и
некоторые другие хлорококковые водоросли.
Посещение островов дает редкую возможность увидеть на
небольшой площади типично морские виды, пресноводную флору в озерах островов,
смесь пресноводных и солоноватоводных видов водорослей в водах Финского залива,
омывающих острова.
Общеизвестно, что воды Финского залива сильно
опреснены, особенно это относится к водам Невской губы, на берегах которой
расположен Санкт-Петербург. Однако мощнейшее влияние на альгофлору Финского
залива оказывает Ладожское озеро, воды которого и соответсвенно виды водорослей
приносятся в залив Невой. Однако зона, находящаяся к западу от о. Сескар до о.
Гогланд находится под воздействием Балтийского моря. Это обстоятельство очень
ярко проявляется в составе альгофлоры.
Разнообразие пресноводных видов ярко представлено в
группе зеленых водорослей, где со значительными оценками обилия представлены Scenedesmus quadricauda, Pediastrum boryanum и некоторые другие виды, которые
являются обычными формами для флоры пресноводных континентальных водоемов. Не
менее значима роль типичных пресноводных видов и среди синезеленых водорослей.
Доминант фитопланктона – Aphanizomenon flos – aquae (L.) Ralfs. Этот вид
встречается в различных пресноводных водоемах, на исследованной акватории он
отмечен как на ближайшем к Санк-Петербургу острове Сескаре, так и на наиболее
дальнем – о Гогланде. Среди диатомей значительно представительство пресноводно-солоноватоводных
видов – Achnanhes clevei Grunow, Amphora veneta Kütz., Navicula cryptocephala Kütz., Navicula radiosa Kütz. и многих других видов, часто встречающихся в
разнообразных пресноводных континентальных водоемах.
Макрофиты представлены во флоре водорослей всех
обследованных островов. Типичный представитель морской флоры водорослей Fucus vesiculosus L.
встречается и у берегов о. Сескар и в водах о. Гогланд. Однако экземпляры в
водах о. Гогланд значительно крупнее, чем у о. Сескар, так как соленость у о.
Гогланд выше, чем у о. Сескар.
Среди микроскопических водорослей одновременно с пресноводными
видами в альгофлоре островов разнообразны солоноватоводные виды. Особенно разнообразны
солоноватоводные виды - мезогалобы среди диатомей – Amphora acutiuscula Kütz., Ctenophora pulchella (Ralfs ex Kütz.) Williams
et Round, Diploneis interrupta (Kütz.) Cl., Diploneis smithii (Bréb.) Cl., Entomoneis paludosa (W. Smith) Reimer, Mastogloia elliptica (C. Ag.) Cl., Mastogloia exigua Lewis, Tabularia tabulata (C. Ag.) Snoeijes
и другие.
Большинство встреченных водорослей широко
распространены как на территории Ленинградской области, так и в других регионах
России. Однако некоторые виды попадают в Красную книгу Ленинградской области,
например, Fucus vesiculosus L., Nodularia crassa (Woronich.) Kom. et al.
По истечении более 15 лет с момента начала экспедиции
ситуация с посещением островов мало изменилась – по-прежнему они остаются
трудно доступными территориями, активно дискутируется вопрос о создании в этом
районе заповедника. Все это дает надежду, что сообщества водорослей сохранятся,
что разнообразие организмов останется неповрежденным.
Альгофлора пещер и гротов национального
природного парка «Подольские Товтры» (Украина)
Виноградова О.Н., Михайлюк Т.И.
Algal flora of caves
and grots
of the natural
National Park «Podolskye Tovtry» (Ukraine)
Vinogradova O.N., Mikhailyuk T.I.
Институт ботаники
им. Н.Г.Холодного НАН Украины
01001, Киев, ул.
Терещенковская, 2, Украина, тел. +38-044-234-22-89
e-mail: o.vinogradova@gmail.com , t-mikhailyuk@ukr.net
К настоящему времени работы по изучению
спелеоальгофлоры ведутся в разных странах мира, однако, по мнению Л. Гоффманна
(Hoffmann, 2002), исследования по таксономии и экологии водорослей
пещер до настоящего времени все еще довольно немногочисленны. Среди нескольких
десятков стран, в которых изучалась пещерная альгофлора, Украина занимает очень
скромное место. Среди публикаций, посвященных этой экологической группе водорослей,
следует отметить работу И.Ю. Костикова (1991),
в которой описан новый для науки вид вольвокальных водорослей из пещеры на
Чатыр-Даге (Горный Крым). В работе О.В. Коваленко и О.А Кисловой (2007),
изучавших синезеленые водоросли национального природного парка (НПП)
„Подольские Товтры”, упоминаются 2 вида цианопрокариот, образовывавшие налет на внутренней стене заброшенной
штольни, имеющей вид пещеры. Т.М. Дариенко (2008), которая также изучала водоросли на
стенах упоминаемой штольни, обнаружила 22 вида водорослей из отделов
Cyanoprokaryota, Chlorophyta, Bacillariophyta.
Еще можно упомянуть работу о водорослях-биодеструкторах пещеры «Зверинецкая» в
Киеве (Костиков и др., 1998). Таким образом, изучение пещерных водорослей в
Украине находится на самом начальном этапе и не случайно, что две из четырех
упомянутых выше публикаций посвящены НПП «Подольские Товтры», ведь по
геологическому происхождению и количеству пещер и гротов, разбросанных по его
территории, этот национальный парк представляет собой уникальный объект для
спелеоальгологических исследований.
Материалы для данного исследования составили 52
образца, взятых с известняковых стен двух пещер – Залучанская пещера и
«Атлантида», трех гротов – Залучанский, Бакотский, грот на товтре «Першак», и
Бакотского скального монастыря. Пещеры характеризуются большой протяженностью
(Залучанская – 20 м,
«Атлантида» – 1.8 км),
наличием участков полной темноты и отностительно стабильными значениями температуры
(10-160С) и влажности воздуха. Гроты образованы нагромождением валунов,
характеризуются небольшими размерами (1.5-3 м глубиной), их стены затенены, но в
определенные моменты дня солнечные лучи их достигают. Бакотский монастырь значительно антропогенно
трансформирован (внешние и внутрение стены побелены известью), а также подвергается
значительной нагрузке – активно посещается верующими и туристами. Пробы изучены методом культур на агаризованной
среде Дрю (Drew; см. Кондратьєва, 1968) и
Болда – 3NBBM (Bischoff, Bold, 1963).
В результате исследования выявлено 86 видов (87 внутривидовых
таксонов) водорослей из отделов: Cyanoprokaryota – 35; Chlorophyta – 35; Streptophyta – 3; Xanthophyta – 5; Eustigmatophyta – 1; Bacillariophyta – 7, среди которых 56
видов впервые выявлены на территории парка, 8 видов – новые для Украины (Gloeocapsa coracina Kützing, Cyanosarcina parthenonensis Anagnostidis, Leptolyngbya hansgirgiana Komárek, L. schmidlei (Limanowska) Anagnostidis
et Komárek, Phormidium vulgare [Kützing] ex Anagnostidis, Calothrix parietina (Nageli) Thuret f. nodosa Ercegovich, Pseudodictyochloris dissecta Vinatzer, Scotiella tuberculata Bourrelly).
В изученных гротах, где было выявлено 67 видов
водорослей, как экологически более комфортных местообитаниях, преобладали
зеленые водоросли (49-58 % видового состава), тогда как цианопрокариоты
составляли 11-29 %. Альгофлора пещер (46 видов) характеризовалась меньшим
видовым разнообразием и значительно большей долей цианопрокариот (40.5-70 %
видового состава), что в целом характерно для пещерной альгофлоры (Albertano et al., 2000; Mulec, 2008).
Исследования
показали, что интенсивность
освещения является ключевым фактором в распределении водорослей в
изученных спелеообъектах, что подтверждается данными литературы (Vinogradova et al.,
1998; Виноградова и др., 2000). Так, в освещенных частях гротов было выявлено
24 вида, из которых большинство (15 видов) составляют зеленые водоросли. Среди
доминирующих здесь отмечены Synechococcus elongatus Nageli, Leptolyngbya schmidlei (Limanowska) Anagnostidis et
Komárek,
Schizothrix lenormandiana Gomont, Nostoc punctiforme (Kützing) Hariot, N. linckia (Roth) Bornet
et Flahault, Desmococcus olivaceus (Pres. ex Ach.) Laundon,
Diplosphaera chodatii Bialosuknia em. Vischer.
В затененных частях гротов наблюдается всплеск видового разнообразия
водорослей всех выявленных отделов (52 вида), доминирующий
комплекс включает Phormidium vulgare [Kützing] ex Anagnostidis, Pseudophormidium hollerbachianum (Elenkin) Anagnostidis,
Tolypothrix byssoidea (Berk.) Kirchn., Bracteacoccus cf. aggregatus Tereg, Klebsormidium flaccidum (Kützing) Silva
et al., K.
cf. nitens (Meneghini in Kützing)
Lokhorst, Mychonastes homosphaera (Skuja) Kalina et
Punochářová и те же
виды Nostoc и Desmococcus, которые дополняются высоким
разнообразием единично представленных видов почвенно-аэрофитной приуроченности.
Всплеск
разнообразия водорослей в затененной части гротов объясняется тем, что
аэрофитные водоросли, хотя и встречаются на ярко освещенных поверхностях, все
же тяготеют к затененным влажным местообитаниям, где и наблюдается их высокое
разнообразие (Hoffmann, 1989; Nienow, 1996).
В освещенной части Залучанской
пещеры, расположенной при входе, отмечено высокое разнообразие водорослей (21
вид) из пяти отделов, в составе доминантов отмечены Phormidium autumnale (Agardh) Gomont
и Nostoc linckia. В затененной
части пещеры наблюдается возрастание видового разнообразия (28 видов), особенно
цианопрокариот, среди доминирующих выявлены Pseudophormidium hollerbachianum, Lyngbya cf. nigra Agardh ex Gomont, Cylindrospermum muscicola Kützing, Nostoc linckia,
а также Desmococcus olivaceus. В зоне полной темноты
видовое разнообразие водорослей значительно падает (11 видов), здесь массово
развиваются Anabaena sp. ster.,
Nostoc linckia, Mychonastes homosphaera. Альгофлора пещеры
«Атлантида», развивающаяся практически в полной темноте (вход в пещеру закрыт
дверью), характеризуется невысоким видовым разнообразием (10 видов), а также
значительным преобладанием цианопрокариот (около 70 % видового состава), среди
которых наиболее обильны Pleurocapsa minor Hansgirg emend. Geitler,
Pseudophormidium hollerbachianum, Tolypothrix tenuis Kützing.
В Бакотском скальном монастыре поверхность стен
покрывали налеты и корочки водорослевой природы, однако видовое разнообразие их
было очень низким, что, очевидно, связано с большой антропогенной нагрузкой,
которой подвергается монастырь. Всего было идентифицировано 10 видов. Роль
доминантов в альгогруппировках играли Leptolyngbya henningsii (Lemmermann) Anagnostidis, Phormidium aerugineo-coeruleum (Gomont) Anagnostidis et Komárek, Nostoc linckia,
Mychonastes homosphaera.
Для выявления влияния физико-химических свойств
субстрата на видовой состав водорослей было проведено сравнение полученных
данных об альгофлоре гротов НПП «Подольские Товтры», сложенных известняками, с
данными об альгофлоре гранитного каньона РЛП «Гранитно-степное Побужье»
(Николаевская обл., окрестности г. Южноукраинск) (Mikhailyuk et al., 2003; 2005). Видовой состав
водорослей на уровне отделов известняковых и гранитных обнажений достаточно
схож, в обоих случаях преобладают по количеству видов зеленые водоросли, за
которыми следуют цианопрокариоты, что в целом,
характерно для альгофлоры аэрофитных местообитаний равнинной умеренной зоны (Nienow, 1996). Отличительными признаками известнякового
субстрата является более высокое разнообразие цианопрокариот (около 30 %
видового состава) и более низкое – зеленых водорослей (около 50 %), тогда как
на гранитных обнажениях эти группы составляют около 20 и 65 % соответственно.
Кроме того, среди зеленых водорослей на гранитном субстрате наиболее разнообразны
представители Trebouxiophyceae, составляющие
основные компоненты аэрофитона, тогда как на известняках, кроме них, также виды
Chlorophyceae – более характерные для почв и затененных влажных
местообитаний. Существенно отличается также доминирующий комплекс водорослей обоих
типов субстратов. Выявленные особенности альгофлоры известнякового субстрата по сравнению с
таковой гранитных обнажений связаны с
физико-химическими свойствами известняков, более благоприятными для развития
водорослей, особенно прокариотических – значительной пористостью и влагоудерживающей
способностью, высоким рН.
Список литературы
Виноградова О.Н., Коваленко
О.В., Вассер С.П., Нево Э.Д., Вайнштейн-Єврон М. Синезеленые водоросли (Cyanoprocaryota
/ Cyanobacteria) пещеры Джамал // Альгология. – 2000. – 9, №1. – С.
82-90.
Даріенко Т.М. Перші відомості про
наземні водорості національного природного парку „Подільські Товтри”. // Зб.
наук. праць „Актуальні проблеми ботаніки та екології” – 2008. – Вип. 2. – С.
13-20.
Коваленко О.В., Кислова О.А. Новые данные о Cyanophyta (Cyanoprocaryota) национального природного парка «Подольские Товтры» (Украина) // Альгология. – 2007. – 17, №1. – С.71- 75.
Кондратьєва Н.В. Клас
гормогонієві – Hormogoniophyceae. К.: Наук. думка, 1968.
– 523 с. (Визначник прісноводних водоростей Української РСР. Вип.2. Синьозелені
водорості – Cyanophyta; Ч.2).
Костиков И.Ю.Chloromonas antrorum (Volvocales, Chlorophyta) – новый вид из пещер
Горного Крыма // Ботан. журн. – 1991. – 76, №7. – С. 990-992.
Костіков І.Ю., Кондратюк Т.О.,
Рибчинська О.М. Біодеструктори печери «Звіринецька» // Проблеми збереження,
консервації та реставрації музейних пам'яток історії та культури. – 1998. –
Спецвипуск. – С. 142-161.
Albertano, P., Bruno L., Moscone D., Palleschi G. Effect of photosynthesis on pH variation in cyanobacterial biofilms from Roman catacombs // J. Appl. Phycol. – 2000 –
12. – P. 279-284.
Bischoff H.W., Bold
H.C. Some soil algae from Enchanted Rock and related algal species // Phycol. Stud.
(Univ. Texas
Publ., ¹ 6318). – 1963. – 4. – P. 43-59.
Hoffmann, L.1989. Algae of terrestrial habitats. Bot. Review. Apr./June
1989. – 55 (2). – P. 77-105.
Mulec J. Microorganisms in hypogeon: examples from Slovenian karst
caves// Acta Carsologica. – 2008. - 37, N1. – P. 153-160.
Mikhailyuk T.I., Demchenko E.M., Kondratyuk S.Ya. Algae of granitе
outcrops from the left bank of Pivdennyi Bug river (Ukraine) // Biologia. – 2003. – 58,
№4. – Р. 589-601.
Mikhailyuk T.I., Demchenko E.M., Kondratyuk S.Ya. Terrestrial
lithophilic algae of canyon Pivdennyi Bug River (Ukraine)
// Intern. Conf. “Algae in terrestrial ecosystems” (Kaniv, 27-30 September
2005). – P. 51.
Nienow J .A. Ecology of subaerial algae //
Nova Hedwigia Beih. – 1996. – 112.
– 537-552.
Vinogradova
O.N., Kovalenko O.V., Wasser S.P., Nevo E., Weinstein-Evron M. Species diversity gradient to
darkness stress in blue-green algae / cyanobacteria: a microscale test in a
prehistoric cave, Mount Carmel, Israel //
Isr. J. Pl. Sci. - 1998. - 46, N.3.
- P. 366-378.
ЦИАНОПРОКАРИОТЫ
ЗАПАДНОГО БЕРЕГА ГРЕН-ФЬЕРДА
(АПХипелаг ШПИЦБЕРГЕН)
Давыдов Д.А.
Cyanoprokaryota of Grønfjord west coast
(Spitsbergen archipelago)
Davydov D.A.
Полярно-альпийский
ботанический сад-институт Кольского НЦ РАН
г. Кировск, (81531) 527-42
e-mail: d_disa@mail.ru
В настоящей публикации представлены результаты
исследования биоты цианопроакриот на западном берегу и в южной кутовой части
залива Грен-фьерд (архипелаг Шпицберген, о-в западный Шпицберген). Эта работа
явилась продолжением ранее опубликованных исследований на восточном берегу
залива (Давыдов, 2005; Королева и др., 2008). В 2004, 2007-2008 гг. нами был
изучен небольшой по площади участок (рис.) Всего нами было собрано около 100
образцов, в которых выявлено 32 таксона. Ниже приводится аннотированный список,
в котором виды приводятся в алфавитном порядке, названия таксонов даются по
системе J. Komárek, K. Anagnostidis (1986, 1989, 1998, 2005;
Anagnostidis, Komárek, 1988, 1990). Новые для архипелага виды отмечены
звездочкой. Цифры, следующие за названием вида соответствуют местам сбора
образцов, указанным на рисунке.
1.
Aphanocapsa
grevillei (Hass.) Rabenh. - 24: на мелкоземе.
2.
Aphanocapsa
muscicola (Menegh.) Wille – 24: на мелкоземе и на мхах.
3.
Aphanocapsa
parietina Näg. - 9: в трещине на скале. 11: небольшое
озеро (с площадью зеркала около 400
м кв., с глубинами до 0.3-0.5 м), имеющее
ледниково-снежное питание, слабопроточное, на небольшом удалении от уреза воды,
на печеночных мхах и мелкоземе. 15: обрастания камней на дне у берега
озера. 20: эпифит на мхах.
4.
Aphanocapsa
testacea Näg. - 21: на зарастающем мхами мелкоземе и на
мхах.
5.
Aphanothece
caldariorum Richter – 20: на мхах и мелкоземе.
6.
Aphanothece saxicola Näg. - 23: на мелкоземе.
7.
Calothrix parietina (Näg.) Thur. ex Born. et
Flah. - 1: на влажных мхах на берегу ручья. 8: озеро в понижении склона (площадь зеркала около 500 м кв), галька на дне у
берега озера, обросшие зелеными водорослями нижние поверхности камня, среди
нитчатых зеленых водорослей. 20: на мхах. 22: на мохообразных и
на камнях. 24: на мелкоземе.
8.
Chroococcus
cohaerens (Bréb.)
Näg. - 1: на влажных мхах
на берегу ручья. 11: небольшое озеро (с площадью зеркала около 400 м кв., с глубинами до
0.3-0.5 м),
имеющее ледниково-снежное питание, слабопроточное, на небольшом удалении от
уреза воды, на печеночных мхах и мелкоземе. Там же на берегу ручья, среди мхов.
9.
*Chroococcus
helveticus Näg. - 11: на берегу ручья, среди мхов.
10.
*Chroococcus
varius A. Br. - 6: эпилит на нижней поверхности сухого
песчаника.
11.
*Geitleribactron
peryphyticum Kom. - 8: озеро в понижении склона (площадь зеркала
около 500 м
кв.), галька на дне у берега озера, обросшие зелеными водорослями нижние
поверхности камня, эпифит на нитчатых зеленых водорослях.
12.
Gloeocapsa
kuetzingiana Näg. - 20: на мхах.
13.
Gloeothece
rupestris (Lyngb.) Born. - 10: обрастания мелкозема на удалении от
воды.
14.
*Leibleinia epiphytica (Hieron. ex Kirchn.) Compere - 8:
озеро в понижении склона (площадь зеркала около 500 м кв), галька на дне у
берега озера, обросшие зелеными водорослями нижние поверхности камня, эпифит на
нитчатых зеленых водорослях.
15.
Leptolyngbya cf. "Albertano / Kovacik-green" – 1: на влажных мхах на берегу ручья. 9:
на камне. 10: Обрастания Si камней, мелкозема и мхов на берегу ручья. 11:
на берегу ручья, среди мхов. 15: обрастания камней на берегу озера. 23:
на мелкоземе.
16.
Leptolyngbya
cf. fallax (Hansg. ex
Forti) Kom. – 5: на мхах и на
мелкоземе в воде.
17.
*Leptolyngbya
subtrunctata (Voronich.) Kom.
et Anagn. - 22: на
мохообразных и на камнях.
18.
*Microcystis
natans Lemm. ex Skuja – 8: озеро в понижении склона (площадь зеркала
около 500 м
кв), галька на дне у берега озера, обросшие зелеными водорослями нижние
поверхности камня, среди нитчатых зеленых водорослей.
19.
Nostoc
commune Vauch. - 1: на влажных мхах на берегу ручья. 3:
на печеночниках. 7: в микропонижениях, эпифит на мхах. 8: сухой
участок тундры, эпифит на мхах среди злаков. 9: в трещине на скале. 10:
обрастания мхов на берегу ручья, под водой (1 см).Там же в отдельной
высохшей луже (40-50 см
в диаметре, 8-10 см
глубиной), обрастания мхов на дне лужи. 11: небольшое озеро (с площадью
зеркала около 400 м
кв., с глубинами до 0.3-0.5 м),
имеющее ледниково-снежное питание, слабопроточное, на небольшом удалении от
уреза воды, на печеночных мхах и мелкоземе. Там же, в 4 м от берега ручья в сухом
хорошо освещенном месте, эпифит на черных бугристых корочках печеночников под
камнем с юго-юго-восточной экспозиции. 17, 18, 23: на мелкоземе. 20,
21: на мхах и мелкоземе. 22: на мохообразных и на камнях. 24:
на мхах.
20.
Nostoc sp.1 – 10:
обрастания камней, мелкозема и мхов. Там же обрастания мелкозема на удалении от
воды. 13: на мелкоземе среди камней. 16, 24: на мелкоземе.
21.
Nostoc sp.2 – 1:
на влажных мхах на берегу ручья. 11: небольшое озеро (с площадью зеркала
около 400 м
кв., с глубинами до 0.3-0.5 м),
имеющее ледниково-снежное питание, слабопроточное, на небольшом удалении от
уреза воды, на печеночных мхах и мелкоземе. Там же, в 4 м от берега ручья в сухом
хорошо освещенном месте, эпифит на черных бугристых корочках печеночников под
камнем с юго-юго-восточной экспозиции. 17, 18: на мелкоземе. 20:
на мхах.
22.
Phormidium formosum (Bory ex Gom.) Anagn. et Kom.
- 2: на дне. 4: на мохообразных. 19: Обрастания камней. 21:
в ручье на камне. 22: на мохообразных и на камнях в воде.
23.
Phormidium
interruptum Kütz. ex Gom. - 1: на влажных мхах на берегу ручья. 5:
эпифит на мхах и на мелкоземе в ручье.
24.
*Phormidium
subfuscum Kütz. ex Gom. - 21: в ручье на камне. 22: на
мохообразных и на камнях в воде. 24: на мелкоземе.
25.
Phormidium
uncinatum Gom. ex Gom. - 11: на берегу ручья, среди мхов. 12:
светло-коричневые маты на камнях на дне и берегу ручья в воде. 14: на
дне ручья в воде. 15: обрастания камней на берегу озера. 19: на
камне в воде.
26.
Pseudanabaena
frigida (Fritsch) Anagn. - 11: мелкий ручей (7 см глубиной и около 60-100 см шириной). Обрастания
на дне ручья, в воде.
27.
Rhabdoderma lineare Schmidle et Laut. - 24: на мхах.
28.
Stigonema hormoides Kütz. ex Born. et Flah. – 10: обрастания камней, мелкозема и мхов.
29.
Symplocastrum friesii [Ag.] ex Kirchn. - 23: на мелкоземе
30.
Synechocystis aquatilis Sauv. - 10: обрастания камней, мелкозема и мхов.
31.
*Tolypothrix distorta (Fl. Dan.) Kütz. - 1, 3: на влажных мхах на берегу ручья.
32.
*Tolypothrix saviczii Kossinsk. - 20: на мхах и мелкоземе.
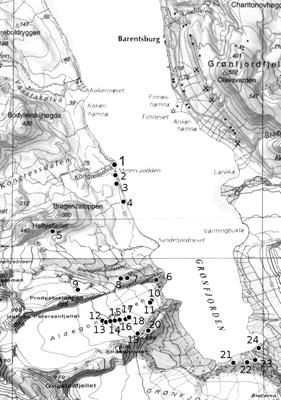
Рис. Схема района исследования. Числами обозначены
места отбора образцов:
1. Ручей на первой приморской террасе, в районе р.
Kongresselva, плоский участок.
2. Первая приморская терраса, русло пересохшего ручья.
3. Первая приморская терраса, плоский участок. У
берега небольшого ручья.
4. Первая приморская терраса, заболоченная тундра.
5. 78°00′38″ с.ш., 14°03′18″
в.д., 210 м
над ур. моря. Склон южной экспозиции г. Heftyefjellet, уклон 40-45°, заросшая
каменистая (галечная) осыпь, слабопроточный ручей.
6. 77°59′47″ с.ш., 14°11′06.1″
в.д., 20 м
над ур. моря. Первая приморская терраса. Кочковатая тундра с Salix polaris
и злаками.
7. 77°59′49″ с.ш., 14°09′14″
в.д., 45 м
над ур. моря. Кочковатая тундра на склоне северной экспозиции г.
Productustoppen с углом наклона 5-10°.
8. 77°59′49″ с.ш., 14°08′56″
в.д., 40 м
над ур. моря. Склон северной экспозиции г. Productustoppen.
9. 77°59′36″ с.ш., 14°05′18″
в.д., 165 м
над ур. моря. Склон северной экспозиции г. Productustoppen, выступающий среди
мелкокаменистой осыпи участок скалы (балкон). В трещинах скалы на вертикальной
стене.
10. 77°59′27″ с.ш., 14°11′08″
в.д., 9 м
над ур. моря. Моренные отложения ледника Альдегонда. Ручей ледникового питания,
образовавший промыв в моренных отложениях, депрессия. Слабопроточные, медленно
текущие воды, глубина воды не более 3-7 см. Ширина ручья 5-6 см, ширина депрессии 8-10 см.
11. 78°00′38″ с.ш., 14°03′18″
в.д., 210 м
над ур. моря. Моренные отложения ледника Альдегонда.
12. 79°59′08″ с.ш., 14°07′14″
в.д., 100 м
над ур. моря. Вблизи ледника Альдегонда, около 150 м от крайнего северного
языка ледника. Медленно текущий ручей, вытекающий из-под моренных отложений
(ширина - 15-20 см,
глубина - 0,5-4 см).
13. 77°59′07″ с.ш., 14°07′30″
в.д., 104 м
над ур. моря. Зарастание пологого участка морены ледника Альдегонда,
горизонтальная поверхность.
14. 77°59′06″ с.ш., 14°08′27″
в.д., 50 м
над ур. моря. Моренные отложения ледника Альдегонда. Медленно текущий ручей к
югу от боковой северной морены, ширина русла 15-60 см, глубина 6-8 см.
15. 77°59′08″ с.ш., 14°08′48″
в.д., 38 м
над ур. моря. Вблизи ледника Альдегонда. Небольшое слабопроточное озеро
(площадь зеркала около 200 м
кв.), питающееся за счет ледникового стока.
16. 77°59′10″ с.ш., 14°09′02″
в.д., 46 м
над ур. моря. Моренные отложения вблизи ледника Альдегонда.
17. 77°59′11″ с.ш., 14°09′02″
в.д., 46 м
над ур. моря. Моренные отложения ледника Альдегонда.
18. 77°59′13″ с.ш., 14°09′32″
в.д., 100 м
над ур. моря. Моренные отложения ледника Альдегонда.
19. 300-400
м от границы ледника Альдегонда. Ручей со слабопроточной
водой, 5-6 см
глубиной, ширина до 1.5-2 м.
20. Склон возвышенности Strandlinuten северной
экспозиции, каменисто-галечниковый склон, с мелкоземом, заросшим лишайниками,
преимущественно Stereocaulon sp., мхами и Salix reticulata. Места
с поздностаивающим снегом.
21. Южный берег (кутовая часть) залива Грен-фьорд.
Моренные отложения ледника Грен-фьерд на берегу залива.
22. Южный берег (кутовая часть) залива Грен-фьорд.
Моренные отложения ледника Грен-фьерд на берегу залива. Ответвление ручья,
несущего ледниковые воды.
23. Южный берег (кутовая часть) залива Грен-фьорд.
Кочковатая тундра на удалении от берега.
24. Южный берег (кутовая часть) залива Грен-фьорд.
Зарастание выположенного участка морского берега, представляющего собой
окатанную гальку и песок. На значительном удалении от воды.
Работа выполнена при поддержке гранта РФФИ
№07-04-00443-а.
К изучению видового состава
наземных водорослей
о. Змеиный (Украина)
Дариенко Т.М.
Study of terrestrial algae species composition
of Zmeiniy island (Ukraine)
Darienko T.M.
Институт ботаники им. М.Г. Холодного НАН Украины
ул. Терещенковская, 2, г. Киев, 01601, Украина,
тел.: +(38)(044)-234-22-89, факс +(38)(044)2355248
e-mail: darienko@ukr.net
Остров Змеиный расположен в Черном море и удален на
юго-восток от суши на расстояние 35
км. Этот скальный остров - континентальный по
происхождению и образован наиболее древними (нижнедевонскими) породами, которые
выходят в черноморском бассейне. Растительность представлена, в основном,
разнотравными степями. Остров подвержен сильным ветрам, высушивающим его
поверхность и приносящим соли (хлоридов и сульфатов натрия) на его поверхность.
В связи с этим здесь формируются уникальные климатические условия, не имеющие
аналогов в Украине (Назарчук, Кондратюк, 2007). Данные о неземных водорослях
этого уникального природного образования полностью отсутствуют.
В ходе проведенных исследований были исследованы
водоросли макроскопических разрастаний, развивавшихся на каменистых отслоениях
морского побережья и почвенные водоросли моховых дернин. Всего было исследованы
13 образцов, из которых 8 – макроскопические разрастания и 5 – моховые дернины. Всего в
исследованных образцах было обнаружено 57 видов водорослей, принадлежащих к 5
отделам: Cyanoprokaryota – 9, Chlorophyta – 35, Xanthophyta – 4, Eustigmatophyta – 1, Bacillariophyta – 8. Наиболее распространенными в исследованных образцах оказались одноклеточные
зеленые и нитчатые водоросли. В тоже время следует отметить, что видовой состав
водорослей двух исследованных биотопов отличался.
В макоскопических образцах на каменистых выходах
выявлено 25 видов (таб. 1) из 4 отделов: Cyanoprokaryota – 3, Chlorophyta –
18, Eustigmatophyta -1. Количество видов в пробе колебалось от одного до
11 видов, и в среднем составляла 5 видов. Все отмеченные рода были представлены
1-2 видами. Следует отметить, что в исследованных образцах полностью
отсутствовали представители желтозеленых водорослей, что, вероятно, объясняется
тем, что эта группа мало распространена на каменистых субстратах, предпочитает
прохладный и влажный климат, а также очень чувствительна к действию
неблагоприятных факторов окружающей среды. Невысокое видовое разнообразие, небольшое
количество видов в пробе, полное отсутствие желтозеленых водорослей
свидетельствуют об экстремальном характере исследованного биотопа.
Характерной особенностью этого биотопа является
доминирование нитчатых ульвофициевых водорослей из родов Dilabifilum,
Pseudendoclonium, Printzina, которые преобладают во влажных местообитаниях в
зонах умеренного и морского климата. Род Dilabifilum и его типовой вид D. arthopyreniae (Vischer
et Klement) Tschermak-Woess был описан
из лишайника Arthopyrenia kelpii, который
развивался на раковинах моллюсков, живущих на морском побережье (Ettl, Gärtner, 1995). Позже был найден и в других типах биотопов, в
частности, в окультуренных почвах (Ihda et al, 1996), солончаках (Vinogradova, Darienko, 2008),
пещерах (Darienko, Hoffmann, 2006), цветении в открытом море (ncbi).
Род Pseudendoclonium и его типовой вид Ps. submarinum Wille, были описаны из обрастаний мертвой древисины
погруженной в морскую воду (Wille, 1901).
Второй вид был описан Ps. printzii (Vischer) Bourrelly был
описан почв, но его последующие находки на коре деревьев и засоленных почвах
демонстрируют его пластичность (Ettl, Gärtner, 1995; Vinogradova, Darienko, 2008).
Виды родов Printzina и Trentepohlia являются широко распространенными
на каменистых выходах и коре деревьев в регионах с влажным тропическим,
умеренным и морским климатом.
Представители упомянутых выше родов доминировали в 5
из 8 исследованных образцов. В одном из оставшихся трех доминировал вид Gloeocapsa dermochroa Nägeli, еще в двух
– Desmococcus olivaceus
(Pers. ex. Ach.) Laundon и Pseudococcomyxa elongata Chodat et Jaag. Что касается видов рода Pseudococcomyxa, то представители этого рода часто присутствуют в
морских биотопах (Ciniglia et al, 2005; Broady, 1987).
Другие, найденные нами виды, относятся к широко распространенным
в наземных биотопах. Следовательно, специфика видового состава макроскопических
разрастаний кристаллических выходов состоит в присутствии нитчатых форм
ульвофициевых водорослей, которые тяготеют к морским и засоленным влажным
биотопам.
В почвах под моховыми дернинами выявлено 44 вида
водорослей (таб. 1) из 5 отделов: Cyanoprokaryota – 6, Chlorophyta – 25, Xanthophyta – 4, Eustigmatophyta
– 1, Bacillariophyta – 8. Количество видов в пробе колебалось от 12 до 20
видов и в среднем составляло 16,5 видов на пробу. Все отмеченные рода были
представлены 1-2 видами. Видовой состав почвенных водорослей исследованного
биотопа имеет две особенности: во-первых, относительно высокое количество
диатомовых водорослей – 8 видов. В наших пробах кроме широко распространенных в
почвах видов встречались диатомеи приуроченные к водным биотопам (Achnanthes sp., Nitzschia sp.) и иногда к солоновато водным (Navicula pusilla W. Sm.) (Bukhtiyarova,
1999). Diadesmis contenta (Grunow ex Van Heurick) Mann in Round – типичный
обитатель хорошо увлажненных каменистых субстратов (Darienko, Hoffmann, 2006).
Кроме того, в пробах часто присутствовал вид Navicula pellicullosa (Bréb.) Hilse, который, несмотря на то, что является широко распространенным, все же тяготеет к степным ценозам .
Во-вторых, в видовом составе
присутствуют также одноклеточные зеленые водоросли, являющиеся типичными
представителями водных биотопов – Keratococcus bicaudatus (A. Braun) J.B. Petersen, Selenastrum bibraianus Reinsch (Царенко, 1990). Присутствие в видовом составе водных представителей
свидетельствуют о хорошем увлажнении, которое обеспечивается способностью моховых
дернин к аккумуляции воды. Также нами были отмечены виды, распространенные на
хорошо увлажненных каменистых субстратах – Chlorolobion lunulatum Hindák, виды рода Pseudococcomyxa (Ettl, Gärtner, 1995). В
видовом составе было отмечено ряд интересных с таксономической точки зрения
видов водорослей, требующих более тщательного изучения из родов Pseudococcomyxa,
Diplosphaera, Stichococcus. В целом видовой состав водорослей найденных в почвах
моховых дернин более сходен с почвенными водорослями, чем с литофитными, хотя
их влияние тоже присутствует.
Таким образом, наши исследования показали достаточно
высокое видовое разнообразие наземных водорослей на острове Змеиный, которое
имеет свою специфику, связанную с климатическими условиями и особенностями исследованных
биотопов.
Список литературы
Назарчук Ю.С., Кондратюк С.Я. Лишайники острова Зміїний (Україна) // Укр. бот.
журн. – 2007. – 64 (7). – С. 859-867.
Царенко П.М. Краткий определитель хлорококковых
водорослей Украинской ССР. – Киев,
Наукова думка, 1990. – 206 с.
Broady P.A. The morphology,
distribution and ecology of Pseudococcomyxa simplex (Mainx) Fott (Chlorophyta, Chlorellaceae),
a widespread terrestrial Antarctic alga. // Polar Biol. – 1987. - 7. – P.
25-30.
Bukhtiyarova L.M. Diatoms of Ukraine. Inland waters. – Kiev, 1999. – 133 pp.
Ciniglia C.,
Valentino G.M., Cennamo R., De Stefano M., Stanzione D., Pinto G., Pollio A.
Influences of geochemical and mineralogical constraints on algal distribution
in acidic hydrothermal environments: Pisciarelli (Naples, Italy) as a model
site // Arch. Hydrobiol. – 2005. – 162. P. 121-142.
Darienko T., Hoffmann L. Diversity and ecology of
sandstone–inhabiting algae in casemates of Luxembourg // Int. J. Algae. –
2006. - 8. – P. 109–128.
Ettl H., Gärtner G. Syllabus
der Boden–, Luft–, und Flechtenalgen. Stuttgart, Jena, New York, Gustav
Fischer, 1995. - 710 pp.
Ihda T., Nakano T., Iwatsuki Z.
Dilabifilum arthopyreniae (Chlorophyta) newly found in Japan // Nova Hedwigia.
– 1996. – 63 (1-2). – P. 195-201.
Vinogradova O.N., Darienko T.M.
Algae of Azovo-Syvashsky National Nature Park (Ukraine) // Int. J. Algae. –
2008. – 10 (2). – P. 1-14.
Wille N: Studien über Chlorophyceen I-VII //
Videnskabsselskabets Skrifter. I. Math.-naturv. Klasse, Christiania – 1901.- 6.- P. 1-46.
Почвенная и эпифитная альгофлора
территории Национального парка «Башкирия»
Дубовик И.Е.,
Рахматуллина И.В., Климина И.П., Смирнова Н.Г.
Soil and epiphytic algal flora of the
National Park «Bashkiria»
Dubovik I.E., Rachmatullina I.V., Klimina I.P.,
Smirnova N.G.
ГОУ ВПО
Башкирский государственный университет
450074, г. Уфа, ул. Заки Валиди, 32, тел. (347) 2736634
e-mail: dubovikie@mail.ru
Проведены исследования почвенных и
эпифитных водорослей на территории Национального парка (НП) «Башкирия». В
почвах был обнаружен 231 вид и внутривидовой таксон водорослей из 6 отделов, 10
классов, 26 порядков, 55 семейств, 108 родов.
Ведущим по числу представителей является
отдел Cyanoprocaryota – 96 видов и
разновидностей (42%). Отдел Chlorophyta представлен 75 видами и внутривидовыми таксонами (32,5%). Bacillariophyta – 38 (16,5%), Xanthophyta - 14 (6%). Представители отделов Euglenophyta и Dinophyta находятся в подчиненном положении и
представлены незначительным числом видов – 6 (2,6%) и 1 (0,6%) вид
соответственно. Единственный представитель последнего отдела Ceratium hirundinella встречен на урезе реки Нугуш.
Соотношение ведущих
отделов Cyanoprocaryota/Chlorophyta для всей
почвенной альгофлоры НП составляет 1,2.
Наибольшим числом таксонов
представлены порядки Oscillatoriales
– 45 видов и разновидностей, Chlorococcales –
40, Nostocales – 27, Naviculales –
17, Chroococcales – 16. Остальные порядки представлены незначительным
числом таксономических единиц. Выявлено 16 одновидовых семейств, что составило
6,9 %.
Экологическая структура альгоценозов исследованных участков парка включала в себя 12 жизненных
форм: Ch40 hydr39 P30 C27 amph25 X15 B13 H12 CF9 NF8 PF7 M6 .
Основу таксономической структуры
составляют водоросли как типично эдафофильные Ch-, P-, C-форм, так и гидрофильные и амфибиальные hydr- и amph- форм, что объясняется близким расположением
реки.
В состав доминантного комплекса нарушенных
участков стабильно входят нитчатые синезеленые р.р. Jaaginema, Leptolyngbya, Phormidium, Oscillatoria, Trichormus, Anabaena и одноклеточные зеленые родов Chlamydomonas, Chlorella.
Всего в исследованных почвенных образцах
липово-кленового леса Национального парка было выявлено 83 вида и внутривидовых
таксонов водорослей, которые по отделам распределились следующим образом: Chlorophyta –38, Cyanoprocaryota - 29, Xanthophyta – 9, Bacillariophyta - 5, Euglenophyta - 2.
Бедность видового состава Bacillariophyta является отличительной чертой видового
разнообразия почвенных водорослей леса. Так, за трехгодичный период изучения
лесных экосистем территории Национального парка, было обнаружено всего 5 видов
и внутривидовых таксонов диатомовых: Hantzschia amphioxys var. аmphioxys, H. amphioxys var. сapitatа, Navicula mutica var. mutica, Pinnularia borealis, P. minor.
Зеленые оказались самыми многочисленными и
представлены видами 4 порядков: Chlamydomonadales, Tetrasporales,
Chlorococcales, Ulotrichales.
Ведущие семейства: Chlorococcaceae (7), Pseudanabaenaceae (7), Phormidiaceae (6), Oscillatoriaceae (5) составляют 49% от всей
идентифицированной альгофлоры исследованных лесов. Ведущие роды: Chloroccocum
(5), Leptolyngbya (5), Phormidium (5), Oscillatoria (5), Chlamydomonas (4) в совокупности занимают 52% определенных видов.
Доминирующие виды: Chloroccocum infusionum, C. minutum, Chlamydomonas atactogama, Ch. gloeogama, Radiosphaera dissecta, Cylindrospermum licheniforme f. licheniforme.
Единая экологическая структура почвенных
водорослей данного леса выражена
формулой: Ch13C12Cf11P10amph8X7hydr5B5Nf5M3Pf2H2.
В дубо-липняке было выявлено 58 видов и
внутривидовых таксонов водорослей, из них Chlorophyta – 26, Cyanoprocaryota - 15, Xanthophyta – 9, Bacillariophyta – 8. Здесь выявлены
те же закономерности, что и в первом широколиственном лесу. Доминировали виды родов Synechococcus, Chlorococcum, Phormidium.
Преобладание одноклеточных водорослей
убиквистов, относящихся к Ch-форме, и ксерофитных представителей Р-
формы связано с антропогенным нарушением почвы. Сравнивая исследованные участки
леса нужно отметить, что лесная альгофлора характеризуется доминированием эдафофильных
видов (68 таксонов рангом ниже рода), количество же amph- и hydr-форм малозначительно: 9 и 6 соответственно.
Распределение
видового состава почвенной альгофлоры происходит неоднозначно: по мере
возрастания антропогенной нагрузки в лесах наблюдается стадия увеличения
видового разнообразия водорослей. Это связано с разрушением почвенно-растительного
покрова, что ведет к увеличению количества экологических ниш для водорослей и
возрастанию флористического разнообразия в альгогруппировках за счет вселенцев
и аллохтонных видов. В то же время степень антропогенной нагрузки еще
незначительна и не вызывает «выпадения» чувствительных к ней видов.
На участках, активно подвергающихся
рекреационной нагрузке (тропинки, гравийная дорога, кострище), при сильно
нарушенном почвенно-растительном покрове, происходит уменьшение синезеленых
азотфиксирующих гетероцитных водорослей (СF – формы). Рост видового разнообразия на
нарушенных участках осуществлялся за счет водорослей отдела Cyanoprocaryota и Chlorophyta.
В целом, альгофлора урезов характеризуется
малочисленными семействами (1-2 вида) и повторяет тенденцию формирования
большинства альгоценозов.
Исследования
эпифитных водорослей позволили идентифицировать 24 вида и внутривидовых
таксона, относящихся к 3 отделам (Chlorophyta, Cyanoprocaryota, Bacillariophyta), 4
классам, 8 порядкам, 13 семействам. Спектр экобиоморф выражен формулой Сh13H2B1P3C3CF2.
Эпифитная
альгофлора характеризовалась преобладанием отдела Chlorophyta, составляющего 62,5% от общего числа
обнаруженных видов. Представители зелёных водорослей распределились на 4
порядка: Chlorococcales, Ulotrichales, Chlorosarcinales, Tetrasporales.
Также в ходе исследования выявлен сквозной вид, встреченный на всех
обследованных территориях (деревьях). Это представитель зеленых водорослей - Desmococcus olivaceus, относящийся к Ch – форме, устойчивый к различным
неблагоприятным условиям. Наши данные совпадают с результатами других
исследователей, которые часто обнаруживали Desmococcus olivaceus на деревьях и других наземных объектах
(Вассер и др., 1989; Воронкова, 1997, 1998; Дубовик, 2005).
На
втором месте по числу видов стоит отдел Cyanoprocaryota (33,3 %), в который
вошли такие порядки, как Chroococcales, Oscillatoriales, Nostocales. Ведущие
роды: Microcystis (3), Phormidium (3).
Анализ
эпифитной альгофлоры национального парка по морфотипам (Пивоварова, Факторович,
2001) показал преобладание одноклеточных неподвижных и
колониально-одноклеточных водорослей, каждый из которых представлен 8 видами,
несколько меньшее количество нитчатых морфотипов - 6, меньше всего видов
принадлежит к группе колониально-нитчатых водорослей - 2.
Представители
диатомовых водорослей отмечены единичным таксоном (Hantzschia amphioxys).
Возможно, более подробные исследования обнаружат и другие виды.
Пространственно–временная
динамика структуры
ценопопуляций
редкой черноморской водоросли
Cladostephus spongiosus
(Huds.) C. Ag. (РНАЕОРhУТА)
Евстигнеева И.К., Таковская И.Н.
Spatio–temporal dynamics of the rare Black sea’s
alga Cladostephus spongiosus (Huds.) C. Ag. (Рhaeophyta)
coenopopulations structure
Evstigneeva
I.K., Tankovskaya
I.N.
Институт биологии южных морей НАН Украины
пр. Нахимова, 2; г. Севастополь, 99011, Украина
е-mail: logrianin@nm.ru
В одной из
последних сводок по бентосной флоре Черного моря олигосапробная бурая водоросль
Cladostephus spongiosus
(Huds.) C. Ag. причислена к группе редких видов, что уже само по
себе делает исследования его сообществ и ценопопуляций актуальными. По нашим
данным, в
настоящее время в прибрежье 14 районов
(бухты Карантинная, Ласпи, Судакская; мысы Херсонесский, Айя, Сарыч; Никитин; Балаклавский,
а также Золотой пляж (г. Балаклава), урочище Батилиман; поселки крымского
южнобережья Изумруд, Форос, Кацивели, Мисхор), охватывающих юго-запад, юг и частично
юго-восток Крыма, кладостефус выполняет роль содоминанта, а в отдельных случаях
и доминанта весенне-летних сообществ бентоса и перифитона. На долю его
фитомассы приходится от 24 до 45% таковой у альгоценозов в целом. Несмотря на
такую функциональную значимость биология данного вида изучена крайне слабо и
частичному решению этой проблемы могли бы способствовать его демэкологические
исследования.
Целью работы стало
изучение размерно-весовой структуры черноморских ценопопуляций Cladostephus spongiosus и ее
пространственно-временной динамики.
Для оценки степени и
характера изменчивости характеристик слоевища применяли коэффициент вариации
(С,%) и семибалльную шкалу вариабельности биологических признаков (Зайцев,
1990).
В бентосных сообществах прибрежья Черного моря
произрастают особи C. spongiosus, индивидуальная длина которых достигает 8 - 145 мм, а масса – 0,001 - 2,5 г. Средняя индивидуальная
длина слоевищ в летних популяциях составляет 59 ± 2 мм, а коэффициент пространственной вариации - 40%.
Летом, в период массовой вегетации водорослей средняя
для каждого из районов длина талломов кладостефуса изменяется от 36 ± 5 (урочище Батилиман) до 79 ± 7 (мыс Сарыч) мм, составляя в
среднем за сезон 59 ± 7 мм.
Коэффициент вариации С, равный 23%, позволяет присвоить
пространственной изменчивости анализируемого признака 2 балла, что
соответствует «нижней норме» вариаций биологического признака.
Для ценопопуляций в акватории мысов Сарыч и
Балаклавский, урочища Батилиман характерны наиболее крупноразмерные слоевища
(77 - 79 мм),
а для мыса Айя – самые мелкие особи (40 ± 7 мм).
Значения коэффициента С для исследуемого параметра
изменяются от 19 - 22 (Судакская бухта, мысы Никитин и Балаклавский) до 50%
(мыс Айя). По шкале вариабельности признаков длина слоевища в ценопопуляциях каждого
из районов варьирует чаще нормально, реже – значительно.
Размерная структура летней ценопопуляции кладостефуса
в исследованных районах включает от 5 до 9 классов с шагом 1 см. Наиболее часто она
сформирована семью классами. Особи первых четырех классов характерны для
ценопопуляций не каждого района, хотя при этом их размерный спектр обязательно
имеет целостный вид без выпадения из его состава тех или иных промежуточных
групп. В большинстве случаев позицию лидеров занимают особи 2 - 6 размерных
классов, доля которых составляет 20 - 29%.
Размерная структура ценопопуляций кладостефуса
меняется во времени. В районах исследования он входит в состав прибрежных
фитоценозов в период с мая по ноябрь, а также в феврале. В это время
индивидуальная длина слоевища варьирует в широких границах: от 8 (11) мм в мае
и октябре и до 145 мм
в июле, составляя в среднем 50 ± 9
мм при коэффициенте С = 27%. Размах изменчивости
линейных размеров слоевища водоросли наиболее существенен в июле (115 мм) и октябре (121 мм). Сначала этот
параметр претерпевает увеличение с мая по июль, затем уменьшение и стабилизацию
на достигнутом уровне в последующие три месяца, после чего в холодное время
года происходит его очередное снижение.
Среднемесячная длина слоевища кладостефуса в период
вегетации варьирует от 32 ± 5
мм в феврале до 70 ± 4 мм в июле. С мая по июль размеры
слоевища удлиняются почти в 2 раза. С августа по ноябрь наблюдается постепенное
снижение данного показателя в той же мере. В февральских популяциях слоевища
самые короткие, что скорее связано со сменой поколений. На протяжении почти
всего срока наблюдений среднемесячная длина варьирует в пределах «верхней» нормы
(С = 32 - 41%) и только в октябре изменчивость признака приобретает характер
значительной (С = 46%), а в ноябре – «нижне» нормальной (С = 23%).
О межгодовой изменчивости размеров слоевища можно
судить на основе данных, полученных летом 2003 - 2006 и в 2008 гг. Наиболее
крупные растения встречались в ценопопуляциях 2004 г. (79 ± 7 мм), близки к ним и особи
ценопопуляции следующего года (67 ±8
мм). С 2006
г. наблюдается снижение средних размеров почти в два
раза. Размах вариации линейных размеров наиболее велик в первый год наблюдений,
когда в состав ценопопуляции входили самые крупные для всего периода вегетации
растения. Второй пик приходится на 2006 г. Значения коэффициента вариации длины
слоевища в разные годы изменяется от 28 (2004 г.) до 50% (2008 г.). За исключением
последнего года, когда вариабельность анализируемого параметра была
значительной, изменения длины всегда соответствовали «верхней» норме (28 -
38%).
Число классов, слагающих разногодичные размерные
спектры, варьировало в незначительных пределах: от 7 (в 2003 и 2008 гг.) до 10
(в 2004 г.).
В первый год в популяции отсутствовали особи 1 класса, а во второй – еще и 2 –
4-го. В остальное время ценопопуляции включали весь спектр размерных групп,
характерных для кладостефуса.
По годам меняется перечень классов, лидирующих по
частоте встречаемости образующих их особей. В первые два года в ценопопуляции
можно было выделить единственный господствующий класс, доля которого составляла
26%. В последующие годы список таких классов расширяется до трех. Независимо от
года наблюдений, доля доминирующего размерного класса остается почти без
изменений, тогда как участие крайних для спектра классов всегда незначительна
(3 - 8%), что соответствует статистическим закономерностям модификационной
изменчивости признака.
Масса слоевища в летних ценопопуляциях
разных районов изменяется от 0,06 ± 0,02 г (мыс Никитин) до 1,28 ± 0,7 г (поселок Мисхор),
составляя в среднем за сезон 0,39 ± 0,14 г. Коэффициент вариации анализируемого
признака в ценопопуляциях, произрастающих на разных участках морского
мелководья, достигает 76% и свидетельствует о большой пространственной
изменчивости (5 баллов). У данного вида водорослей накопление массы наиболее
активно протекает на закрытых участках моря, поскольку в противоположных
условиях возрастает вероятность повреждающего действия волны. По сравнению с
индивидуальной длиной масса является более пластичным признаком. Летом этот
показатель изменяется от 0,01 до 7,0
г, составляя в среднем для исследованной акватории 0,37±0,05 г при коэффициенте
вариации 172%, свидетельствующем об аномально высоком варьировании
биологического признака. Такой характер изменчивости наиболее полно проявляется
на участке берега в районе Балаклавского мыса, Золотого пляжа и до бухты Ласпи,
а также у мыса Сарыч. В остальных районах изменчивость признака чуть ниже, но и
она соответствует категориям большой, очень большой и значительной.
Среднемесячная масса слоевищ C. spongiosus колеблется
от 0,03 ± 0,01 до 0,40 ± 0,07
г с максимумом в теплое время года (июль – август) и
минимумом в холодное (ноябрь, декабрь). Помесячная изменчивость признака обычно
выше, чем межмесячная. Коэффициент корреляции «r» между помесячными изменениями длины и массы слоевища
кладостефуса изменяется от 0,7 в августе до 0,94 - 0,96 в июле и ноябре.
Высокие значения этого коэффициента свидетельствуют о наличии прямой и сильной
корреляционной связи между характеристиками слоевища. Чем крупнее по размерам
растение, тем больше вероятность образования на его главном стволе боковых
осей, за счет чего, в частности, и происходит наращивание массы.
В летних ценопопуляциях разных лет масса
слоевища кладостефуса варьирует в широких границах. Коэффициент разногодичной
вариабельности массы слоевища неизменно высок и нарастает от начала до конца
наблюдений. В состав весового спектра летней ценопопуляции разных лет входит от
4 до 13 классов, среди которых неизменно доминируют особи, масса слоевища
которых составляет 0,1 г.
Доля таких особей составляет 48-79%. В отличие от размерного спектра весовой характеризуется
«разорванностью» за счет выпадения из общего спектра некоторых классов.
Таким
образом, данные, впервые полученные для черноморского
кладостефуса, позволяют определить границы размерно-весовых спектров его
ценопопуляций в различных районах крымского прибрежья Черного моря и выявить
специфику их меж- и внутригодичных изменений.
ВОДОРОСЛИ В НАЗЕМНЫХ ЭКОСИСТЕМАХ БАЙКАЛЬСКОЙ СИБИРИ
Егорова И.Н.,
Судакова Е.А.
ALGAE IN TERRESTRIAL
ECOSYSTEMS OF BAICALIAN SIBERIA
Egorova I.N., Sudakova E.A.
Сибирский институт физиологии и биохимии растений СО РАН
664033, г. Иркутск - 33, Лермонтова-132, тел.:
8(3955)42-45-95, факс: 8(3955)51-07-54
e-mail: egorova@sifibr.irk.ru
В ботанико-географической литературе территория
Иркутской области, республики Бурятия и Забайкальского края (бывшая Читинская
область) рассматривается как Байкальская Сибирь (Пешкова, 1985). Это горная
страна с резко пересеченным рельефом. Регион располагается на стыке активного
взаимодействия северо-западных и юго-восточных воздушных масс, что приводит к
формированию континентального климата с варьированием от умеренного до
ультраконтинентального. Особенности рельефа и климата региона обусловливают
сложную мозаику растительности с господством лесного типа. Территория богата
минеральными и термальными водами.
Планомерные исследования водорослей в наземных
экосистемах Байкальской Сибири были начаты Е.А. Судаковой в 70-е годы прошлого
века. На протяжении более чем 30 лет ею изучались водоросли почв на территории
Иркутской области и республики Бурятия. Исследованиями охвачены лесные,
тундровые, луговые, степные, болотные почвы и почвы антропогенно нарушенных
ландшафтов. Альгофлору почв Приольхонских степей (Иркутская область) изучали
В.М. Андреева и Н.В. Сдобникова (1975). Водоросли почв и подстилки на
обращенном к озеру Байкал макросклоне хребта Хамар-Дабан и у его подножия в
лесных, луговых, остепненных луговых и гольцовых сообществах (Байкальский
заповедник, Бурятия) исследовали Г.Н. Перминова, И.С. Гутишвили, Е.В. Китаев
(1989). Изучением альгофлоры почв, формирующихся в зоне разгрузки термальных
вод Иркутской обл. и Бурятии, занимается Е.Н. Максимова (2000-2005). Водоросли
каменистых субстратов на территории Иркутской области и Бурятии изучались Т.А.
Сафоновой (2000, 2001, 2008). Егоровой И.Н. с 2001 г. ведутся исследования
водорослей в наземных экосистемах Байкальской Сибири, наибольшее внимание
уделяется водорослям растительных субстратов (древесных и мохообразных).
Водоросли изучали методами, опубликованными в работах
Э.А. Штиной, М.М. Голлербаха (1976), Т.И. Алексахиной, Э.А. Штиной (1984),
Водоросли…(1989) и т.п. Таксономический список водорослей составлен в
соответствии с системой, приводимой в работе И.И. Васильевой-Кралиной (1999) с
выделением отдела EUSTIGMATOPHYTA согласно работам H. Ettl, G. Gärtner
(1995), Н.П. Масюк, И.Ю. Костiков (2002).
Всего выявлено 619 видов водорослей (688 с учетом
внутривидовых таксонов) из 6 отделов, 9 классов, 28 порядков, 66 семейств, 179
родов. Анализ полученных данных проведен на внутривидовом уровне.
Разнообразием представителей отличаются отделы
CYANOPHYTA – 264 и CHLOROPHYTA – 239 видовых и внутривидовых таксонов, что
составляет 38,4 % и 34,7 % соответственно от общего состава альгофлоры.
Выявлено довольно значительное число видов и разновидностей водорослей из
отдела BACILLARIOPHYTA – 108, 15,7 % от всех найденных водорослей. Наибольшее
число этих организмов отмечалось в почвах, формирующихся вблизи водоемов:
луговых, болотных, термальных источников, – а также на орошаемых землях.
Представители отдела XANTHOPHYTA занимают четвертую позицию, обнаружено 69
видов, разновидностей и форм, 10,0 %. Отделы EUSTIGMATOPHYTA и EUGLENOPHYTA
представлены каждый 4 видами, их долевое участие в альгофлоре составляет по 0,6
%.
В таблице 1 представлены данные о таксономической
структуре альгофлоры. Как видно из приведенных сведений, ведущие таксоны
альгофлоры составляют лишь 1/3 часть от соответствующих таксономических единиц.
При этом они объединяют более 70% состава водорослей.
Таблица 1
Состав альгофлоры наземных экосистем Байкальской
Сибири
|
Таксон
|
Число таксонов
|
Средний уровень видовой насыщенности (СУВ)
|
Число таксонов выше СУВ
|
Число водорослей в ведущих таксонах / %
|
|
Класс
|
9
|
76,4
|
3
|
650 / 94,5
|
|
Порядок
|
28
|
24,6
|
8
|
587 / 85,3
|
|
Семейство
|
66
|
10,4
|
21
|
527 / 76,6
|
|
Род
|
179
|
3,8
|
49
|
491 / 71,3
|
Ведущие порядки по видовому разнообразию ранжируются
следующим образом: Oscillatoriales – 131 вид и разновидность, Chlorococcales – 107, Raphinales – 94, Nostocales
– 76, Mischococcales
– 49, Ulotrichales – 44, Chroococcales – 42, Chlamydomonadales – 42 вида, разновидности и формы.
На родовом уровне ведущими являются следующие роды: Oscillatoria – 43, Chlamydomonas – 40, Phormidium –
37, Nostoc – 20, Pinnularia – 19, Anabaena, Navicula –
по 17, Gloeocapsa – 16, Lyngbya –
14, Schizothrix, Plectonema, Characiopsis – по 12, Calothrix, Nitzschia, Tetracystis
– по 10, Cylindrospermum, Scytonema, Tolypohrix, Stigonema, Cymbella, Tribonema, Chlorococcum, Chlorella
– по 8, Microcystis, Eunotia, Scenedesmus, Klebsormidium, Stichococcus,
Trentepohlia – по 7, Stauroneis, Pleurochloris, Monodus, Xanthonema, Cosmarium – по 6, Synechocystis, Microcoleus, Achnanthes, Epithemia, Hantzschia, Ankistrodesmus – по 5, Pseudoanabaena, Gomphonema, Bumilleriopsis, Bracteacoccus, Tetraёdron, Scotiellopsis, Chlorosarcinopsis, Leptozira, Closterium – по 4 видовых и внутривидовых таксона.
По приуроченности водорослей к определенным условиям
обитания, в целях анализа, мы выделяем три группы: почвенные водоросли;
водоросли каменистых и растительных субстратов.
Почвенная
альгофлора (рассматриваются водоросли, живущие в почве, на ее поверхности и в
подстилке) насчитывает 552 вида, разновидности и формы из 6 отделов. Лидирует
отдел CYANOPHYTA – 209 видовых и внутривидовых таксонов, 37,9 % от общего
состава почвенной альгофлоры. На втором месте CHLOROPHYTA – 171 вид и разновидность,
30,9 %. Практически все BACILLARIOPHYTA обнаружены в почвах – 105 видов и
разновидностей, 19,1%. Так же в почвах найдено большинство представителей
XANTHOPHYTA – 62, 11,2 %, и EUGLENOPHYTA – 4, 0,7%. Отмечен здесь и
представитель EUSTIGMATOPHYTA – 1 вид, 0,2 %.
Альгофлору почв составляют водоросли из 150 родов, 62
семейств, 24 порядков, 9 классов (табл. 2).
Таблица 2
Состав альгофлоры почв Байкальской Сибири
|
Таксон
|
Число таксонов
|
Средний уровень видовой насыщенности (СУВ)
|
Число таксонов выше СУВ
|
Число водорослей в ведущих таксонах / %
|
|
Класс
|
9
|
61,3
|
4
|
502 / 90,9
|
|
Порядок
|
24
|
23,0
|
8
|
481 / 87,1
|
|
Семейство
|
62
|
8,9
|
18
|
418 / 75,7
|
|
Род
|
150
|
3,7
|
43
|
402 / 72,8
|
В почвенной альгофлоре, также как и в целом в
альгофлоре наземных экосистем Байкальской Сибири, основной вклад в видовое
разнообразие вносит лишь 1/3 часть таксонов рангом выше вида (табл. 2). Ведущие
порядки остаются теми же, однако ранжируются несколько иначе: Oscillatoriales – 123 вида,
разновидности и формы, Raphinales – 94, Chlorococcales
– 73, Nostocales – 56, Mischococcales – 44, Chlamydomonadales – 42, Chroococcales – 25, Ulotrichales – 24. В составе почвенной альгофлоры повышаются
позиции порядка водорослей BACILLARIOPHYTA.
В числе лидирующих по разнообразию представителей
родов отмечены следующие: Oscillatoria – 43, Chlamydomonas – 40, Phormidium –
32, Pinnularia – 18, Anabaena, Navicula – по 17, Lyngbya, Nostoc – по 14, Schizothrix – 12, Characiopsis – 11, Plectonema – 10, Nitzschia – 9, Cymbella –
8, Gloeocapsa – 7, Microcystis, Microcoleus, Scytonema, Calothrix, Achnanthes,
Stauroneis, Epithemia, Hantzschia, Pleurochloris, Tetracystis, Klebsormidium, Cosmarium – по 5, Pseudoanabaena, Tolypohrix, Gomphonema, Bumilleriopsis, Xanthonema, Tetraёdron, Ankistrodesmus, Closterium – по 4 видовых и внутривидовых таксона. Как видно из
приведенного списка ведущих родов, первые три места занимают те же роды, что и
в общем составе альгофлоры.
Альгофлора различных наземных субстратов (каменистых,
растительных) в рассматриваемом регионе представлена 274 видами,
разновидностями и формами. Найдены водоросли из 5 отделов. Доминируют
CYANOPHYTA – 124 видовых и внутривидовых таксонов, 45,3 % от общего состава
альгофлоры наземных субстратов, и CHLOROPHYTA – 120 видов и разновидностей,
43,8 %. Вторую позицию занимают XANTHOPHYTA – 17, 6,2 %. Влаголюбивые
BACILLARIOPHYTA единичны. Здесь их найдено всего 9 видов и разновидностей, 3,3
%. Немногочисленны и EUSTIGMATOPHYTA – 4 вида, 1,5 %.
Как видно из таблицы 3, в альгофлоре наземных
субстратов ведущие таксономические единицы также объединяют более половины ее
видового состава. Однако здесь, на данном этапе исследования, выявляется
достаточно высокая представленность надвидовых таксонов при их небольшом
видовом разнообразии.
В числе ведущих порядков отмечены только 5: Chlorococcales
– 62, Nostocales – 42, Oscillatoriales – 38, Ulotrichales – 33, Chroococcales – 32. Лидирующие позиции у порядка отдела
CHLOROPHYTA, в сравнении с почвенной альгофлорой, где первые позиции занимают
CYANOPHYTA. Интересно, что второе место по числу представителей у порядка Nostocales, в
альгофлоре почв он занимает лишь четвертую позицию. В рассматриваемой альгофлоре
из числа ведущих выпали порядки, объединяющие наиболее требовательные к
условиям обитания водоросли – Raphinales, Chlamydomonadales
и Mischococcales. Для сравнения, в
альгофлоре каменистых и древесных субстратов они представлены 9, 8 и 11 видами
соответственно.
Таблица 3
Состав альгофлоры наземных субстратов Байкальской
Сибири
|
Таксон
|
Число таксонов
|
Средний уровень видовой насыщенности (СУВ)
|
Число таксонов выше СУВ
|
Число водорослей в ведущих таксонах / %
|
|
Класс
|
8
|
34,1
|
2
|
207 / 75,5
|
|
Порядок
|
16
|
17,1
|
5
|
207 / 75,5
|
|
Семейство
|
43
|
6,4
|
19
|
220 / 80,3
|
|
Род
|
102
|
2,3
|
30
|
176 / 64,2
|
Роды, уровень видового и внутривидового разнообразия
которых выше среднего, ранжируются следующим образом: Phormidium, Gloeocapsa – по
15 видов, разновидностей и форм, Nostoc – 14, Plectonema, Calothrix, Chlamydomonas –
по 8, Stigonema, Tetracystis,
Chlorella,
Trentepohlia – по 7, Scytonema, Tolypohrix, Chlorococcum, Stichococcus – по 6, Microcystis,
Oscillatoria, Klebsormidium – по 5, Anabaena, Leptozira – по 4, Synechococcus, Synechocystis,
Schizothrix, Hantzschia, Xanthonema, Neospongiococcum, Dictyochloropsis,
Myrmecia, Bracteacoccus, Coccomyxa, Scotiellopsis – по 3. Позиции и
состав ведущих родов в альгофлоре наземных субстратов Байкальской Сибири существенно
отличаются от такового почвенной альгофлоры. Преобладают роды, представители
которых способны выносить резкие перепады увлажненности, температуры,
освещенности, поступления минеральных веществ. Выявляется определенная
субстратная приуроченность некоторых родов. В частности, на каменистых
субстратах – наибольшее разнообразие видов Gloeocapsa и Stigonema. Виды рода Trentepohlia преимущественно
развиваются на коре деревьев, лишь немногие на камнях. В наших исследованиях
они не найдены в почве и не регистрировались среди водорослей, ассоциированных
с мохообразными.
Сходство состава почвенной альгофлоры и альгфлоры
различных наземных субстратов рассматриваемого региона составляет 50,0 %
состава водорослей, найденных на камнях, деревьях, мохообразных и 24,8 %
состава водорослей в почве.
СТЕПЕНЬ ИЗУЧЕННОСТИ ВИДОВОГО СОСТАВА ВОДОРОСЛЕЙ
НЕКОТОРЫХ ВОДОЕМОВ СРЕДНЕГО И ЮЖНОГО УРАЛА
Еремкина Т. В.1,
Ярушина М. И.2
The state of some water bodies’ algae biodiversity
studies
in Middle and Southern Ural
Eremkina T.V.1, Yarushina
M.I.2
1Уральский научно-исследовательский институт метрологии,
620000, г. Екатеринбург,
ул. Красноармейская, 4
e-mail: tver60@mail.ru
2Институт экологии растений и животных УрО РАН,
620144, г. Екатеринбург, ул. 8-е Марта, 202
e-mail: nvl@ipae.uran.ru
Изучение биологического разнообразия и его сохранение
- актуальные проблемы в условиях антропогенного воздействия на среду обитания,
одной из важнейших составляющих которой являются водные экосистемы. Объективным
показателем, характеризующим процессы, происходящие в водном объекте, могут
выступать водоросли.
Исследование какой-либо конкретной
флоры водорослей, как правило, начинается с оценки имеющегося видового состава.
При этом в качестве критерия системности для альгофлористических исследований
предлагается использование распределения числа видов по числу родов - зависимости
Виллиса (Баринова и др., 2006). В настоящей работе обобщены результаты анализа
качества и степени изученности видового состава водорослей 16 водоемов Среднего
и Южного Урала, проведенного по оригинальным, архивным и литературным данным
(Ярушина и др., 2004).
На основе унифицированных с учетом современных
представлений о систематике и таксономии списков видов (табл. 1) была
составлена единая база данных и построены зависимости Виллиса для альгофлор исследуемых водоемов.
Таблица 1
Таксономическая структура альгофлор исследуемых
водоемов
|
Отдел
|
Количество таксонов (видов и разновидностей)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
|
Cyanophyta
|
47
|
69
|
84
|
22
|
21
|
47
|
14
|
40
|
34
|
29
|
41
|
17
|
26
|
24
|
22
|
25
|
|
Euglenophyta
|
12
|
33
|
34
|
8
|
14
|
2
|
15
|
17
|
7
|
2
|
7
|
1
|
6
|
24
|
11
|
20
|
|
Dinophyta
|
8
|
9
|
8
|
9
|
2
|
1
|
2
|
12
|
9
|
7
|
7
|
1
|
9
|
7
|
11
|
5
|
|
Cryptophyta
|
3
|
6
|
10
|
-
|
-
|
-
|
3
|
1
|
1
|
-
|
-
|
-
|
4
|
3
|
-
|
4
|
|
Chrysophyta
|
15
|
26
|
28
|
7
|
2
|
-
|
6
|
13
|
5
|
5
|
9
|
3
|
3
|
9
|
3
|
5
|
|
Bacillariophyta
|
90
|
126
|
111
|
144
|
61
|
25
|
54
|
103
|
47
|
43
|
122
|
38
|
39
|
39
|
22
|
41
|
|
Xanthophyta
|
5
|
13
|
8
|
2
|
2
|
3
|
-
|
5
|
-
|
-
|
6
|
1
|
2
|
2
|
3
|
1
|
|
Chlorophyta
|
96
|
165
|
236
|
73
|
85
|
22
|
39
|
72
|
33
|
32
|
92
|
28
|
55
|
60
|
76
|
127
|
|
Raphydophyta
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
1
|
-
|
-
|
-
|
|
Rhodophyta
|
-
|
-
|
-
|
-
|
-
|
-
|
1
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Charophyta
|
-
|
-
|
-
|
1
|
-
|
-
|
-
|
-
|
-
|
-
|
1
|
1
|
-
|
-
|
-
|
-
|
|
Всего
|
276
|
447
|
519
|
266
|
187
|
100
|
134
|
263
|
136
|
118
|
285
|
90
|
145
|
168
|
148
|
228
|
Примечание. 1 – оз. Иткуль; 2 – оз. Синара; 3 – оз. Силач; 4 –
оз. Тургояк; 5 – Аргазинское водохранилище; 6 – оз. Кундравинское; 7 – оз.
Иртяш; 8 – оз. Б. Миассово; 9 – оз. М. Миассово; 10 – оз. Ильменское; 11 – оз.
Б. Кисегач (Ильменская группа); 12 – оз. М. Кисегач (Ильменская группа); 13 –
оз. Б. Таткуль; 14 – оз. Багаряк; 15 – Исетское водохранилище; 16 – Рефтинское
водохранилище
Анализ
полученных графических кривых показал, что зависимость Виллиса в общем
виде в той или иной мере соблюдается для всех составленных списков. Однако
распределение числа видов по числу родов для исследуемых водоемов имеет
различные формы гиперболической зависимости.
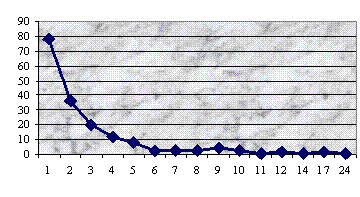 Так, в альгофлорах оз. Синара, Силач (рис. 1), Большой
Кисегач, Большое Миассово (рис. 2) и Иткуль наблюдается плавная зависимость
Виллиса, что позволяет считать выявленные
флоры системой и рассматривать их с позиций системного анализа. По своей форме
полученные кривые сопоставимы с таковыми достаточно хорошо изученных альгофлор
других регионов России (Баринова и др., 2006). Исследуемые водоемы представляют
собой крупнейшие озера Челябинской области, входящие в состав Увильдинской
озерной зоны. Озера зарегулированы в 19 веке в единую водную систему и используются
для хозяйственно-питьвего и промышленного водо- Рис. 1. Зависимость Виллиса
для оз. Силач
Так, в альгофлорах оз. Синара, Силач (рис. 1), Большой
Кисегач, Большое Миассово (рис. 2) и Иткуль наблюдается плавная зависимость
Виллиса, что позволяет считать выявленные
флоры системой и рассматривать их с позиций системного анализа. По своей форме
полученные кривые сопоставимы с таковыми достаточно хорошо изученных альгофлор
других регионов России (Баринова и др., 2006). Исследуемые водоемы представляют
собой крупнейшие озера Челябинской области, входящие в состав Увильдинской
озерной зоны. Озера зарегулированы в 19 веке в единую водную систему и используются
для хозяйственно-питьвего и промышленного водо- Рис. 1. Зависимость Виллиса
для оз. Силач
снабжения,
приема сточных вод, рыбохозяй-
ственных
и рекреационных целей. Данные по видовому составу водорослей для этих водоемов
обобщены за период около 100 лет, включая результаты палеогеографических
исследований донных отложений.
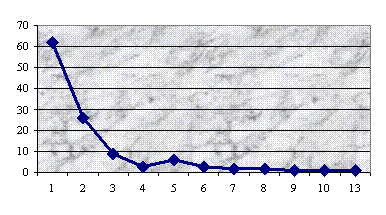 Другую группу водоемов по степени изученности
альгофлор составляют оз. Тургояк, Ильменское, Малый Кисегач,
Кундравинское, Малое Миассово (рис. 3),
Аргазинское водохранилище (рис. 4). Гиперболы представляют собой прогнутые
кривые, но не имеющие плавного падения.
Причиной неравномерности кривых является спорадичность сборов преимущественно
в течение летнего сезона. Кроме того, в
этих водоемах можно отметить недостаточную изученность тех
или иных отделов водорослей. Так, например, в Аргазинском водохранилище требуют
дополнительного изучения диатомовые, золотистые криптофитовые, динофитовые и
желто-зеленые водоросли. Их разнообразие в близлежащих водоемах, сходных с
водохранилищем по происхождению и трофическому статусу (оз. Тургояк, Б. Кисегач)
гораздо выше. В то же время разнообразие зеленых водорослей в оз. Тургояк существенно
ниже, чем в оз. Б. Кисегач, хотя по своим гидрохимическим и гидробиологическим
характеристикам, включая разнообразие диатомовых, эвгленовых, золотистых
водорослей эти водоемы достаточно похожи. Рис. 2. Зависимость
Виллиса для оз. Большое Миассово
Другую группу водоемов по степени изученности
альгофлор составляют оз. Тургояк, Ильменское, Малый Кисегач,
Кундравинское, Малое Миассово (рис. 3),
Аргазинское водохранилище (рис. 4). Гиперболы представляют собой прогнутые
кривые, но не имеющие плавного падения.
Причиной неравномерности кривых является спорадичность сборов преимущественно
в течение летнего сезона. Кроме того, в
этих водоемах можно отметить недостаточную изученность тех
или иных отделов водорослей. Так, например, в Аргазинском водохранилище требуют
дополнительного изучения диатомовые, золотистые криптофитовые, динофитовые и
желто-зеленые водоросли. Их разнообразие в близлежащих водоемах, сходных с
водохранилищем по происхождению и трофическому статусу (оз. Тургояк, Б. Кисегач)
гораздо выше. В то же время разнообразие зеленых водорослей в оз. Тургояк существенно
ниже, чем в оз. Б. Кисегач, хотя по своим гидрохимическим и гидробиологическим
характеристикам, включая разнообразие диатомовых, эвгленовых, золотистых
водорослей эти водоемы достаточно похожи. Рис. 2. Зависимость
Виллиса для оз. Большое Миассово
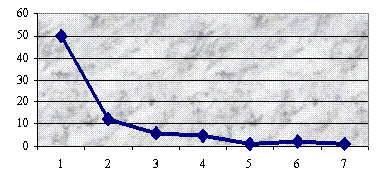 Озера Малое и Большое Миассово (рис. 2, 3), являясь
фактически единым целым и отличаясь лишь морфометрическими характеристиками,
существенно различаются по степени
изученности диатомовых, зеленых, эвгленовых, желтозеленых водорослей и
альгофлоры в целом.
Озера Малое и Большое Миассово (рис. 2, 3), являясь
фактически единым целым и отличаясь лишь морфометрическими характеристиками,
существенно различаются по степени
изученности диатомовых, зеленых, эвгленовых, желтозеленых водорослей и
альгофлоры в целом.
Рис. 3 Зависимость Виллиса для оз. Малое
Миассово
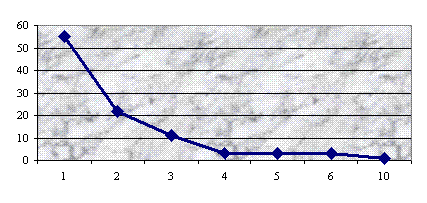 Остальные водоемы – Рефтинское водохранилище (рис. 5),
озера Иртяш, Большой Таткуль
(рис. 6), Исетское водохранилище,
Багаряк - объединены в последнюю
группу, где кривые распределения существенно отличаются от гиперболы. Характер кривых свидетельствует о недостаточности
альгологической выборки для системного
анализа видового богатства. И, действительно, для составления списка видов
водорослей в оз. Иртяш и Большой Таткуль использовались литературные и архивные данные, которые носят
отрывочный характер. В Исетском водохранилище анализировались списки, по-
Остальные водоемы – Рефтинское водохранилище (рис. 5),
озера Иртяш, Большой Таткуль
(рис. 6), Исетское водохранилище,
Багаряк - объединены в последнюю
группу, где кривые распределения существенно отличаются от гиперболы. Характер кривых свидетельствует о недостаточности
альгологической выборки для системного
анализа видового богатства. И, действительно, для составления списка видов
водорослей в оз. Иртяш и Большой Таткуль использовались литературные и архивные данные, которые носят
отрывочный характер. В Исетском водохранилище анализировались списки, по-
Рис.
4 Зависимость Виллиса для Аргазинского водохранилища лученные за два вегетационных
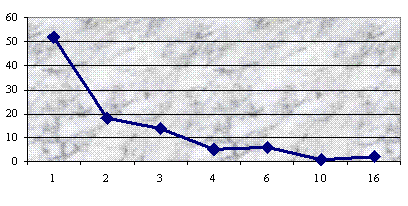 периода 1993 и 2007 гг. Для оз. Багаряк использовались данные
зимних, летних и осенних сборов
за 2005 и 2006 гг., для Рефтинского водохранилища систематизировали списки
водорослей по результатам гидробиологических исследований 1976-1977,
1985, 2005-2006 годов.
периода 1993 и 2007 гг. Для оз. Багаряк использовались данные
зимних, летних и осенних сборов
за 2005 и 2006 гг., для Рефтинского водохранилища систематизировали списки
водорослей по результатам гидробиологических исследований 1976-1977,
1985, 2005-2006 годов.
Отмечено,
что зависимость Виллиса имеет плавный характер
для водоемов с общим количеством видов, разновидностей и форм от 263 до
543. Для второй группы водо-
Рис. 5 Зависимость Виллиса для Рефтинского водохранилища
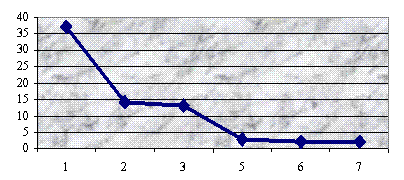
емов
эти величины достигают 90-266 таксонов, в то время как в третьей группе
количество выявленных таксонов колеблется от 134 до 228. Следовательно,
характер кривой не определяется общим количеством отмеченных таксонов.
Таким образом, анализ видового состава альгофлоры с использованием
зависимости Вилиса
с. 6 Зависимость Виллиса для оз. Большой Таткуль позволил объективно
оценить ка-
чество, однородность и полноту
его
изученности в исследуемых водоемах. Кроме того, полученные данные позволяют
определить наименее изученные объекты и оценить возможность применения списков
видового состава не только для флористического анализа, но и для прикладных
целей, например, при экологическом мониторинге и рыбохозяйственных исследованиях.
альгологические исследования на острове
Старичков
(восточная Камчатка). предварительные данные
Жигадлова
Г.Г.
Phycological
studies on Starichkov Island (Eastern Kamchatka).
Preliminary data
Zhigadlova G.G.
Камчатский
филиал Тихоокеанского института географии ДВО РАН
г.
Петропавловск-Камчатский, ул. Партизанская, 6, Россия, 683000,
т. (4152) 423457, факс (4152) 412464
e-mail: Zhigadlova@rambler.ru
Изучая водоросли-макрофиты особо охраняемых природных
территорий Восточной Камчатки, мы проводили альгофлористические исследования на
о. Старичков, Памятнике Природы регионального значения. Остров Старичков и прилегающая к нему
акватория - уникальная природная система, аналогов которой на побережье вблизи
от Петропавловска-Камчатского нет. Несмотря на близость острова к
тихоокеанскому побережью Камчатки и удаленность от Командорских о-вов, было
отмечено значительное сходство водорослевых сообществ о. Старичков с
командорскими (Иванюшина и др., 1991).Остров является ценным для науки объектом
– местом наших многолетних наблюдений по экологии и биологии некоторых массовых
видов водорослей.
Остров Старичков представляет собой небольшой
скалистый останец вулканического происхождения, площадью 0.4 км2 ,
расположенный в Авачинском заливе в 3 км от камчатского побережья (Рис. 1) и по
всему периметру окружен 3-мильной охранной морской зоной. Вблизи острова расположены
довольно высокие отвесные скальные образования – кекуры.
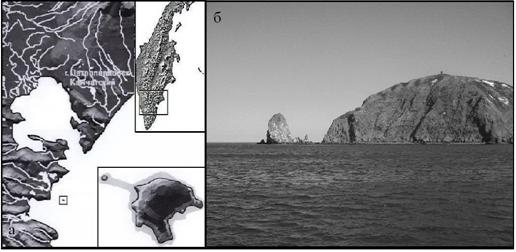
Рис. 1. Район исследований. а – карта-схема района; б
– о. Старичков и кекур Часовой
Одной из главных особенностей острова является крупный
птичий базар, занимающий практически весь остров. Авифауна оказывает заметное
влияние на химический состав прибрежных вод, вызывая их эвтрофикацию за счет
продуктов жизнедеятельности птиц (Иванов, 2003). Акватория вокруг о-ва
Старичков характеризуется большим биоразнообразием и высокой продуктивностью бентосных
организмов, включая водоросли-макрофиты.
Полученные данные являются результатом обработки альгологического
материала, собранного на о. Старичкове в период с 1984 по 2008 г. Водоросли собирали с
мая по октябрь на литорали во время отливов, из штормовых выбросов и с
использованием легководолазной техники на глубинах 1−25 м. Собранный
материал изучали по стандартной методике с использованием светового микроскопа
«Олимпус». Для изучения биологии некоторых видов водорослей в полевых условиях
нами в 2002 г.
был заложен экспериментальный полигон на одном из мысов о. Старичков.
Наблюдения проводились с весны (май) до поздней осени (конец октября).
Таксономическое разнообразие макрофитов о-в Старичков
достаточно велико и представлено 3 отделами: Ochrophyta (класс Phaeophyceae), Chlorophyta, Rhodophyta, 16
порядками, 31 семейством, 58 родами и 84 видами. В ходе наших исследований
обнаружены водоросли-макрофиты, ранее не отмеченными на тихоокеанском побережье
Камчатки: Acrochaete geniculata (Gardn.) O’Kelly, Acrochaete repens Pringsh., Pseudulvella prostrata (Gardn.) S. et G., Acrochaetium humile
(Rosenv.) Børg., в некоторых случаях наши находки водорослей на о-ве
Старичков уточняют ранее известные ареалы видов: Phycodrys valentinae Seliv. et Zhigad.
(описан нами из Берингова моря (Селиванова, Жигадлова, 2003), Erythrocladia irregularis Rosenv., Palmaria mollis (S. et G.) Van der Meer et Bird,
Acrochaetium parvulum (Kyl.) Hoyt и Polysiphonia
morrowii Harv.
Продолжая флористические работы, параллельно мы приступили
к экологическим наблюдениям и изучению биологии некоторых массовых видов на
экспериментальном полигоне. Одной из задач было определение возраста и продолжительности
жизни растений на примере изучения бурой водоросли Fucus evanescens C. Ag. Существует метод возрастной диагностики фукоидов по
числу дихотомических разветвлений, который постулирует, что одно ветвление
(реже два) соответствует одному году жизни растения (О.В. Максимова, 1980). Мы
обозначили этот метод как морфобиометрический. Однако наши наблюдения показали,
как ненадежен этот метод, а получаемые с его помощью данные о возрасте растений
нередко очень далеки от реальности. В рамках нашего исследования на о-ве
Старичков была поставлена задача определения подлинного возраста фукуса с
применением хронометрического метода и сравнения этих данных с данными морфобиометрического
анализа.
Специального выкашивания водорослей нами не
проводилось, т.к. на большинстве из площадок старые растения элиминировались
естественным путем к концу вегетационного периода (к началу сентября), однако с
интервалом примерно в 2 недели (средина сентября) эти участки побережья
оказались вновь заселенным и молодыми проростками фукуса из осенней генерации.
Еще через 2 недели (начало октября) обследованные нами растения увеличились в
размерах, по меньшей мере, вдвое и образовали от 2 до 5 дихотомических
ветвлений (рис. 2).

Рис. 2.
Первогодние образцы Fucus на
литорали.
Именно эти молодые растения из осенней генерации
представляют собой зимующую стадию, уходящую под снег и лед, и пребывающую там,
вероятно, в состоянии покоя. Ранней весной они продолжают свой рост и развитие.
Если судить о нашим данным, то трехлетнее растение фукуса может иметь до 15
дихотомических ветвлений, поскольку первогодние образцы уже имели по 5. В литературе
имеются сведения о 5-8-летней продолжительности жизни этих водорослей у берегов
Камчатки и даже о нахождении 12-летних образцов (Чмыхалова, 2005). Однако,
полагаем, что недооценка количества возможных ветвлений, образующихся в первый
год жизни растений, ляется причиной резкого
завышения подлинного возраста фукусов.
Другой задачей наших исследований на полигоне о-ва
Старичков было изучение размножения как важнейшей характеристики биологии одорослей. Основным объектом исследований,
как и в первом случае, был выбран фукус исчезающий.
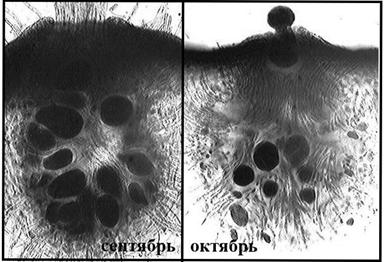 Наши наблюдения свидетельствуют
о том, что растения F. evanescens могут начать размножение уже на первом году жизни.
Образцы с о-ва Старичков, из осенней генерации, достоверно определяемые нами
как первогодние, поскольку за 2 недели до их появления данный участок скалы был
лишен растительности, уже несут рецептакулы со зрелыми концептакулами (Рис. 3).
Наши наблюдения свидетельствуют
о том, что растения F. evanescens могут начать размножение уже на первом году жизни.
Образцы с о-ва Старичков, из осенней генерации, достоверно определяемые нами
как первогодние, поскольку за 2 недели до их появления данный участок скалы был
лишен растительности, уже несут рецептакулы со зрелыми концептакулами (Рис. 3).
Помимо данных по
размножению фукуса, мы также вели наблюдения по развитию других групп
водорослей. В частности, ламинарии,
Рис.
3. Зрелые концептакулы первогодних образцов Fucus которые достигают пика обилия в ию-
ле-августе, имеют в этот период на своих пластинах спороносные пятна той
или иной степени зрелости и практически полностью элиминируются к октябрю.
Представители рода Alaria вступают в период активного
спороношения несколько позже – в августе-сентябре. Другие представители класса
бурых водорослей (Scytosiphon,
Chordaria) также
фертильны в период с конца июля по август.
Большинство красных
водорослей размножаются с июня по август (Palmaria, Gloiopeltis, Hymenena, Phycodrys, Pterosiphonia, Neorhodomela и др.). Кроме того, нами отмечено одновременное развитие в
июле-августе всех органов размножения, как мужских и женских генеративных
структур, так и тетраспорангиев, у некоторых представителей семейства Rhodomelaceae (Neorhodomela (Рис. 4) и Pterosiphonia). Судя по всему, наблюдается параллельное
существование и развитие нескольких поколений этих багрянок, бесполых и
половых. Также в августе отмечено массовое развитие микроскопических эпифитов: Acrochaetium, Erythrocladia
(Rhodophyta) и Pringsheimiella,
Pseudulvella, Acrochaete (Chlorophyta), которые обнаруживаются, главным образом, на
поверхности пальмариевых водорослей.

Рис. 4. Фертильные образцы Neorhodomela
Данное исследование показало, что пока не существует
более надежного и достоверного метода определения возраста морских водорослей в
природных условиях, кроме хронометрического. Единственным существенным его
недостатком является его длительность. Однако, его достоинство – абсолютная
точность – значительно перекрывает этот недостаток, т.к. достоверное
определение возраста водорослей, в особенности промысловых, крайне важно для
организации их рационального промысла и принятия правильных решений по
сохранению биоразнообразия морских экосистем.
О. Старичков – всего лишь небольшой остров в
Авачинском заливе, благодаря географическому положению, особенностям
геологического строения и уникальному сочетанию экологических факторов, имеет
очень высокие показатели биоразнообразия на единицу площади, видовое богатство
флоры и фауны этого островка, позволяет считать его значимым объектом с точки зрения
изучения и сохранения биоразнообразия Камчатки.
Список литературы
Иванов А.Н. Орнитогенные геосистемы малых островов
северной Пацифики // Мат-лы IV науч. конф.
«Сохранение биоразнообразия Камчатки и прилегающих морей». П-Камчатский: Камчатпресс,
2003. С. 47-51.
Иванюшина Е.А., Ржавский А.В., Селиванова О.Н.,
Ошурков В.В. Структура и распределение сообществ бентоса мелководий
Командорских островов // Природные ресурсы Командорских о-вов (запасы,
состояние, вопросы охраны и использования). М.: Изд-во МГУ, 1991. С. 155-170.
Максимова О.В. Некоторые сезонные особенности развития
и определения возраста беломорских фукоидов // Донная флора и продукция краевых
морей. М. Наука, 1980. С. 73-78.
Селиванова О.Н., Жигадлова Г.Г. Phycodrys valentinae sp.nov. (Delesseriaceae,
Rhodophyta) с обсуждением других видов рода Phycodrys из Северной Пацифики // Биол. моря, 2003. Т. 29. № 4.
С. 240-248.
Чмыхалова В.Б. Развитие бурой водоросли Fucus evenescens Ag. в прикамчатских водах // Автореф. дисс…канд.
биол. наук, Петропавловск-Камчатский, КГТУ, 2005. 25 с.
Альгофлора минерализованных водоёмов курорта
“Старая Русса”
(Новгородская обл.)
Капитонова Е.Ю.
Algal flora of
mineralized water bodies of spa «Staraya Russa» (the Novgorod Region)
Kapitonova E.Y.
Ботанический институт
им. В.Л. Комарова РАН
Санкт-Петербург,
ул. профессора Попова, 2
e-mail: ekapitonova@yandex.ru
Минерализованные водоемы широко распространены на
планете, имеют разные генезис, химические параметры и температуру, исторический
возраст. Во многих из них образуются лечебные грязи – сложная гетерогенная физико-химическая
система, существенную роль в формировании которой играют водоросли.
Важнейшим направлением в изучении водорослей
составляют флористические исследования, поскольку их данные лежат в основе
рационального использования природных ресурсов и разработке мер по охране
природы.
Целью данной работы явилось изучение флоры синезеленых
и диатомовых водорослей минерализованных водоемов курорта “Старая Русса”, так
как в альгологическом отношении обсуждаемые водоёмы изучены слабо. Изучению подверглись
оз. Верхнее, Среднее, Нижнее, ручей Войе и Южный развив ручья Войе.
Была проведена инвентаризация флоры Cyanophyta и Bacillariophyta;
составлен аннотированный список, включающий в себя 20 видов Cyanophyta и 25 (30 видовых и внутривидовых таксонов) Bacillariophyta. Основу флоры составляют водоросли порядков Raphales – 38% от общего числа видов, Araphales – 15%, а также Oscillatoriales – 22% и Chroococcales – 16%.
Впервые для флоры России указан вид Synechococcus subsalsus Skuja.
(оз. Нижнее) для континентальных водоемов России – Aphonocapsa cf. reinboldii (Richt.) Kom. et Anagn. (ручей Войе) и Diatoma moniliformis Kütz. (Южный разлив).
Анализ распределения синезеленых и диатомовых
водорослей старорусских минерализованных водоемов показывает, что все
зарегистрированные виды являются бентосными, населяющие рыхлые грунты,
развивающиеся как эпифиты водных растений и в обрастании искусственных субстратов.
Собственно планктонные формы не обнаружены.
В составе рыхлых грунтов – эпипелона обнаружено 24
вида (14 диатомовых, 10 синезеленых).
В оз. Верхнем найдено 15 видов. В состав доминантов
входят: диатомовые Synedra tabulata var. tabulata, S. tenera, Diploneis parma, Navicula salinarum, Amphora coffeaformis var. coffeaformis, Nitzschia obtusa, N. sigma
и синезеленая Leptolyngbya cf. fragilis. В
оз. Среднем в эпипелоне зарегистрировано 10 видов. Доминантами являются
диатомовые Synedra tabulata var. tabulata, S. tenera, Diploneis parma, Nitzschia sigma и синезеленая Spirulina major. Сообщество рыхлых грунтов оз. Нижнего слагается 17
видами. Доминируют диатомовые Synedra tabulata var. tabulata, Diploneis parma, Nitzschia sigma и
синезеленые Spirulina major, S.
subtilissima. В ручье
Войе в эпипелоне обнаружено 6 видов, из которых доминантами являются только
диатомовые водоросли – Synedra tabulata var. tabulata и Diploneis parma. В
вышеназванном сообществе Южного разлива отмечено 12 видов. Доминанты сообщества
– диатомовые Synedra tabulata var. tabulata, Diploneis parma, Nitzschia sigma, Surirella ovalis, Synedra tenera, Amphora coffeaformis var. coffeaformis. Синезеленые среди доминантов не отмечены.
Таким образом, число видов в сообществах эпипелона
исследованных водоемов колеблется от 15 до 17 в озерах Верхнее и Нижнее, 10–12
– в оз. Среднее и Южном разливе, и до 6 в ручье Войе. Наибольшее количество доминантов
отмечено в оз. Верхнем и Южном разливе (8 и 6 соответственно). Остальные
водоемы насчитывают 5–6 доминантных видов. В видовом составе доминантов наблюдается
большое сходство.
Наибольшее количество видов обнаружено в составе
сообщества эпифитона: 25 видов (15 – диатомовые, 10 – синезеленые).
В оз. Верхнем в состав эпифитона входят 12 видов:
доминанты – Chlogloea microcystodes (синезеленая), Diploneis parma, Nitzschia obtuse, Synedra tabulata var. tabulata, S.
tenera (диатомовые).
В оз. Среднем зарегистрировано 10 видов, из которых на доминанты приходится 2
вида диатомовых – Diploneis parma, Synedra tabulata var. tabulata, синезеленых
водорослей в качестве доминантов не обнаружено. Сообщество эпифитов оз. Нижнего
представлено 12 видами. Доминантами являются Synedra tabulata var. tabulata, S.
tenera, Nitzschia sigma (диатомовые), Spirulina major (синезеленая).
В ручье Войе в составе эпифитона синезеленые и диатомовые водоросли не обнаружены.
В Южном разливе эпифитон представлен 12 видами. К доминантам относится Spirulina major (синезеленая),
Synedra tabulata var. tabulata, S.
tenera, Diploneis parma, Amphora coffeaformis var. coffeaformis, Nitzschia sigma (диатомовые).
Таким образом, в эпифитоне, исключая ручей Войе,
зарегистрировано 10–12 видов. Наибольшее число видов-доминантов найдено в
сообществе водорослей Южного разлива
(6), оз. Верхнего (5), оз. Нижнего (4), наименьшее – в оз. Среднем (2).
Как и в эпипелоне, состав доминантов в целом сходен.
Сообщество обрастания искусственных субстратов
(деревянные сваи, стенки деревянного колодца), насчитывает 16 видов из них 10
диатомовых и 6 синезеленых.
В озерах Верхнее и Среднее встречено по 5 видов, из
которых доминантами являются диатомовые водоросли Synedra tabulata var. tabulata, Nitzschia sigma (только в оз. Верхнем). Сообщество
обрастания искусственных субстратов оз. Нижнего представлено 3 видами, как и в
оз. Верхнем отмечены 2 доминирующих вида диатомовых – Synedra tabulata var. tabulata и Nitzschia sigma (диатомовые). В ручье Войе
встречено 7 видов, к доминантам относится Synedra tabulata var. tabulata. В Южном разливе встречено 6 видов, из которых к
доминантам относятся Synedra tabulata var. tabulata, Nitzschia sigma (диатомовые), синезеленых не
встречено.
По сравнению с сообществами эпипелона и эпифитона в
составе обрастания отмечается более бедный видовой состав (16 видов против 24 и
25 соответственно), уменьшается число доминантных видов до 1–2.
О МАЛОИЗУЧЕННОМ ВИДЕ РОДА GYMNODINIUM (DINOPHYTA) ИЗ БАЙКАЛА
Кобанова Г. И.
About the little
studied species from genus Gymnodinium
(Dinophyta) from
Baikal
Kobanova G.I.
Научно-исследовательский
институт биологии при ИГУ
664003. Иркутск, 3, а/я 24
e-mail: kobanov@iszf.irk.ru
Введение. Динофитовые
водоросли или динофлагелляты достигают высокого разнообразия в морских экосистемах
и формируют обширные «цветения» воды. Многие виды токсичны и могут вызывать
гибель животных во время массового развития.
В самой крупной и древнейшей пресноводной экосистеме – оз. Байкал число
динофитовых водорослей мало, известно лишь около десяти видов. Из них массового
развития достигают виды рода Gymnodinium. Таксономия и биология этой чрезвычайно интересной
группы организмов, находящейся на стыке между миром животных и растений, все
еще далека от полного изучения. Эти, не имеющие панциря жгутиконосцы,
утрачивают естественные формы в пробах фитопланктона даже при использовании
«мягкого» фиксатора (раствор Утермеля) и совсем не выдерживают формальдегидную
консервацию. Их идентификация возможна только при наличии живого материала.
Однако в процессе изучения под микроскопом активное движение особей препятствует
выявлению ряда главных таксономических признаков, таких как форма и
расположение борозд, структурных элементов на поверхности оболочки. Кроме того,
воздействие тепла и яркого света способствуют их быстрой гибели. При этом форма
клеток и хлоропластов мгновенно меняют свои очертания, они округляются, затем
их оболочки взрываются. Поэтому два основных байкальских вида – G. coeruleum Ant. и G. baicalense Ant. с разновидностью
var. minor Ant. были описаны лишь в середине
шестидесятых годов минувшего столетия как эндемики (Антипова, 1955).
Эти два вида, имея близкую форму тела, различаются по типу питания,
количественному развитию и распространению в Байкале. Голозойный тип питания
характерен для G. coeruleum, у которого отсутствуют хлоропласты. Он
встречается в Байкале круглогодично, регистрируется на больших глубинах, входит
в число доминантных компонентов, однако, «цветения» воды не вызывает. Сейчас
этот вид найден во многих других водоемах с разным трофическим уровнем – от ультраолиготрофного
до гиперэвтрофного (Кожова и др., 1977, Михеева, 1999) и его можно охарактеризовать
как вид, имеющий высокую степень толерантности (Кобанова, 2007).
Автотрофный Gymnodinium baicalense с
многочисленными хлоропластами все еще считается эндемиком Байкала. Он
вызывает «цветение» подо льдом в марте – начале апреля в литоральной части,
когда вода ледовых прорубей и расщелин приобретает чайный оттенок. Популяция
концентрируется в верхнем слое воды. При росте численности вид распространяется
от берега в открытое «море» и часто в массовом количестве регистрируется на
глубоководной станции (2,5 км
от берега). Отсутствие вспышки развития на этой станции, возможно, связано с
неполным отбором проб из-за непрочного льда. После схода ледостава вид не
обнаруживается в планктоне и вновь появляется только через год.В имеющемся на
данный момент диагнозе G. baicalense отсутствует морфологическая характеристика
хлоропластов (указан лишь их цвет), присутствуют неточности в определении
основных элементов клетки. До сих пор не известны покоящиеся стадии вида и не
понятно, в какой форме этот организм переносит неблагоприятные условия.
Автор представляет на обсуждение материалы, полученные при изучении
вида в живом состоянии. Проведенные исследования позволили выявить большое
разнообразие форм, обнаружить дополнительные еще не описанные для вида процессы,
они отражены в микрофотоснимках.
Методы. Изучали живые
природные популяции Gymnodinium baicalense с
использованием световых немецких микроскопов – Laboval фирмы Carl Zeiss Jena и DMLB фирмы Leica. Микрофотографии
получены с помощью камеры DC 300 Leica. Пробы воды отбирали на стационарной пелагической станции
напротив пос. Бол. Коты круглогодично в течение нескольких лет.
Рузультаты и обсуждение. Для
динофитовых водорослей характерно вегетативное и половое размножение.
Вегетативные клетки размножаются, главным образом, бесполым путем, делясь на
две дочерние клетки. Предполагают, что половое размножение наступает при
истощении питательных веществ в окружающей среде. В результате полового
размножения образуется подвижная планозигота, переходящая в покоющуюся
гипнозиготу.
Большое разнообразие форм было обнаружено в подледной популяции Gymnodinium. В качестве
первой группы надо назвать овальные крупные клетки (рис.1), которые по форме
полностью соответствуют Gymnodinium baicalense Ant., но
отличаются по описанию. В диагнозе (Антипова, 1955) эпивальва характеризуется,
как высокий купол, с несколько затупленной или как бы срезанной верхушкой, а
гиповальва как широкая часть тела с выпуклыми боками, конец которой иногда
несколько оттянут. При этом указано, что длина эпивальвы больше, чем гиповальвы
и составляет 53-55 % от общей длины тела. Наблюдения за природной популяцией
показали, что в действительности передний конец клетки – эпивальва, более
короткий, чем задний – гиповальва. Направление движения особи можно четко установить
по микрофотоснимкам (при отсутствии видеозаписи), на которых при ее движении отображаются две проекции,
окрашенные в разные тона.

Вторая группа – клетки характеризуются широко овальной формой (рис.2),
и полностью соответствуют G. baicalense var. minor. Возможно, это молодые дочерние особи G. baicalense.
Третья группа – форма клеток близка G. baicalense (рис.3), но
их гиповальва завершается заостренной, остро-конической частью. Эта форма по
очертаниям клетки совпадает с Gymnodinium fuscum (Ehr.) Stein (Киселев,
1954), но отличается по структуре. Основное отличие – невысокая гребневидная
складка в нижней половине гиповальвы, крайне редко ее можно зафиксировать.
Четвертая группа имеет почти эллипсоидную форму клетки (рис. 4) и
гребневидная складка у нее отсутствует, однако имеется крошечный зубчик на
конце гиповальвы. Похоже, он является выступающим краем меняющейся гребневидной
складки в процессе микроскопирования. Эти особи по основным морфологическим
признакам – форма клетки, цвет хлоропластов, форма и расположение ядра
полностью соответствует Gymnodinium wigrense Wołosz., который описан Волошинской из польского озера еще в
1925 г.
(Starmach. 1974). Кроме того, в живом материале неоднократно
встречались на редкость устойчивые экземпляры, которые сохранялись на
протяжении всего периода наблюдений под микроскопом (в течение двух часов). На
полюсах таких клеток имелись студенистые образования. Для G. wigrense
также нередки случаи образования студенистой капсулы вокруг клетки.
Пятая форма совпадает по размерам с G. wigrense,
но она как бы утеряла отчетливость очертаний и приобрела более сглаженные
черты.
Все эти формы можно рассматривать как самостоятельные виды. Но автор
склоняется к выводу, что это один вид, испытывающий изменения формы клетки в
процессе жизненного цикла, а также во время наблюдения под микроскопом и его
исходную форму очень трудно уловить. Это ближайший родственник Gymnodinium wigrense Wołosz., а,
возможно, и сам вид. К сожалению, у этого вида, как и у G. baicalense, описавшие их авторы не показали расположение и форму хлоропластов, но
другие приведенные характеристики и экологические особенности – вид озерный,
планктонный с зимне-весенней вегетацией, полностью соответствуют байкальскому.
Все представленные формы объединяет однотипная структура хлоропластов – они
бурые, довольно крупные, удлиненные и расположены в клетке радиально. Была
встречена еще одна форма, которую трудно интерпретировать. Это шарообразная
студенистая клетка, покидавшая довольно плотную округлую, по всей видимости,
целлюлозную оболочку. Внутри клетки находились четыре, содержащие хлорофилл
особи, с четкими поперечными бороздами. Их форма была близка форме гамет, которые
впервые зарегистрированы в Байкале.
Встречены одиночные и парные копулирующие гаметы на ранней стадии
слияния, а также на поздней – стадии планозиготы с двумя продольными жгутами,
расположенными параллельно друг другу. Гаметы по форме отличались от описанных
выше вегетативных клеток. Парные гаметы были одинаковые по форме и размерам и
присоединялись друг к другу брюшными сторонами. Форма гамет соответствовала
особям или тельцам, находящимся в студенистой капсуле. Содержимое планозиготы
было диффузным и обособленного ядра не было видно. Оформленные хлоропласты
отсутствовали, лишь обнаруживались их следы. Кроме того, неоднократно
встречались активно подвижные особи, соответствующие по форме планозиготе, и
они были сплошь «заполнены» мелкими клеточками. При их разрушении освобождалась масса (около 300)
мелких клеточек двух типов (рис.). Одни были довольно крупные, округлые, с зерновидным
включением в центре. По внешнему виду они похожи на цианобактериии, и их можно
принять за самостоятельный вид. Другие клеточки были более мелкие заостренные
без центрального включения. Также встречались пары клеточек – округлые с
включением и мелкие заостренные, которые можно принять за сливающиеся. Такие
особенности в популяции G. baicalense, мы наблюдали в течение нескольких лет во время
массового развития водоросли, и это характеризует их как постоянные.
Можно, конечно, полагать, что мелкие клеточки являются крахмальными зернами,
симбиотическими или паразитическими организмами. Однако имеются некоторые
основания, которые позволяют расценить их как генеративные женские и мужские,
образующиеся и развивающиеся в одной особи. Среди них встречаются такие,
которые имеют структуру, характерную для зигот. Они часто встречаются в
свободном состоянии, а накануне появления вегетативных клеток Gymnodinium в планктоне постоянно встречаются переходные формы
между маленькой округлой с центральным включением клеточкой (генеративной) и
вегетативной клеткой Gymnodinium,
т.е. складывается ряд последовательных превращений развития «зиготы».
Имеется также повод для предположения, что женские клеточки
(яйцеклетки) образуются из хлоропластов, а мужские из ядерного материала. Такая
гипотеза не противоречит существующему взгляду на происхождение растительной
клетки эукариотического типа как результат симбиотического существования,
возникшего в процессе пищевых взаимоотношений между протистами и прокариотическими
хлорофиллоносными организмами.
В целом, рассмотренный представитель является литоральным,
холодолюбивым, а образование вспышки развития в период, приуроченный к
весеннему равноденствию, дает основание характеризовать его как светолюбивый.
Отсутствие G. baicalense поздней осенью, при сходных термических условиях, но
при низкой освещенности и значительном ветровом перемешивании вод, наводит на
мысль, что он является реликтовым, и формирование его как вида произошло в
ледниковый период.
Работа
выполнена при финансовой поддержке Аналитической ведомственной целевой
программы "Развитие научного потенциала высшей школы (2009-2010 гг.)"
проект № 2.1.1/1359.
ТАКСОНОМИЧЕСКИЙ
СОСТАВ ВОДОРОСЛЕЙ НИЖНЕЙ КОЛЫМЫ
Копырина Л. И.
Algae taxonomic
composition of the Kolyma
River downstream
Kopirina L.I.
Институт
биологических проблем криолитозоны СО РАН, Якутск
e-mail: l.i.kopyrina@mail.ru
Материалом для наших исследований послужили
количественные и качественные пробы фитопланктона, собранные в.н.с. Тетериным В.Г. ДБР МОП РС (Я) в
августе-октябре 2006-2007 гг. из 7 участков нижней Колымы: Походска, Большой
Тони, Черского, Ермоловки, Колымского и из двух участков правого притока - р.
Омолон (в 100 и 200 км
выше от устья). Ранее работы по изучению водорослей р. Омолон не проводились.
По предварительным результатам исследований водорослей
некоторых водоемов нижней Колымы составлен систематический список,
насчитывающий 174 вида или 187 видов и разновидностей водорослей, относящиеся к
66 родам, 48 семействам, 23 порядкам, 12 классам и 7 отделам. Ведущая роль
принадлежат отделам Bacillariophyta (47,0% от общего
числа видов и разновидностей) – 81 или (89 видов и разновидностей), Chlorophyta (25,0%) – 47 или (49) и Cyanophyta (11,0%) – 20 (20) и Xanthophyta – 16 (16 видов и разновидностей) водорослей.
Наименьшее число видов найдены из
отделов Chrysophyta - 6, Rhodophyta – 3 и
Dinophyta – 1 вид водорослей. Найдены 13 новых для альгофлоры
Якутии видов из 5 отделов, где отдел Rhodophyta
(красные водоросли) впервые указывается для водоемов реки Колымы.
В исследованных водоемах выявлены редкие и новые для
Якутии виды: из синезеленых – Microcystis marginata, Nodularia harveyana, Xenococcus chroococcoides, Chamaesiphon
curvatus, Spirulina laxissima; золотистых – Epipyxis alaskana; диатомовых – Diatoma elongatum var. pachycephala,
Navicula falaisiensis, Cymbella acuta, Nitzschia apiculata, Surirella biseriata, S.
capronii, S. splendida, S. tenera; желтозеленых – Akanthochloris brevispinosa, Bumilleria angustata,
B. Sicula; красных – Chantransia chalybea, Ch. Hermannii, Ch. Leibleinii; зеленых – Ulothrix
flacca, Gonatozygon monotaenium, Closterium ehrenbergii,
Eurastrum verrucisum var. alatum, Staurastrum ophiura,
S. paradoxum, Spondilosium moniliforme, Hyalotheca dissiliens
(табл. 2).
Среди одиннадцати ведущих семейств, объединяющих 92
вида (52,8% от общего числа видов водорослей) преобладали 3 отдела: диатомовые
– 64 вида (36,8%), зеленые – 12 (12,6) и желтозеленые - 7 видов (4,0%). Первые
ранговые места занимают семейства Naviculaceae – 16 видов, вторые и третьи места заняли семейства Fragilariaceae и Cymbellaceae
по 10 видов, затем следуют Ulotrichaceae
– 9, Nitzschiaceae – 8, Surirellaceae, Tribonemataceae, Gomphonemataceae по 7 видов и Achnanthaceae, Desmidiaceae
по 6 видов водорослей.
Ведущие девять родов включают 65 видов (37,4%)
водорослей и представлены тремя отделами: диатомовыми – 46 (26,4%) видов,
зелеными – 12 и желтозелеными – 7 видов.
Первые ранговые места распределяются следующим образом: Cymbella – 10 видов, Fragilaria – 8, Navicula, Gomphonema, Nitzschia, Surirella и Tribonema по 7, Ulothrix и Spirogyra по
6 видов водорослей.
В целом, такое распределение семейств и родов в
фитопланктоне водоемов соответствует таксономическому спектру флор проточных
водоемов высоких широт Севера и Арктики. Эта черта свойственна альгофлорам
водоемов Большеземельской тундры, Западной Сибири, Якутии, Чукотки и
Магаданской области (Васильева, 1989; Гецен, 1985).
Видовое разнообразие фитопланктона исследованных
участков нижней Колымы в целом, как и ранее (Разнообразие, 2005), определяют
диатомовые водоросли (47,0 % от общего числа видов и разновидностей). Во всех
водоемах присутствуют пресноводные, широко распространенные виды, развивающиеся
преимущественно в толще, обрастаниях и в бентосе холодных текучих вод,
родниках. Среди них лидирующее положение в фитопланктоне занимает типичные
криофильные виды водной толщи Melosira varians, Asterionella formosa, Aulacoseira granulata, Fragilaria arcus, F. сapucina. Наряду с пресноводными видами
выявлены пресноводно-солоноватоводные и солоноватоводные виды родов Nitzschia, Hantzschia и Surirella, что говорит о
влиянии Восточно-Сибирского моря.
Второе место в видовом разнообразии фитопланктона занимают зеленые водоросли
(25,0%), среди которых в первую очередь виды с нитчатой структурой таллома,
которые в массе образуют скопления на субстрате и способствуют формированию
вторичной эпифлоры из диатомовых и желтозеленых водорослей, а также большую
роль играют в формировании численности и биомассы. Среди них часто встречались
виды Ulothrix
zonata, Spirogyra varians, S. tenuissima, Zygnema pectinalis, Chlohormidium
flaccidum. Нередко отмечались виды Pediastrum
boryanum, Gonatozygon monotaenium и виды родов Closterium. Следует отметить, что большинство из доминирующих нитчатых
зеленых водорослей относятся к повсеместно распространенным таксонам, типичным
для олиготрофных водоемов бореальной и арктической зон.
Синезеленые водоросли встречены в малом количестве
всего - 10,7% от общего числа найденных водорослей. На участке Большая Тоня
найден редкий род Woronichinia
и новый для водоемов Якутии род Nodularia. Численность и биомасса, которых составила 18, 8 тыс. кл/л – 0,023
мг/л. В исследованных участках часто встречались планктонные виды из родов Anabaena, Aphanizomenon, а также реофильные виды рода Tolypothrix.
Таким образом, несмотря на низкую температуры воды,
видовой состав фитопланктона развит хорошо и представлен 174 видами водорослей, относящиеся к 7 отделам. Ведущая роль принадлежат отделам Bacillariophyta, Chlorophyta и Cyanophyta. Найдены 13 новых для альгофлоры Якутии видов из 5
отделов, где отдел Rhodophyta (красные водоросли)
впервые указывается для водоемов реки Колымы. По численности выделяется участок
Виска, а по биомассе участок Походск и р. Омолон (в 200 км).
ВОДОРОСЛИ БАССЕЙНА
РЕКИ КОЛЫМЫ
Васильева-Кралина
И.И., Копырина Л.И. 1, Пшенникова Е.В. 2
Algae of the Kolyma river
basin
Vasilyeva-Kralina I.I., Kopirina L.I. 1, Pshennikova E.V. 2
1Институт
биологических проблем криолитозоны СО РАН
e-mail: l.i.kopyrina@mail.ru
2Медицинский
институт Якутского госуниверситета
e-mail: el_viss@mail.ru
Изучение альгофлоры бассейна р.Колымы началось в
1960-е годы. При изучении диатомовых водорослей р. Колымы в районе
Среднеколымска определено 155 видовых и внутривидовых таксона из 52 родов
(Комаренко, 1960). При температуре 18-20оС доминировали 15 видов
диатомей, представленные преимущественно бентосными видами.
Озерная система средней и нижней Колымы изучалась в
1970-е годы (Комаренко, Васильева, 1972; Комаренко и др., 1974). Тогда было
выявлено 349 таксонов из 7 отделов, среди которых доминировали диатомовые (130)
и зеленые (110) водоросли. Общая численность фитопланктона при температуре воды
17о С не превышала 1,7 млн.кл/л.
В 1980-е годы появились работы, посвященные анализу
качественного состава и количественного развития водорослей р. Колымы, ее
пойменных и термокарстовых озер (Васильева, Ремигайло, 1980; Пшенникова, 1986
а,б; Васильева, Пшенникова, 1988; Васильева, 1989). В зависимости от типа
водоема, сроков взятия проб и климатических факторов число таксонов колебалось
от 193 до 280. В значительной степени отличались и количественные показатели.
Так, в термокарстовых озерах на глубине 4 м и максимальном прогреве воды до 15оС
численность фитопланктона достигала 223,6 тыс. кл/л, биомасса – 0,79мг/л, тогда
как в пойменных озерах на меньших глубинах (2-2,5 м) и прогреве воды до 18о
С зарегистрированы более высокие показатели численности (998,12 тыс.кл/л) и
биомассы (1,23 мг/л).
Последующие работы проводились в дельте р. Колымы на
стационаре «Походск» и они отражены в монографиях (Комаренко, Васильева, 1975,
1978; Васильева, 1987; Егорова, Васильева и др., 1991) и статьях (Васильева, Догадина,
1986). При изучении водорослей р. Колымы и ее притоков в среднем течении в
1990-е годы (Васильева, Пшенникова, 1996) выявлено и определено 84 вида,
представленных 95 разновидностями и формами, включая номенклатурный тип вида
(далее таксона). Распределение видового состава по отделам было следующим: Cyanophyta – 11 (13), Chysophyta – 4 (5), Xanthophyta – 3 (3), Baccillariophyta – 54 (62), Chlorophyta – 12 (12).
Таблица 1
Динамика
изученности водорослей бассейна р. Колымы в разные годы исследований
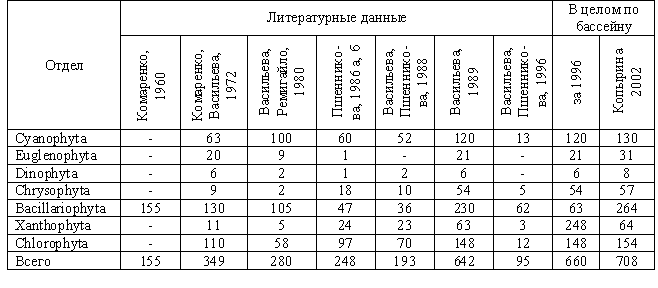
Доминировали,
как и ранее, диатомовые водоросли, среди которых на протяжении всего лета чаще
встречались Asterionella gracillima и Synedra ulna.
В целом для бассейна р. Колымы
известно 660 таксонов видового и внутривидового рангов из 7 отделов, что
составляет 26,4% состава флоры водорослей Якутии (табл. 1). В реке было всего
172 вида водорослей, в притоках – 9, в стоячих водоемах бассейна 533 вида. Если
в реке доминировали диатомовые, зеленые и синезеленые, то в стоячих водоемах –
зеленые водоросли (Васильева-Кралина, Пшенникова, 1996). Присутствие в составе
альгофлоры озерных видов синезеленых, зеленых и желтозеленых водорослей свидетельствует
о поступлении их в реку из придаточной системы. Многочисленные притоки р.
Колымы обогащают ее альгофлору диатомовыми, зелеными и синезелеными водорослями.
Речная
система бассейна р. Колымы в ее среднем течении не одинакова. На 10 ведущих родов
речной альгофлоры среднего течения реки приходится 44 вида, что составляет
46,3% флоры водорослей. Преобладают бентосно-планктонные реофильные виды диатомовых
водорослей.
В нижнем
течении реки на 10 ведущих родов приходится 42 вида (65,6%), однако число видов
диатомовых водорослей уменьшилось, по сравнению с таковыми среднего течения.
Кроме того, для нижнего течения характерна значительная примесь лимнофлоры из синезеленых
и зеленых водорослей, т.е. происходит обогащение речной флоры за счет озерной и
почвенной из поймы реки.
С 2002 г. проводились
исследования в бассейне среднего течения р. Колымы. Исследования водоемов проводились
в маршрутном порядке. Пробы брались в самой реке, озерах, ручьях и речках.
Всего было выявлено 96 видов и разновидностей водорослей из 7 отделов. Во всех
водоемах в видовом отношении преобладали диатомовые водоросли (48 видов и
разновидностей), меньше было синезеленых (16) и эвгленовых (15 видов и
разновидностей). Беден состав зеленых, золотистых, желтозеленых и динофитовых
водорослей, что обусловлено началом зимнего периода и ледостава в реке и
озерах.
По результатам исследований в
самой реке Колыма в 6 точках выявлено 37 видов и разновидностей водорослей из 6
отделов с преобладанием диатомовых водорослей – 27 видов, встречались единичные
представители эвгленовых – 4, синезеленых – 3, динофитовых, желтозеленых и
зеленых (по 1 виду) водорослей.
Численность
фитопланктона на разных участках реки колебалась от 2,20 до 59,4 тыс.кл/л, а
биомасса с 0,09 до 0,3 мг/л, причем на долю эвгленовых приходилось 1,14 тыс.
кл/л; 0,078 мг/л и диатомовых - 0,72 тыс.
кл/л, при биомассе 0,037 мг/л. Индекс сапробности (S) по Пантле и Буку на разных участках составлял 0,88 -
2,3. Вода в реке относилась в основном к II-III, а на
некоторых участках (ниже населенных пунктов) к IV классу чистоты.
В озерах, расположенных в
бассейне р. Колымы было обнаружено 58 видов и разновидностей водорослей из 7
отделов, где основной фон составляли, встречались синезеленые и эвгленовые водоросли.
Часто встречались такие широко распространенные в планктоне и обрастаниях
литорали виды, как Melosira ambigua, Navicula
cryptocephala, N. lanceolata, Tabellaria flocculosa, Caloneis bacillum, Neidium dilatatum var. jacuticum, Nitzschia palea, Cymbella
ventricosa var. hankensis, Achnanthes inflata. Единичные
представители синезеленых (Oscillatoria guttulta, O. planctonica, O. amoena,
O. mirabilis, Cylindrospermum stagnale, Phormidium cincinnatum, Anabaena
flos-aquae f. Aptecariana) водорослей. Среди эвгленовых
обнаружены Trachelomonas volvocina, T. oblonga var. australica,
Euglena praerupta var. inflata. Численность
фитопланктона в различных озерах составляла от 28,8 до 110,88 тыс.кл/л , при
биомассе 0,78 до 7,4 мг/л. Индекс сапробности (S) по водорослевым сообществам составил 2,19, а вода по биологическим
показателям отнесена к III классу
качества воды, α-мезосапробной зоне самоочищения, что говорит о периодическом
воздействии различной нагрузки на озеро (Баринова и др., 2000).
Таким образом, в
целом флора водорослей бассейна р. Колымы представлена 708 видами и
разновидностями из 7 отделов, среди которых доминировали диатомовые, зеленые и
синезеленые водоросли (табл. 1).
Анализ,
опубликованных ранее и современных данных по флоре водорослей в бассейне р. Колымы
свидетельствует о богатстве ее видового состава в целом и преобладании флоры
нижнего течения над таковой среднего течения р. Колымы. Лимнофлора в 4-7 раз
богаче реофлоры. В бассейне р. Колымы найдены виды водорослей, характерные для
северо-востока Сибири и Аляски. Здесь присутствуют редкие виды из отделов
желтозеленых (Gaumiella bellifontana) и золотистых (Dinоbryon annulatum) водорослей. Для
вида Chlorallantus attenuatus, встреченного только в этом районе была описана И.И.
Васильевой и зарегистрирована новая вариация C. kolymensis. А так же были расширены и дополнены морфологические и экологические
характеристики некоторых водорослей (Merismopedia ellipsoidea, Gaumiella bellifontana, Centritractus rotundatus, Chlorothecium pirrotae,
Gloeoskene turfosa и др.).
К ИЗУЧЕНИЮ АЛЬГОФЛОРЫ
НАЦИОНАЛЬНОГО ПАРКА АЛГЕТИ
(ГРУЗИЯ)
Кухалеишвили Л.К
Studies of algal flora in the National Park “Algeti” (Georgia)
Kukhaleishvili L.K.
Тбилисский ботанический сад и Институт ботаники
Грузия, Тбилиси, 0105, N
Коджорское шоссе N 1, тел. 34.73. 02
Национальный
парк Алгети расположен в верхней части бассейна р. Алгети. Он находится в
Восточной Грузии и административно входит в Тетрицкаройскй район. Парк
организован в 2007 году на базе Алгетского гос. заповедника, который в сваю
очередь был основан в 1965 году. Площадь парка равна 6822 гектарам. Его большая
часть покрыта хвойными и лиственными лесами, охрана которых – основная цель
данного парка. Кроме того, он имеет эстетическое и курортологическое значение
(Мамисашвили,1975). Рельеф парка горный. Амплитуда высот над ур. моря колеблется
от 1000 до 2000 м.
Главная водная артерия района – р. Алгети. В пределах исследуемой территории в
нее впадают несколько относительно крупных и достаточное количество мелких
притоков; реки здесь типично горные. В летний период, во время обильных дождей
и таяния снегов, их уровень сильно подымается (Цховребашвили, 1956, Апхазава,
1971; Дробишев и др.,1974). На территории парка множество ручейков, родников,
встречаются временные водоемы, искусственные пруды.
Имеются
две работы К.Г. Канчавели, касающиеся альгофлоры данного района. Одна из них
рукопись (Канчавели, 1970)], которая
хранится в фондах Института ботаники им. Н.Н. Кецховели (ныне Тбилисский
ботанический сад и Институт ботаники); вторая -
опубликованная статья (Канчавели, 1973). В них для исследуемого района указано 28 таксона
водорослей, 10 из которых нам удалось обнаружить.
Альгологическое
обследование водоемов Национального парка Алгети проводилось в летные периоды
2007 – 2008 гг. Часть проб была взята в сентябре 2005 г. Изучались водоемы
разного типа. Всего из 17 пунктов было собрано 77 проб. Обрабатывался
фиксированный материал. По возможности определялись все группы водорослей.
В
результате наших исследований выявлено 305 таксонов водорослей, которые относятся к 6 отделам, 12 классам, 26 порядкам, 50
семействам и 80 родам.
Наиболее
разнообразны были диатомовые (Bacillariophyta). К ним принадлежит 206 видовых и
внутривидовых таксона; это – 68 % от общего числа обнаруженных нами водорослей.
Они здесь представлены 3 классами. По числу видов - 180 доминирующим является
класс Bacillariophyceae. Класс Fragilariophyceae с 24 таксонами на втором месте
и лишь 2 вида относится к классу
Coscinodiscophyceae.
Среди
порядков данного отдела по богатству видов доминируют; Naviculales (64),
Cymbellales (46), Bacillariales (33). Менее разнообразны Fragilariales (23) и
Achnanthales (15). Другие порядки представлены значительно беднее, так
Surirellales насчитывает 11 таксонов, Rhopalodiales – 6, Thalassiophysales - 5,
Thalassiosirales – 2, Tabellariales -1 вид.
Основу
диатомовой флоры исследуемого района
составляют семейства -Bacillariaceae
(33), Cymbellaceae (23), Gomphonemataceae (21), Naviculaceae (20), Pinnulariaceae (18). Остальные
17 семейств представлены намного скуднее.
Обильно
развивающимися в количественном отношении и к тому же характерными для водоемов данного парка оказались
сравнительно немногие виды: Synedra ulna,
Cymbella helvetica, C. affinis, C. ventricosa, Cocconeis pediculus, C.
placentula var. euglypta, Nitzschia
linearis, Navicula tripunctata, N. radiosa, Gomphonema angustatum, G.
intricatum, Gomphoneis olivaceum, Surirella ovata, S.angustata, Hantzschia
amphioxys, Achnanthes minutissima, Planothidium lanceolata.
Несколько
уступают им в развитии, но распространнены довольно широко; Diatoma moniliforme, Cymbella aspera,
Fragilaria vaucheriae, Gomphonema parvulum, G. productum, Cocconeis placentula,
Navicula cryptocephala, Nitzschia palea, N. vermicularis, Rhoicosphenia
curvata.
Большинство
же представителей этого отдела встречались реже и в малом количестве, хотя были
и такие, которые в отдельных
местонахождениях развивались обильно, напр.: Neidium iridis var.
ampliatum, Cymbella helvetica var.
curta, Hannaea arcus, Meridion circulare var. constrictum, Navicula viridula var. rostellata, Reimeria sinuata, Nitzschia fonticola.
Диатомовые
доминировали во всех типах водоемов. Они населяли орошаемые водой скалы, камни и различные
подводные предметы. Встречались чисто диатомовые налеты на камнях, но чаще
всего мы их находили вместе с зелеными нитчатками. Преобладающее большинство
диатомовых является широко распространенными видами вообще, и в частности в
Грузии.
Значительно
уступают диатомовым по видовому разнообразию и по массовости развития синезеленые
водоросли (Cyanophyta). Они содержат 36 представителей, т.е. 12 % всей
альгофлоры изучаемого района. Основу разнообразия в этом отделе формирует класс
Hormogoniophyceae (30); к классу Chroococcophyceae принадлежит - 5, а к классу
Chamaesiphonophyceae - 1 вид. Ведущими порядками являются - Oscillatoriales
(20) и Nostocales (10). Порядок Chroococcales насчитывает - 5, а Pleurocapsales
- 1 вид.
Наиболее
богато видами семейство Oscillatoriaceae
(19). Другие семейства представлены значительно беднее (4 -1 вид). Самим
распространенным оказался Phormidium
autumnale. В этом отношении от него намного отстает Oscillatoria brevis. Оба эти вида развивались обильно. Остальные же
найдены чрезвычайно редко и в основном малом количестве, но такие как Gloeocapsa minuta, Osillatoria formosa, O.
limnetica, O. pseudogeminata, Nostoc punctiforme, N. calcicola, Tolypothrix
distorta развивались хорошо, некоторые из них даже массово.
Из
отдела зеленых водорослей (Chlorophyta)
в водоемах данной территории выявлено 33 видовых и внутривидовых таксона, или
11 % общего числа обнаруженной альгофлоры. По видовому богатству лидирующим
является класс Zygnematophyceae, к
которому относится 21 представитель. Менее богаты видами классы Chlorophyceae (7) и Ulvophyceae (5).
Наибольшим
числом видов отмечается порядок Desmidialles (17). Другие порядки включают
меньшее число видов, так Chlorococcales
и Zygnematales соответственно 5 и 4;
Ulotrichales и Cladophorales 3 и 2 и
по одному виду порядки Volvocales и Oedogoniales.
Для
исследуемого района характерно сравнительно широкое распространение и относительное
обилие Rhizoclonium hieroglyphicum и
стерильных нитей рода Spirogyra. Но
самим обычным был Cladophora glomerata;
особенно массово он встречался в реках. Большинство же видов обнаруженны в
одном или двух местах в незначительном количестве. Среди них более развитыми
оказались: Closterium acerosum f. elongatum, C. kuetzingii, C. parvulum,
Cosmarium subcostatum. C. undulatum.
В
краине малом количество выявлены виды
эвгленофитовых водорослей (Euglenophyta) - 22 (7 %). Они здесь представлены
только одним порядком - Euglenales,
включающим 4 рода из которых более
разнообразны Euglena (8) и Phacus (7), а роды Trachelomonas и Lepocinclis
объединяют соответственно 4 и 3 представителя. Большинство эвгленофитовых
отмечены с одного местонахождения. В двух или трех местах мы их находили редко.
Они преимущественно обитали в лужах и
стоячих водоемах, где развивались слабо, хотя некоторые из них достигали
большого количества или были развиты
массово как напр.: Trachelomonas
volvocina, Tr. hispida var. crenulatocollis, Euglena proxima, E.
geniculata, Phacus caudatus var. minor,
Ph. pleuronectes.
Отдел
динофитовых (Dinophyta) и желтозеленых (Xanthophyta) водорослей представлены чрезвычайно
слабо – по четыре вида каждый. Виды из родов Ceratium, Glenodinium и Gymnodinium
(отдел Dinophyta) обитали исключительно в стоячих водах, где развивались довольно
хорошо.
Виды
родов Tribonema и Vaucheria (отдел Xanthophyta) обнаружены
очень редко только в проточных водах и в незначительном количестве, лишь
стерильные нити рода Vaucheria развивались
массово.
Из
305 видовых и внутривидовых таксонов обнаруженных нами в водоемах Национального парка Алгети, 295 впервые
отмечены для данной территории, среди
них 9 оказались новыми для альгофлоры
Грузии.
Список литературы
Апхазава И.С. и др. Черное море и водная сеть суши. В
кн. Геоморфология Грузии. «Мецниереба», Тбилиси, 1971, с. 77 – 89.
Дробишев О.А., Месхишвили О.А., Двали Ш.Б., Апхазава
И.С. Ресурсы поверхностных вод СССР. Гидрографическое описание рек, озер и
водохранилищ. Закавказье и Дагестан. Т. 9, вып. 1, Л., 1974, с. 428 – 432.
Мамисашвили К.Д. Заповедники Грузии. Тбилиси, 1975, с.
47.
Канчавели К.Г. Альгофлора Триалети. Фонды Института
ботаники им. Н.Н.Кецховели. Регистрационный
N 68053459, 1970, 219 с.
Канчавели К.Г. Представители зеленых вордорослей –
новые для Грузии. Заметки по систематике и географии растений. Вып. 30,
«Мецниереба», Тбилиси, с. 1973, 3 – 5.
Цховребашвили Ш.А. О некоторых особенностях долины р.
Алгети. Тр. Тбилисского государственного университета. Изд. ТГУ, Тбилиси, т.
58, 1956, с.77 – 81.
МАКРОЭПИФИТЫ ПРИБРЕЖНЫХ ФИТОЦЕНОЗОВ ЧЕРНОГО МОРЯ
Лисовская О.А.
Macroepiphytes of the Black
Sea coastal phytocenoses
Lisovskaya O.A.
Санкт-Петербургский Государственный Университет,
199034 Санкт-Петербург, Университетская наб. 7/9
e-mail: o_lisovskaya@mail.ru
Морские прибрежные фитоценозы характеризуются
достаточно высоким разнообразием водорослей-макрофитов, в большой степени это
определяется составом эпифитных синузий. Исследования, касающиеся макрообрастаний
водорослей и трав в Черном море, встречаются преимущественно в работах
украинских специалистов (Евстигнеева, 1993; Чернышева, 2007).
В настоящей работе рассмотрены эпифитные синузии
прибрежных морских фитоценозов восточного побережья Черного моря. Качественный
отбор проб осуществляли с использованием легководолазного снаряжения до глубины
2–3 м. Материал фиксировали 4% раствором формалина или гербаризировали.
Камеральную обработку проводили на живом и фиксированном материале, а также по
гербарным образцам. Для определения водорослей были использованы «Определитель
зеленых, бурых и красных водорослей южных морей СССР» А. Д. Зиновой (1967) и
«Ульвовые водоросли (Chlorophyta) морей СССР» К. Л. Виноградовой (1974).
На выбранном для наблюдений участке побережья в районе
Туапсе и Большого Сочи в прибрежных фитоценозах обнаружено 120 видов
водорослей-макрофитов, из них 39 видов (32,5% от общего количества видов) из
отдела Chlorophyta, 21 (17,5%) – из
отдела Phaeophyta, 60 (50%) – из отдела Rhodophyta. Обнаруженные водоросли
принадлежат к нескольким экологическим группам: эпилиты, эпифиты и эндофиты,
кроме того, достаточно большая группа водорослей имеет смешанную экологию (эпилит/эпифит).
Среди обнаруженных в районе исследования макроводорослей 69 видов (57,5% от
общего количества видов) встречены в обрастаниях макрофитобентоса.
Заметны сезонные изменения состава эпифитокомплекса. В
целом, в весенний период наблюдается большее разнообразие эпифитов, чем в
летнее-осенний, что согласуется с данными других авторов (Rindi, Guiry, 2004;
Чернышёва, 2007).
Распределение обнаруженных эпифитов по отделам
представлено в табл. 1.
Таблица 1
Видовой состав фитоценозов района исследования
|
|
Общий видовой состав
фитоценозов
|
Видовой состав
эпифитов
|
|
Группа водорослей
|
Кол-во видов
|
% от общего кол-ва
видов
|
Кол-во видов
|
% от общего кол-ва
видов эпифитов
|
|
Зеленые
|
39
|
32,5%
|
15
|
21,8%
|
|
Бурые
|
21
|
17,5%
|
13
|
18,8%
|
|
Красные
|
60
|
50,0%
|
41
|
59,4%
|
|
Общее кол-во видов
|
120
|
|
69
|
|
Встреченные нами в прибрежных
сообществах макроэпифиты можно разделить на две группы видов в зависимости от
средних размеров слоевищ. К первой принадлежат водоросли небольших размеров (до
1 см),
являющиеся преимущественно строго эпифитными по своей экологии. Ко второй
группе отнесены крупные эпифиты (размер слоевища более 1 см), имеющие смешанную экологию.
Эти группы видов различались количеством видов базифитов, на которых они были
встречены. На наибольшем количестве видов базифитов представлены эпифиты малых
размеров, таких видов как Goniotrichum
elegans (Chauv.) Zanard., Erythrocladia subintegra Rosenv., Kylinia virgatula (Harv.) Papenf., K. secundata (Lyngb.) Papenf., Melobesia farinosa Lamour. и др. Из крупных эпифитов
большинство встречено на 1-3 видах базифитов (это касается как ведущих, так и
сопутствующих и редких видов), большое разнообразие используемых в качестве
субстрата видов демонстрируют лишь Cladophora
albida (Huds.) Kütz., Ceramium elegans Ducl., Callithamnion corymbosum (J. E. Smith) Lyngb.
и Spermothamnion strictum (Ag.) Ardiss. Все перечисленные виды имеют высокую встречаемость
в районе исследования.
Базифиты относятся к 27 видам (6 видов зеленых
водорослей, 6 - бурых, 15 - красных). Они представлены преимущественно видами с
крупными талломами различной структуры. Наибольшее разнообразие эпифитов
отмечено на талломах вида-доминанта прибрежных фитоценозов района исследования Cystoseira barbata (Good. et Wood.) Ag.
– 48 видов (9 видов зеленых водорослей, 10 - бурых, 29 - красных). Из указанных
48 видов 19 встречены только на слоевищах Cystoseira
barbata (2 вида зеленых водорослей, 5 - бурых, 12 - красных). Достаточно
разнообразно эпифиты были представлены также на талломах Cladostephus verticillatus (Lightf.) Ag., Ulva rigida Ag., Ceramium rubrum (Huds.) Ag. Причем на Ulva rigida и Ceramium rubrum встречены преимущественно эпифиты небольшого размера.
В целом, из 69 видов эпифитов 30 обнаружены нами на базифите только одного вида
(3 вида зеленых водорослей, 8 - бурых и 19 - красных). Большинство из них
относятся к группам редких и сопутствующих видов. Литературные данные указывают
на находки многих из этих видов на различных макрофитах (Зинова, 1967).
Для некоторых эпифитов из группы ведущих и сопутствующих
видов можно выделить группы характерных базифитов. Это более характерно для
крупных эпифитов - они чаще встречаются на видах с жестким, прочным слоевищем,
таких как Cystoseira barbata,
Cladostephus verticillatus. Заростки крупных эпифитов, например рода Ceramium, в
большом количестве встречаются также на нитчатых и нежных пластинчатых
слоевищах видов родов Callithamnion, Cladophora, Enteromorpha, однако зрелые слоевища крупных эпифитов на указанных
водорослях не обнаружены.
Таким образом, более половины видов, встреченных в
районе исследования, входят в состав эпифитных синузий. Среди них велика доля
редких видов, которые определяют высокое разнообразие макрофитобентоса
восточного побережья. По сравнению с общим видовым составом прибрежных
сообществ в эпифитных синузиях разнообразнее представлены красные водоросли,
доля зеленых водорослей меньше чем в фитоценозах в целом. В весенний период
разнообразие эпифитов заметно повышается за счет сезонных видов. Строгая
приуроченность эпифитов к определенному фитосубстрату не выявлена, однако
выделены группы базифитов, характерные для определенных эпифитов и
различающиеся морфологией талломов.
Список литературы
Виноградова К. Л.
Ульвовые водоросли (Chlorophyta) морей СССР. Л., 1974.
Зинова А. Д.
Определитель зеленых, бурых и красных водорослей южных морей СССР. М.; Л., 1967.
Евстигнеева И.К. Видовой состав и количественная
характеристика эпифитов Cystoseira crinita Bory // Альгология. 1993. Т. 3, № 4. C. 52-57.
Чернышёва, Е. Б. Структурные особенности эпифитной
синузии цистозировых фитоценозов Карадагского природного заповедника //
Экология моря. 2007. Вып. 74 С. 84-90.
Rindi F., Guiry M.
D. Composition and spatio temporal variability of the epiphytic macroalgal assemblage
of Fucus vesiculosus Linnaeus at Clare
Island, Mayo, western Ireland
// Journal of Experimental Marine Biology and Ecology. 2004. Vol. 311. P. 233– 252.
К флоре пресноводных зеленых водорослей класса
Zygnematophyceae Северо-Запада России
Лукницкая А.Ф.
Flora of freshwater
green algae from class Zygnematophyceae in the north-west of Russia
Luknitskaya A.F.
Ботанический институт
им. В. Л. Комарова РАН
197376
Санкт-Петербург, ул. Проф. Попова, д. 2, тел. 346-44-28
e-mail: aliyalukn@mail.ru
Пресноводная
альгофлора Северо-Запада России до сих пор остается неравномерно и недостаточно
изученной. Полнее всего обследована флора пресноводных водорослей Ленинградской
области, далее по степени изученности идут Новгородская, а затем Псковская
области.
Нами изучались конъюгаты (кл. Zygnematophyceae) Ленинградской и Псковской областей и в меньшей степени
более северные регионы Европейской части России. Следует подчеркнуть, что в
основном исследованиям были подвергнуты водоемы особо охраняемых природных территорий
(в дальнейшем ООПТ) этих регионов.
Как
известно, в последнее время все больше и больше внимания уделяется ООПТ как
эталонам растительности для сравнения с территориями, несущими антропогенную
нагрузку.
Водоросли
водоемов – неотъемлемая часть флоры и растительности экосистем ООПТ России.
Известно, что дефицит минеральных веществ в воде оказывает тормозящее влияние
на развитие большинства водорослей. Конъюгаты, а среди них в первую очередь
мезотениевые и десмидиевые водоросли, - одна из немногих групп, которая находит
себе оптимальные условия в водоемах бедных минеральными веществами, но с
достаточным содержанием органических веществ, т. е. главным образом болота и
заболоченные территории.
Водоросли – тонкий реагент на антропогенные
воздействия, что и позволяет использовать их в качестве биоиндикаторов при
разработке природоохранных меропртятий. Видовой состав и количественное
распределение пресноводных зеленых мезотениевых и десмидиевых водорослей могут
служить одним из наиболее чутких показателей состояния водных экосистем.
Сотрудниками лаборатории альгологии
Ботанического института им. В. Л. Комарова РАН было обследовано более 30 ООПТ
Северо-Запада России, среди которых после просмотра собранного материала
наибольшего внимания заслуживают заповедники – Нижнесвирский (Ленинградская область,
Лодейнопольский район) и “Кивач” (Кольский полуостров, Карелия), ряд
существующих, проектируемых и предлагаемых к охране заказников или памятников
природы, расположенных на Карельском перешейке и в Выборгском и Ломоносовском
районах Ленинградской области, а также национальный парк «Себежский»,
расположенный в Псковской области.
Далее приводится список наиболее
интересных и полнее обследованных территорий ООПТ Северо-Запада России.
1. 1989 – 1991
г.г. Нижнесвирский заповедник (Ленинградская область).
2. 1989 г. Болота Низовское и Термоловские (Ленинградская
область)
3. 1990 г. Стрельнинский берег (Красносельский район г. Санкт-Петербурга)
4. 1993 г. Заповедник «Кивач» (Кольский полуостров, Карелия)
5. 1994 г. Полярно-алпийский Ботанический сад-институт,
территория которого приравнивается к ООПТ (Кольский полуостров, Хибины)
6. 2001 г. Заказник «Березовые острова» (Ленинградская область)
7. 2002 г. Старая Русса, грязеобразующие озера этого курорта
приравниваются к ООПТ (Новгородская область)
8. 2005 г. Заказник «Котельский» (Ленинградская область)
9. 2005 г. Болото «Ламмин-Суо» (Ленинградская область)
10. Череменецкие озера (Ленинградская область)
11. 2005 – 2007
г. г. Национальный парк «Себежский» (Псковская область)
Ниже приводится современная система пресноводных
зеленых водорослей группы конъюгат.
Отдел Streptophyta
Класс Zygnematophyceae
Пор. Zygnematales
Сем. Mesotaeniaceae
Сем. Zygnemataceae
Пор. Desmidiales
Сем. Gonatozygaceae
Сем. Peniaceae
Сем. Closteriaceae
Сем. Desmidiaceae
Интересно отметить, что впервые в Красную
Книгу Ленинградской области (Красная Книга природы Ленинградской области, т.2,
2000) внесен 71 вид водорослей, из которых 21 представитель относится к группе
конъюгат. Это – Spirotaenia turfosa, Genicularia elegans, G.
spirotaenia, Gonatozygon brebissonii,
Closterium idiosporum, C.
nordstedtii, Cosmarium isthmium,
C. praegrandae, Micrasterias jenneri, M. mahabuleshwarensis, Pleurotaenium baculoides,
Staurodesmus tumidus, Triploceras gracile, Xanthidium fasciculatum, Mougeotia varians, Spirogyra colligata, S.
mirabilis, S.
reticulata, S.
subcrassa, S.
ternata, Zygnema peliosporum.
В результате анализа проведенных
исследований на обследованных ООПТ Ленинградской области было выявлено 198
видов или 225 видов и внутривидовых разновидностей конъюгат, относящихся к 26
родам (Actinotenium, Bambusina, Closterium, Cosmarium, Cosmoastrum, Cosmocladium, Cylindrocystis, Desmidium, Docidium, Euastrum ,Genicularia, Gonatozygon, Hyalotheca, Micrasterias, Netrium, Penium, Pleurotaenium, Raphidiastrum, Spondylosium, Staurastrum, Staurodesmus, Tetmemorus, Xanthidium, Mougeotia, Spirogyra, Zygnema). Важно отметить среди
выявленных видов Cosmarium schröderi Grönblad, впервые обнаруженный в России (заказник «Березовые
острова», Ленинградская область) и Staurodesmus tumidus (Bréb.) Teil., редкий вид, занесенный в Красную Книгу
природы Ленинградской области.
До настоящего времени сведения о пресноводных
водорослях Псковской области остаются довольно скудными. Среди многочисленных
озер Псковской области только Псковско – Чудское озеро можно считать наиболее
исследованным, по другим же водоемам имеются в лучшем случае краткие
одноразовые сведения, в которых чаще всего не приводятся списки водорослей.
Существенным вкладом в изучение водорослей Псковской
области следует рассматривать работу Д. Н. Суднициной «Водоросли водоемов
Псковской области», составленную на основе анализа литературных и собственных
данных автора, в которой приводится общий аннотированный систематический список
водорослей (работа находится в печати, предполагалось издание в 2008 г.).
Несмотря на то, что в последнее время все больше и
больше внимания уделяется ООПТ как эталонам растительности для сравнения с
территориями, несущими антропогенную нагрузку, следует отметить, что в
отношении растительности и биологического разнообразия ООПТ лучше изучены
высшие растения, в то время как низшие растения, а среди них в первую очередь
водоросли, остаются до сих пор самой мало исследованной и изученной группой.
Сотрудниками лаборатории альгологии Ботанического
института им. В. Л. Комарова РАН в летние месяцы 2005 – 2007 г. г. обследовались
разнотипные водоемы и водотоки национального парка “Себежский” (Псковская область,
Себежский район). Водоемы, расположенные на территории этого парка, (а их
насчитывается более 100) практически не изучались. Только в нескольких озерах в
летний период одноразово были взяты и просмотрены пробы фитопланктона
(Судницина, 1999).
Парк был основан в 1997 году с целью сохранения
уникального природного комплекса южной части Псковской области. Общая площадь
водного фонда составляет 7150
га. На территории парка протекают 20 рек и расположено
большое количество озер ледникового происхождения: Нечерица, Себежское, Осыно,
Ороно и др. Многие из 86 больших и малых озер парка соединены между собой
многочисленными речками и протоками. Средняя глубина озер – 3 – 5 м, максимальная – 7 –12 м. Несколько
озер – Себежское, Ороно, Вятитерево, Глыбочно, Белое, Озерявы и Нечерица –
представляют собой единую систему водоемов, которая имеет выход в р. Западная
Двина и далее в Балтийское море. В парке представлены водоемы различной
морфометрии и трофности, различные по времени и пути формирования.
Результаты изучения водоемов национального парка
“Себежский” показали, что общий список конъюгат (кл. Zygnematophyceae) насчитывает 112 видов и 8 разновидностей или 120
видов и внутривидовых разновидностей, относящихся к 21 роду (Actinotaenium, Closterium, Cosmarium, Cosmoastrum, Cylindrocystis, Bambusina, Euastrum, Gonatozygon, Micrasterias, Netrium, Penium, Pleurotaenium, Raphidiastrum, Spondylosium, Staurastrum, Staurodesmus, Teilingia, Tetmemorus, Mougeotia,
Spirogyra, Zygnema.)
Были встречены два представителя редких десмидиевых водорослей – Staurastrum gracile var. cyathiforme W. et G. S. West u S. leptocladium var. cornutum Wille,
которые в дальнейшем следует занести в Красную Книгу природы Псковской области.
Среди представителей из других отделов водорослей были
встречены: редкая разновидность зеленых хлорококковых водорослей – Pediastrum duplex var. gracillimum W. et G. S. West; вид красных
водорослей, занесенный в Красную Книгу природы Ленинградской области – Batrachospermum moniliforme Roth, а также редкие виды перидиниевых водорослей – Ceratium carolinianum (Bail.) Jцrg. и С. cornutum (Ehr.) Clap. et Lachm. Род Phacus из эвгленовых
водорослей вызывал “цветение” в канаве около дер. Осыно. Все редкие виды
несомненно следует в будущем занести в Красную Книгу природы Псковской области.
Наибольшей видовой насыщенностью в изученном парке
отличаются роды Cosmarium (34), Staurastrum (19) и Closterium (14).
Отрадно отметить нахождение видов рода Micrasterias (5),
особенно M. sol, которые в последнее время встречаются все реже и
реже.
Таким образом, общее число видов и видовых
разновидностей для обследованного нами Северо-Запада России составляет 226
видов или 259 видов и внутривидовых разновидностей, которые распределились
следующим образом:
Cylindrocystis – 2 вида, Maesotaenium – 1 вид, Netrium
– 3 вида и 4 разновидности, Actinotaenium
– 5 видов, Bambusina – 1 вид и 1
разновидность, Closterium – 37 видов и 4
разновидности, Cosmarium – 50 видов и 11
разновидностей, Cosmoastrum – 18 видов и 2
разновидности, Сosmocladium
– 1 вид, Docidium – 1 вид, Desmidium – 3 вида, Euastrum – 19 видов и 3 разновидности, Hyalotheca – 1 вид, Micrasterias – 8 видов и 2 разновидности, Penium - 6 видов, Pleurotaenium – 5 видов и 4 разновидности, Raphidiastrum – 6 видов, Spondylosium – 2 вида, Staurastrum – 25 видов и 4 разновидности, Staurodesmus – 11 видов, Tetmemorus – 3 вида и 1 разновидность, Teilingia – 1 вид, Xanthidium – 4 вида и 3 разновидности, Genicularia – 1 вид, Gonatozygon – 3 вида, Mougeotia –
2 вида, Spirogyra – 1.
Видовой состав и количественное
распределение пресноводных зеленых водорослей класса Zygnematophyceae могут служить одним из наиболее чутких показателей
состояния водных экосистем. Изучение альгофлоры и взаимодействия водорослей с
другими компонентами биогеоценозов является необходимой частью комплексного
изучения, что составляет научную основу рационального освоения и охраны
природных ресурсов. Поэтому создание и изучение ООПТ России как эталонов
нетронутой природы, необходимо для сохранения биологического разнообразия и поддержания
устойчивого экологического развития.
Список литературы
Лукницкая А.Ф. К альгофлоре Псковской области:
пресноводные зеленые водоросли (Streptophyta, Zygnematophyceae) национального парка «Себежский» // Новости
систематики низших растений. 2008. Т. 42 (в печати)
Красная книга природы Ленинградской
области. Т. 2. Растения и грибы. СПб., 2000. 672 с. (Водоросли. С. 359 – 437).
Судницина Д.Н. Летний фитопланктон
некоторых озер Себежского национального парка // Проблемы экологии и
региональной политики Северо-Запада России и сопредельных территорий. Материалы
международной общественно-научной конференции. Псков. 1999. С. 21-23.
Судницина Д.Н. Водоросли водоемов
Псковской области. Разнообразие водорослей водоемов и водотоков Псковской
области (Предварительные данные). Псков. 2008. (в печати).
АЛЬГОФЛОРА ПОЧВ ЛЕСОВ СТЕПНОЙ ЗОНЫ УКРАИНЫ
Мальцева И.А.
Forest soil algal flora of Ukraine steppe zone
Malseva I.A.
Мелитопольский государственный педагогический университет имени
Б.Хмельницкого
ул. Ленина, 20, г.
Мелитополь, Запорожская обл., Украина, 72312, тел.+038-0619-421528
e-mail: Maltseva_irina@ukr.net
С позиции общей теории систем внутренняя структура
экосистем определяется характером и способом взаимодействия элементов. Лесные
ценозы способны в значительной степени влиять на формирование своей экологической
среды и значительно сильнее взаимодействовать с окружающей средой, чем другие
типы растительности. Относительно травянистых сообществ они характеризуются
определенным качественным отличием и изоляцией видового состава организмов, которые
их населяют, что находит проявление в спектре ведущих семейств, жизненных форм
и т.п. Это в полной мере относится и к фитоэдафону лесных биогеоценозов. На
фоне ряда географических особенностей, в общих чертах описанных Т.И.
Алексахиной и Э.А. Штиной (1984), альгогруппировки лесов сохраняют свои особенные
черты.
Для почв Украины известно 892 вида водорослей
(Костиков и др., 2001), более половины которых – 66,1 % (590 видов), как
показал произведенный анализ, встречены в лесных экосистемах лесостепной зоны,
Украинского Полесья, Украинских Карпат и Горного Крыма. В результате исследования
фитоэдафона лесов степной зоны Украины естественного и искусственного
происхождения в пределах долинно-террасового и приводораздельно-балочного ландшафтов обнаружено 288 видов водорослей: Cyanophyta – 35 (12,1 %), Euglenophyta – 2 (0,7 %), Eustigmatophyta – 7 (2,4 %), Xanthophyta – 54 (18,8 %), Bacillariophyta – 29
(10,1 %) і Chlorophyta –
161 (55,9 %)
(Мальцева, 2005).
Рассчитанные показатели коэффициента общности Жаккара
показали, что видовой состав альгофлоры исследованных лесов наиболее подобен
фитоэдафону Лесостепи Украины (табл. 1).
Таблица 1
Матрица расчетов коэффициента общности Жаккара для
полных видовых списков водорослей лесных биогеоценозов различных регионов
Украины
|
Регион
|
Украинские
Карпаты
|
Украинское
Полесье
|
Лесостепь
|
Степь
|
Горный
Крым
|
|
Украинские
Карпаты
|
214
|
115
|
127
|
106
|
59
|
|
Украинское
Полесье
|
32,9
|
251
|
167
|
135
|
65
|
|
Лесостепь
|
29,1
|
38,7
|
347
|
164
|
85
|
|
Степь
|
26,8
|
33,4
|
34,8
|
288
|
71
|
|
Горный
Крым
|
20,2
|
22,6
|
21,3
|
20,1
|
137
|
Примечание: по диагонали – количество видов водорослей
в альгофлоре лесов региона; над диагональю – количество общих видов в
сравниваемых списках; под диагональю – значение коэффициента общности Жаккара.
Сравнительный анализ структуры альгофлоры на уровне
отделов выявил ряд тенденций, которые демонстрирует рис. 1. Наиболее заметным
есть, с одной стороны, уменьшение части зеленых водорослей в альгогруппировках
лесов в ряду: Украинские Карпаты-Полесье-Лесостепь-Степь-Горный Крым, с другой
– увеличение в этом же направлении разнообразия синезеленых водорослей. Роль
желтозеленых достаточно стабильна, а доля диатомовых в общем разнообразии видов
несколько возрастает в степных лесах, а в Украинских Карпатах есть наименьшей.
Известно, что разные типы растительности отличаются по
видовому составу водорослей и структурно-функциональной организации
альгогуруппировок. Зональной смене растительности и почв соответствуют определенные
перестройки в составе фитоэдафона (Голлербах, Штина, 1969; Штина, Голлербах,
1976). Различными исследованиями показаны специфические черты водорослевых
сообществ лесных, степных, пустынных и др. биогеоценозов. Это согласуется с
определением сути экосистемы, где она представлена совокупностью
взаимосвязанных организмов, которые функционируют на одной территории и
взаимодействуют с окружающей средой таким образом, что поток энергии формирует
четко обозначенные биотические структуры и круговорот веществ между живой и
неживой составляющей. При этом экологические факторы не только взаимосвязаны между
собой и определяют характер растительных группировок, но и последние выступают
как мощный экологический фактор, который формирует специфику экотопа. Поэтому,
как подчеркивают Я.П. Дидух и П.Г. Плюта (1994), несмотря на тесную связь
растительности с условиями среды, между их сменою нет линейной зависимости, и
она имеет более сложный характер.
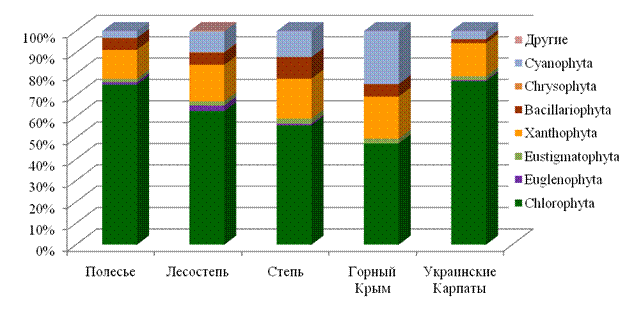
Рис. 1. Структура систематического списка водорослей,
обнаруженных в почвах лесных биогеоценозов разных регионов Украины, на уровне
отделов.
Растительные сообщества или фитоценозы чаще в
экологическом отношении представляют собой образование гетерогенного порядка.
Только в крайних позициях, когда сужается экологический объем местообитаний,
структура ценоза упрощается и они начинают слагаться с экологически равноценных
видов (Одум, 1986 а,б).
Необходимость глубокого анализа сложных
взаимоотношений между растительными организмами и конкретными условиями, в
которых они существуют, стала толчком для развития учений о жизненных формах.
Построение детализированных схем и спектров разнотипных жизненных форм есть
объективно сложным, трудоемким, усложненным особенностями становления и
развития теоретических положений и определений самого учения о жизненных формах
заданием, но таким, которое благоприятствует познанию структуры, динамики,
эволюции растительных сообществ, их взаимосвязи со средой и перспектив
регулирования человеком. Учение о жизненных формах отличается длительной
периодизированной историей, которой посвящены детальные обзоры многих ученых (Серебряков,
1962; Серебрякова, 1972 и др.). Большое внимание на экобиоморфологический
состав рекомендует обращать Т.А. Работнов (1992), рассматривая его как
результат длительного отбора видов, способных существовать вместе в условиях
гетерогенной и динамичной среды, занимая разные экологические ниши. Почвенные
водоросли имеют различные приспособления для жизни в почве и на ее поверхности.
В тоже время, они имеют определенные структурные и физиологические особенности
на уровне всего таллома или отдельных клеток, которые дают возможность
различать их по приспособленности к пространственному расселению и закреплению
на территории, к наиболее полному использованию всего комплекса условий
местообитания (Голлербах, Штина, 1969; Штина, Голлербах, 1976). Это дало
возможность разработать классификацию жизненных форм водорослей (Штина,
Голлербах, 1976), которая раскрывает отношение видов к действию ряда
экологических факторов. В первую очередь, увлажнения, освещения, температуры.
Дальнейшее развитие и детализация существующей классификации связана с целым
рядом трудностей, на которые указывали еще М.М. Голлербах и Э.А. Штина (1976).
Среди них – микроскопический размер и однообразие морфологических структур
большинства почвенных водорослей, недостаточность сведений о экологической
характеристике видов по наблюдениям в природе (определение водорослей
происходит главным образом на культуральном материале, в большинстве случаев в
описаниях отсутствуют физико-химические характеристики почв), образование
комплексов, в которых один вид находится в той или иной связи с другими и т.п.
Перспективным можно считать оценку каждого вида водорослей относительно различных
факторов, на которые можно разделить многогранную среду обитания. Экотоп, как составляющая
биогеоценоза, может быть разделена на климатоп и эдафотоп, а последние, в свою
очередь, – на гелиотоп и термотоп, трофотоп и гигротоп. Для выделения
взаимосвязи растительных организмов и среды обитания, а также уровня
приспособления отдельных фитокомпонентов к наиболее значимым элементам ценоза,
система экоморф должна включать, кроме оценки приспособления видов к каждому из
структурных элементов экотопа в отдельности, так и приспособленность видов к
фитоценозу в целом (Бельгард, 1980). Такой подход позволяет глубже раскрыть
взаимосвязь растительных организмов и водорослей в том числе, к главным
составляющим биогеоценоза.
Был проведен анализ гетерогенности состава водорослей
в почвах лесов степной зоны Украины по принадлежности их к определенному типу
фитоценоза. В результате оценки встречаемости видов в лесных, луговых и степных
фитоценозах Украины было выделено шесть групп видов. Наибольшая по количеству
видов группа объединяла представителей, которые одинаково часто встречалась в
различных фитоценозах, в том числе и степных лесах. Это достаточно разнородная
группа, которая объединила различные экобиоморфы: Ch25Х22С7H6B5
Р2CF1amph1 (69). Критерием дальнейшего
разделения на группы мы взяли не менее чем двукратное превышение показателя
встречаемости в одном типе фитоценоза относительно другого. «Лугово-степной»
комплекс объединил 10 видов: Р5М1H1NF1CF1B1;
«лесной» - 56: Ch18С17Х12H5B1amph3;
«степной» - 20: CF4Х4Ch3Р3С2H2B2;
«луговой» - 5: CF2Х1Ch1С1. Еще одна группа объединила редкие и новые для
альгофлоры Украины виды, которые часто встречались только в лесах степной зоны.
На данном этапе стало возможным сделать только определенные предположения о
характере связи видов почвенных водорослей с определенным местообитанием и
типом фитоценоза. Связано это, в большей степени, с невысокими показателями
встречаемости большинства видов. Из 885 видов водорослей почв Украины (Костиков
и др., 2001) в состав активно вегетирующего комплекса, используя в качестве пороговой величины предложенный И.Ю. Костиковым
критерий встречаемости гидрофильных видов, можно отнести только 225. Дальнейшие
исследования позволят уточнить характер распространения видов водорослей и
выделить не только ценоморфы водорослей, но и на основе экологических паспортов
видов составлять экологические спектры альгогруппировок: соотношение гелиомор,
термоморф, трофоморф, гигрофорф и ценоморф.
Список литературы
Алексахина Т.И., Штина Э.А. Почвенные
водоросли лесных биогеоценозов. – М.: Наука, 1984. – 150 с.
Бельгард А.Л. К вопросу об экологическом анализе и
структуре лесных фитоценозов в степи // Вопросы биологической диагностики
лесных биогеоценозов Присамарья. Днепропетровск, ДГУ, 1980. – С. 11–43.
Водорості ґрунтів України
(історія та методи дослідження, система конспект флори) / Костіков І.Ю., Романенко
П.О., Демченко Е.М., Дарієнко Т.М., Михайлюк Т.І., Рибчинський О.В., Солоненко
А.М. – Київ: Фітосоціоцентр, 2001. – 300с.
Голлербах М.М., Штина Э.А. Почвенные водоросли. –
Ленинград: Наука, 1969. – 143с.
Дідух Я.П., Плюта П.Г.
Фітоіндикація екологічних факторів. – Київ: Наукова думка, 1994. – 280 с.
Мальцева І.А.
Біорізноманіття та екологія ґрунтових водоростей лісових біогеоценозів справжніх
степів України: Автор. дис. д-ра біол. наук, 2005. – Дніпропетровськ, 36 с.
Работнов Т.А. Фитоценология. – М.: МГУ, 1992. – 352 с.
Одум Ю. Экология: Т.1. – М.: Мир, 1986а. – 328 с.
Одум Ю. Экология: Т.2. – М.: Мир, 1986б. – 376 с.
Серебряков И.Г.
Экологическая морфология растений. – М.: Высшая школа, 1962. – 379 с.
Серебрякова Т.И. Учение
о жизненных формах растений на современном этапе // Итоги науки и техники. Ботаника.
– М.: ВИНИТИ, 1972. – Т. 1. – С. 84–169.
Штина Э.А., Голлербах М.М. Экология почвенных
водорослей. – М.: Наука, 1976. – 143 с.
АЛЬГОФЛОРА
ПРИРОДНОГО ПАРКА «ВЕПССКИЙ ЛЕС»
Нестерович
А.С., Балашова Н.Б.
ALGAL FLORA OF THE «VEPSSKY FOREST»
NATURAL PARK
Nesterovich A.S., Balashova N.B.
Санкт-Петербургский
Государственный Университет
СПб,
Университетская набережная, 7/9, тел.
88123289543, тел./факс 88123289703
e-mail: Anesterovich@gmail.com
Природный парк «Вепсский лес»
расположен на востоке Ленинградской области, на границе с Вологодской. В
пятидесятые годы во время рекогносцировок биологи Ленинградского (ныне
Санкт-Петербургского) Государственного Университета пришли к убеждению, что
только на крайнем востоке нашей области сохранились фрагменты практически
девственных лесов. Ещё в конце 50-х — начале 60-х годов прошлого века известные
ботаники А. А. Ниценко и Н. А. Миняев под впечатлением полевых наблюдений
предложили организовать здесь охраняемую территорию. Однако государственное
природоохранное учреждение Природный парк «Вепсский лес» появляется только в
начале ХХI века — 4 мая 2001г. (Природный парк "Вепсский лес", 2005).
Несмотря на то, что Ленинградская область исследуется альгологами давно, изучена
она всё ещё не полно и менее всего изучен восток области. Данные по альгофлоре
парка до настоящего времени отсутствовали. Не изучался Парк из-за своей
труднодоступности, но это обстоятельство имеет и положительную сторону – Парк
малопосещаем. Многие участки считаются старовозрастными, т.е. не подвергавшимися
хозяйственной деятельности в течение, по крайней мере, одного поколения
доминирующего в фитоценозе вида. Для ели — главной породы таких участков — этот
срок составляет около трёхсот лет. Зональной растительностью для Парка являются
таёжные леса и верховые болота, представленные здесь очень широко.
В Парке представлены средне-таёжные и
южно-таёжные типы растительности, варианты еловых, сосновых и смешанных лесов,
а также вторичных мелколиственных лесов, которые замещают коренные типы после
вырубки. Леса в естественном состоянии занимали до 70-80% от всей территории.
Сейчас на лесные угодья приходиться 68% площади Парка; пятую часть занимают
болота, особенно широко распространённые в юго-восточной части. В пределах
Парка болота встречаются на различных формах и элементах рельефа: на
водораздельных равнинах, пологих склонах, в межхолмных котловинах и ложбинах,
на озёрных и речных террасах, в поймах рек. Они отличаются по типу питания:
верховые — олиготрофные, с питанием атмосферными осадками; низинные — эвтрофные
с грунтовым питанием; переходные — мезотрофные, со смешанным питанием. Наиболее
широко представлены верховые болота. Луга занимают небольшую площадь (около 1%)
и приурочены к долинам рек и озёрным котловинам.
Материалом для данной работы послужили
сборы, проведённые в сентябре-октябре 2005 года, в августе 2006, в июле и
августе 2007 и в июле 2008 годов. В Природном парке выделено 7 резерватов —
особо охраняемых участков, где полностью запрещена хозяйственная деятельность.
Отбор проб водорослей осуществлялся во всех резерватах — "Вепсский
лес", "Линзболото", "Карбоновые отторженцы",
"Леринский", "Урья-Канжая", "Ащозерский" и
"Висячие озёра"; обследовались также некоторые участки между ними.
Водоросли собирались во всех доступных
местообитаниях, чтобы получить наиболее полное представление о разнообразии
этой группы организмов в исследуемом регионе: на поверхности воды — скопления
плавающих нитчаток и плёнки одноклеточных водорослей; из поверхностного слоя воды
— пробы планктона; со дна водоёмов — макрофиты, соскабливались налёты с камней,
с высшей водной растительности и других подводных предметов; с поверхности
почвы и мхов снимались слизистые плёнки. В небольших временных водоёмах —
лужах, в придорожных канавах и других водоёмах, в которых наблюдалось
«цветение» воды, отбирался объём равный 100 мл. При видимом развитии аэрофитона
на коре деревьев водоросли собирались вместе с корой. Особенно следует выделить
такой тип отбора проб, как выжимки, поэтому основная часть проб — выжимки из
мхов, как правило сфагновых. Выжимались мхи в открытых болотах с разными
травянистыми растениями, старовозрастных заболоченных ельниках и сосняках; мхи,
растущие на пространствах без видимой (открытой) воды, и мхи, погружённые в
воду. Подводные мхи произрастали в самых различных водоёмах: ручьях и протоках
на болоте, первичных зарастающих озёрах, вторичных озёрах в грядово-озерковых
комплексах. Все озёра, в которых брались пробы, располагались в торфянистых
берегах, окружённые массивом болот. Всего отобрана и обработана 171 проба.
В результате в Вепсском лесу обнаружено
234 вида и внутривидовых таксона, относящихся к 9 отделам: Cyanophyta,
Euglenophyta, Dinophyta, Chrysophyta, Haptophyta, Bacillariophyta, Xanthophyta,
Chlorophyta и Rhodophyta (табл.).
Таблица
Систематический состав альгофлоры
|
Отдел
|
Кол-во видов и
внутривидовых таксонов
|
% от общего числа встреченных видов
|
|
Cyanophyta
|
40
|
17.1
|
|
Euglenophyta
|
7
|
3
|
|
Dinophyta
|
1
|
0.4
|
|
Chrysophyta
|
5
|
2.1
|
|
Haptophyta
|
1
|
0.4
|
|
Xanthophyta
|
10
|
4.3
|
|
Bacillariophyta
|
25
|
10.7
|
|
Chlorophyta
|
143
|
61.1
|
|
Rhodophyta
|
2
|
0.9
|
|
Итого
|
234
|
100
|
Наибольшего качественного разнообразия достигают
водоросли, принадлежащие отделу Chlorophyta — 61.1%. На втором месте —
синезелёные водоросли, а диатомеи сильно уступают двум доминирующим отделам.
Такая ситуация с диатомовыми водорослями объясняется неполнотой изученности
материала.
Сравнение полученных данных с результатами
исследований Ленинградской области показывает, что структура альгофлоры
Вепсского леса очень схожа с таковой в болотах других районов. Как и во всех
обследованных на территории области болотистых местообитаниях, доминирующее положение
занимают коньюгаты, особенно десмидиевые водоросли. Такое доминирование этой
группы водорослей может быть связано с двумя обстоятельствами; во-первых,
одноклеточные коньюгаты чрезвычайно характерны для альгофлоры болот, это
адаптированная к условиям высокой кислотности группа водорослей; во-вторых,
исторически сложилась ситуация, что болота обследовались специалистами именно
по мезотениевым и десмидиевым водорослям, поэтому представители других отделов
водорослей оставались практически незамеченными, тогда как известно, что в
болотах могут быть чрезвычайно широко представлены, например, диатомовые
водоросли (Куликовский, 2007).
Для болот
северных широт характерно по качественному разнообразию преобладание видов р. Cosmarium
Corda (Паламарь-Мордвинцева, 1982), но в Вепсском лесу мы
отмечаем наибольшее видовое разнообразие у р. Closterium Nitzsch ex
Ralfs.
Обращает на себя внимание необычно высокое
разнообразие отдела Xanthophyta, занимающего четвёртое место по числу таксонов.
Кроме того, представители этого отдела часто доминировали в сообществах.
Например, виды родов Tribonema Derb.
образовывали сплошные маты на болотах, а Vaucheria A. P. de Candolle –
тонкие плёнки на глинистых почвах. Клетки Chlorothecium capitatum Pascher и
Chlorothecium crassiapex
(Printz) Pascher обильно обрастали нити Tribonema, а Myxochloris spagnicola Pascher заполнял подавляющее большинство водозапасающих
клеток мхов.
Сопоставления с данными по разнообразию водорослей в
Ленинградской области (Балашова и др., 1999; Балашова, рукопись) показали, что
в альгофлоре Природного парка "Вепсский лес" присутствуют редкие для
Ленинградской области виды, некоторые из них отмечаются в этом регионе впервые:
•
Batrachospermum vagum (Roth.) Ag. — первая находка на территории
Ленинградской области.
•
Tabellaria binalis (Ehr.) Round — впервые отмечена на территории области.
•
Tabelaria binalis (Ehr.) Round var.
elliptica Flower — первая
находка в области.
•
Tabellaria quadriseptata Knudson — впервые отмечена в Ленинградской области.
•
Kobayasiella parasubtilissima (Kobayasi&Nagumo) Lange-Bertalot — впервые отмечена на территории области.
• Frustulia
rhomboides (Ehr.) De Toni var.
crassinerva (Bréb.) Ross — впервые отмечена на территории области.
Представляют
интерес находки Fortiea striatula (Hy) De Toni, внесённой в Красную
книгу Ленинградской области, и Myxochloris
spagnicola, встречающегося нечасто.
При анализе экологических характеристик использованы
материалы работы Бариновой С.С. с соавторами (2006). Среди видов, для которых
известна географическая приуроченность, преобладают широко распространённые в
водоёмах всех широт водоросли-космополиты. К видам-космополитам относятся почти
все виды, вызывавшие "цветение" водоёмов в Парке — Anabaena flos-aquae (Lyngb.) Bréb., Botryococcus braunii Kütz., Euglena polymorpha Dang., Nostoc kihlmani Lemm..
Исключение составляют Euglena hemichromata Skuja
и Cosmoastrum muricatum (Bréb.) Pal.-Mordv.,
достигающие массового развития, но относящиеся к голарктическому
географическому элементу. В Парке в равном количестве представлены как
планктонные, так и бентосные формы. Планктонные формы развиваются чаще в озёрах
и лужах. К ним относится такой широко встречаемый в литорали озёр вид, как Bambusina brebissonii Kütz.. Типичными планктёрами являются и многие формы,
вызывавшие цветение: Anabaena flos-aquae, Euglena hemichromata,
Nostoc kihlmani, Volvox cf. aureus Ehr..
Бентосные виды тяготеют к болотам и чаще встречаются среди мхов и в мочажинах
(виды рода Eunotia Ehr..). Среди ярких представителей бентоса, развивавшихся
массово, можно назвать Batrachospermum vagum и Cosmoastrum muricatum. По отношению к рН выделяются водоросли ацидофилы и
индифференты, не было отмечено ни одного представителя группы алкалифилов,
предпочитающих воды с щелочной реакцией среды. Среди водорослей, обнаруженных
на исследуемой территории, 98 видов являются показателями состояния воды. Более
всего представлены группы олигосапробов и β-мезосапробов. Если использовать крупные категории,
объединив виды-индикаторы от ксено- до β-мезосапробов в группу показателей
«условно чистых вод», а остальных — «загрязнённых» вод, то характер водоёмов
проявится ярче. В первой группе окажется 90 видов, а во второй — только 8. Данное
обстоятельство указывает на олигосапробный характер местообитаний. Это очень важный
момент, т.к. болота, занимающие огромные территории, могут рассматриваться как
хранилища чистых вод (Вепсский лес, 2005). Исходя из проведённого анализа можно
отнести обследованные водоёмы к дистрофным, олигосапробным. Основной болотный
массив обладает всеми характеристиками ненарушенного олиготрофного сообщества:
систематический состав, наличие специфических видов, таких как Eunotia exigua (Bréb.) Rabenh., Tetmemorus brebissonii (Menegh.) Ralfs, Xanthidium antilopaeum
(Bréb.) Kütz., которые
считаются типичными обитателями верховых болот (Лукницкая, 1992), высокое
разнообразие водорослей при их низкой биомассе, доминирование олигогалобов и
олигосапробов.
Список литературы
Балашова
Н.Б., Белякова Р.Н., Лукницкая А.Ф., Ковальчук Н.А., Басова С.Л., Жакова Л.В.
Альгофлора Санкт-Петербурга и Ленинградской области //Биоразнообразие
Ленинградской области. Труды С-Петербургского общества естествоиспытателей.
Серия 6. 1999. Т.2. С.13 – 78.
Балашова Н.Б. Зелёные (хлорококковые),
золотистые, динофитовые, жёлтозелёные, красные водоросли Ленинградской области.
Рукопись
Баринова С.С., Медведева Л.А., Анисимова О.В.
Биоразнообразие водорослей – индикаторов окружающей среды. Тель-Авив. 2006. 498
с.
Лукницкая А.Ф.
Десмидиевые и мезотениевые водоросли (Chlorophyta:
Desmidiales, Mesotaeniales)
некоторых болот Карельского перешейка // Новости систематики низших
растений.1992. Т. 28. С. 16-20.
Куликовский М.
Диатомовые водоросли некоторых сфагновых болот Европейской части России //
Дисс. на соиск. уч. степ. к.б.н. СПб. 2007.
Определитель
пресноводных водорослей СССР. Вып. 11(2). Зелёные водоросли, класс Конъюгаты,
порядок Десмидиевые. М.-Л. 1982. 620 с.
Попова Т.А.,
Березкина Л.И., Бычкова И.А., Леонтьева Е.В., Семенова Н.Н., Шубина М.А.
Природный парк "Вепсский лес". СПб. 2005. 343 с.
Видовое разнообразие цианопрокариот
восточноевропейских тундр России
Патова Е.Н.
Cyanoprokaryota Species
diversity in Russia
east european tundra
Patova E.N.
Институт биологии,
Коми НЦ УрО РАН,
Республика Коми,
г. Сыктывкар, 167982 ул. Коммунистическая, 28
e-mail: patova@ib.komisc.ru
К настоящему времени в восточноевропейских
тундрах зарегистрировано 334 вида (371 с внутривидовыми таксонами)
цианопрокариот из 4 порядков, 20 семейств и 69 родов (табл. 1-3). Учитывая, что
сводный список водорослей региона
включает около 1900 видов с разновидностями и формами (водоемы – 1460, почвы –
253) из 10 отделов (Гецен и др., 2002), синезеленые региона, формируют 19 % от всего
выявленного разнообразия водорослей, что указывает на значительное
флористическое богатство этого отдела. По разнообразию цианопрокариоты
уступают только диатомовым и зеленым водорослям (Гецен и др., 1994; 2002).
Флора цианопрокариот восточноевропейских тундр составляет около 80% от
выявленного разнообразия этой группы в российском секторе Арктики. На Таймыре, в Якутии, Мурманской области и в ряде
других северных территорий цианопрокариоты
составляют от 7 до 45 % альгофлор
(рис.). На данный момент зарегистрированное для восточноевропейских тундр
разнообразие цианопрокариот является одним из самых высоких для субарктических
и арктических регионов России, что связано в первую очередь с лучшей
изученностью и широким охватом разнообразных местообитаний. В водоемах
зарегистрировано 304, в почвах – 158 видов с разновидностями и формами
цианопрокариот (табл. 1). Общими для водных и наземных экосистем являются 87
видов. Сходство видового разнообразия цианопрокариот водоемов и почв достигает
39 %. В условиях дефицита азота в
экосистемах тундры ведущее место в структуре флоры принадлежит видам, способным
к фиксации молекулярного азота. Потенциально способные к азотфиксации
гетероцитные виды формируют 31 % (111 видов):
для водоемов – 34 % (92), для
почв – 30 % (46 видов).
Таблица 1
Таксономическое разнообразие Cyanoprokaryota в восточноевропейских тундрах
|
Таксономические
характеристики
|
Всего
|
Водоемы
|
Почвы
|
|
Семейств
|
20
|
19
|
18
|
|
Родов
|
69
|
63
|
44
|
|
Видов
|
334
|
268
|
154
|
|
Видов
с внутривидовыми таксонами
|
371
|
304
|
158
|
|
Среднее:
|
|
|
|
|
Число
родов в одном семействе
|
3.5
|
3.3
|
2.4
|
|
Число
видов в одном семействе
|
16.7
|
14.1
|
8.6
|
|
Число
видов в одном роде
|
4.8
|
4.1
|
3.5
|
В результате исследований флора
цианопрокариот восточноевропейских тундр с момента последней инвентаризации,
проведенной для Большеземельской тундры
(Гецен и др., 1994), была дополнена для водоемов на 135, для почв на 41 видовых и внутривидовых
таксона. Современные пропорции флоры цианопрокариот составляют 1: 3.5:16.7.
Родовая насыщенность видами - 4.8 (табл. 1). Эта величина в 2.5 раза ниже, чем для диатомовых и зеленых
обсуждаемого региона (Гецен и др.,
1994), но несколько превосходит значения, рассчитанные для цианопрокариот ряда
других северных альгофлор (Сдобникова, 1986; Перминова, 1990; Флора
тундровой зоны…, 1991; Skulberg, 1996;
Комулайнен, 2004; Ярушина, 2004; Давыдов, 2006; и др.). Как видно из таблицы 1, во флоре водоемов видовая насыщенность родов и
видов выше, чем в почвах.
А
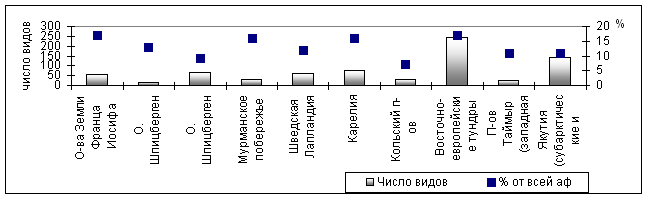
Б
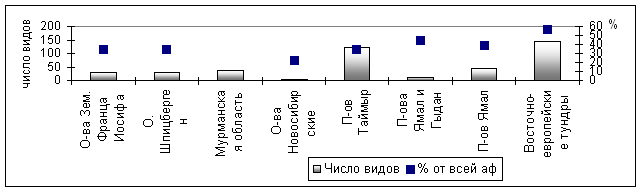
Рис. Распределение видового разнообразия (число видов)
и участия цианопрокариот
в альгофлорах (%) северных регионов. А – водные
экосистемы, Б – наземные экосистемы.
По: Сдобникова, 1986; Перминова, 1990; Флора тундровой
зоны…, 1991; Skulberg, 1996;
Комулайнен, 2004; Давыдов, 2006; Флора тундровой зоны…,
1991 и др.
Лидирующие позиции по видовому
разнообразию во флоре региона занимают семейства: Nostocaceae, Phormidiaceae и Oscillatoriaceae (табл. 2). Десять ведущих
семейств включают 80 % всего видового разнообразия цианопрокариот. Эта величина
близка к полученной для ведущих семейств всей альгофлоры Большеземельской тундры,
которая по данным М. В. Гецен (1985) составила 86 %. Спектр ведущих семейств
сходен с таковым, полученным для наиболее хорошо изученной к настоящему времени
флоры цианопрокариот Мурманской области, где к ведущим относятся Nostocaceae,
Merismopediaceae, Phormidiaceae (Давыдов, 2006). Здесь эти
семейства включают почти половину (44%) всего видового разнообразия цианопрокариот.
Семейственные спектры альгофлоры водоемов и почв имеют
некоторые отличия (табл. 2). Так, в наземных экосистемах водоросли семейства Nostocaceae
уступают лидирующие позиции представителям Phormidiaceae. Более высокий
ранг занимает – Pseudanabaenaceae. Два последних семейства, наряду с Oscillatoriaceae,
обычно лидируют во флорах цианопрокариот почв не только арктических регионов,
но и других природных зон (Базова, 1968; Новичкова-Иванова, 1980; Алексахина, Штина, 1984; Приходькова,
1992; Кузяхметов, 2006; Патова, Белякова, 2006 и др.).
Таблица 2
Соотношение по числу таксонов семейств Cyanoprokaryota во флоре
восточноевропейских тундр
|
Место семейства
|
Семейство
|
Место семейства
|
Число родов
|
Число видовых и внутривидовых таксонов
|
|
водоемы
|
почвы
|
всего
|
всего
|
|
водоемы
|
почвы
|
водоемы
|
почвы
|
|
1
|
Nostocaceae
|
1
|
2
|
8
|
84
|
|
7
|
5
|
75
|
22
|
|
2
|
Phormidiaceae
|
2
|
1
|
7
|
57
|
|
5
|
5
|
42
|
37
|
|
3
|
Oscillatoriaceae
|
3
|
4
|
3
|
46
|
|
3
|
3
|
39
|
13
|
|
4
|
Merismopediaceae
|
4
|
8-9
|
8
|
31
|
|
8
|
2
|
29
|
7
|
|
5
|
Rivulariaceae
|
5
|
6
|
4
|
29
|
|
4
|
3
|
28
|
9
|
|
6
|
Pseudanabaenaceae
|
6
|
3
|
5
|
28
|
|
5
|
3
|
22
|
16
|
|
7
|
Synechococcaceae
|
7
|
5
|
8
|
26
|
|
7
|
5
|
21
|
11
|
|
8
|
Microcystaceae
|
11
|
7
|
3
|
11
|
|
2
|
3
|
6
|
8
|
|
9
|
Chroococcaceae
|
8-9
|
10
|
3
|
10
|
|
2
|
2
|
8
|
8
|
|
10
|
Microchaetaceae
|
8-9
|
11-12
|
3
|
9
|
|
3
|
2
|
8
|
5
|
|
11
|
Schizotrichaceae
|
13-14
|
8-9
|
1
|
8
|
|
1
|
1
|
3
|
7
|
|
12-20
|
Прочие
|
-
|
-
|
13
|
32
|
|
11
|
7
|
23
|
15
|
|
|
|
|
|
|
|
|
|
|
|
|
Сравнение семейственных спектров цианопрокариот
исследованных в Якутии (Флора тундровой зоны…, 1991), на Таймыре (Сдобникова,
1986), Мурманской обл. и о. Шпицберген (Давыдов, 2006; Флора и растительность…,
2008), показало, что в целом спектры семейств восточноевропейских тундр и
других северных регионов довольно схожи, что отражает принадлежность сравниваемых
флор цианопрокариот к арктическим и гипоарктическим широтам. Особенностями
семейственной структуры цианопрокариот восточноевропейских тундр являются: 1)
большее число семейств; 2) высокое видовое разнообразие семейств Phormidiaceae
и Oscillatoriaceae, что
объясняется большей изученностью водных экосистем; 3) низкое положение в семейственном
спектре Merismopediaceae, Pseudanabaenaceae и Synechococcaceae по сравнению с флорой цианопрокариот Мурманской обл.,
это в свою очередь может быть связано с меньшей изученностью в нашем регионе
горных экосистем и моховых стаций.
Ведущими родами по числу видов
во флоре цианопрокариот восточноевропейских тундр являются: Anabaena (52), Phormidium (40), Oscillatoria (31), Nostoc (20), Calothrix (17), Leptolyngbya (14), Aphanocapsa (11) и Lyngbya
(10) (табл. 4). Они формируют 54 % от общего разнообразия флоры цианопрокариот,
остальные - содержат менее 10 видов. Родовые спектры для водоемов и почв имеют
заметные различия (табл. 3). В формировании облика флоры водных экосистем лидируют
виды рода Anabaena, типичные для планктонных
сообществ, а также высока доля видов родов, характерных для перифитона и
бентоса лентических систем (Phormidium,
Oscillatoria, частично Nostoc) и реофильных водоемов (Calothrix, ряд видов
Nostoc).
В структурной организации почвенной
альгофлоры заметное участие принимают таксоны, встречающиеся преимущественно в
наземных сообществах (Phormidium,
Leptolyngbya, Schizothrix), а также в
водных и наземных экосистемах (Nostoc,
Oscillatoria, Stigonema).
Таблица 3
Родовая структура (число видов с внутривидовыми
формами) Cyanoprokaryota
во флоре
восточноевропейских тундр
|
Место
|
Род
|
Общее число видов (таксонов)
|
Водоемы
|
Почвы
|
|
Число видов (таксонов)
|
Место
|
Число видов (таксонов)
|
Место
|
|
1
|
Phormidium
|
43
|
31
|
2
|
28 (29)
|
1
|
|
2
|
Anabaena
|
32 (49)
|
31 (48)
|
1
|
5
|
7-10
|
|
3
|
Oscillatoria
|
26 (34)
|
21 (29)
|
3
|
8 (9)
|
4
|
|
4
|
Nostoc
|
15 (20)
|
11 (14)
|
5
|
9 (11)
|
3
|
|
5
|
Calothrix
|
15 (18)
|
15 (18)
|
4
|
6
|
6
|
|
6
|
Leptolyngbya
|
14
|
10
|
6
|
12
|
2
|
|
7-8
|
Aphanocapsa
|
11
|
9
|
7-8
|
4
|
11-12
|
|
7-8
|
Lyngbya
|
11
|
9
|
7-8
|
3
|
13-19
|
|
9
|
Aphanothece
|
9
|
8
|
9
|
4
|
11-12
|
|
10
|
Chroococcus
|
8
|
7
|
10
|
7
|
5
|
|
11
|
Rhabdogloea
|
7
|
5
|
12-15
|
2
|
20-28
|
|
12-14
|
Schizothrix
|
6
|
2
|
29-42
|
5
|
7-10
|
|
12-14
|
Rivularia
|
6
|
6
|
11
|
1
|
29-44
|
|
12-14
|
Jaaginema
|
6
|
4
|
18-19
|
1
|
29-44
|
|
15-69
|
Прочие
|
124
|
99
|
-
|
58
|
-
|
|
|
Всего: 69
|
334 (371)
|
268 (304)
|
63
|
158 (154)
|
44
|
Родовая структура цианопрокариот
восточноевропейских тундр сходна с таковой для других арктических регионов,
например, в альгофлоре Якутии к числу ведущих относятся роды Phormidium (40), Oscillatoria (31), Anabaena (25), Nostoc (20) и Calothrix (17 видов) (Флора тундровой
зоны…, 1991). Для Мурманской области наблюдается еще большее сходство, ведущими
здесь являются роды Nostoc (11), Anabaena (10) и Phormidium (10)
(Давыдов, 2006). Особенностями родовой структуры цианопрокариот
восточноевропейских тундр, по-сравнению с выше приведенными, являются: 1) более
высокое разнообразие на родовом уровне; 2) лидирующая роль в родовом спектре Phormidium и
Anabaena, многие
виды которых являются характерными доминантами холодных тундровых вод и почв;
3) присутствие во флоре видов из родов Gloeobacter, Fischerella, Plectonema,
обитающих на криогенных пятнах, которые являются постоянным компонентом
растительных сообществ восточноевропейских тундр, и достаточно хорошо изучены;
4) появление в родовом спектре родов Chlorogloea, Gomphosphaeria
и Tychonema, видимо, связано с более детальным изучением
солоноватоводных водоемов в нашем регионе.
Для количественной оценки
флористического сходства видового состава флор восточноевропейских тундр и
Мурманской области и был рассчитан коэффициент Стугрена-Родулеску (К). Он оказался
равен – 0.32, что говорит о значительном своеобразии флоры этих регионов.
Аналогичные данные были получены ранее и при сравнении флор Мурманской области,
Большеземельской тундры и о. Шпицберген (Давыдов, 2006).
В целом, флора Cyanoprokaryota восточноевропейских тундр по таксономической
структуре во многом близка флорам других субарктических и арктических регионов.
Отличия объясняются разной степенью изученности, характерными особенностями
климата, физико-географического положения и гидрографии регионов исследования.
Работа выполнена при поддержке гранта РФФИ
№07-04-00443-а.
Список литературы
Алексахина Т.И., Штина Э.А. Почвенные водоросли лесных биогеоценозов.
М.,1984. 149 с.
Базова Г.А. Почвенные водоросли высокогорий Памира.
Душанбе, 1978. 171 с.
Гецен М.В. Водоросли в экосистемах Крайнего Севера (на
примере Большеземельской тундры). Л.,
1985. 165 с.
Гецен М..В., Стенина
А.С., Патова Е.Н. Альгофлора Большеземельской тундры в условиях антропогенного
воздействия. Екатеринбург, 1994. 148 с.
Гецен М.В., Стенина А.С., Патова Е.Н. Изучение
водорослей Большеземельской тундры: традиции и современные тенденции //
Возобновимые ресурсы водоемов Большеземельской тундры. Сыктывкар, 2002. С.
15-24.
Давыдов Д.А.
Цианопрокариоты и их роль в процессе азотфиксации в наземных экосистемах мурманской
области.): Автореф. дис... канд. биол. наук. Сыктывкар, 2006. 24 с.
Комулайнен С.Ф. Экология фитоперифитона малых рек
Восточной Скандинавии. Петрозаводск, 2004. 182 с.
Кузяхметов Г.Г. Водоросли зональных почв степи и
лесостепи. Уфа, 2006. 286 с.
Новичкова – Иванова
Л.Н. Почвенные водоросли фитоценозов Сахаро-Гобийской пустынной области. Л.,
1980. 256 с.
Патова Е.Н.,
Белякова Р.Н. Наземные Cyanoprokaryota
острова Большевик (Архипелаг Северная Земля) // Нов. систем. низш. раст.,
2006. Т. 40. С. 83 – 91.
Перминова Г.Н.
Почвенные водоросли некоторых районов севера Евразии и Дальнего Востока. Киров,
1990. Деп. в ВИНИТИ. N 4471-В90. 41 с.
Приходькова Л.П. Синзеленые водоросли почв степной
зоны Украины. Киев, 1992. 216 с.
Сдобникова Н.В.
Почвенные водоросли в южных тундрах Таймыра // Южные тундры Таймыра. Л., 1986. С.
68-79.
Флора и растительность побережья залива Грен-Фьорд
(архипелаг Шпицберген). Королева Н.Е., Константинова Н.А., Белкина О.А.,
Давыдов Д.А. и др. Апатиты, 2008. 132 c.
Флора тундровой зоны Якутии / Егорова А.А., Васильева И.И., Степанова
Н.А., Н.Н.Фесько. Якутск: ЯНЦ СО АН СССР, 1991. 186 с.
Ярушина М.И. Водоросли // Биоресурсы
водных экосистем Полярного Урала. Екатеринбург, 2004. С. 18-56.
Skulberg O.M. Terrestrial and limnic algae and cyanobacteria // A catalogue
of Svalbard plants, fungi, algae and cyanobacteria.
Elvebakk, A., Prestrud, P. (eds.). Norsk Polarinstitutt, Skrifer 198. 1996. pp.
383 – 395.
Водоросли водоемов комплексного заказника
«Хребтовый» (Полярный Урал)
Патова Е.Н.1,
Бришкайте Р. 2, Демина И.В. 1
Algae in water bodies of the wildlife preserve
“Khrebtovyj” (Polar Ural)
Patova E.N. 1, Briskajte R. 2, Demina I.V. 1
1Институт
биологии, Коми НЦ УрО РАН,
Республика Коми,
г. Сыктывкар, 167982 ул. Коммунистическая, 28;
2 Кафедра генетики и ботаники Вильнюсского
университета, Вильнюс, Литва
e-mail: patova@ib.komisc.ru, braske666@gmail.com
На территории Республики Коми находятся 253 особо
охраняемых природных территорий (ООПТ), которые служат для сохранения редких
видов флоры, фауны и их местообитаний, а также для охраны ландшафтов и геологических
памятников. Большая часть из них расположена в таежной зоне. В тундровых
регионах Республики Коми находится всего восемь ООПТ, из них только один
является комплексным. Заказник «Хребтовый» образован Постановлением Совета
Министров Коми АССР в 1989 г.
Цель создания заказника - сохранение эталонных типичных и редких тундровых
ландшафтов гор Полярного Урала. В заказнике охране подлежат 8 типов
растительности, термокарстовые и горные озера, скальные выходы вдоль рек с
редкими группировками растительности, редкие растения, насекомые и птицы,
внесенные в Красную книгу Российской Федерации. Заказник расположен на
территории МОГО «Воркута» в 35
км к юго-востоку от п. Советский, на юго-восточном
склоне хребта Енганэпэ – одного из наиболее заметных на Полярном Урале (67o20” с.ш., 65o06” в.д.). Границы его проходят в горной части по
вершинам хребта, в равнинной части – по руслу ручья Хребтовый и рек
Нанги-Тоолькотальбе и частично Нияю. Площадь резервата – 4 тыс. га. На территории
заказника охраняются следующие водные объекты: две реки – Нияю и
Нанги-Тоольктальбе, четыре крупных горных ручья, около десяти мелких ручьев,
более 30 термокарстовых озер и одно каровое озеро.
Водоросли являются
важным компонентом водных экосистем различных природно-климатических зон, особенно
высока их роль в экстремальных условиях, в том числе в горных водотоках и
озерах, где эти автотрофные организмы играют основную роль в продуцировании
органического вещества. Всестороннее изучение этой группы фототрофов имеет
большое значение для понимания закономерностей функционирования водных
экосистем. Многие водоросли являются хорошими индикаторами, чутко реагирующими
на изменение экологических условий, что широко используется при проведении
экологической оценки состояния водоемов на ООПТ.
В июле-августе 2006
и 2008 гг. проведено изучение видового разнообразия водорослей водоемов заказника
(за исключением диатомовых).
Всего в
обследованных водоемах обнаружено 275 видов (с внутривидовыми таксонами) водорослей,
относящихся к 98 родам, 51 семейству, 22
порядкам, 8 отделам, что свидетельствует о богатстве водорослями изученных
водоемов заказника и достаточно высоком
уровне таксономического разнообразия водорослей в них. Впервые для Полярного
Урала приводится 47 вида с внутривидовыми таксонами, для Большеземельской
тундры – 25. Такое большое число новых
видов объясняется как малой изученностью альгофлоры этого региона Полярного
Урала в целом, так и включением в исследования сообществ перифитона и бентоса.
Ранее основное внимание уделялось изучению фитопланктона. Наиболее разнообразны
водоросли озер, здесь отмечено 257 видов. Видовой состав исследованных озер и водотоков
типичен для водных экосистем Полярного Урала (Биоразнообразие…, 2007).
Сопоставление таксономической структуры изученных
отделов показало, что основу выявленного флористического разнообразия (около 94
%) составляют зеленые (Chlorophyta) и
синезеленые (Cyanoprokaryota). Остальные отделы
– Dinophyta, Xanthophyta, Rhodophyta, Chrysophyta, Euglenophyta и Charophyta –
представлены одним – восьмью таксонами. Пропорции
альгофлоры (соотношение числа семейств, родов и видов) составляют 1 : 2,1 :
5,8, родовая насыщенность видами – 2.8. Пропорции близки к таковым, полученным
для Большеземельской тундры и других арктических регионов (Ермолаев и
др., 1971; Флора тундровой…., 1991; Гецен и
др., 1994), а также горных водоемов Полярного Урала (Ярушина, 2004) и Западной Сибири (Сафонова, 1997).
Сведения о разнообразии диатомовых водорослей в водоемах Полярного Урала
приведены в ряде научных публикаций (Стенина, 1993; Ярушина, 2004; Биоразнообразие…,
2007).
Среди изученных отделов ведущие позиции в составе
сообществ водорослей занимают семейства, включающие более десяти видов: Desmidiaceae (27 %; 85 видов и внутривидовых таксонов), Scenedesmaceae (9
%; 29), Nostocaceae (8 %; 25), Merismopediaceae
и Hydrodictyaceae (по 4 %; 13 видов соответственно), Rivulariaceae (4 %; 12), Chlorellaceae (4 %; 11). В общей
сложности они формируют 60% таксономического разнообразия исследованных отделов
водорослей. Это является одной из характерных черт высокоарктических альгофлор,
отмеченных ранее многими исследователями, также как и заметное лидирование по
видовому богатству семейств Desmidiaceae,
Scenedesmaceae и Nostocaceae (Ермолаев и др.,1971; Гецен, 1985; Флора тундровой….,
1991; Сафонова, 1997; Ярушина,
2004). Лидирующее положение в структуре альгофлоры занимает семейство Desmidiaceae, видовое разнообразие которого свидетельствует о
голарктических чертах флор северного полушария (Комулайнен, 2004), а также
характерно для горных районов с суровым климатом (Coesel, 1996). Кроме
того, в эколого-географическом аспекте общеизвестна приуроченность десмидиевых
северного распространения к заболоченным местообитаниям (Гецен, 1985). Видовой
состав водорослей является отражением гидрологических и физико-гидрохимических
условий исследованных водоемов заказника: заболоченные водосборы, холодные воды
с низкой минерализацией, бедный ионный состав, невысокое содержание биогенных
элементов и органических веществ. Это приводит к развитию в водоемах, наряду с
диатомовыми водорослями приспособленных к таким условиям видов - обитателей
северных широт из десмидиевых, зеленых и синезеленых водорослей.
Высокие показатели встречаемости в исследованных
водоемах имели Pediastrum boryanum (73%), Cosmarium granatum (54
%), C. botrytis и C. protractum (по 50%), с высокой частотой отмечены Snowella lacustris и Desmodesmus communis (по
48%), S. quadricauda и Cosmarium subtumidum (по 45%), Merismopedia
glauca и Hydrurus foetidus (по 43%). Эти виды представлены в доминирующих
комплексах большинства обследованных
водных объектов. Интересны находки редких видов Tolypothrix saviczii, Nostoc pruniforme,
Stigonema mamilosum, Fischerella
muscicola.
Из водорослей, занесенных в новую редакцию Красной
Книги Республики Коми (2009) отмечены: Batrachospermum moniliforme (ручьи в середине заказника, вытекающие из
болот), Nitella opaca (оз. 10), Nostoc punctiforme (оз. 14) (рис.), необходима охрана популяций этих видов. Из редких видов, занесенных в
многие региональные Красные книги можно отметить золотистую водоросль Hydrurus
foetidus (рис.), на территории
заказника и других районов Полярного Урала эта водоросль развивается в массе в
горных ручьях, угрозы исчезновения ее
популяций на данном этапе нет.
Основная часть выявленных таксонов в соответствии с
экологической приуроченностью относится к планктонно-бентосным (54%),
значительную долю составляют планктонные (23%) и бентосные формы (14%). В
планктоне чаще других представлены виды из родов Anabaena, Snowella, Aphanothece, Gomphosphaeria, Coelosphaerium, Coenocystis, Tetraedron, Cosmarium и Pediastrum. В перифитоне
основу доминирующих комплексов формируют виды из родов Nostoc, Calothrix,
Dichothrix, Ulothrix, Tetraspora, Oedogonium и др. Кроме этих видов в ручьях в перифитоне водных мхов
часто отмечали виды родов Chamaesiphon, Siphononema, Cyanophanon. В комплексе альгогруппировок бентоса чаще других представлены виды из
родов Phormidium, Lyngbya, Nostoc, Pediastrum,
Scenedesmus, Desmodesmus и Stigeoclonium.
Основу альгофлоры формируют широко распространенные
виды-космополиты (78%). 8.8 % видов – голарктические, среди них с высоким
обилием в альгоценозах встречаются Calothrix
braunii, C. сlavata, Сosmarium
subprotumidum. Десмидиевые водоросли Cosmarium caelatum, C. microsphinctum, C. speciosum, C. tatricum, Spondylosum planum
вместе с цианопрокариотами родов Gloeocapsopsis и Chroococcus формируют аркто-альпийский (5.5%) комплекс видов (Coesel, 1996). Бореальный компонент во флоре представлен
незначительным числом таксонов (7.7%), среди которых следует отметить Anabaena lemmermanii, Phormidium ingricum, Pediastrum angulosum var. angulosum, Coenocystis subcylindrica
и Cosmarium difficile.
Преобладание в водоемах тундровых регионов,




Рис. Редкие виды водорослей
в водоемах заказника: Nostoc punctiforme, Batrachospermum moniliforme, Nitella
opaca, Hydrurus foetidus (фото: Патовой Е.Н).
например,
для Большеземельской тундры, видов с
широким ареалом отмечено во многих исследованиях (Стенина, 1993; Гецен и др.,
1994).
Положение
по шкале галобности известно для 47 таксонов, подавляющее большинство из которых
относится к индифферентам (64%). Преобладание галофобных видов (25%) над
галофильными (11%) связано с низкой минерализацией вод. Из числа галофобов
высокую частоту встречаемости имели Cosmarium microspinctum, C. punctulatum, Euastrum
bidentatum, E. dubium, E. elegans. Присутствие галофилов (Aphanothece stagnina, Chroococcus minimus,
Gloeocapsopsis magma, Gloeocapsa punctata, Merismopedia
tenuissima) отмечено в эпилитоне. Индикаторных видов по отношению к рН
водной среды обнаружено мало, большинство из них относятся к индифферентам (67%). Из
ацидофилов обнаружены Aphanocapsa
grevillei, Cosmarium punctulatum и C. subtumidum, последний из которых
наиболее типичен для озерных альгоценозов.
В
водорослевых сообществах много β-мезосапробов (39%), меньше олигосапробов
(32%), из них в составе доминирующих комплексов отмечены Calothrix parietina и Tribonema minus. Наиболее часто встречаемый олигосапробный
вид Ulothrix zonata обильно
представлен в большинстве проб или входит в комплекс доминантов, что указывает
на относительную чистоту исследованных водоемов. Ксеносапробов мало, но
некоторые из них, например, Hydrurus foetidus и Tribonema vulgare
представлены в сообществах очень часто и с высоким обилием. Встречаются
также и α-мезосапробы Cosmarium
botrytis, Oscillatoria subtilissima, Stigeoclonium tenue
и один полисапробный вид - Аnabaena constricta.
Термокарстовые и ледниковые озера, а также ручьи и
реки заказника отражают основной спектр водных экосистем Полярного Урала, они
характеризуют специфику водных объектов в условиях отсутствия антропогенного
влияния. Проведенные
исследования показали высокое разнообразие водорослей в исследованных водоемах.
Видовой состав и таксономическая структура исследованных отделов водорослей
типична для альгофлор высокоширотных и горных регионов, не испытывающих
антропогенного воздействия. По составу
водорослей-биоиндикаторов органического
загрязнения водоемов, исследованные водоемы можно охарактеризовать как чистые и
очень чистые. Полученные показатели можно
рассматривать как фоновые при оценке степени трансформации сообществ водорослей
горных и тундровых пресноводных экосистем в условиях планируемого промышленного
освоения Полярного Урала.
Работа выполнена при поддержке гранта РФФИ
№07-04-00443-а.
Список литературы
Биоразнообразие экосистем
Полярного Урала/ Под. ред. М.В.Гецен. Сыктывкар, 2007. 252 с.
Гецен М.В. Водоросли в экосистемах Крайнего Севера (на
примере Большеземельской тундры). Л.,
1985. 165 с.
Гецен М..В., Стенина
А.С., Патова Е.Н. Альгофлора Большеземельской тундры в условиях антропогенного
воздействия. Екатеринбург, 1994. 148 с.
Ермолаев В. И., Левадная Г. Д., Сафонова Т. А. Альгофлора водоемов окрестностей
Таймырского стационара // Биогеоценозы Таймырской тундры и их продуктивность.
Л.: Наука, 1971. С. 116-129.
Комулайнен С.Ф. Экология фитоперифитона малых рек
Восточной Скандинавии. Петрозаводск,
2004. 182 с.
Красная книга Республики
Коми, Сыктывкар, 2009 (в печати).
Сафонова Т. А. Водоросли горных водотоков юга Западной Сибири.
Разнообразие и таксономическая структура // Сиб. экол. журн., 1997. № 1. С. 91–96.
Стенина А.С. Первые сведения о
пресноводной флоре диатомовых водорослей бассейна реки Кары (Полярный Урал) //
Споровые растения Крайнего Севера России.
Сыктывкар, 1993. С. 12–25. (Тр.
Коми научного центра УрО Российской АН;
№ 135).
Флора тундровой зоны Якутии / Егорова А.А., Васильева
И.И., Степанова Н.А., Н.Н.Фесько. Якутск: ЯНЦ СО АН СССР, 1991. 186 с.
Ярушина М.И. Водоросли // Биоресурсы
водных экосистем Полярного Урала. Екатеринбург,
2004. С. 18-56.
Coesel P.F.M. Biogeography of desmids // Hydrobiol. 1996. Vol. 336. P. 41-53.
РАЗНООБРАЗИЕ, ЭКОЛОГИЯ И ГЕОГРАФИЯ ДИАТОМОВЫХ ВОДОРОСЛЕЙ ОЗЕР
ЯКУТИИ
Пестрякова Л.А.
Diversity, ecology and geography of diatoms from Yakutia lakes
Pestryakova L.A.
ВПО ГОУ Якутский государственный университет им. М.К. Амосова
677000,
г. Якутск, ул. Белинского, 58. Тел./факс
(4112) 360934
e-mail: lapest@mail.ru
Объект исследования – диатомовые комплексы донных
осадков 199 озер, расположенных в трех климатических зонах Якутии. Основной
объем фактического материала собран автором при проведении полевых экспедиционных
работ в период (июль) 2000-2006 гг. лабораторией водных экосистем ИПЭС АН РС
(Я) и российско-германского сотрудничества между Якутским государственным
университетом им. М.К. Аммосова и Институтом полярных и морских исследований
им. Альфреда Вегенера (ФРГ, Потсдам). По собранным в полевых условиях пробам
верхних слоев донных осадков 199 озер были приготовлены образцы (более 1000) и
выполнен диатомовый анализ. Результаты анализа наряду с 34 лимнологическими и
физико-химическими параметрами каждого конкретного озера легли в основу количественной биотической и
абиотической составляющих калибровочного банка данных. При этом изученные
объекты были объединены на группы по существующим растительным зонам (Атлас…,
1989). Девять озер расположены в зоне арктической тундры (группа A), шесть - в
зоне бореальных притундровых редкостойных лиственничных лесов (группа B1), 25
озер представляли зону бореальных северотаежных редкостойных лиственничных
лесов (группа B2), но большинство озер (113) было расположено в зоне бореальных
среднетаежных лесов (группа В3). Кроме того, 16 озер были окружены гористыми
лесами (группа B4), и 30 озер были расположены в речных долинах (группа R).
Изученные озера территориально были приурочены: 37 % - к бассейнам 27 рек разного порядка; 52 % - к территориям
50 сельских населенных пунктов (сел) и одного поселка городского типа; остальные 11 % - к городским ландшафтам
(Якутска, Ленска, Вилюйска, Верхоянска, Среднеколымска, Удачного).
В пробах 199 озер («всего набора озер»)
зарегистрировано 496 видов и разновидностей диатомей, относящихся к 55 родам,
18 семействам, 5 порядкам и 2 классам отдела Bacillariophyta.
Экологический спектр диатомовых флор изученных 199
озер Якутии показывает, что среди диатомей преобладают бентосные формы: донные
виды – 48 %, обрастатели – 42 %. Планктонный комплекс развит слабо (10 %).
Сравнительный анализ численности створок диатомовых комплексов опробованных
озер, находящихся в разных экосистемах показал относительно стабильную
структуру при абсолютном доминировании
обрастателей. Последние указывают на наличие многочисленных мелководий с
развитыми зарослями макрофитов у большинства обследованных озер. Этот факт
также подтверждается превалированием
донных форм (25-27 %) над планктонными в озерах более высоких
географических широт (А, В1 и В2) и указывает на относительно высокую
прозрачность их вод (до 1 м). В частности, в этих группах средняя глубина
озер составляет 3,33 м,
а прозрачность до 1 м.
В среднетаежных водоемах (В3) и в
озерах речных долин (R) наоборот, по
численности преобладали планктонные. Среди них наиболее обильны – Stephanodiscus hantzschii
(4,5 %), Cyclotella meneghiniana (2,7 %), Aulacoseira granulate
(2,3 %), Fragilaria capucina
(1,9 %), Tabellaria fenestrata
(1,6 %) и др.
В озерах горных лесов отмечено почти равная доля
донных и планктонных форм.
По отношению к солености имеются сведения для 405 видов (82 %) от
общего числа, из которых подавляющая часть – индифференты (73,1 %).
Представители остальных категорий галобности малочисленны. Галофобы - виды,
предпочитающие ультрапресную воду (до
0,02 ‰) во флоре изученных озер занимают всего 8 %. Столько же составляют
галофилы, живущие обычно в воде в пресных водах, но наибольшего развития,
достигающие при солености 0,4-0,5 ‰. Среди пресноводной флоры были
зафиксированы солоноватоводные виды - мезогалобы (26 видов или 5,4 %). Также интересным фактом является наличие во
флоре трех видов - олигогалобов (Amphora
robusta, Diploneis elliptica, D. schmidtii), обитающих в соленых
морских водах. В частности виды диатомей, предпочитающие морские соленые воды
больше оказались в в бассейне р. Анабар. Они, в основном, представлены родом Diploneis (D. elliptica,D. schmidtii, D. smithii).
Также были зафиксированы Achnanthes delicatula, Navicula peregrine, Nitzschia distans, Caloneis ladogensis, C. silicula var. kjellmaniana.
Следует отметить, что в реке Анабар из-за отсутствия дельты при низкой межени
приливная волна распространяется вверх до 190 км (Глушков, 1996),
вероятно это указывает на генетическую связь озер, находящихся на низком
гипсометрическом уровне с морем.
В диатомовых спектрах озер бассейна реки Муна – левого
притока Лены (В2) многочисленны виды солоноватоводных биотопов (до 16,4 % от
500 ств.), особенно за счет Mastagloia smithii –
редкого вида, впервые встреченного в диатомовом комплексе современных якутских
озер. В наших исследованиях он в «массе» встречался только в донных отложениях
озера Улахан Чабыда, сформированных в атлантическое время (Пестрякова, 1994).
В доминирующий комплекс из солоноватоводных видов в
озерах среднетаежных лесов (В3) зафиксирован только Anomoeoneis sphaerophora var. polygramma.
Кроме того, были встречены: планктонный вид – Melosira moniliformus; обрастатели
- Achnanthes taeniata, Fragilaria tabulata; донные
- Amphora delicatissima, A.coffieformis, Caloneis silicula
var. kjellmaniana, Nitzschia acuminata, N. commutata, Navicula crucicula, N. peregrina. Из
эугалобов - Amphora robusta и Diploneis elliptica.
В целом высокая численность в диатомовых спектрах
участие мезогалобов и галофилов, отвечающих на засоление воды в озерах
Центральной Якутии объясняется своеобразием природно-климатических условий
района, которые выражаются, прежде всего, исключительно высокими для этих широт
температурами воздуха в летнее время. По годовому количеству осадков (250-300 мм) район исследования
приближается к степным и полупустынным районам (Гаврилова, 1973). При наступлении
сухого жаркого лета усиливается испарение воды и, как следствие, происходит
возрастание роли диатомей мезогалобов в мелководных водоемах (Пестрякова,
2008).
Сведения по отношению к рН воды имеются для 329 (66 %)
видов. Почти половина из них являются алкалифилами (45 %). Меньшинство видов
относятся к нейтрофилам (24 %) и ацидофилам (20 %). Доля алкалибионтов - видов,
предпочитающих воду только выше 7 – до 10 %, также малохарактерны ацидобионты (до 1 %).
По отношению к группам галобности, при абсолютном
доминировании индифферентов во всех озерных группах, доля галофобов выше в
северных и горных водоемах (А, В1, В2 и В4), тогда как в озерах Центральной
Якутии (В3) и речных долин (R) преобладают
галофилы за счет Cyclotella meneghiniana, Fragilaria
construens f. subsalina, Anomoeoneis sphaerophora, Cocconeis
pediculus, Sellaphora pupula и другие.
По отношению к температурным условиям во
флоре изученного региона доминирует
группа бореальных диатомей (до 47% от числа видов), а космополиты и северные
виды составляют почти равную долю.
Однако по численности их створок между озерными группами имеются
некоторые различия. В озерах группы А и В1 превалируют спектры из
северо-бореальных видов (63 и 65 %, соответственно), южнее (В2, В3 и R), наоборот,
значительно преобладают полизональные виды (51,64, 59 %,
соответственно). В отличие от спектра арктических озер здесь появляются бореальные-южные
виды - Achnanthes hungarica, Amphora
subcapitata и Navicula crucicula et var. obtusata.
В диатомовых комплексах горных озер, где при
незначительном преобладании северных форм зафиксирована равная доля участия
двух других категорий.
Таким образом, диатомовая флора в поверхностных
осадках озер включающая 496 видов, представляет собой флору умеренно
континентального типа, характерную для Палеарктической области в целом. По
составу и характеру экологических групп диатомовые комплексы озер определяются
как пресноводные, характерные для относительно мелководных водоемов, со
слабощелочной активной реакцией воды.
Большая часть (77,4 % от 496) видов, встреченных в
диатомовых комплексах в 199 озер, имеют низкую оценку обилия.
Список руководящих таксон диатомового комплекса
изученных 199 озер составил 112 наименований, из них четыре рода имели открытую
номенклатуру на уровне вида. Остальные 108 видов составили массовые формы диатомей,
прежде всего доминантов (более 10 % от общего количества створок в пробе) и
субдоминантов (5-10 %). Из них 45,4 % характерны только для озер среднетаежных лесов (В3), однако их
активность значительно ниже (от 1 до 49 озер).
Из общего количества массовых видов самыми активными и
постоянными оказались всего 13 видов: Achnanthes laevis (в
50,3 % озер от 199), A. minutissima
(50,8 %), Aulacoseira granulata (51,3
%), Eunotia praerupta (53,8 %), E.
monodon (54,3 %), E. veneris
(51,8 %), F. brevistriata (52,8 %), F. ulna (53,3 %), F. pinnata (56,3 %), F. construens
et f.venter (55,3
%), Stauroneis anceps et f.gracilis (52,3
%), Tabellaria fenestrata
(54,8 %) и T. flocculosa (55,8 %). Все
перечисленные постоянные виды были зафиксированы «в массе» во всех шести
группах озер, кроме Achnanthes laevis и A. minutissima. Эти виды не были
«массовыми» в озерах лесотундры (В1). Большинство перечисленных видов по экологической
структуре относились к обрастателям.
Только по одному виду (Stauroneis anceps et f. gracilis, Aulacoseira granulata) – представлены
были донные и планктонные формы.
По частоте встречаемости из 496 видов, встреченных в
199 озерах всего 2,4 % таксон являются ведущими в диатомовых комплексах.
Абсолютное доминирование по встречаемости и по количеству створок принадлежит Fragilaria construens et f. venter Hust.-
космополит, типичный массовый вид в водоемах Центральной Якутии, особенно его
форма venter (Пестрякова, 2008). Второй таксон Stephanodiscus hantzschii Grun.
характерный вид относительно глубоких озер, развивающийся в массе высокоэвтрофных водах, по структурным характеристикам
значительно уступает F. construens et f. venter Hust.,
занимая всего 7%. Третий вид – F. pinnata
Ehr. по сравнению с F. construens
чаще встречается относительно холодноводных в водоемах региона.
Список литературы
Атлас сельского хозяйства Якутской АССР. М.: ГУГК,
1989.115 с.
Гаврилова М.К.
Климат Центральной Якутии. Якутск, 1973. 120 с.
Пестрякова Л.А. Эволюция озерных экосистем Центральной
Якутии (по материалам диатомового анализа донных отложений): Автореф. дис. ...
канд. биол.наук. Якутск: Изд-во ЯГУ, 1994. С.23.
Пестрякова Л.А. Диатомовые комплексы озер Якутии. Якутск: изд-во ЯГУ. 2008. С.177.
Почвенные
водоросли Якутии
Пшенникова Е.В.
Soil algae of Yakutia
Pshennikova E.V.
Якутский
государственный университет, Республика Саха (Якутия), Якутск
Первое упоминание о почвенных водорослях Якутии
принадлежит Т.А. Работнову (1934), описавшему наземную водоросль Nostoc commune в напочвенном покрове солонцеватых почв Якутии. Далее
сведения о почвенных водорослях появились лишь в 1959 г. в статье Е.В.
Дорогостайской, где она приводит результаты обработки материалов окрестностей
пос. Тикси. Ею обнаружено 58 видов почвенных водорослей из трех отделов: Cyanophyta, Chlorophyta, Xanthophyta. Особое внимание уделяется пятнистым тундрам. Автор
отмечает, что альгофлору данного местообитания в целом нельзя назвать
оригинальной и наибольшего распространения и обилия здесь достигают обычные
почвенные водоросли стран умеренного климата (Botrydiopsis arhiza, Chlorococcum humicola, Chlorella vulgaris и др.).
Почти полностью отсутствуют нитчатые формы синезеленых и зеленых водорослей
(встречен только Phormidium boryanum).
Автор сравнивает альгофлору окрестности пос. Тикси с альгогруппировками Чукотки
и о. Б. Ляховский (Новосибирские острова).
Почвенные водоросли степей Северо-Восточной Якутии
изучались в 70-е годы Ж.Ф. Пивоваровой. Результатами этих исследований являются
несколько статей (Пивоварова, 1976, 1986, 1988; Пивоварова и др., 1975, 1977;
Берман и др., 1978). В них описана флора микроводорослей почв горных островных
степей и степных участков в долинах рек Лены, Яны, Индигирки. Всего в степях Якутии обнаружено 242 вида водорослей, объединенных
в 79 родов. Более половины флоры (54%) составляют синезеленые. Обследованы
ризосферные группировки водорослей ряда видов растений.
С 80-х годов стали планомерно изучаться почвенные
водоросли аласов Якутии (Дубовик, 1988; Васильева И.И. и др., 1996; Пшенникова,
1988, 1992, 1993,1994, 1995; Саввинов и др., 2000). Аласы представляют
интересный объект для исследований, т.к. они являются термокарстовыми, геохимически
замкнутыми котловинными формами рельефа со специфичными условиями почвообразования
и формирования растительности. По мере высыхания озера, в связи с различными
условиями увлажнения и засоления выделены несколько концентрических поясов
занятых болотной, луговой и степной растительностью. Таким образом, почвенно-растительные
пояса образуют катену, в которой последовательно сменяются не только почвы и
растительность, но и соответствующие им альгосинузии. Благодаря этому аластые экосистемы отличаются
богатством почвенной альгофлоры. В почвах аласов обнаружено 178 видов водорослей
из 84 родов, 44 семейств, 20 порядков и 7 отделов. На уровне отделов
преобладали представители Cyanophyta, Chlorophyta, Xanthophyta и Bacillariophyta, в основном, из семейств Oscillariaceae, Chlamydomonadaceae, Anabaenaceae. Отмечено значительное разнообразие желтозеленых
(влияние таежных почв) и диатомовых (влияние гидрофильного пояса) водорослей.
Экологические спектры альгосинузий характеризуются преобладанием P-, Ch- и C- жизненных форм. Особенностью аласных почв является
резко выраженная сезонная динамика не только численности и биомассы, но и
состава водорослей: пик видового разнообразия приходится на период наиболее
высокой температуры поверхности почвы на конец июля – начало августа, максимум
численности может продолжаться до сентября. Характерной особенностью для почв
аласов является довольно низкая среднелетняя численность (от 42,4 до 123,0 тыс.
кл/г) и биомасса (от 0,03 до 0,18 мг/г) водорослей – для ксерофильного пояса
(остепненных лугов) и высокая – соответственно от 535,6 до 538,9 тыс. кл/г и
3,34 мг/г – для гидрофильного пояса. Новыми для почв Якутии являются 68 видов
водорослей, а представитель зеленых – Rhizothallus islaandicus Dangeard (Bourelly, 1966), обнаружен впервые не только для почв Якутии,
но и для России и стран ближнего зарубежья.
В конце 90-х годов изучались почвенные водоросли
тундровых почв естественных и нарушенных фитоценозов низовья реки Яны
(Пшенникова, 1995; Карпов и др., 1996). В целом в почвах субарктической тундры
было выявлено 84 вида водорослей из 4 отделов, которые распределились следующим
образом: Cyanophyta – 32, Chlorophyta – 25, Xanthophyta –
18, Bacillariophyta – 9 видов. Преобладали представители родов Nostoc, Oscillatoria,
Chlamydimonas. Желтозеленые представлены преимущественно одноклеточными формами. Из
диатомовых в тундровых почвах распространены Pinnularia borealis и Hantzschia amphioxys.
Обнаружено 19 видов водорослей новых для альгофлоры Якутии. В целом, почвенная
альгофлора тундр является мало оригинальной, где преобладали виды, широко распространенные
и в других районах Евразии.
С 2001 года начались исследования почвенных водорослей
таежной зоны Центральной и Южной Якутии.
На коренном берегу р. Лена в лиственничном лесу на
дерново-палевых почвах в районе национального парка «Ленские столбы», береговых
участков р. Лены и ее мелких притоков и ручьев. Всего было обнаружено 49 видов
(60 видов и разновидностей) водорослей из 4 отделов: Bacillariophyta – 28 видов (39 видов и разновидностей), Cyanophyta – 10, Chlorophyta – 8,
Xanthophyta – 3 вида.
Альгосинузии лесных почв были сравнительно
однообразны. Преобладали зеленые водоросли родов Chlorococcum, Sphaerocystis, Nautococcopsis, Tetraspora, им сопутствовали синезеленые (Oscillatoria,
Phormidium) и желтозеленые (Botrydiopsis, Chloropedia) водоросли. Численность водорослей лиственничных
лесов составила на поверхности и в составе опада 74 – 1876 тыс. кл/г. На
береговых участках преобладали диатомовые водоросли.
Хотя для лесов не совсем характерно преобладание
видового разнообразия диатомовых водорослей, наши данные подтвердили
исследования альгофлоры горных лесов Сибири (Артамонова, 1982), где, как и в
нашем случае, при значительном видовом разнообразии доминировании по численности
диатомеи (около 50% биомассы), зеленые и желтозеленые водоросли. Отмечено
довольно значительное видовое богатство синезеленых, биомасса которых не
превышала 1 г/м2. В луговых ассоциациях, благодаря устойчивой
влажности почв и преобладанию дернового процесса формируются более сложные
альгосинузии. Из синезеленых интенсивно развиваются Oscillatoria amphibia, Phormodium ambiguum, Nostoc commune, из диатомей Navicula mutica, Pinnularia borealis, Hantzschia amphioxys.
Были встречены представители водной флоры (влияние реки).
Кроме того, проводились альгологические исследования в
брусничном лиственничном лесу на мерзлотных палевых осолоделых почвах
Центральной Якутии. Протаивание мерзлоты под таким лесом варьирует от 1,0-1,6 м. Среднемесячная
температура поверхности почвы колебалась от 7,0 до 15 С. Влажность почвы
колебалась в течении лета и иссушение почвенного профиля способствовало
поднятию и формированию карбонатного горизонта. Суммарный запас влаги за сезон
составил 110-130 мм,
а влажность 19,0 - 24,1%. Для почв изученных лесных фитоценозов характерна
относительная бедность альгофлоры. Было обнаружено 35 видов водорослей. Здесь
по количеству видов доминировали, а так же по численности клеток и по биомассе
зеленые (20) и желтозеленые (7) водоросли, относящиеся к Ch-, C-, и жизненным
формам. Наиболее характерными видами были Pleurochloris magna, Botrydiopsis arhiza, Vischeria stellata, Chloropedia plana, Chlamydomonas atactogama, C. elliptica, C. speciosa, Chlorococcum dissectum, C. hypnosporum, Macrochoris dissecta, Chlorhormidium flaccidum и
др. Средневегетационная численность и биомасса водорослей составила соответственно
48,5 тыс. кл/г и 1,1 мг/г. Анализ экологических групп и жизненных форм водорослей
показал, что эдафофильные водоросли составляют 80%, гидрофильные и амфибиальные
– 20%. Экологическая структура эдафофильных водорослей выражалась формулой Ch9C6Х6H4P2B1 hydr7. Таким образом, в брусничном лиственничном лесу
сформировалась альгосинузия, характерная для лесных фитоценозов.
В других районах Центральной Якутии, менее отдаленных
от речной системы, в таежной зоне, представленной лиственничным лесом на
мерзлотных слабосолоделых почвах с содержанием гумуса 21.1% было обнаружен 51
вид почвенных водорослей, среднелетняя численность которых составила 37,1 тыс.
кл/г, биомасса – 0,29 мг/г. Альгологический фон, в равной степени составляли
зеленые и синезеленые водоросли, принадлежащие к P-, C-, Ch- жизненным формам на протяжении всего лета в пробах
присутствовали Oscillatoria brevis, Phormidium autumnale, P. ambiguum, P. corium, Pinnularia borealis, а
также виды рода Chlamydomonas. А виды Gloeocapsa turgida, Nostoc linckia, Anabaena oscillarioides,
Chlorella terricola, Stichococcus bacillaris, Coccomyxa solorinae Gongrosira terricola
являются специфичными. В сравнении с альгосинузиями более отдаленных от речной
системы районах альгосинузии содержали больше синезеленых, в том числе азотфиксирующих
видов. Среднегодовая биомасса водорослей была ниже. Коэффициент флористического
сходства – 17%. Однако экологические спектры их сходны, доминирует Ch-форма (Ch12X8Cf8C7B2H2M1N1hydr3).
Список литературы
Алексахина Т.И., Штина Э.А. Почвенные водоросли лесных
биогеоценозов. – М.: Наука, 1984. – 149 с.
Дорогостайская Е.В. К вопросу о почвенной альгофлоре
пятнистых тундр Крайнего Севера // Бот. журн. 1959. Т. 44. №3. С. 312-321.
Дубовик И.Е. О некоторых закономерностях распределения
почвенной альгофлоры в аласах Центральной Якутии // Биологические науки. 1988.
№2. С. 52-55.
Пивоварова Ж.Ф. Особенности флористического состава и
фитоценотической организации водорослевых группировок горных степей
Северо-Восточной Азии // Бот. журн. 1986. Т. 71. №4. С. 521-527.
Пшенникова Е.Е. Почвенные водоросли аласов
Лено-Амгинского междуречья (Якутия, Россия)
// Альгология. Т. 5. №3. 1995. С. 269-275.
Пшенникова Е.В. Изучение почвенных водорослей в Якутии
// Мат. междунар. науч. Саха-Финляндской конф., посвящ. 100-летию экспедиции
А.К. Каяндера по реке Лене «Проблемы ботаническиз и лесоводственных исследований
в республике Саха (Якутия) и Финляндии», Якутск: ЯФ СО РАН, 2003. – С. 41-44.
Работнов Т.А. Nostoc commune
L. в напочвенном
покрове солонцеватых почв Якутии // Сов. ботаника. 1934. №2. С. 107-108.
КОЛЛЕКЦИЯ ХАРОФИТОВ (CHAROPHYTA) В ЛАБОРАТОРИИ ГИДРОМОРФНЫХ ЭКОСИСТЕМ
СУРГУТСКОГО ГОСУДАРСТВЕННОГО УНИВЕРСИТЕТА
свириденко Т.В., Свириденко Б.Ф.
A collection of charophytes (Charophyta) in the laboratory of
hydromorphic ecosystems of Surgut
State University
Sviridenko T.V., Sviridenko B.F.
НИИ природопользования и экологии Севера, Сургутский государственный
университет
Тюменская обл., ХМАО-Югра, г. Сургут, ул. Энергетиков, 14, т.
(3462)763098
Лаборатория гидроморфных экосистем
е-mail: tatyanasv29@yandex.ru
В лаборатории гидроморфных экосистем
Научно-исследовательского института природопользования и экологии Севера
(НИИПиЭС) Сургутского государственного университета (СурГУ) хранятся гербарные
образцы харовых водорослей, собранных
в 1982 – 2008 гг. Большинство образцов получено в пределах южной части
Западно-Сибирской равнины от степной зоны до средней тайги на территории России
(Омская, Тюменская, Новосибирская области), в степной и лесостепной зонах
Республики Казахстан (Павлодарская, Северо-Казахстанская и Кустанайская
области). Довольно многочисленны образцы, полученные из водных объектов на
территории Казахского мелкосопочника и Тургайского плато (Республика Казахстан).
Коллекция включает также немногочисленные образцы из водоёмов Тувы, Хакасии,
Монголии (Монгольский Алтай), Норвегии.
Сбор образцов выполнялся системно при
гидроботанических исследованиях разнообразных водных объектов: озёр, рек,
водохранилищ, каналов, прудов, котлованов, временных водоёмов. Основными
коллекторами являются авторы — Б.Ф. Свириденко и Т.В.
Свириденко. Отдельные образцы собраны Ю.В. Науменко, А.И. Пяком, А.В. Убаськиным,
О.Е. Токарь, К.С. Евженко, Г.С. Тараном, Р.Г. Зариповым, Г.В. Самойловой,
О.В. Вурдовой, А. Лангангеном.
Таксономическая обработка
образцов проведена авторами по определителям [1-4]. Точность определения отдельных
образцов была подтверждена В. Краузе (Германия) и А. Лангангеном (Норвегия). Коллекция насчитывает 1337 образцов 24 видов харовых
водорослей, относящихся к 5 родам, в том числе род Chara представлен 17 видами, род Lamprothamnium
— 1 видом, род Nitella — 4 видами, род Nitellopsis — 1 видом, род Tolypella — 1 видом. Количественное
распределение образцов харовых водорослей по регионам представлено в таблице.
Таблица
Распределение образцов харовых водорослей
по регионам
|
Виды
|
Россия
|
Казахстан
|
Монголия
|
Норвегия
|
Всего
|
|
Тюм.
|
Ом.
|
Нов.
|
Хак.
|
Тува
|
Куст.
|
Кокч.
|
Сев.-Каз.
|
Павл.
|
|
Chara altaica
|
-
|
-
|
-
|
2
|
4
|
5
|
38
|
34
|
-
|
2
|
-
|
85
|
|
C. aspera
|
-
|
-
|
8
|
-
|
1
|
-
|
33
|
23
|
33
|
3
|
-
|
101
|
|
C. baueri
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
10
|
-
|
-
|
-
|
10
|
|
C. braunii
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
15
|
-
|
-
|
15
|
|
C. canescens
|
-
|
-
|
7
|
-
|
-
|
27
|
69
|
29
|
23
|
-
|
-
|
155
|
|
C. connivens
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
11
|
-
|
-
|
11
|
|
C. contraria
|
-
|
23
|
-
|
-
|
-
|
-
|
42
|
18
|
53
|
1
|
2
|
139
|
|
C. locuples
|
-
|
-
|
-
|
-
|
-
|
-
|
20
|
-
|
-
|
-
|
-
|
20
|
|
C. fragifera
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
1
|
-
|
1
|
|
C. fragilis
|
5
|
39
|
-
|
-
|
-
|
-
|
41
|
109
|
-
|
-
|
-
|
194
|
|
C. kirghisorum
|
-
|
-
|
-
|
-
|
-
|
-
|
28
|
-
|
-
|
-
|
-
|
28
|
|
C. neglecta
|
-
|
-
|
-
|
-
|
-
|
4
|
32
|
1
|
-
|
-
|
-
|
37
|
|
C. schaffneri
|
-
|
4
|
-
|
-
|
-
|
5
|
12
|
8
|
-
|
-
|
-
|
29
|
|
C. strigosa
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
3
|
3
|
|
C. tenuispina
|
-
|
-
|
-
|
-
|
-
|
-
|
6
|
4
|
5
|
-
|
-
|
15
|
|
C. tomentosa
|
-
|
-
|
21
|
4
|
2
|
25
|
74
|
-
|
27
|
2
|
-
|
155
|
|
C. vulgaris
|
2
|
36
|
25
|
-
|
1
|
28
|
18
|
35
|
-
|
-
|
-
|
145
|
|
L. papulosum
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
22
|
-
|
-
|
-
|
22
|
|
Nitella сonfervacea
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
28
|
-
|
-
|
-
|
28
|
|
N. flexilis
|
11
|
-
|
-
|
-
|
-
|
-
|
4
|
-
|
-
|
-
|
-
|
15
|
|
N. hyalina
|
-
|
-
|
-
|
-
|
-
|
4
|
-
|
26
|
-
|
1
|
-
|
31
|
|
N. mucronata
|
-
|
10
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
10
|
|
Nitellopsis obtusa
|
-
|
-
|
-
|
-
|
-
|
15
|
-
|
-
|
-
|
-
|
-
|
15
|
|
Tolypella
prolifera
|
-
|
-
|
-
|
-
|
-
|
-
|
14
|
59
|
-
|
-
|
-
|
73
|
|
Всего
|
18
|
112
|
61
|
6
|
8
|
113
|
431
|
406
|
167
|
10
|
5
|
1337
|
Примечание. L. papulosum — Lamprothamnium papulosum. В настоящей работе сохранено
административное деление, действовавшее во время проведения исследований. Приняты следующие сокращения административных
территорий: Омская обл. — Ом., Новосибирская обл. — Нов., Тюменская обл. —
Тюм., Хакасия — Хак., Северо-Казахстанская обл. — Сев.-Каз., Кустанайская обл.
— Куст., Кокчетавская обл. — Кокч., Павлодарская обл. — Павл.
Анализ коллекции позволяет рассмотреть особенности
широтно-зонального изменения видового состава харофитов в пределах профиля,
проложенного в направлении от Казахского мелкосопочника через южную половину
Западно-Сибирской равнины на север. В широтном плане профиль охватывает полосу
от 51º с.ш. до 63º с.ш. В меридиональном плане он занимает полосу
между 60º в.д. и 83º в.д.
В целом на юге этой территории в степной зоне и горной
лесостепи образцы представляют 18 видов из 4 родов, в том числе в горных
районах Казахского мелкосопочника, на сравнительно небольшой по площади
территории, отмечено повышенное разнообразие (16 видов из 4 родов). В равнинной
западносибирской степной части отмечено только 7 видов из 2 родов. В обширной
по площади лесостепной зоне западносибирской части территории отмечено
несколько меньшее таксономическое разнообразие — 16 видов из 4 родов. В
пределах также обширной лесной зоны западносибирской части обследованной
территории найдено только 2 вида харофитов из 2 родов.
С этой территории максимальным числом образцов в
коллекции представлены такие виды, как Chara fragilis, C. tomentosa, C. canescens, C. vulgaris, C. contraria, C. aspera (от 194 до 101 таллома каждого вида из большого числа водных
объектов). В коллекции также есть редкие образцы, например, в пределах Западной
Сибири (казахстанский участок) собраны уникальные образцы очень редкого вида Chara baueri, не встречаемого в настоящее время даже в
ранее известных участках его ареала.
Представленные гербарные материалы ранее послужили
основой для научных публикаций авторов [5-22].
Однако, учитывая фрагментарный характер материалов, содержащихся в указанных работах,
считаем возможным привести более полные сведения о коллекции харофитов в СурГУ
в отдельной статье.
Список литературы
1. Голлербах М.М., Красавина Л.К. Определитель
пресноводных водорослей СССР. — Харовые водоросли — Charophyta. Вып. 14. — Л.,
1983. — 190 с.
2. Krause
W. Sůβwasserflora von Mitteleuropa. — B. 18. Charales (Charophyceae). — Jena; Stuttgart; Lubek; Ulm, 1997. — 202 S.
3. Wood R.D., Imahori K. Iconograph of the Characeae (Revision
of the Characeae). — Weinheim: Verlag
von J. Cramer, 1964. — Icon.
1-395.
4. Wood R.D.,
Imahori K. Monograph of the Characeae. — Weinheim: Verlag von J. Cramer, 1965.
— 904 p.
5. Свириденко Б.Ф., Свириденко Т.В. Харовые водоросли
(Charophyta) во флоре Северо-Казахстанской и Кустанайской областей.
— Алма-Ата, 1985. — Деп. в КазНИИНТИ 12.06. 85. № 990 Ка-85 Деп. — 22 с.
6. Свириденко Б.Ф., Свириденко Т.В. Cолевыносливость
водных макрофитов Северного Казахстана. — Алма-Ата, 1986. — Деп. в КазНИИНТИ
17.02. 86. № 1186. — 25 c.
7. Свириденко Б.Ф., Свириденко Т.В. Харовые водоросли
(Charophyta) Северного Казахстана // Бот. журн. — 1990. — Т. 75. — № 4. — C.
564-570.
8. Свириденко Б.Ф., Свириденко Т.В. Новые находки
харовых водорослей (Charophyta) в Северном Казахстане // Бот. журн. — 1995. —
Т. 80. — № 9. — С. 111-116.
9. Свириденко Б.Ф., Свириденко Т.В. Жизненные формы
харовых водорослей (Charophyta) Северного Казахстана // Вестн. Омского ун-та. —
1997. — № 2(4). — C. 32-35.
10. Свириденко Б.Ф., Свириденко Т.В. Ценотическое
значение харовых водорослей (Charophyta) в Северном Казахстане // Состояние и
перспективы развития Гербариев Сибири. — Томск: ТГУ, 1997. — С. 109-112.
11. Свириденко Б.Ф., Свириденко Т.В. Экология
гидромакрофитов Северного Казахстана // Уч. зап. биол. ф-та ОмГПУ. — Омск,
1997. — Вып. 2. — Ч. 2. — С. 82-109.
12. Свириденко Б.Ф. Флора и растительность водоёмов
Северного Казахстана. — Омск, ОмГПУ. 2000. — 196 с.
13. Свириденко Б.Ф., Свириденко Т.В. Харовые водоросли
(Charophyta) Баянаульского национального парка (Республика
Казахстан) // Естественные науки и экология. — Омск: ОмГПУ, 2004. — Вып.8. —
Кн. 1. — С. 117-120.
14. Свириденко Б.Ф., Свириденко Т.В. Редкие
растительные сообщества водоёмов Барабинской равнины (Новосибирская область) //
Природное наследие России: Мат. Междунар. науч. конф. — Тольятти, 2004. — С.
244-245.
15. Свириденко Б.Ф., Свириденко Т.В. Макроскопические
водоросли оз. Толбо-Нуур (Западная Монголия) // Природные условия, история и
культура Западной Монголии и сопредельных регионов: Мат. VII Междунар. конф. (г. Кызыл, 19-23 сент. 2005 г.) — Кызыл, 2005. — С.
283-286.
16. Свириденко Б.Ф., Свириденко Т.В. Харовые водоросли
(Charophyta) в Омской области // Проблемы изучения растительного
покрова Сибири: Мат. III Междунар.
науч. конф., посвящ. 120-летию Гербария им. П.Н. Крылова Томского гос. ун-та. —
(г. Томск, ТГУ. 16-18 ноября. 2005 г.) — Томск,2005. — С. 185-186.
17. Свириденко Б.Ф., Юрлов А.К. Гиперценотическая
организация растительности озёр Барабинской равнины (Новосибирская область) //
Естественные науки и экология. — Вып. 9. — Омск: ОмГПУ, 2005. — С. 48-57.
18. Свириденко Б.Ф., Свириденко Т.В. Флора и
растительность водоёмов долины реки Глубокий Сабун // Биологические ресурсы и
природопользование: Сб. науч. тр. — Вып. 9. — Сургут: Дефис, 2006. — С.
109-144.
19.
Свириденко Б.Ф., Свириденко Т.В. Растительный покров водоёмов долины реки
Глубокий Сабун (Ханты-Мансийский автономный округ, природный парк «Сибирские
Увалы») // Омская биологическая школа: Межвуз. сб. науч. тр. — Вып. 4. — Омск:
Ом ГПУ, 2007. — С. 24-38.
20. Langangen A., Sviridenko
B.F. Chara baueri A. Br., a charophyte
with a disjunct distribution // Cryptogamie, Algologie. — Parish, 1995. — № 16
(2). — P. 125-132.
21. Sviridenko B.F.,
Sviridenko T.V. Distribution and ecology of Charophyta in the Northern Kazakhstan
// Abstracts the III International Symposium on Extant and Fossil Charophytes (Najing, China,
October 16-19, 2000). — Najing, 2000. — P. 32.
22. Sviridenko B.F.,
Sviridenko T.V. Distribution and ecology of Charophyta in the Northern
Kazakhstan // Acta Micropalaeontologica Sinica. Science Press. Beijing. 2003. 20(2). — P. 139-146.
МАТЕРИАЛЫ К
АЛЬГОФЛОРЕ ЗАПОВЕДНИКА «КОЛОГРИВСКИЙ ЛЕС»
(КОСТРОМСКАЯ
ОБЛАСТЬ)
Смирнова С.В.
Балашова Н.Б.
Algal flora of the
«Kologrivskiy forest» reserve
(the Kostroma Region)
Smirnova S.S. Balashova N.B.
Санкт-Петербургский
государственный университет
Санкт-Петербург,
Университетская набережная 7
тел. 7(812)3285543, факс 7(812)3289703
e-mail: smirsvetvict@yandex.ru
«Кологривский лес» - самый молодой заповедник России,
он был создан в 2006 году. Заповедник располагается в северо-восточной части
Русской равнины (Кологривский, Мантуровский, Нейский, Парфеньевский и
Чухломский районы Костромской области). Большую площадь заповедника занимают
еловые леса с участием пихты. Сохранились также уникальные насаждения лиственницы
сибирской. Эта порода деревьев характерна для южной тайги, но никак не для
европейской части России. Самый большой по площади участок коренного
темнохвойного леса - бывший памятник природы «Кологривский лес», расположенный
в бассейне реке Вонюх и составляющий ядро заповедника. Остальные массивы,
меньшие по площади (обычно до 100
га), приурочены к поймам и долинам рр. Нельша, Понга,
Лондушка, Кисть, Юрманга, Сеха, Вонюх, Черная, Родля, Метенька, а также безымянных
речек и ручьев. Уникальность этого уголка природы в том, что здесь находится
реликтовый лес. По подсчетам специалистов за последние 200 лет его не касалась
рука человека и цивилизация вообще.
В формировании современного рельефа основную роль
сыграли плейстоценовые оледенения. Костромское Заволжье - равнина с достаточно
однородным геологическим строением и преимущественно пологохолмистым и волнистым
рельефом ледникового и водноледникового происхождения. Климат на территории
заповедника умеренно-континентальный, со сравнительно теплым летом и холодной
многоснежной зимой. Самая низкая температура из отмеченных -53ºС, максимальная
достигала +36°С. Все реки, дренирующие территорию региона, относятся к бассейну
внутреннего стока и являются левыми притоками р. Волги различных порядков. По
территории 1-го участка заповедника протекают только малые реки - правые
притоки р. Унжи различных порядков. Вся территория второго участка заповедника
относится к бассейну р. Кастово - левого притока р. Унжи. Основным источником
питания рек служат снеговые воды , подземный и дождевой стоки. Снеговое питание
преобладает в период половодья. Все реки и озера региона в течение 4,5-5,5
месяцев имеют устойчивый ледовый покров. Достаточно обширные площади
заповедника занимают болота и заболоченные территории, что обусловлено, в
первую очередь, плоским выровненным рельефом. Наиболее крупные болотные
комплексы приурочены к плакорам; заболочены нередко и широкие террасы больших
рек и их крупных притоков. В этих условиях обычно развиты верховые (чаще всего
древесно-сфагновые) и переходные болота. Широко распространены болота на поймах
рек, а также в днищах балок и междуречных ложбин стока, где доминируют низинные
болота.
Несмотря на то,
что альгофлора Волги и её притоков изучена довольно подробно, на территории
Костромской области были проведены немногочисленные альгологических
исследований (Ляшенко, 2001; Охапкин, 2001), а водоросли заповедника вообще до
сих пор не изучались.
Материалом для исследования послужили 40
альгологических проб, собранных в августе 2008 года в северной части
заповедника «Кологривский лес», в квартале нерубленного тёмнохвойного леса
размером 3 на 4 км.
Пробы были собраны из двух рек, берущих своё начало на территории заповедника –
р. Вонюх и р. Ухта и их притоков, а так же из верхового болота в южной части
квартала. Отбраны скопления водорослей на дне (бентос), в обрастаниях на различных
погруженных в воду предметах и высшей водной растительности, в выжимках из
сфагнума. Весь материал фиксировался 4 %-м раствором формалина. Сбор и
обработка альгологического материала проводились по общепринятым методам
исследования. Одновременно с отбором проб измерялись температуры и рН воды. Температура
воды колебалась в пределах 12-14º С, рН воды лежал в кислой области и
примерно равнялся 5.
В результате камеральной обработки материала было
выявлено 139 видов и внутривидовых таксонов, относящихся к 6 отделам:
Cyanophyta – 17 родов, 26 видов и
внутривидовых таксонов, Euglenophyta – 3
рода 13 видов и внутривидовых таксонов, Bacillariophyta – 26 родов 66 видов и
внутривидовых таксонов, Xanthophyta – 3 рода 4 вида, Chlorophyta – 10 родов 29
видов и внутривидовых таксонов, Rhodophyta – 1вид. Наибольшим видовым
разнообразием отличаются рода Closterium Nitzsh. – 15 видов и
внутривидовых таксонов, Eunotia Ehr. – 10 видов и внутривидовых
таксонов, Pinnularia Ehr. – 10 видов, Euglena Ehr. – 9 видов и внутривидовых таксонов, Oscillatoria
Vauch. – 6 видов.
По обилию преобладают представители трёх отделов:
Cyanophyta (виды родов Oscillatoria и Phormidium),
Bacillariophyta (представители родов Surirella Turp., CymatopleuraW. Sm., Eunotia
Ehr.) и Euglenophyta (виды рода Euglena Ehr.). В лужах, образовавшихся в пересохшей части речного
русла, массово развиваются Oscillatoria limosa Ag. , Oscillatoria
splendida Grev. В выжимках сфагнума из верхового болота по обилию
преобладали виды рода Eunotia (Eunotia bilunaris (Ehr.) Mills, Eunotia
minor (Kutz.) Grun., Eunotia gracialis Meist., Eunotia
muscicola Krasske var. tridentula Norpel & Lange-Bertalot).
По отношению к сапробности большая часть
представленных видов приурочена к водам, свободным от органического загрязнения
(χ-, χ-о, о-, о-β ) – 37,6%, менее разнообразны, но чаще встречаются
β-мезосапробы – 32,7%, α- мезосапробов и полисапробов немного – 6%. Возможно, такой
разброс обусловлен тем, что к моменту сбора проб воды в реках было очень мало,
некоторые части русел рек пересыхали и становились непроточными. По отношению к
галобности значительная часть видов является индифферентами – 63,4%. По
отношении к кислотности среды ацидофилы, алкалифилы и индифференты представлены
примерно в равной степени (29,9%, 32,8%, 35,8% соответственно). Значительная
часть выявленных видов по своему географическому распространению является космополитами
– 78,8%, встречаются также аркто-альпийские, бореальные и голарктические виды.
Полученные данные включены в список видов, обитающих
на территории заповедника и могут быть использованы для анализа состояния
водных объектов на его территории.
ДИАТОМОВЫЕ
ВОДОРОСЛИ РОДНИКОВ В ОКРЕСТНОСТЯХ Г. МУРМАНСКА
Смирнова С.В.
Балашова Н.Б.
DIATOMS OF SPRINGS IN MURMANSK SUBURB
Smirnova S.S. Balashova N.B.
Санкт-Петербургский государственный
университет, Санкт-Петербург
Университетская набережная 7/9, тел.
7(812)3285543, факс 7(812)3289703
e-mail: smirsvetvict@yandex.ru
Родник, источник —
естественный выход подземных вод на земную поверхность. В альгологическом
отношении родники являются одними из наименее изученных водных объектов.
Мурманская область
расположена в пределах Балтийского бассейна трещинно-жильных вод. По химическому составу подземные воды
родников гидрокарбонатные с преобладанием ионов натрия и кальция, весьма
пресные - минерализация от 0,04 до 0, 49
г/л, величина водородного показателя (рН) колеблется от 6 до 8.
В октябре 2007 года
были обследованы два родника, находящиеся в окрестностях города Мурманска.
Родник № 1 - "Фадеев ручей" расположен между 7 и 8 км окружной автотрассы
вокруг г. Мурманска, в 100
метрах от моста через Фадеев ручей, на правом берегу
ручья. Родник № 2 – у посёлка Абрам-мыс (68º59’90,4”СШ, 33º00’96,8”ВД). Родник № 1 – выход воды
на поверхность каптирован, т.е. заключён в трубу, на расстоянии 10 метров от истока течение
замедляется, воды родника образуют небольшое низовое болото. В месте вытекания родника из трубы и через 5 метров от истока воды
были собраны пробы ила и коричневого налета с камней, ниже по течению (в месте
перехода в низовое болото) взяты пробы – выжимки из палой листвы. Родник № 2 –
выход воды на поверхность каптирован, из
трубы вода попадает в образовавшуюся в результате падения струи чашу (углубление
в грунте) с песчаным дном, из которой вытекает небольшой ручей, который на
расстоянии 15 метров
от истока переходит в низовое болото. Возле истока воды и в 5 и 10 метрах от истока собран
ил и нитчатые водоросли; после перехода родника в низовое болото, была взята
выжимка из палой листвы.
В результате
камеральной обработки проб выявлено 58 видов и внутривидовых таксонов диатомей
– представителей 24 родов, относящихся к трём классам Coscinodiscophyceae (1 вид и внутривидовой таксон), Fragillariophyceae (8 видов и внутривидовых таксонов), Bacillariophyceae (49 видов и
внутривидовых таксонов): Achnanthes
–3 вида и внутривидовых таксона, Aulacosira
– 1 вид, Brachysira – 2 вида, Caloneis – 1 вид, Cocconeis – 1 вид, Cymbella
– 3 вида, Diatoma – 1 вид, Diploneis – 1, Epithemia – 1 вид, Eunotia
– 7 видов, Fragilariforma – 4 вида и
внутривидовых таксона, Fragilaria – 1
вид, Frustulia – 1 вид, Gomphonema – 6 видов и внутривидовых
таксонов, Hantzschia – 2 вида и
внутривидовых таксона, Luticola – 1
вид, Martyana – 1 вид, Meridion – 1 вид, Navicula – 3 вида, Nitzschia
– 2 вида, Pinnularia – 10 видов и внутривидовых таксонов, Rhopalodia – 1 вид, Stauroneis – 2 вида, Tabellaria
– 2 вида.
В роднике № 1 флора
диатомей представлена 42 видами и внутривидовыми таксонами, в роднике № 2 – 29
видами и внутривидовыми таксонами, общие для обоих родников 13 видов (23%). Доминирующий
комплекс в первом источнике представлен 2 видами: Diatoma mesodon (Ehr.)
Kütz., Meridion constrictum
Ralfs. Во втором источнике доминируют Achnanthes
lanceolata (Bréb.) Grun., Meridion
constrictum Ralfs, Diatoma mesodon
(Ehr.) Kütz., Navicula veneta
Kütz. Все эти виды являются типичными обитателями родниковых сообществ. В
месте перехода родника № 1 в низовое болото начинают встречаться типичные для
болотных сообществ виды родов Eunotia,
Pinnularia.
По отношению к
сапробности преобладают виды, приуроченные к водам, свободным от органического
загрязнения (χ-, χ-о, о-, о-β ). По отношению к минерализации
доминируют преимущественно индифференты (67,2%). По отношению к рН среды
встречаются главным образом индифференты (34,5%), алкалифилы и ацидофилы
представлены в равной степени, при этом ацидофилы приуроченны к заболоченным
частям источников. Анализ географического распространения водорослей показал,
что основную часть выявленной флоры диатомей составляют виды – космополиты (42
вида и внутривидовых таксона, 72%), другие группы представлены значительно
беднее: бореальные виды (6 видов и внутривидовых таксонов, 10,3%),
аркто-альпийские виды (4 вида и внутривидовых таксона, 6,9%).
РАЗНООБРАЗИЕ
ПОЧВЕННЫХ ВОДОРОСЛЕЙ АВСТРИЙСКИХ АЛЬП
Сугачкова Е.В.
SOIL ALGAE DIVERSITY OF AUSTRIAN ALPS (AUSTRIA)
Sugachkova E.V.
ГОУ ВПО
«Башкирский государственный педагогический университет им. М. Акмуллы
45000, г. Уфа,
ул.Октябрьской революции, 3а. тел. (347)273-02-90
e-mail: polson2006@yandex.ru
В основу настоящей работы положены
описания 7 смешанных почвенных образцов, отобранных на территории горнолыжного
комплекса, расположенного в Эцтальских Альпах (Зельден, Австрия) в январе 2008 г. Пробы отбирали на
различных высотах (3058 м,
3000 м,
2300 м,
2078 м,
1970 м,
1700 м,
1300 м).
Видовой состав выявляли с помощью классических почвенно-альгологических методов
– чашечных культур со «стеклами обрастания» [2]. Степень обилия оценивали по
15-балльной шкале [4,5]. Состав экобиоморф определяли по классификации Э.А. Штиной
[1,2]. Для удобства изложения материала, ускорения процедур сопоставления и
сравнительного анализа водорослевых сообществ использовали формулу качественного
состава альгогруппировок, предложенную Р.Р. Кабировым [3].
Всего было обнаружено 57 видов
водорослей, принадлежащих к четырем отделам. Общая формула качественного
состава альгогруппировок исследованного местообитания следующая: Cyan318
Chl1033Xan3Bac13 с общей
суммой баллов обилия 361 (верхний индекс показывает число видов в отделе,
нижний – число порядков в отделе). В состав доминирующего комплекса входили Phormidium
foveolarum (Mont.) Gom., Phormidium papyraceum (Ag.)
Gom., Phormidium tenue (Menegh.) Gom., Bracteacoccus minor (Chodat.) Petrova, Coccomyxa confluens (Kütz.) Fott, Dictyococcus varians Gern., Stichococcus bacillaris Näg., Stichococcus exiguus. В
комплекс наиболее активных видов, на основании значений коэффициента ЭЦЗ, вошли
Stichococcus bacillaris Näg. (0,57) и Bracteacoccus minor (Chodat.) Petrova (0,43). Эколого-ценотическая значимость
других доминирующих видов колебалась в пределах 0,14-0,28. Наиболее высокая
встречаемость отмечена у Stichococcus bacillaris Näg. (57,14%) и Bracteacoccus minor (Chodat.) Petrova (42,85%).
Р. Терк
и Г. Гартнер, изучая водоросли Альп, также отмечали, что среди зеленых
водорослей наиболее часто встречались разрастания Bracteacoccus minor (Chodat.) Petrova, Chlorella vulgaris Beijer., Elliptochloris subsphaerica (Reisigl) Ettl et Gärtner и Stichococcus bacillaris Näg.; среди желтозеленых преобладали
представители родов Chloridella и Xanthonema [6]. Г.Рейзигл
указывал, что среди синезеленых типичными для альпийских почв являлись представители
родов Nostoc, Phormidium, Symploca, а среди диатомовых – Pinnularia borealis Ehr. и Hantzschia amphioxys (Ehr.) Grun. [7].
По
числу видов и сумме баллов обилия в альгогруппировке преобладали представители
отделов Chlorophyta (58%
и 56% соответственно) и Cyanophyta (32% и 41% соответственно).
Представители других отделов – Xanthophyta
и Bacillariophyta
– встречались единично. Из диатомовых обнаружено 3 вида – Hantzschia
amphioxys (Ehr.) Grun., Navicula mutica Kütz., Pinnularia
borealis Ehr., причем живые клетки найдены только у Navicula mutica.
Из желтозеленых - Isthmochloron lobulatum (Näg.) Skuja и Chlorogibba
pentagonia Pasch.
Основу
экологической структуры составляли представители Р, Х и Ch-форм, доля которых в альгогруппировках составила 21%,
19% и 18% соответственно. Кроме того, было встречено довольно много
гидрофильных видов - 11% от общего числа видов: Katagnymene accurata
Geitl., Phormidium papillaterminatum Kissel, Mesotaenium sp., Cosmarium obliguum
Nordst., Cosmarium decendens (Reinsch) Racib., Cosmarium sp.
Альгогруппировки,
сформировавшиеся на разной высоте над уровнем моря очень сильно отличались друг
от друга. Наибольшим видовым разнообразием характеризовались альгогруппировки,
обнаруженные на высотах 1970м (20 видов), 2078м (21 вид) и 2300м (18 видов).
Для этих участков свойственна высокая гетерогенность экологических факторов
среды, что и определило как высокое видовое разнообразие, так и высокую сумму
баллов обилия (136, 113 и 76 баллов соответственно).
Наиболее
низкое число видов было выявлено на площадках, расположенных на высотах 1300 м, 1700 м и 3058 м. и составляло 3, 2 и
3 вида соответственно. Сумма баллов обилия этих участков также была
незначительна (45, 3, 13 баллов соответственно). Снижение видового разнообразия
на высотах 1300 м,
1700 м,
возможно, связано с тем, что в городе развито животноводческое хозяйство,
которое способствует накоплению большого количества органических элементов в
почве и препятствует росту почвенных водорослей. А уменьшение числа видов на
высоте 3058 м
обусловлено экстремальными условиями местообитания (резкие и значительные
перепады температур, выдувание снежного покрова, высокая инсоляция и т.д.).
Список
литературы
1. Алексахина Т.И., Штина Э.А. Почвенные водоросли лесных
биогеоценозов. М.: Наука, 1984.- 150 с.
2. Голлербах М.М., Штина Э.А. Почвенные
водоросли. Л.: Наука, 1969. 228с.
3. Кабиров Р.Р. Формализованное описание
сообществ почвенных водорослей // Альгология. –1997. – Т.7. №4. – С. 365 – 370.
4. Кабиров Р.Р., Шилова И.И. Почвенные
водоросли свалок и полигонов твердых
бытовых и промышленных отходов в условиях крупного
промышленного города // Экология.
1990. №5. С.10-18.
5. Суханова Н.В. Почвенные водоросли
городских экосистем: Дисер. канд. биол. наук. Уфа, 1996. 156с.
6.
R.Tärk, G.Gärtner, 2001: Biological soil crusts of subalpine, alpine
and nival areas in the Alps. In: J. Belnap and O.L. Lange (eds.) Biological
soil crusts: structure, function, and management: Ecological studies, Vol.150:
67-73.
7. H.Reisigl, 1964:
Zur systematic und ökologie alpine bodenalgen. Innsbruck.P.401-499.
ДИАТОМОВЫЕ
ВОДОРОСЛИ В ОТЛОЖЕНИЯХ ТРЕХ ГОРНЫХ ОЛИГОТРОФНЫХ ОЗЕР БАС. Р. АМГУЭМА (ЧУКОТКА)
В.Г. Харитонов
Diatoms
(Bacillariophyceae) in the sediments of three
mountain oligotrophic lakes in the Amguema River basin (Chukotka)
W.G. Kharitonov
Институт биологических проблем Севера ДВО
РАН
г. Магадан, ул. Портовая 18, тел./факс
(4132) 63-44-63
е-mail: kharitonov@ibpn.ru
В 1989 г.,
исследуя видовое разнообразие водоемов бассейна р. Амгуэма, с целью экспертизы
проекта строительства Амгуэмской ГЭС, мы, уже на стадии предварительного
изучения собранного материала (Харитонов, 1993), обнаружили в нем богатый
набор видов, разновидностей и форм диатомовых водорослей, сравнимый с флорой
диатомовых бас. р. Анадырь (Харитонов, 1989 а). Интересно, что ненамного больше
форм диатомей приводится в работах И. И. Васильевой (Васильева-Кралина и др.,
2005) и Л. А. Кухаренко (1989), посвященных диатомовым Якутии и Приморского
края. Примерно того же порядка достигают объемы диатомовых флор таких обширных
речных бассейнов, как Енисей (Левадная, 1986), Колыма (Харитонов, 1991), Амур
(Медведева, Сиротский, 2002) или таких стран как Монголия (Дорофеюк, Цэцэгмаа,
2002). Подобное разнообразие, отмеченное для относительно небольшой заполярной
территории, показалось нам далеко не ординарным.
Необычно высокое для арктических широт видовое разнообразие водных
сообществ и своеобразная палеогеография региона (Жиготский, 1982; Экология
...., 1993) вызвали определенный интерес к структуре тех или иных комплексов
диатомовых водорослей конкретных водоемов данного бассейна. Известно, что
диатомеи служат важным источником сведений не только о настоящем состоянии
озерно-речных систем, но и об их прошлом, что позволяет реконструировать и прогнозировать
основные этапы жизни водоемов, а соответственно и территорий. Кроме того,
структура диатомовых комплексов танатоценозов может стать надежным репером, как
в таксономическом, так и в гидробиологическом мониторинге. В настоящее время, в
пределах азиатского сектора Берингии, подобная информация, в достаточном
объеме, известна лишь для двух горных озер Крайнего Северо-Востока Азии – оз.
Эльгыгыгытгын (Жузе, Сечкина, 1960; Харитонов, 2008) и оз. Дж. Лондона
(Харитонов, 2006) и существенно в меньших объемах для некоторых горных озер
Верхоянья (Васильева-Кралина и др., 2004).
Материал для данной работы собран в летне-осенний период 1989 г. в озерах
Эрвынайгытгын, Матачингайгытхын, Экитики (рис. 1).
Озеро Матачингайгытхын расположено в истоках одноименной реки и
практически лишено водосборной площади. Эрвынайгытгын отличается обширным
заболоченным бассейном и разветвленной сетью притоков. Озеро Экитики, имея достаточно обширный водосборный бассейн, расположено
в ущелье и единственное из трех, имеет ложе каньонообразной формы с крутыми или
обрывистыми берегами.
Всего в отложениях трех вышеуказанных озер выявлено 385 видов и
разновидностей диатомовых водорослей из 69 родов. Представители порядка Centrales, включающего 8 родов, составляют в этом списке 8% от всех
выявленных форм; – сем. Fragilariaceae
(13 родов) – около 14%, – сем. Eunotiaceae (1 род) – чуть больше 9%, – сем. Achnanthacea (8 родов) – около 5%, – сем. Naviculaceae (29
родов) – 46%, доля каналошовных диатомей, включающая 10 родов, достигает 18%.
В десятку ведущих (по разнообразию) родов входят: Pinnularia –
41 видов и разновидностей, Eunotia – 36, Surirella – 25, Nitzschia – 22, Gomphonema – 20, Navicula
– 18, Fragilaria – 15, Cymbella – 12, Cyclotella – 11, Aulacoseira – 11,
составляющие почти 55% объема всей флоры.
Рис. 1. Карта-схема
расположения исследованных озер
Наиболее богатым
оказался комплекс диатомовых водорослей в отложениях озера Эрвынайгытгын (290
видов и разновидностей, 121 из которых отмечены лишь в этом озере). В озере
Матачингайгытхын обнаружено 186 форм (дифференциальных – 29), а в оз. Экитики –
165 (дифференциальных – 34). Разница в объемах выявленных форм обусловлена на
наш взгляд, в первую очередь, различиями в морфометрии исследованных озер и их
бассейнов.
Обработанный
материал исследованных озер не является равнозначным, поэтому данные о
диатомовых водорослях отложений этих озер мы рассматриваем как предварительные
и вместо сравнительного анализа озерных комплексов диатомей, ограничиваемся
замечаниями о некоторых особенностях выявленной флоры.
Одной из таких особенностей можно считать наличие в
ней представительной группы каналошовных диатомей, особенно из родов Surirella и Nitzschia. В свое время А. П. Жузе и Т. В. Сечкина,
анализируя флору диатомовых водорослей оз. Эльгыгытгын, отмечали: "…
впервые для таких высоких широт констатировано присутствие Surirella и
в обильном развитии" (Жузе, Сечкина, 1960, стр. 60). Тогда речь шла о
четырех таксонах. Сегодня в оз. Эльгыгытгын идентифицировано не менее 20 видов
и разновидностей из рода Surirella (Харитонов, 2008), а в еще более северных озерах бас.
р. Амгуэма выявлено более 25 таксонов видового и подвидового ранга этого рода.
Кроме того, следует отметить, что в десятку ведущих
родов выявленной флоры входят Cymbella и Cyclotella, чего не
наблюдалось, например, ни
в озерах Верхней Колымы
(Харитонов, 2006), ни в бас. р. Анадырь (Харитонов, 2008). Заметим так же, что
в горных озерах Верхоянья (бассейнах рек Яна и Индигирка) отмечено всего лишь
4 представителя Surirella и по 15 таксонов из
родов Eunotia и Pinnularia (Васильева-Кралина и др., 2004). Совокупная доля этих
родов составляет 12% флоры горных озер Верхоянья, в то время как в
бассейне р. Амгуэма они являются наиболее обширными родами и их совокупная доля
достигает более 26% всей флоры.
Наряду с флористическими различиями, между озерами
наблюдаются и некоторые биоценотические расхождения. Например, из 32
преимущественно планктонных форм центрических диатомей, присутствующих в
списке, лишь 5 найдены во всех трех озерах. В то же время дифференциальных
элементов, в этой группе видов, отмечено в три раза больше. В целом, для трех
озер, доля общих элементов в их флорах достигает 19%, дифференциальных элементов – 48%.
Коэффициенты флористического сходства (Sorensen, 1948), при этом следующие:
Эрвынайгытгын – Матачингайгытхын = 0,55; Эрвынайгытгын – Экитики = 0,43;
Матачингайгытхын – Экитики = 0,56. Однако, несмотря на различие источников
формирования диатомовых комплексов исследованных танатоценозов, экологические
характеристики выявленных флор оказались близки между собой и соответствуют
общей ситуации, сложившейся в горных, озерно-речных системах бассейна р.
Амгуэма. Например, доля галофобов в общем списке составляет 30-31%, индифферентов
65-68%, галофилов 2-3%; – олигосапробионтов 67-69%, β-мезосапробионтов
24-25%, α-мезосапробионтов 7-8%; – нейтральных (по отношению к pH) форм достигает 37-40%, почти столько же (39-41%)
отмечено алкалифилов, группа ацидофилов составляет 20-22%; доля арктобореальных
видов достигает 35-37%, – космополитов 60-63%. При отдельном анализе диатомовых
комплексов исследованных озер оказалось, что в каждом из них эти доли близки к
указанным значениям.
Подавляющее большинство приведенных в списке диатомей
широко распространено в пределах Берингии (Харитонов, 2001, 2005 а, б, в), 24%
из них встречаются повсеместно и часто; 44% –
повсеместно, но нечасто; 3-4% –
повсеместно, но редко. Видов с ограниченным распространением насчитывается
25-30%, половина из них – редкие формы. При этом 70% обнаруженных видов и разновидностей
широко распространены в водоемах Якутии; 79% – в бассейне р. Анадырь; 88% – в
бассейне Колымы и 76% – в водоемах Аляски.
Следует отметить, что в список включены таксоны,
которые, при микроскопировании собранного материала, были отмечены лишь один
раз и, безусловно, требуют подтверждения своего местонахождения в указанных
озерах, например: Achnanthes stauroneiformis; Adlafia minuscula var. muralis; Amphora mongolica; Caloneis alpestris var. sarnensis; Campylodiscus fragilis; Cyclotella distinguenda var. unipunctata; C. planctonica; Cymbella skvortzowii; C. tartuensis;
Denticula thermalis; Diploneis boldtiana var. baicalensis; Gomphonema semiapertum; Navicula ajajensis; N. cingens; N. jasnitskyi var. obtusa;
N. pseudococconeiformis; N. unipunctata; Nitzschia regula; Pinnularia. spitsbergensis; P. viridissima; Sellaphora hustedtii; Stauroneis legumen; S. schutzii; Surirella arcta; S. lepnewae; S. oöphora; S. tientsinensis и др. Большинство
из них характеризуются как редкие формы с ограниченным распространением.
Список литературы
Васильева-Кралина И. И., Габышев В. А.,
Пшенникова Е. В., Иванова А. П. Водоросли горных водоемов Верхоянья // Биол.
внутр. вод. – 2004. – № 3. – С. 3–15.
Водоросли / Васильева-Кралина И. И.,
Ремигайло П. А., Габышев В. А., [и др.] // Разнообразие растительного мира
Якутии. – Новосибирск: Издательство СО РАН, 2005. – С. 150–272.
Дорофеюк Н. И., Цэцэгмаа Д. Конспект
флоры водорослей Монголии. – М.: Наука, 2002. – 285 с.
Жигоцкий В. Е.
Коренное изменение геохимии ландшафтов на низменностях Северо-Востока СССР на
границе плейстоцен-голоцен // Мерзлотно-геологические процессы и палеогеография
низменностей Северо-Востока Азии. – Магадан, 1982. – С. 101–110.
Жузе А. П., Сечкина
Т. В. Диатомовые водоросли в донных отложениях озера Эльгыгытгын (Анадырское
плоскогорье) // Тр. лаб. озероведения АН СССР. – 1960. – Т. 10. – С. 55–62.
Кухаренко Л. А. Водоросли пресных водоемов Приморского края. – Владивосток:
ДВО АН СССР, 1989. – 142 с.
Левадная Г. Д. Микрофитобентос реки Енисей. – Новосибирск: Наука, 1986.
– 286 с.
Медведева Л. А.,
Сиротский С. Е. Аннотированный список водорослей р. Амур и водоемов его
придаточной системы // Биогеохим. и геоэколог. исслед. наземных и пресноводных
экосистем. – Владивосток: Дальнаука, 2002. – Вып. 12. – С. 130–218.
Харитонов В. Г. К флоре диатомовых водорослей северо-востока Азии
(бассейн р. Анадырь) / АН СССР ДВО; ИБПС ДВО РАН. – Магадан, 1989 а. – 70 с. –
Деп. в ВИНИТИ 03.08.89. № 5251-В89.
Харитонов В. Г. К флоре диатомовых водорослей северо-востока Азии
(бассейн р. Колыма) / АН СССР ДВО; ИБПС ДВО РАН. – Магадан, 1991. – 106 с. –
Деп. в ВИНИТИ 01.03.91. 1991, № 908-В91.
Харитонов В. Г. Диатомовые водоросли пресных
водоемов // Экология бассейна р. Амгуэма. Владивосток: Дальнаука. 1993. – С.
47–81.
Харитонов В. Г.
Представители семейства Achnanthaceae (Bacillariophyta) в пресных Водоемах
Берингии // Бот. журн. – 2001. – Т. 86, № 4. – С. 53–61.
Харитонов В. Г. Предствители семейства Enotiaceae (Bacillariophyta)
в пресных водоемах Берингии // Бот. журн. – 2005 а. – Т. 90, № 2. – С. 165–182.
Харитонов В. Г. Представители Centrales (Bacillariophyceae) в водоемах Берингии // Бот. журн. – 2005 б. – Т. 90,
№ 3. – С. 336–350.
Харитонов В. Г. Представители сем. Fragilariaceae (Bacillariophyceae) в водоемах Берингии // Бот. журн. – 2005 в. – Т. 90,
№ 11. – С. 1693–1710.
Харитонов В. Г. Диатомовые водоросли оз. Дж.
Лондона и водоемов его бассейна (Верхняя Колыма) // Вестник СВНЦ ДВО РАН. –
2006. – № 3. – С. 40–53.
Харитонов В.
Г. Диатомовые водоросли (Bacillariophyceae) озера Эльгыгытгын и водоемов
его бассейна (Чукотский автономный округ) // Вестник СВНЦ ДВО РАН. – 2008. – №
2. – С. 41–54.
Экология бассейна
р. Амгуэма (Чукотка). – Владивосток: Дальнаука, 1993. – Ч. 2. – 126 с.
Cladophora aegagropila (Chlorophyta) в реках
Вологодской области
Чемерис Е.В.,
Бобров А.А., Филиппов Д.А.
Cladophora aegagropila (Chlorophyta) in rivers
of the Vologda region
Chemeris E.V., Bobrov A.A., Philippov D.A.
Институт биологии внутренних вод им. И. Д. Папанина РАН
152742 Ярославская обл., Некоузский р-н, пос. Борок
тел.: 8 48547 24486, факс: 8 48547 24042
е-mail: lechem@ibiw.yaroslavl.ru
В ходе изучения растительного покрова ручьёв, малых и
средних рек на севере европейской России в 2007—2008 гг. в 4 реках, протекающих
по территории Вологодской обл., была найдена интересная, прежде нам не встречавшаяся
водоросль — Cladophora aegagropila. этот вид и раньше, и в настоящее время многие исследователи
рассматривают в составе отдельного рода Aegagropila linnaei (Guiry, Guiry, 2009).
Найденная водоросль привлекла наше внимание необычностью формы роста и
особенностями местообитаний. C. aegagropila
по литературным источникам ранее указывался преимущественно в озёрах (Starmach, 1972; Голлербах, Сдобникова, 1980; Guiry, Guiry, 2009),
однако, Н. Н. Воронихин (1953) отмечал его в разливе р. Молога (Тверская обл.,
около г. Бежецк). Нами вид отмечен в следующих реках: р. Пежма (Верховажский
р-н, с. Морозово, 08.08.2007), р. Илеза (Бабушкинский р-н, ниже д. Дор,
22.07.2008); р. Вотча (Бабушкинский р-н, выше д. Шилово, 23.07.2008); р.
Шарженьга (Никольский р-н, ниже д. Люльково, 23.07.2008). Участки рек, где
обитает C. aegagropila,
отличаются следующими условиями: воды — светлые, мало минерализованные (102—177
мг/л), нейтральные до щелочных (pH 7.6—9.5);
течение — от очень слабого до достаточно сильного (до 0.6—1 м/с); субстрат —
средние и крупные валуны. В руслах всех рек, в которых была найдена водоросль,
представлены выходы коренных пород в виде известняков. Во всех точках вид
отмечен на хорошо освещённых открытых участках, на небольших глубинах (0.1—0.4
м). Водоросль обрастает гранитные валуны, реже глыбы известняка, формируя крупные,
округлые пятна 5—20 см в диаметре или образуя сплошные коврики, по внешнему
виду напоминающие толстый, плотный войлок чёрно-зелёного цвета. При наличии
быстрого течения водоросль располагается на защищённой от потока стороне
камней. Обширные дерновинки, разрастаясь, вспухают, формируют небольшие выпуклости
с полостью над субстратом, которые затем разрываются и нарушают целостность
покрова.
Строение таллома водоросли изоморфное, талломы
кустистые, достигают 1 см
длины, прикреплённые с помощью коралловидных ризоидов. Для вида характерна
выраженная инверсия полярности, наблюдается массовое отрастание на вершинах
боковых и основных ветвей ризоидов, дающих начало новым талломам. Инсерция
ветвей (тип прикрепления) латеральная. Ветвление и ризоиды обильные. Клетки
цилиндрические, ближе к базальной, старой части таллома булавовидные, наверху
вздутые. От типичной озёрной формы речные растения отличается чуть меньшими
размерами (см. табл.).
Такая прикреплённая форма с более узкими и короткими
клетками, более компактными талломами скорее всего является приспособлением
водоросли к обитанию в условиях течения, обеспечивает её большую механическую
устойчивость и способствует сохранению таллома, прежде всего во время паводков.
Размножение в реках предположительно вегетативное, при помощи фрагментов талломов
(дерновинок).
В рр. Илеза и Шарженьга C. aegagropila
формирует сообщества, которые занимают заметные площади на каменистых участках,
представляя собой характерную черту растительного покрова этих рек. Фитоценозы
примитивные, кроме доминирующего вида с проективным покрытием 60—100%, в них
представлены с незначительным обилием водные мхи Fontinalis antipyretica и Leptodictyum
riparium.
Таблица
Основные размерные характеристики озёрной и речной
форм Cladophora aegagropila
|
Форма / параметры
|
Озёрная
(по: Голлербах, Сдобникова, 1980)
|
Речная
(оригинальные данные)
|
|
Длина отдельных растений
|
до 3 см
|
до 1 см
|
|
Ширина клеток основной оси
|
125—200 мкм
|
80—120(150) мкм
|
|
Длина клеток основной оси
|
190—3000 мкм
|
120—500 мкм
|
|
Ширина клеток конечных
ветвей
|
30—100 мкм
|
30—50(70) мкм
|
|
Длина клеток конечных
ветвей
|
150—2400 мкм
|
100—1000 мкм
|
|
Ширина оболочки клеток
|
до 20 мкм
|
10—15(20) мкм
|
В заключение можно отметить, что в ручьях и реках
Вологодской обл. и всего севера европейской России Cladophora aegagropila
имеет очень ограниченное распространение. Ещё более редки здесь сообщества
этого вида. Из более 300 изученных водотоков он был обнаружен только в 4 малых
реках, а его сообщества отмечены только в 2-х из них. Несомненно, что это очень
редкая для речных экосистем водоросль, поэтому необходимо продолжить наблюдение
за известными популяциями вида и рекомендовать к охране его местообитания.
Работа выполнена при финансовой поддержке Российского
фонда фундаментальных исследований (проекты №№ 01-04-49524, 04-04-49814) и
Фонда содействия отечественной науке.
Список литературы
Воронихин Н. Н. Растительный мир континентальных
водоёмов. М.—Л., 1953. 410 с.
Голлербах М. М., Сдобникова Н. В. Зелёные водоросли:
Сифонокладовые // Определитель пресноводных водорослей СССР. Л., 1980. Вып. 13. С. 7—89.
Guiry M. D., Guiry
G. M. AlgaeBase: World-wide electronic publication. National University of Ireland,
Galway, 2009. http://www.algaebase.org (дата обращения 27.03.2009).
Starmach K. Chlorophyta III. Zielenice nitkowate: Ulotrichales, Ulvales, Prasiolales, Sphaeropleales, Cladophorales, Chaetophorales,
Trentepohliales, Siphonales, Dichotomosiphonales
// Flora słodkowodna Polski. Warszawa – Kraków, 1972. T. 10. 750 s.
Макроскопические водоросли
в реках на севере европейской
России
Чемерис Е.В.,
Бобров А.А.
Macroscopic algae in rivers in the north of european Russia
Chemeris E.V., Bobrov A.A.
Институт биологии внутренних вод им. И. Д. Папанина РАН
152742, Ярославская обл., Некоузский р-н, пос. Борок
тел.: 8 48547 24486, факс: 8 48547 24042
е-mail:
lechem@ibiw.yaroslavl.ru
Более 10 лет проводится изучение растительного покрова
ручьёв, малых и средних рек на севере европейской России. Территория
исследования охватывает бассейны Северной Двины (Архангельская, Вологодская
обл.), Кулоя (Архангельская обл.), Онежского озера (Карелия, Вологодская обл.),
Верхней Волги (Вологодская, Тверская, Ярославская, Костромская, Ивановская
обл.), Вятки (Кировская обл.) и находится приблизительно между 57°00' и 65°00' с. ш., 35°00' и 48°00' в. д. Нами изучено более 300 водотоков, из которых более
200 малых рек, примерно по 50 ручьёв и средних рек. Исследование проводилось по
оригинальной методике (Бобров, Чемерис, 2006). Специального изучения макроскопических
водорослей в реках региона ранее не проводилось.
Самые обычные и
часто встречаемые в растительном покрове всех типов водотоков на севере европейской России зелёные нитчатые (Chlorophyta) (8 видов), а также жёлтозелёные сифоновые (Xanthophyta) (5 видов) водоросли. Они отмечены практически во
всех реках региона, распространены в водотоках разных ландшафтов, в водах с широким
диапазоном гидрохимических показателей: от низко до высоко минерализованных
(150—700 мг/л), от мягких до умеренно жёстких (3—5 мг-экв/л), от нейтральных до
слабо щелочных (pH 6.5—8). Несколько отличается
только отношение видов к скорости течения. Так, Cladophora glomerata, C. fracta, Vaucheria dichotoma, V. terrestris и др. виды
характерны для участков рек со слабым до умеренного течением (0—0.5 м/с). В экотопах
с более быстрыми скоростями (0.5—1 м/с) встречаются Cladophora glomerata, C.
aegagropila, Draparnaldia mutabilis, Stigeoclonium tenue, Vaucheria sessilis, V. geminata, Ulotrix zonata и др. Большинство названных видов обычны не только в
малых реках региона, но и в других водных объектах (Голлербах, Сдобникова,
1980; Рундина, 1998). Редки Draparnaldia mutabilis, Vaucheria aversa, Cladophora aegagropila. Виды водорослей с нитчатым и сифональным
талломом способны образовывать как прикреплённые формы, так и свободно
плавающие, в виде скоплений (матов) в толще или на поверхности воды. Иногда,
развиваясь в большом количестве, они способны занимать всё сечение русла и
погребать под своими массами другие виды водных растений и животных, лишая их
доступа к свету, кислороду, тем самым негативно влияют на состояние речной
биоты. Способны формировать примитивные маловидовые сообщества. Нами выявлены
ценозы с доминированием Cladophora glomerata
(асс. Cladophoretum glomeratae),
C. fracta (асс. Cladophoretum fractae), Vaucheria dichotoma
(асс. Nitello-Vaucherietum
dichotomae), Stigeoclonium tenue (асс. Stigeoclonietum tenuis),
характеризующие участки рек с замедленным водообменом, небольшими глубинами
часто с незначительными нарушениями, соответствующие b—a-мезосапробной зоне (Бобров и др., 2005). Доминирование
этих сообществ в водотоках связано с умеренным притоком органического вещества,
повышением щелочности воды (pH >7.5) и
осветлением русел в результате хозяйственной деятельности человека. В малых и
средних реках региона, протекающих в освоенной человеком местности, «цветение»
приурочено к середине—концу лета, когда температура воды максимальна и активно
идут микробиологические процессы. Большинство видов с нитчатым строением
таллома способны связывать содержащийся в воде азот и фосфор, что очень важно
для процесса самоочищения рек. Сообщества асс. Vaucherio-Cladophoretum с
преобладанием прикреплённых поточных форм Cladophora glomerata и Vaucheria sessilis
характерны для более благополучных участков рек (b-мезосапробная зона), произрастают при больших
скоростях течения в чистых и прохладных водах (Бобров и др., 2005). Все
перечисленные фитоценозы имеют циклический характер развития. Для сообществ Cladophora spp., Stigeoclonium spp. пик приходится на середину или конец лета, Vaucheria spp. — конец лета, начало осени. Ценозы большинства
указанных ассоциаций широко распространены по всей территории исследования. Более
редки сообщества Draparnaldia mutabilis,
которые наблюдались нами только в 2 реках, и Cladophora aegagropila — в 4 водотоках. Синтаксономический статус
этих ценозов пока непонятен. Продукционные способности сообществ нитчатых и
сифоновых водорослей в периоды их массового развития очень высоки, так, сырая
фитомасса C. glomerata в
реках региона колеблется от 1 до 8 кг/м2, воздушно-сухая — от 50 до
400 г/м2. С. Ф. Комулайнен (2004) отмечает, что для восточной Фенноскандии
биомасса фитоперифитона в реках формируется в первую очередь видами с нитчатой
структурой таллома. Подобная закономерность, видимо, характерна и для рек
нашего региона.
Пресноводные красные водоросли (Rhodophyta), или багрянки не часто встречаются в реках
территории исследования. Эта группа немногочисленна и отличается специфическими
требованиями к условиям обитания (Виноградова, 1980; Eloranta, Kwandrans, 2007). Всего нами выявлено 12 видов, отмеченных на
38 станциях в 28 водотоках. Реки или их участки, в которых распространены
красные водоросли, характеризуются чистыми, прохладными водами, богатым
родниковым питанием, сильным течением, небольшой глубиной, плотными грунтами
(валуны, галька), наличием выходов коренных пород в руслах (чаще в виде
известняков и доломитов). Багрянки распространены в водотоках с низко
минерализованными (20—250 мг/л), мягкими (0.4—3.3 мг-экв/л), с кислыми до
нейтральных (pH 5—7) водами. Представители
родов Lemanea и Audouinella ярко
выраженные рео- и фотофилы. Их местообитания — это быстрые перекаты и пороги с
сильным и очень сильным течением (выше 1—1.5 м/с). Здесь отмечены Lemanea borealis, L. fluviatilis
и L. rigida, как
эпифит на леманеях и водных мхах произрастает Audouinella hermannii, на
известняках при более умеренном течении (до 1 м/с) — A. chalybaea. Все виды
встречаются на открытых и хорошо освещённых участках речных русел, чаще в
светлых, прозрачных водах. Виды рода Batrachospermum
занимают мелководья с глубинами до 0.5 м, реже больше, со слабым и умеренным
течением (до 0.5 м/с). Однако, B. gelatinosum
способен расти и на быстрых перекатах (скорость течения до 0.7 м/с). Для
светлых, нейтральных и слабощелочных (pH
7.6—8.5) вод характерны B. anatinum, B. atrum, B. confusum и B. gelatinosum. Виды B. turfosum, B. keratophytum и Sirodotia
suecica были отмечены в тёмноцветных, кислых (pH 4.2—5.5) водах рек, вытекающих из болотных массивов.
Виды багрянок в целом редко встречаются в регионе, некоторые известны по единичным
местонахождениям: Batrachospermum
anatinum, B. atrum, B. confusum, Lemanea
borealis, Sirodotia suecica.
Самый распространённый вид — Batrachospermum gelatinosum
спорадически встречается по всему региону в холодноводных ручьях и реках, часто
в местах выхода грунтовых вод. Крайне редко, при особых условиях багрянки
способны выступать в качестве ценозообразователей, их сообщества крайне просто
устроены. Ценозы с доминированием видов Lemanea
(асс. Lemaneetum fluviatilis)
обитают на незначительных глубинах до 0.5 м, на гранитных валунах, известковых
монолитах, при средних и высоких скоростях течения (0.3—1.5(2) м/с), в умеренно
жёстких (3—5 мг-экв/л), нейтральных или слабо щелочных (pH 7—8), прозрачных водах. Произрастают на хорошо
освещённых открытых участках — порогах, перекатах, водопадах. По своей сути это
горные сообщества, тяготеющие к быстрым, холодноводным, чистым рекам. Пик их
развития приходится на конец весны, начало лета, что совпадает со сроками в
Карелии (Комулайнен, 2004). Отмечены в 7 реках северо-западной части региона.
Ценозы Batrachospermum gelatinosum
(асс. Batrachospermetum gelatinosi)
изредка встречаются в водотоках региона. Они
развиваются на небольших глубинах на разнообразных субстратах: валунах, крупном
песке, известняке, затопленной древесине, в условиях сильного затенения. Пика
развития достигают ближе к осени. Данные сообщества были отмечены в 7
реках (большинство в Вологодской и 1 в Костромской обл.). В одной реке (р. Колошма,
Вологодская обл.) с тёмной (>400 градусов цветности) и кислой водой (pH 5.4), вытекающий из болотного массива, нами были
отмечены своеобразные сообщества асс. Batrachospermetum vagi с
доминированием B. turfosum
и/или B. keratophytum.
Все перечисленные сообщества багрянок в исследованных реках встречаются редко.
Наибольшее их разнообразие сосредоточено в водотоках северо-западной части
региона (Вепсовская и Андомская возв., Вологодская обл.). Продукционные возможности
багрянок, по видимому, достаточно велики. Так, по нашим данным, сырая биомасса Lemanea fluviatilis составляет от 4.5 до 6.5 кг/м2, а
воздушно-сухая может достигать 500—780 г/м2.
Весьма интересна группа харовых водорослей
(Charophyta), для которой обитание в реках в целом не характерно
(Голлербах, Красавина, 1983). Это подтверждается и нашим материалом: в реках
исследованной территории харовые редки. Они были найдены только в 30 реках (10%
от всего числа исследованных). Представлены в светлых, средне и высоко
минерализованных водах (250—900 мг/л) с нейтральной или слабощелочной средой
(рН 6.5—8.5). В реках с тёмной, слабокислой водой они отсутствуют. Было
выявлено всего 8 видов: Chara aspera,
C.
contraria, C. delicatula, C. globularis, C. intermedia, C.
vulgaris, Nitella flexilis и N.
mucronata. Наиболее обычные виды в реках региона — Chara globularis (24 находки) и C. vulgaris (8 точек), остальные
встречаются заметно реже: Nitella
flexilis — 4 местонахождения, Chara
contraria — 3, оставшиеся представлены в 1—2 реках. Местообитания харовых
водорослей в водотоках — это экотопы со слабым течением или стоячей водой,
обычно с илистыми или песчаными грунтами. В районах с близким залеганием
карбонатных пород (северо-восток и северо-запад Вологодской обл., Архангельская
обл.), в реках с более минерализованными водами (300—900 мг/л), роль хар в
растительном покрове несколько возрастает. Здесь выявлено максимальное
разнообразие видов и харовые заметны в растительных сообществах, в таких реках
они способны формировать придонный ярус в сообществах рдестов (Potamogeton spp.), элодеи (Elodea canadensis)
и гелофитов (Schoenoplectus lacustris, Equisetum fluviatile и
др.). Развитию харовых водорослей также может способствовать хозяйственная
деятельность человека (умеренное нарушение русла, загрязнение органикой,
вырубка долинных лесов и т. д.). Из сообществ харовых нами отмечались
только ценозы Chara vulgaris
(асс. Charetum vulgaris),
которые изредка развиваются в мелководных затонах с илистыми грунтами во второй
половине лета. В целом хары факультативный компонент речных экосистем
европейского севера России. На что указывает их небольшое видовое разнообразие,
преобладание видов с «широкой» экологической амплитудой и крайне редкое формирование
собственных сообществ.
Макроскопические водоросли в реках севера европейской
России — важная и значимая часть растительного покрова, они проявляют себя в
условиях, при которых невозможно или затруднено развитие водных мохообразных и
сосудистых растений. Смещение вегетационной активности водорослей по отношению
к высшим макрофитам на более ранний или более поздний срок (весну, начало лета,
осень) и освоение специфичных местообитаний и субстратов даёт возможность использовать
незанятые в реках экологические ниши. Ценозы макроскопических водорослей часто
выступают в роли пионерных, подготавливающих среду для заселения другими
организмами и являются поставщиками органического вещества в крайних условиях.
Всё это приводит к обогащению биоты, усложнению взаимосвязей внутри биоценозов
и в конечном итоге к увеличению продуктивности и устойчивости экосистем
водотоков. При продвижении на север, северо-запад региона, в ландшафты с выходами
коренных пород, где в руслах рек представлены плотные каменистые и карбонатные
субстраты, а воды отличаются чистотой и низкой температурой, разнообразие видов
и сообществ макроводорослей и их участие в растительном покрове водотоков
возрастает.
Работа выполнена при финансовой поддержке Российского
фонда фундаментальных исследований (проекты №№ 01-04-49524, 04-04-49814) и
Фонда содействия отечественной науке.
Список литературы
Бобров А. А., Киприянова Л. М., Чемерис Е. В.
Сообщества макроскопических зелёных нитчатых и жёлтозелёных сифоновых
водорослей (Cladophoretea) некоторых регионов
России // Растительность России. 2005. № 7. С. 50—58.
Бобров А. А., Чемерис Е. В. Изучение
растительного покрова ручьёв и рек: методика, приёмы, сложности // Матер. VI
Всерос. школы-конф. по водным макрофитам «Гидроботаника 2005» (пос. Борок,
11—16 октября 2005 г.).
Рыбинск, 2006. С. 181—203.
Виноградова К. Л. Красные водоросли // Определитель
пресноводных водорослей СССР. Л, 1980. Вып. 13. С. 153—231.
Голлербах М. М., Красавина Л. К. Харовые водоросли — Charophyta
// Определитель пресноводных водорослей СССР. Л., 1983. Вып. 14. 190 c.
Голлербах М. М., Сдобникова Н. В. Зелёные водоросли:
Сифонокладовые // Определитель пресноводных водорослей СССР. Л., 1980. Вып. 13.
С. 7—89.
Комулайнен С. Ф. Экология фитоперифитона малых реках
Восточной Фенноскандии. Петрозаводск, 2004. 181 с.
Рундина Л. А. Зигнемовые водоросли России.
СПб., 1998. 351 с.
Eloranta P., Kwandrans J.
Freshwater red algae, Rhodophyta. Identification guide to European taxa,
particularly to those found in Finland
// Norrlinia. 2007. Vol. 15. P. 1—103.
Водоросли отдела Chlorophyta
в стоячих водоемах среднего
Тимана (бассейн р. Ижмы)
Шабалина Ю.Н.
Chlorophyta of stagnant water bodies in the middle timan
(basin of the Izhma
river)
Shabalina J.N.
Сыктывкарский государственный университет, кафедра экологии
167001, Сыктывкар, Октябрьский пр., д. 55
e-mail: ulik321@rambler.ru
Отдел зеленые водоросли – обширная и широко
распространенная группа растений, насчитывающая к настоящему времени более 20
тыс. видов (Водоросли, 1989). Альгофлора водоемов таежной зоны северо-востока
европейской части России исследована неравномерно. Водоросли отдела Chlorophyta
были выявлены главным образом для рр. Вычегда и Печора, а также для некоторых
водоемов их бассейнов (Воронихин, 1929; Чернов, 1945; и др.). В водных объектах
таежной зоны, связанных с Тиманским кряжем, данные о зеленых водорослях имеются
для нескольких притоков р. Печоры: рр. Сойва, Нибель, Сев. Мылва и Печорская
Пижма (Borge, 1894: цит. по Гецен, 1973; Гецен, 1968; 1971; 1973); сведения о
водорослях фитопланктона р. Ижмы и ее притока р. Ухты остались в виде рукописи
(Воронихин, 1929: цит. по Гецен, 1968; 1973). В настоящей работе приводятся
данные о составе зеленых водорослей разнотипных стоячих водоемов, расположенных
на отрогах Тиманского кряжа в бассейне среднего течения р. Ижмы – притока р.
Печоры.
Материалом послужили пробы фитопланктона, фитобентоса
и обрастаний различных субстратов, собранные автором в 2003-2004 и 2006-2007
гг. из четырех карстовых озер гидрологического памятника природы «Параськины
озера», сапропелевого оз. Пионерского – источника лечебных грязей, и верхового
болота. Водные объекты расположены в бассейнах двух притоков р. Ижмы – р. Тобысь
(карстовые озера и озерко на болоте) и р. Ухты (оз. Пионерское), которые
относятся к Тиманскому гидрологическому округу. Альгологические пробы отбирали
на доступной глубине общепринятыми методами и фиксировали 4% формалином.
В исследованных водоемах бассейна р. Ижмы из отдела
Chlorophyta было обнаружено 136 видов с разновидностями и формам, что составило
23.3 % от общего числа таксонов водорослей, выявленных в этих водных объектах.
Данные виды относятся к четырем классам, девяти порядкам, 24 семействам и 46
родам; 14 таксонов определены до рода. По разнообразию отдел Chlorophyta стоит
на втором месте после Bacillariophyta (347 таксонов), что характерно для Севера
(Гецен, 1978; Ярушина, 2004; Альгофлора…, 2006; Патова, Демина, 2007), в то
время как во флорах более южных территорий зеленые лидируют по количеству видов
или их разнообразие сопоставимо с диатомовыми (Михеева, 1999; Снитько,
Сергеева, 2003; Селезнева, 2007).
По количеству родов, представленных одним видом, отдел
Chlorophyta в изученной альгофлоре стоит на первом месте и составляет 30 родов
или 39 % от всех родов водорослей.
Наибольшее число видов Chlorophyta было выявлено для
класса Zygnematophyceae (82 таксона), порядка Desmidiales (79) и семейства
Desmidiaceae (58). Ведущее положение этих таксонов в альгофлорах северных
территорий отмечалось неоднократно (Гецен, 1973; 1985; Альгофлора…, 2006).
Давно известен факт высокого разнообразия десмидиевых в областях, где
материнской породой являются палеозойские и докембрийские отложения (Косинская,
1960), что справедливо и в отношении исследуемой территории. Район исследования
большей частью расположен на протерозойских горных породах девонской системы,
среди которых наиболее часто встречаются конгломераты, песчаники, глина,
глинистые и битуминозные сланцы, известняки, доломиты и мергели, а также на
Тимане нередки изверженные породы (базальтоиды). Карстовые озера расположены на
каменноугольных отложениях, образующих мощные толщи доломитов, песчаников,
конгломератов, глинистых и кремнистых сланцев (Атлас …, 2001). В исследованных
водоемах из класса Zygnematophyceae также были обнаружены представители
Zygnematales из родов Mougeotia и Spirogyra, идентифицированные до рода.
Широкий экологический спектр видов Spirogyra
обуславливает их распространение в водоемах различного типа, а предпочитающие
щелочные воды представители рода Mougeotia
(Рундина, 1998) были обнаружены лишь в карстовых озерах, где часто в массе
развивались на литорали.
На втором месте по количеству видов среди зеленых
водорослей в альгофлоре бассейна р. Ижмы находится класс Chlorophyceae,
преимущественно это представители порядка Chlorococcales (81.6 % от всех видов
и разновидностей класса). Одной из характерных черт флоры хлорококковых
Голарктического флористического царства является ведущее положение по видовому
разнообразию семейств Scenedesmaceae (и соответственно среди родов – Scenedesmus), Selenastraceae и
Oocystaceae, которые объединяют более половины видов хлорококковых (Царенко,
2000). В альгофлоре бассейна р. Ижмы обнаружены представители только двух
первых семейств (некоторые были идентифицированы до рода), они составили 47.5 %
от всех видов отдела. Отсутствие водорослей сем. Oocystaceae, вероятно, в
большой степени связано с трудностями их определения в фиксированном материале.
Среди родов хлорококковых по разнообразию выделяется Scenedesmus (13 таксонов, или 26.5 %), остальные роды этого класса
представлены одним-четырьмя видами. В целом слабое развитие протококковых
водорослей в таежных озерах Республики Коми отмечал еще В.К. Чернов (1945) для
Озельских озер, в водоемах бассейна р. Печоры М.В. Гецен (1973) было выявлено
только девять видов. Причиной относительно низкого разнообразия этих водорослей
могут быть слабый прогрев воды, низкое содержание органических веществ, фосфора
и азота.
Роды порядков Volvocales и Tetrasporales представлены
единичными видами. Водоросли порядка Oedogoniales в основном были найдены в
стерильном состоянии, что затрудняло установление их видовой принадлежности. На
основании ярко выраженных морфологических отличий вегетативных клеток удалось
идентифицировать только Oedogonium
undulatum, остальные представители Oedogonium
и Bulbochaete были определены до
рода. Водоросли рода Oedogonium –
постоянный компонент водоемов исследованной территории, за исключением луж (в
озерах Параськино № 3 и 4 вероятно нахождение представителей рода при
дальнейших более подробных исследованиях перифитона). Эпифитные представители
класса Ulotrichophyceae были обнаружены почти во всех водоемах, кроме луж и одного
из карстовых озер. Пять родов представлены единичными видами.
Только в крупных карстовых озерах с умеренной
минерализацией и в сапропелевом оз. Пионерском на мелководье были обнаружены
обширные заросли видов из рода Chara.
Данные водоемы обладают всем спектром необходимых экологических условий для
развития харовых: илистое или песчаное с наилком дно, прозрачная, мягкая вода с
близкой к нейтральной кислотностью, относительно высоким содержанием кальция и
низкой концентрацией фосфора (Голлербах, Красавина, 1983). На территории
северо-востока европейской части России известны лишь отдельные популяции
харовых в озерах Большеземельской тундры, на Приполярном Урале, бассейне
верхней Вычегды, в тиманских реках Сойва и Печорская Пижма (Гецен, 1968;
Жакова, 1995; Патова и др., 2008), как правило, они приурочены к местам
близкого залегания или выходов горных пород, в озерах карстового и
термокарстового происхождения.
Таким образом, в водоемах среднего течения р. Ижмы,
расположенных на отрогах Тиманского кряжа, отдел Chlorophyta представлен
большим количеством видов, в том числе ограниченно распространенными и редкими
(например, Raphidocelis mucosa
(Korš.) Kom., Pleurotaenium
truncatum (Bréb.) Nag. var. farquharsonii
(Roy) W. et G.S. West и др.). Преобладание десмидиевых при относительно низком
разнообразии хлорококковых – обычное явление для северных водоемов. Большое
разнообразие и нередко высокое обилие индикаторов щелочных вод и кальцефилов (Chara cf. globularis Thulill., C. vulgaris L., Cosmarium humile (Gay) Nordst. in De Toni, Staurastrum pingue Teil.) - отличительная особенность выявленной
флоры водорослей бассейна р. Ижмы, как и Печорского бассейна в целом (Гецен,
1973).
Список литературы
Альгофлора озер и рек Карелии. Таксономический состав
и экология / С.Ф. Комулайнен, Т.А. Чекрыжева, И.Г. Вислянская. – Петрозаводск:
Карельский научный центр РАН, 2006. – 81 с.
Атлас Республики Коми. – М.: Изд-во «Дизайн. Информация.
Картография», 2001. – 552 с.
Водоросли. Справочник / Вассер С.П., Кондратьева Н.В.,
Масюк Н.П. и др. – Киев: Наук. думка, 1989. – 608 с.
Воронихин Н.Н. Опыт сравнительного
изучения микрофлоры озера Дон-ты (обл. Коми) и его отложений // Изв. сапропел.
комитета АН СССР, 1929. – Вып. 5. – С. 117-186.
Гецен М.В. Альгофлора водоемов в долине Средней Печоры
// Биология северных рек на древнеозерных низинах. – Сыктывкар, 1971. – С.
16-26. (Тр. Коми филиала АН СССР; № 22).
Гецен М.В. Водоросли бассейна Печоры: состав и
распространение. – Л.: Наука, 1973. – 147 с.
Гецен М.В. Водоросли в экосистемах крайнего Севера (на
примере Большеземельской тундры). – Л.: Наука, 1985. – 165 с.
Гецен М.В. О водной флоре притоков Печоры в области
Тимана // Ботан. журн., 1968. – Т. 53, № 7. – С. 967-970.
Гецен М.В. Особенности флоры восточной части
Большеземельской тундры. Водоросли // Флора и фауна водоемов Европейского
Севера: на примере озер Большеземельской тундры. – Л.: Наука, 1978. – С. 11-21.
Голлербах М.М., Красавина Л.К. Определитель
пресноводных водорослей СССР. Т 14. Харовые водоросли. – Л.: Наука, 1983. – 190
с.
Косинская Е.К. Флора споровых растений СССР. Т. V.
Конъюгаты, или сцеплянки (2). Десмидиевые водоросли. Вып. 1. – М.-Л.: Изд-во АН
СССР, 1960. – 708 с.
Михеева Т.М. Альгофлора Беларуси. Таксономический
каталог. – Минск: БГУ, 1999. – 396 с.
Патова Е.Н., Демина И.В. Водоросли других отделов //
Биоразнообразие экосистем Полярного Урала. – Сыктывкар, 2007. – С. 69-90.
Рундина Л.А. Зигнемовые водоросли России (Chlorophyta:
Zygnematophyceae, Zygnematales). – СПб.: Наука, 1998. – 356 с.
Селезнева Н.В. Сравнительный анализ альгофлоры
водоемов лесостепной зоны Русской равнины // Ботан. журн., 2007. – Т. 92, № 4.
– С. 457-468.
Снитько Л.В., Сергеева Р.М. Водоросли разнотипных
водоемов восточной части Южного Урала. – Миасс: ИГЗ УрО РАН, 2003. – 166 с.
Царенко П.М. Закономерности распределения
Chlorococcales региональных флор Земного шара // Альгология, 2000. – Т. 10, №
1. – С. 67-81.
Чернов В.К. Материалы по фитопланктону Озельских озер:
Рукопись. Фонды Коми филиала АН СССР. – Сыктывкар, 1945. – Ф. 86. Оп. 5, № 1.
Ярушина М.И. Водоросли // Биоресурсы водных экосистем
Полярного Урала. – Екатеринбург: УрО РАН, 2004. – С. 18-56.
Жакова Л. В. Tolypella
spicata (Nitellaceae) – новый для флоры России вид Charophyta // Ботан.
журн, 1995. – Т. 80, № 8. – С. 109-113.
Патова Е.Н., Стерлягова И.Н., Шабалина Ю.Н. Редкие
водоросли-макрофиты северо-востока европейской части России // Вестн. Тверского
государственного ун-та, 2008. – № 3. –
С. 105-112.
Цианопрокариоты хребта Монче-тундра
(Лапландский заповедник)
Шалыгин
С.С., Давыдов Д.А.
Cyanoprokaryota
of the Monche-Tundra
range
(the Lapland Reserve)
Shalygin S.S., Davydov D.A.
Полярно-альпийский
ботанический сад-институт Кольского НЦ РАН
г. Кировск, (81531) 527-42
e-mail: d_disa@mail.ru
Цианопрокариоты играют особую роль в сообществах
северных экосистем. Инвентаризация биологического разнообразия, особенно в
заповедниках, является одной из важнейших задач альгологии на современном этапе.
Лапландский государственный биосферный заповедник (ЛГБЗ) представляет собой
территорию, для которой, до настоящего времени, отсутствовали данные по
видовому составу цианопрокариот.
Хр. Монче-тундра расположен на восточной границе ЛГБЗ в
пределах широт с 68°02' по 67°49' и долгот с 32°24' по 32°48'. Работы
проводились в 2008 году маршрутным методом в северо-западной части хребта. Массив
сложен, в основном, протерозойскими габбро и габбро-норитами с редкими жилами
гранитов, на северной оконечности - ультраосновными периодитами,
габбро-норитами и пироксенитами (Геология СССР…, 1958). Склоны хребта скальные
или осыпные, вершинные части образованы скально-глыбовыми полями, реже -
вершинными останцами, наивысшая точка - г. Хипик (965 м над ур. м.). Климат
территории приморский субарктический, влажный, мягкий, с прохладным летом и
теплой зимой, но с сильными ветрами, ввиду нахождения территории в
Атлантико-Арктической зоне умеренного климата с избыточным переувлажнением
(Атлас..., 1970). Из-за изрезанности рельефа, толщина снегового покрова
колеблется от нулевой на обдуваемых вершинах до двух метровой толщины (Семенов-Тянь-Шанский,
1975). Растительность относится к полосе редкостойных лесов северотаежной
подзоны (Раменская, 1983). Выражена высотная поясность, представлены
горно-лесной (преимущественно еловые и сосновые ценозы) пояс, пояс березовых криволесий
и горно-тундровый пояс.
Всего нами было собрано 120 образцов, в которых
выявлено 34 таксона. Ниже приводится аннотированный список, в котором виды
расположены в алфавитном порядке, названия таксонов даются по системе J.
Komárek, K. Anagnostidis (1986, 1989, 1998, 2005; Anagnostidis,
Komárek, 1988, 1990). Новые для области виды отмечены звездочкой.
1. Aphanocapsa muscicola (Menegh.) Wille
- 67º54'58'' с.ш., 32º38'27'' в.д., 670 м над ур. моря, исток
притока р. Вите, скалистый каньон, осыпь, ручей, текущий по наклонной
поверхности, под нависающим камнем в потоке, в условиях высокой освещенности,
эпилит в воде; на вертикальной скале, на стыке двух вертикальных плоскостей, на
высоте 2 м
над подножием, эпилит. 67º56'22'' с.ш., 32º37'52'' в.д., 760 м над ур. моря, ручей,
приток р. Вите третьего уровня, в мелком водопаде, эпилит на вертикальной
поверхности, в воде; в русле ручья, эпилит на вертикальной влажной поверхности,
в условиях высокой освещенности; эпилит на вертикальной поверхности между двумя
водопадами. 67º57'47'' с.ш., 32º32'57'' в.д., 965 м над ур. моря, вершина
г. Хипик, в щели на дальней нижней горизонтальной поверхности, в условиях
среднего освещения.
2. Aphanocapsa parietina Näg. - 67º56'22'' с.ш., 32º37'52'' в.д., 760 м над ур. моря, ручей,
приток р. Вите третьего уровня, скалистый берег озера, эпилит на наклонной
поверхности, в условиях высокой освещенности. 67º55'51'' с.ш., 32º34'59''
в.д., 450 м
над ур. моря, левый борт долины р. Вите, ручей стекающий с осыпи, замшелый камень
в русле (выс. 10 см),
эпилит на вертикальной поверхности под куртиной мха, в условиях низкой
освещенности; эпилит на глыбе на дне ручья в березовом криволесье; эпилит на
вертикальной поверхности камня, лежащего в русле ручья на глубине 10 см, под куртиной мха, в
условиях низкой освещенности.
3. *Aphanocapsa testacea Näg. - 67º55'05'' с.ш., 32º37'37'' в.д. 570 м над ур. моря, скалы на
левом борту притока р. Вите, эпилит на вертикальной поверхности скалы, рядом с
мохообразными. 67º55'51'' с.ш., 32º34'59'' в.д., 450 м. над ур. моря, левый
борт притока р. Вите, ручей стекающий с осыпи, его правый берег ручья, замшелый
камень (40 см
выс.), вертикальная поверхность обращенная к потоку, эпифит на куртине мха. 67º55'51''
с.ш., 32º34'59'' в.д. 450
м над ур. моря, левый борт долины р. Вите, ручей
стекающий с осыпи, замшелый камень в русле (выс. 10 см), эпилит на вертикальной
поверхности под куртиной мха, в условиях низкой освещенности. 67º55'24'' с.ш.,
32º33'19'' в.д., 250 м
над ур. моря, долина р. Вите, горно-лесной пояс, лужа (размером 1 м на 75 см, глубина 50 см, дно завалено опавшими
листьями) в русле пересохшего ручья в 2 м от берега р., на дне лужи.
4. Aphanothece saxicola Näg.
- 67º56'22'' с.ш., 32º37'52''
в.д. 760 м
над ур. моря, исток притока р. Вите третьего уровня, эпилит на вертикальной
грани камня (10 см
шир.и дл., 3 см
выс.) в зоне брызг водопада (менее 50 см выс.). 67º54'58'' с.ш., 32º 38'
27'' в.д. 670 м.
над ур. моря, исток притока р. Вите, скалистый каньон, осыпь, ручей, текущий по
наклонной поверхности, под нависающим камнем в потоке, в условиях высокой
освещенности.
5. Chroococcus cohaerens (Bréb.) Näg. -
67º54'58'' с.ш., 32º38'27'' в.д., 670 м. над ур. моря, исток
притока р. Вите, скалистый каньон, осыпь, скала с поперечной щелью (глубина
щели 1м), эпилит на мокрой вертикальной поверхности над козырьком, в условиях
высокой освещенности.
6. *Chroococcus
helveticus Näg. - Там же.
7. *Chroococcus montanus Hansg. -
67º58'33'' с.ш., 32º30'54'' в.д. 760 м над ур. моря, каньон между
двумя вершинами, скалы N-W экспозиции,
эпилит на нависающей мокрой скале (1
м выс.), в условиях высокой освещенности.
8. Cyanothece aeruginosa (Näg.) Kom.
- 67º58'33'' с.ш., 32º30'54''
в.д., 760 м
над ур. моря, каньон между двумя вершинами, скалы N-W экспозиции, вертикальная скала (3 м выс.), эпилит на высоте 2 м, терраса (1 м дл., 30 см шир.), горизонтальная
поверхность, эпифит на куртине мха. 67º57'47'' с.ш., 32º32'57'' в.д.,
965 м
над ур. моря, вершина г. Хипик, отдельно лежащая глыба, эпифит среди мхов, в
условиях низкого освещения. 67º54'58'' с.ш., 32º38'27'' в.д., 670 м над ур. моря, исток
притока р. Вите, скалистый каньон, осыпь, скала с поперечной щелью (глубина
щели 1м), эпилит на верхней части мокрой вертикальной поверхности над
козырьком, в условиях высокой освещенности. 67º55'51'' с.ш., 32º34'59''
в.д., 450 м
над ур. моря, левый борт долины р. Вите, ручей стекающий с осыпи, пересыхающая
лужа около притока ручья, эпилит рядом с куртиной мха, в условиях высокой
освещенности.
9. Cyanothece major (Schröt.) Kom. - 67º55'42'' с.ш., 32º39'28'' в.д., 841 м над ур. моря, вершина
горы, горная тундра, вершинный останец, скала S экспозиции, эпилит в щели в стене (4 см).
10. Dichothrix gipsophila (Kütz.) Born.
et Flah. - Эпилит
на влажных скалах, различных экспозиций, во многих местах.
11. Gloeocapsa atrata Kütz. - 67º55'51''
с.ш., 32º34'59'' в.д., 450
м над ур. моря, левый борт долины р. Вите, правый берег ручья
стекающего с осыпи, замшелый камень (40 см выс.) вертикальная поверхность обращенная
к потоку, эпифит на мхах.
12. *Gloeocapsa caldariorum Rabenh. - с.ш.,
32º38'27'' в.д., 670 м
над ур. моря, исток притока р. Вите, скалистый каньон, осыпь, скала с
поперечной щелью (глубина щели 1м), эпилит на вертикальной поверхности, в
условиях средней освещенности.
13. Gloeocapsa compacta Kütz. - 67º58'33''
с.ш., 32º30'54'' в.д., 760
м над ур. моря, каньон между двумя вершинами, скалы N-W экспозиции, эпилит на нависающей влажной скале (1 м высотой), в условиях
высокой освещенности. 67º56'22'' с.ш., 32º37'52'' в.д., 760 м над ур. моря, исток
притока р. Вите третьего уровня, берег ручья, эпилит на вертикальной
поверхности.
14. *Gloeocapsa decorticans (A.
Br.) Richt.
- 67º55'42'' с.ш.,
32º39'28'' в.д., 841 м
над ур. моря, горно-лесной пояс, долина р. Вите, борт долины, эпифит на куртине
мха на берегу р. в 5 см
от воды. 67º55'51'' с.ш., 32º34'59'' в.д., 450 м над ур. моря, левый
борт долины р. Вите, русло ручья эпифит на мхах, растущих на дне (глубина 5 см), в условиях хорошей
освещенности.
15. Gloeocapsa kuetzingiana Näg. - 67º54'58''
с.ш., 32º38'27'' в.д., 670
м над ур. моря, исток притока р. Вите, скалистый каньон,
осыпь, скала с поперечной щелью (глубина щели 1м), эпилит на верхней части мокрой
вертикальной поверхности над козырьком, в условиях высокой освещенности. 67º56'22''
с.ш., 32º37'52'' в.д., 760
м над ур. моря, исток притока р. Вите третьего уровня,
эпилит на скалистом дне лужи, а также между двумя водопадами на вертикальной
поверхности.
16. Gloeocapsa rupicola Kütz. - 67º54'58''
с.ш., 32º38'27'' в.д., 670
м над ур. моря, исток притока р. Вите, скалистый каньон,
осыпь, вертикальная мокрая скала (4
м на 4 м),
эпилит на поверхности между медленнотекущими потоками, в условиях высокой
освещенности.
17. Gloeocapsopsis magma (Bréb.) Kom. et Anagn.
- Эпифит на мхах и эпилит в различных
местообитаниях, во многих местах.
18. Jaaginema pseudogeminatum (Schmid) Anagn. et Kom. -
67º58'33'' с.ш., 32º30'54'' в.д., 760 м над ур. моря, каньон
между двумя вершинами, скалы N-W экспозиции, наклонная поверхность глыбы, эпилит на вертикальной
плоскости, в условиях высокой освещенности.
19. Leptolyngbya
foveolarum (Mont. ex Gom.) Anagn.
et Kom. - 67º56'15'' с.ш., 32º37'30'' в.д., 730 м над ур. моря, глыба в
русле ручья, выступающая над водой наклонная поверхность, в условиях высокой
освещенности.
20. Merismopedia
glauca (Ehrenb.) Kütz. - 67º55'24''
с.ш., 32º33'19'' в.д., 250
м над ур. моря, долина р. Вите, горно-лесной пояс, лужа
(размером 1 м
на 75 см,
глубина 50 см,
дно завалено опавшими листьями) в русле пересохшего ручья в 2 м от берега реки, на дне
лужи, в слизи др. цианей.
21. Nostoc commune Vauch. ex Born. et Flah. -
67º55'51'' с.ш., 32º34'57'' в.д. 450 м над ур. моря, левый
борт притока р. Вите, ручей стекающий с осыпи, в поясе берёзовых криволесий,
пересыхающая лужа около притока ручья, эпифит на мхах, в условиях высокой
освещенности. 67º55'05'' с.ш., 32º37'37'' в.д., 570 м над ур. моря, скалы на
левом борту притока р. Вите, эпилит на вертикальной поверхности скалы, рядом с
мохообразными.
22. *Phormidium interruptum Kütz. ex
Gom. - 67º56'15'' с.ш., 32º37'30'' в.д., 730 м над ур. моря, глыба в
русле ручья, выступающая над водой наклонная поверхность, в условиях высокой
освещенности.
23. Phormidium kuetzingianum (Kirchn.) Anagn. et Kom. - 67º58'33''
с.ш., 32º30'54'' в.д., 760
м над ур. моря, каньон между двумя вершинами, скалы N-W экспозиции, полость в скале, эпилит на вертикальной
поверхности, в условиях средней освещенности. 67º56'22'' с.ш., 32º37'52''
в.д., 760 м
над ур. моря, исток притока р. Вите третьего уровня, эпилит на гальке в озерке
под водопадом.
24. *Phormidium lividum Näg. ex Gom. -
67º58'33'' с.ш., 32º30'54'' в.д., 760 м над ур. моря, каньон между
двумя вершинами, скалы N-W экспозиции,
полость в скале, эпилит на вертикальной поверхности, в условиях средней освещенности.
67º56'15'' с.ш., 32º37'30'' в.д., 730 м над ур. моря, ручей на
плоской наклонной плите с уклоном 5º, эпилит на камне в русле ручья, в
условиях высокой освещенности. 67º54'58'' с.ш., 32º38'27'' в.д., 670 м над ур. моря, исток
притока р. Вите, скалистый каньон, осыпь, под нависающим камнем в воде в
условиях высокой освещенности.
25. Porphyrosiphon sp. - 67º56'22''
с.ш., 32º37'52'' в.д., 760
м над ур. моря, исток притока р. Вите третьего уровня,
эпифит на мхах, растущих в водопаде.
26. Scytonema mirabile (Dillw.)
Born. - Эпифит
на мхах и эпилит в различных местообитаниях, во многих местах.
27. *Stigonema hormoides Kütz. ex Born.
et Flah. - Эпифит на мхах и эпилит в различных местообитаниях, во многих
местах.
28. Stigonema informe Kütz. ex Born. et Flah. -
67º58'33''с.ш., 32º30'54'' в.д., 760 м над ур. моря, каньон
между двумя вершинами, скалы N-W экспозиции, вертикальная скала (3 м высотой), на высоте 2 м , терраса (1 м дл., 30 см шир.), эпилит на горизонтальной
поверхности около куртины мха.
29. Stigonema mamillosum (Lyngb.) Ag. ex Born. et Flah. -
67º55'24'' с.ш., 32º33'19'' в.д., 250 м над ур. моря,
горно-лесной пояс, долина р. Вите, борт долины, эпилит на горизонтальной
плоскости камня в русле р., на глубине 3 см.
30. Stigonema ocellatum (Dillw.)
Thur. ex Born. et Flah. - Эпифит
на мхах и эпилит в различных местообитаниях, во многих местах.
31. Symplocastrum
muelleri (Näg. ex Gom.) Anagn. - Эпилит в
различных местообитаниях, во многих местах.
32. Synechococcus cf. elongatus (Näg.) Näg. - Верховья
ручья - правого притока р. Сейтер-вуомь, мелкозем на месте стаявшего снежника,
эпифит на печеночниках.
33. Synechocystis cf. aquatilis Sauv. - 67º57'47'' с.ш., 32º32'57'' в.д., 965 м над ур. моря, вершина
горы Хипик, замшелая глыба, эпилит на горизонтальной поверхности. 67º56'22''
с.ш., 32º37'52'' в.д., 760
м над ур. моря, исток притока р. Вите третьего уровня,
под нависающей влажной поверхностью глыбы, эпилит на камне, в условиях средней
освещенности.
34. Tolypothrix distorta (Fl. Dan.)
Kütz. - 67º55'51'' с.ш., 32º34'57'' в.д., 450 м над ур. моря, левый
борт притока р. Вите, ручей стекающий с осыпи, в поясе берёзовых криволесий,
эпифит на мохообразных, растущих на глыбе в русле ручья над водой.
Таким образом, обследование хр. Монче-тундра позволило
выявить 8 ранее не известных для территории Мурманской области видов. Сравнение
биоты данного горного массива с биотами других районов представляется нам
преждевременным, так как видовой состав Монче-тундры выявлен не полностью.
Работа выполнена при поддержке гранта РФФИ
№07-04-00443-а.
Почвенные водоросли лиственных лесов
Южно-Уральского заповедника
Шмелёв Н.А.
Soil algae of
leafy woods of the South-Urals reserve
Shmelev N.A.
Бирская
государственная социально-педагогическая академия,
республика
Башкортостан, г. Бирск, ул. Интернациональная, 10, тел. (34784) 31301
е-mail: reptil11@yandex.ru
Почвенные водоросли входят в состав экосистем в виде
альгоценозов – водорослевых группировок, пространственно и экологически
обособленных от других частей экосистемы. Наряду с почвенными условиями, высшие
растения являются важнейшим природным фактором, оказывающим влияние на состав
альгоценозов, при этом имеет значение как прямое воздействие на водоросли в зоне
ризосферы, так и средообразующая роль высших растений.
Нами исследовались типичные для Южного Урала
лиственные леса: липняк снытевый, кленовник широкотравный, березняк
широкотравный, осинник снытевый, осинник широкотравный. На каждом участке было
отобрано по 10 почвенных проб классическими альгологическими методами
(Голлербах, Штина, 1969). Для культивирования водорослей использовали метод
чашечных культур со стеклами обрастания (Lund, 1945), степень развития (ИПР) выражали в баллах
обилия (Кабиров и др., 1999). Для характеристики участия вида в альгоценозе
использовали коэффициент эколого-ценотической значимости (ЭЦЗ) (Кабиров,
Шилова, 1990).
В исследованных
нами лиственных лесах было выявлено 140 видов почвенных водорослей и
цианопрокариот, при этом доля цианопрокариот составила – 9,28%, зелёных
водорослей – 62,85%, хризофитовых – 12,14%, диатомовых – 15,7%. Общая формула
видового состава: Cyan13Chlor88Chrys17Bac22(140).
Цианопрокариоты были представлены одним классом, двумя порядками и тремя
семействами (наиболее представлено семейство Oscillatoriaceae), зелёные водоросли – пятью классами, восемью
порядками и двенадцатью семействами (наиболее многочисленны по числу видов – Chlamydomonadaceae
и Chlorococcaceae). Хризофитовые включали один класс, два порядка и
пять семейств (по видовому разнообразию лидировали виды Pleurochloridaceae).
Диатомовые были представлены одним классом, одним порядком, пятью семействами
(лидировали по видовому разнообразию представители Naviculaceae). Общий ИПР для почвенных водорослей и цианопрокариот
исследованных лиственных лесов – 3316 баллов, при этом доля цианопрокариот
составляла 0,75%, зелёных водорослей – 61,85%, хризофитовых – 10,16%,
диатомовых – 27,24%. В комплекс доминиирующих видов входили: Bracteacoccus
minor, Chlamydomonas gloeogama, Dictyococcus variams, Nitzschia palea,
Klebsormidium flaccidum, Dispora crucigenoides, Pinnularia borealis, Hantzschia
amphioxys, Vischeria helvatica, Pleurochloris commutata, Navicula pelliculesa,
Tetracystis intermedia, Tetracystis diploponticoidea, Tetracystis
isobilateralis. Ведущими семействами являлись: Chlamydomonadaceae,
Chlorococcaceae, Myrmeciaceae, Chlorellaceae, Klebsormidiaceae,
Pleurochloridaceae, Naviculaceae, Oscillatoriaceae. Выявлено 9 жизненных
форм водорослей и цианопрокариот. Общая формула жизненных форм: X20C19Ch16B14H14
hydr.12amph.9P7Cf6. Виды с высоким
значением ЭЦЗ (0,2 и выше): Bracteacoccus minor, Dictyococcus variams,
Chlorella minutissima, Navicula pelliculesa, Pinnularia borealis, Hantzschia
amphioxys, Nitzschia palea, Klebsormidium flaccidum.
Проведенные
исследования в целом показали
относительно высокое разнообразие видового состава почвенных водорослей и
цианопрокариот исследованных лесов, лидерство зеленых водорослей по видовому
составу и по степени развития, также значительное (для лесных экосистем)
видовое разнообразие и обилие диатомовых водорослей. Комплекс доминант
составляли виды зеленых водорослей, а также диатомовых и хризофитовых, в группу
видов с высоким значением ЭЦЗ входили виды зеленых и диатомовых водорослей.
Ведущие семейства относятся в основном к зеленым водорослям, но представлены и
семейства хризофитовых, диатомовых и цианопрокариот.
К ИЗУЧЕНИЮ ВОДОрослей ГАЛИННОГО ВОДОЕМА ОХРИМОВСКОГО ПОДА
Яровая Т.А., Гузий
О.В., Олейник А.И.
Study of saline water body algae in the Okhrymovsky bay
Yarovaya T.A., Guzi O.V., Olejnik A.I.
Мелитопольский государственный педагогический университет им.
Б.Хмельницкого,
Украина, Мелитополь, ул. Ленина, 20
Побережье Азовского моря благодаря определенным
климатическим условиям и равнинному рельефу и нестабильному гидрологическому
режиму, имеет большое количество галинных водоемов с разным составом солей и
степенью засоленности, которые характеризуются довольно специфической
альгофлорой.
Водоем Охримовского пода является галинным, пролегающий с севера на юг. Во время отбора
проб он имел длину 120 м,
ширину 40 м.
Водоем мелководный, глубина - до 20 см. Вода прозрачная до
дна, сероватого оттенка, температура 12ºС, активная реакция воды
кисловатая (рн=6,28), соленость воды - 56,91 г/л. Дно покрыто макроскопическим
цветением пробкового и войлокоподобного типа, под которым наблюдается черный
маслянистый ил, местами светло-серый в поверхностном пласте, который имеет
запах сероводорода.
Материалами исследований послужили водные пробы из
всего водного пласта (разделения на бентос и планктон не проводили, так как
водоем очень мелководный) и отбор макроскопических разрастаний дна водоема и
его пересохшей части. Пробы отбирались в
ноябре 2007 года по общепринятой методике.
Обнаружено 15 видов водорослей принадлежащих 3 отделам,
14 классам, 9 семействам и 13 родам. Cyanophyta - 8 видов, Chlorophyta - 6,
Bacіllarіophyta - 3. По данным Л.П. Приходьковой и Н.С. Водопьяна в ряде соленых
водоемов преобладают синезеленые водоросли [1, 4]. В пересоленных водоемах чаще
всего доминируют по количеству видов диатомовые водоросли. Водоем Охримовского
пода по степени засоленности относится к пересоленным (от 50,25 до 378,44 г/л),
но структура альгофлоры близкая к альгофлоре соленых водоемов со степенью
минерализации от 16,85 до 46,57 г/л [2, 3, 5].
Доминирующим является порядок Oscіllatorіales, который
представлен 5 видами. Подобные результаты при изучении синезеленых водорослей определил и Н.С. Водопьян
при исследовании минерализованных водоемов Крыма [1]. Почти две трети синезеленых
водорослей автор отнес к классу Hormogonіophyceae, в котором наиболее разнообразно представлен порядок
Oscіllatorіales.
Ведущим семейством водоема Охримовского пода является
семейство Phormіdіaceae (3 вида). В
равной степени представленные роды Phormіdіum, Chlorella, Stіchococcus - по
2 вида.
Степень встречаемости видов азотфиксирующих синезеленых
водорослей: Nostoc punctіforme, Anabaena thermalіs f. varіabіlіs, - в водоеме Охримовского пода невысокая, что
совпадает с данными Л.П. Приходьковой, которые были получены при исследовании
эфемерных водоемов [4]. Степень встречаемости этой группы водорослей автор
связывает с разной степенью минерализации исследованных водоемов.
Макроскопические разрастания на дне водоема образованы
Cladophora с участием диатомовых водорослей. Разрастания пленочного
и пробкового типа, толщиной до 1
см.
Дальнейшие исследования зависимости развития
водорослей от степени минерализации воды дадут возможность распространить
список видов водорослей засоленных водоемов побережья Азовского моря и выделить
комплекс видов-индикаторов солености воды.
Список литературы
1. Водопьян Н.С.
Водоросли минерализованных водоемов Юга Украны и взаиоотношения главнейших
ультрагалинных видов в культуре. Автореферат… канд. биол. наук. АН УССР. Ин-т ботаники. К., 1971.
19с.
2. Герасименко Л.М.,
Венецкая С.Л., Дубинин А.В., ОрлеанскийВ.К., Заваарзин Г.А. Альгобактериальные
сообщества гиперсоленых лагун Сиваша (Крым) // Альгология. 1992. 2, №2. С. 88-94.
3. Дексбах Н.К. Дно Коссинских озер как среда и его
обитатели// Труды Косинской биологической станции. 1925.
4. Приходькова Л.П. Синезеленые водоросли Степной зоны
Украины. К.:, Наукова думка, 1972. 218с.
5. Прошкина-Лавренко А.И. Гидробиологическое
районирование Сиваша на основании изучения его альгофлоры. // Труды конф. по
проблеме Сиваша, 1938. К.: Изд-во АН УССР, 1940. С. 121-129.
ВОДОРОСЛИ ПРИМОРСКИХ СОЛОНЧАКОВ Полуострова ЧОНГАР (СИВАШ)
Яровой С.А., Солоненко А.Н.
Algae of
the coastal salt-marshes
Chongar peninsula
(Sivash)
Yarovoy
S.A., Solonenko A.N.
Мелитопольский
государственный педагогический университет им. Богдана Хмельницкого
г. Мелитополь
72312, ул. Ленина 20. тел. 6-90-91
е-mail:
Dilabif@ukr.net
Полуостров Чонгар
является крайним южным участком материковой части Украины, длиной до 26 км, и шириной от 2 до 14 км.
Территория полуострова расположена в акватории озера Сиваш и имеет равнинный
характер с незначительными изменениями микро- и нанорельефа, отдельными неглубокими
балками и степными блюдцами (Барабоха, Маценко, 2004).
Характерной
особенностью этой территории является наличие мокрых солончаков с разреженной
галофильной растительностью: Salicornia europaea (L.) Suaeda altissima (L.) Pall., Salsola soda L., Halocnemium
strobilaceum (Pall.) Bieb., Limonium
vulgare P. Mill (Добрачаев и др., 1987).
В альгологическом
отношении солончаки полуострова Чонгар являются неизученными.
В результате
исследования на приморских солончаках п-ва Чонгар было выявлено 17 видов водорослей
из 3-х отделов: Chlorophyta – 8 видов (47,5% от общего количества найденных
видов), Cyanophyta – 7
(41,2%), Bacillariophyta –
2 (11,3%). Обнаруженные виды водорослей относились к 8 порядкам, 11 семействам,
12 родам. Наиболее разнообразно в видовом отношении в исследуемых солончаках
были представлены семейства Phormidiaceae (5 видов), Stichococcaceae
(3 вида) и рода Phormidium (4 вида), Stichococcus (3 вида).
При концентрации солей
в почве 145-170 г/л и pH – 8,0 сине-зеленые водоросли Рhormidium paulsenianum Boye-Petersen f. takyricum, Microcoleus
chthonoplastes Thuret ex Gomont., Lyngbya
semiplena J. Agardh ex Gomont., зеленые: Chlorella minutissima Fott et Nováková., Pseudendoclonium sp. Wille и диатомовая
водоросль Hantzschia amphioxys (Ehr.)
Grun. in Cl. et Grun. встречались наиболее часто и были выявлены в 85 %
исследованных образцах почвы. Достаточно часто (57% в исследованных образцах
почвы) встречались такие виды водорослей, как Phormidium subfuscum Kützing ex Gomont 1892, Leptolyngbya valderiana (Gomont) Anagnostidis et Komárek 1988, Leptolyngbya
tenuis (Gomont) Anagnostidis et Komárek 1988,
Diplosphaera chodatii Bialosuknia emend. Visher 1960, Stichococcus bacillaris Nägeli 1849, Amphora veneta Kützing 1844. Другие
виды водорослей были отмечены реже.
Анализ распространения выявленных видов водорослей в разных
физико-географических зонах Украины (Костиков и др., 2001; Мальцева, 2004;
Солоненко, Яровой, Разнополов, 2004; Солоненко и др., 2005; Яровой и др., 2008; Солоненко, Яровой, 2008;
Виноградова, Дариенко, 2008;) свидетельствует о том, что среди найденных видов водорослей в
солончаках п-ва Чонгар есть виды, которые встречаются преимущественно на солончаках
и иногда в незасоленных почвах, виды с более широкой экологической амплитудой встречаемости
(основным местом нахождения для которых являются незасоленные почвы, но нередко
и солончаки) и заносные виды, которые тяготеют только к незасоленным почвам.
К первой группе видов
водорослей относятся: Leptolyngbya tenuis – 16
находок на солончаках, 1 – в незасоленных почвах, Microcoleus chthonoplastes
– 18 находок на солончаках, 6 – в незасоленных почвах, Lyngbya semiplena
– 9 находок на солончаках, 1 – в незасоленных почвах, Pseudendoclonium sp. – 6 находок на
солончаках.
Ко второй группе видов
водорослей принадлежат: Leptolyngbya valderiana –18 находок в незасоленных почвах, 11 – на
солончаках, Рhormidium paulsenianum f. takyricum – 17 находок в незасоленных почвах, 4 – на
солончаках, Phormidium subfuscum – 11 находок в незасоленных почвах,
2 – на солончаках, Diplosphaera chodatii – 6 находок в незасоленных
почвах, 2 – на солончаках, Chlorella minutissima –124 находки в
незасоленных почвах, 10 – на солончаках, Stichococcus bacillaris – 88 находок
в незасоленных почвах, 9 – на солончаках, Planophila bipyrenoidosa Reisigl 1964 – 2 находки в незасоленных почвах, 1 – на
солончаках, Klebsormidium flaccidum (Kützing)
Silva et al.
1972 – 427 в незасоленных почвах,
5 – на солончаках, Hantzschia amphioxys – 319 в незасоленных почвах, 10
– на солончаках.
В третью группу вошли
следующие виды водоросли: Phormidium
favosum Gomont ex Gomont 1892 – 3 находки в незасоленных почвах, Stichococcus minutus Grintzesco
et Péterfi S. 1932 – 18 находок в незасоленных почвах, Stichococcus
chlorelloides Grintzesco et Péterfi S. 1932 – 2 находки в незасоленных почвах, Amphora veneta –
1 находка в незасоленных почвах, 2 – на солончаках, но этот вид относится к
заносным, поскольку в известных нам литературных источниках (Топачевский О.В.,
Оксиюк О.П., 1960), он классифицируется как гидрофильный вид пресных и
солоноватых водоемов, встречающийся в ставках Харьковской области и притоках
рек: Южный Буг, Самара, Северский Донец, Молочная.
Основу видового
состава, а именно 52% (от общего количества найденных видов водорослей данной
территории) представляют эвритопные виды. По 24% приходится на две группы
водорослей: виды водорослей, для которых основным местом обитания являются
засоленные почвы, и виды водорослей которые встречаются только на незасоленных
территориях.
Проведенные
исследования пополнили сведения о видовом составе водорослей засоленных почв территории
Украины в целом. Полученные данные свидетельствуют о необходимости дальнейшего
изучения водорослей этой территории.
Список литературы
Барабоха Н.М., Маценко А.Л. Топонімічний словник-довідник України / Мелітополь: ТОВ «Вид-во
Мелітополь», 2004. – 92 с.
Виноградова О.Н., Дариенко Т.М. Водоросли
Азово-Сивашского национального природного парка (Украина) // Альгология. – 2008, Т. 18. – №2.
– С. 183 – 197.
Голлербах М.М., Штина Э.А. Почвенные водоросли. – Л.:
Наука, 1969. – 228 с.
Добрачаев Д.Н., Котов М.И.,
Прокудин Ю.Н. и др. / Определитель высших
растений Украины. – Київ: Наук. думка, 1987. – 548 с.
Костіков І.Ю., Романенко П.О., Демченко
Е.М., Дарієнко Т.М., Михайлюк Т.І., Рибчинський О.В., Солоненко А.М. Водорості ґрунтів України
(історія та методи дослідження, система, конспект флори). – Київ:
Фітосоціоцентр. 2001. – 300 с.
Мальцева И.А. Водоросли почв Приазовья (Запорожская обл., Украина) //
Альгология. – 2004. – Т. 14. - №3. – С. 246 – 253.
Солоненко А.Н., Яровой С.А.,
Разнополов О.Н. Почвенные водоросли
солончаков побережья Молочного лимана в районе алтагирского лесничества //
Вісник Запорізького національного університету. – 2004. – Вип.1. – С. 206 –
212.
Солоненко А.Н., Яровой С.А., Разнополов О.Н.,
Подорожный С.Н. Водоросли солончаков побережья залива Сиваш // Вісник
Запорізького національного університету. – 2005. – Вип.1. – С. 163 – 167.
Солоненко А.Н.,
Яровой С.А., Подорожный С.Н., Разнополов О.Н. Водоросли солончаков Степановской
и Федотовой кос Северо-Западного побережья Азовского моря // Ґрунтознавство. –
Дніпропетровськ: ДДУ - 2006. – Т. 7. – №3-4. – С. 123 – 127.
Солоненко А.Н., Яровой С.А., Водоросли солончаков
устьевой части реки Корсак и урочища Тубальский лиман // Бюллетень
государственного Никитского ботанического сада. – 2008. – Вып. 96. – С. 26 –
29.
Топачевский О.В., Оксіюк О.П. Датомові водорості – Bacillariophyta (Diatomeae) / Визначник прісноводних
водоростей Української РСР. – Вип. ХІ. – Київ: Вид-во АН УРСР, 1960. – 412 с.
Яровой С.А., Яровая Т.А., Солоненко А.Н. К изучению
водорослей солончаков Бердянской косы в районе озера Красное // Екологія та ноосферологія.
– 2008. – Т. 19. – № 1-2. – С. 160 – 162.
К истории изучения диатомовых водорослей
Ильменского заповедника (Южный Урал)
Ярушина М.И.1,
Исакова Н.А.2
To the history of the
Ilmensky reserve diatoms study
(South Ural)
Yarushina M.I.1, Isakova N.A.2
1Институт
экологии растений и животных УрО РАН
Екатеринбург, ул.
8 Марта, 202, тел. 8 (343) 210-38-58, факс 8 (343) 260-82-56
e-mail: nvl@ipae.uran.ru
2ПНИГУ
«Ильменский государственный заповедник им. В.И. Ленина УрО РАН»
тел. 8 (3513)
59-18-48, факс 8 (3513) 270-39-70
e-mail: savel@ilmeny.ac.ru
Диатомовые водоросли могут служить индикаторами уровня
и характера антропогенной нагрузки на водоемы. При этом одним из перспективных
подходов является детальное исследование диатомовых комплексов в поверхностных
горизонтах донных отложений озер (Stockner et al., 1967; Давыдова и др., 1979; Давыдова и др., 1987;
Разумовский, 2004; Долгоносов и др., 2006 и др.). Такой ретроспективный анализ
позволяет сопоставить современную лимнологическую обстановку с предшествующей и
способствует лучшему пониманию закономерностей формирования и развития континентальных
водоемов. В связи с этим в 2008
г. начаты работы по изучению диатомовых водорослей и их
комплексов в верхнем горизонте донных отложений озер Ильменского заповедника.
Настоящая работа на данном этапе имела своей целью восполнить и обобщить
сведения о современных и ископаемых диатомовых водорослях в историческом
аспекте.
Имеющиеся работы, в которых упоминаются диатомеи
исследуемой территории, большей частью можно отнести к гидробиологическим и
палеолимнологическим, ряд публикаций – к флористическим. Они охватывают период
около 80 лет.
Комплексные гидробиологические исследования на
водоемах Ильменского заповедника начали проводиться в 1928-29 гг. и
продолжаются в настоящее время. К ним можно отнести опубликованные и рукописные
работы ЦНИИРХ 1928-29 гг., УралВНИИОРХ 1936-37 гг., Н.Н. Липиной, А.О. Таусон,
С.К. Осипова, Н.В. Бондаренко, Г.И. Летанской, С.Г. Захарова, Л.В. Снитько
(Справочник по водным …, 1936; Осипов, 1936-38; Бондаренко, 1938; Таусон, 1940;
Подлесный, Троицкая, 1941; Летанская, 1978; Летопись природы …, 1996; Снитько,
2000; Снитько, Рогозин, 2000 и др.). Необходимо отметить, что одной из первых
работ, внесшей значительный вклад в изучение как всех систематических групп
водорослей, так и диатомовых, является архивный отчет А.О. Таусон 1940 г. «Гидробиология Ильменских
озер и их рыбохозяйственная оценка». В нем приводится список из 123 таксонов
диатомовых водорослей (планктонных, обрастателей и бентосных форм), отмеченных
в 16 водоемах Ильменской группы, из которых 119 таксонов встречается в 10
озерах заповедника.
К группе публикаций с палеолимнологической тематикой
относится работа А.П. Жузе (1939), в которой приводятся этапы формирования озер
Ильменской группы в послеледниковое время. Для всех ильменских водоемов выявлен
солоноводный диатомовый комплекс: Anomoeoneis polygramma, A. sculpta
и Campylodiscus clypeus (здесь и далее видовые названия диатомовых водорослей
даются по первоисточнику), указывающий на фазу осолонения в начале дриасового
периода (DR3). Изучению сапропелей и донных отложений озер
Ильменской группы также посвящен ряд работ А.И. Прошкиной-Лавренко (1945), Н.В.
Кордэ (1949), В.С. Шешуковой-Порецкой (1955). В них упоминаются диатомовые
водоросли как индикаторы экологических условий этапов формирования и развития
озер. В 1972-73 гг. экспедицией Института озероведения АН СССР изучались
диатомовые комплексы в донных отложениях уральских озер, из которых Большой
Кисегач (его западное побережье) находится на территории заповедника (Давыдова,
1978; Драбкова и др., 1981). Установлено, что фаза осолонения сопровождалась
снижением уровня озера и повышением минерализации в мелководных заливах озера в
период похолодания и иссушения климата (DR3). С
целью выяснения влияния процесса эвтрофирования Л.Ю. Чагина (1981) изучает на
оз. Б. Кисегач эколого-систематический состав диатомовых водорослей в
поверхностных отложениях донных отложений. Выделено два характерных комплекса
диатомей. В первом комплексе, распространенном в северо-западной и центральной
части озера, доминируют планктонные формы: Cyclotella bodanica, C. comta, C. ocellata, Fragilaria crotonensis,
Stephanodiscus astraea. Второй комплекс состоит исключительно из видов рода Fragilaria: F. brevistriata, F. construens, F. construens var. binodis et var. venter, F. lapponica, F. pinnata. В этом комплексе массово развиваются обрастатели и
донные формы. Он характерен для заливов, сильно заросших макрофитами. Некоторое
отличие в нем наблюдается у южной протоки водоема, где впадают воды из оз.
Малый Теренкуль. Здесь встречаются Synedra parasitica, Navicula cincta, N. cryptocephala, N. exigua и др. виды, предпочитающие воды β-мезосапробного
типа. Всего в поверхностных донных отложениях оз. Б. Кисегач Л.Ю. Чагина
обнаружила 216 видов и разновидностей диатомей. К сожалению, в работах Н.Н. Давыдовой
(1978) и Л.Ю. Чагиной (1981) приводится только количественная оценка видового
разнообразия диатомей с примерами их доминирующих комплексов и отсутствует
обобщающий список видов.
К публикациям флористического характера принадлежат
две монографические обработки материалов по исследованию флоры водорослей Ю.
Урала, в которых для отдела Bacillariophyta
за основу принята система Раунда с соавторами (Raund et al., 1990). В этих работах для региона приводится от 260
(Снитько, 2003) до 496 (Ярушина и др. 2004) видов и разновидностей диатомей,
соответственно для Ильменского заповедника – 146 и 197.
Взяв за основу наиболее полную региональную сводку с
учетом вышеизложенных материалов, нами составлен список диатомовых водорослей.
В работе применена классификация, разработанная З.И. Глезер и др. (Диатомовые
…, 1988, 1992) с учетом современных взглядов на систематическое положение
таксонов родового и видового рангов. После номенклатурных и таксономических
преобразований список включает 203 вида и их внутривидовых таксонов. Наиболее
многочисленными родами Кл. Centrophyceae
являются Cyclotella (11 таксонов) и Aulacoseira (8), Кл. Pennatophyceae – Navicula (29), Nitzschia (19), Cymbella
(16), Achnanthes (10), Gomphonema (9), Synedra
(8), Pinnularia, Epithemia
(по 6), Cocconeis, Amphora, Surirella
(по 5), Diatoma и Eunotia (по 4). Они объединяют 71,4% от общего состава
диатомовой флоры известной на сегодняшний день. Остальные рода содержат от 1 до
3 таксонов. Флора диатомовых водорослей поверхностных донных отложений водоемов
Ильменского заповедника на данный момент включает 58 таксонов.
Список литературы
Бондаренко Н.В. Биология горных озер. Архив
Ильменского государственного заповедника, оп.2, д. № 7. 1938. 65 с.
Диатомовые водоросли СССР (ископаемые и современные).
СПб.: Наука, 1988. Т.2. Вып. 1. 116 с.; 1992. Т. 2. Вып. 2. 125 с.
Давыдова Н.Н. Диатомовые водоросли в отложениях
озер // Ландшафтный фактор в формировании гидрологии озер южного
Урала. Л: Наука, 1978. С. 228-237.
Давыдова Н.Н., Жаковщикова Т.К., Стрельникова Н.И.
Современные методы изучения диатомей в континентальных осадках и донных отложениях
озер // Вест. ЛГУ. Сер. 3. Вып. 2. № 10. 1987. С. 29-34.
Давыдова Н.Н., Трифонова И.С. Диатомеи планктона и
донных отложений и содержание хлорофилла в осадках двух разнотипных озер
Карельского перешейка как показатели процесса эвтрофирования // Ботан.
журн. Т. 64. №. 8. 1979. С. 1174-1183.
Долгоносов Б.М. Метод описания техногенной сукцессии
диатомового палеокомплекса // Докл. РАН. 2006. Т. 411. № 6. С. 812-815.
Драбкова В.Г., Давыдова Н.Н., Сергеева Л.В., Хомутова
В.И., Яковлева Л.В. Палеолимнология озера Большой Кисегач //
Палеолимнологический подход к изучению антропогенного воздействия на озера. Л.:
Географическое общ-во СССР, 1981. С. 73-83.
Жузе А.П. Палеогеография водоемов на основе
диатомового анализа // Тр. Верхневолжской экспедиции. Вып. 4. Л.: Изд-во ЛГУ, 1939. 86 с.
Кордэ Н.В. История альгофлоры некоторых озер Среднего
Урала // Тр. лаб. сапропелевых отложений. М.-Л. 1949. Вып. 3. С.
68-100.
Летанская Г.И. Фитопланктон и его
продукция // Эколого-продукционные особенности озер различных ландшафтов
Южного Урала. Л.: Наука, 1978. С. 81-106.
Летопись природы Ильменского государственного
заповедника за 1996 г.
Архив Ильменского государственного заповедника, оп. 2. д. № 406. 1997. 258 с.
Осипов С.К. Отчет по гидробиологическому изучению озер
Ильменского заповедника. Архив Ильменского государственного заповедника, оп.2,
д. № 15. 1938. 285 с.
Подлесный А.В., Троицкая В.И. Ильменские озера и их
рыбохозяйственная оценка // Тр. УралВНИИОРХ. 1941. Т. 3. С. 124-174.
Прошкина-Лавренко А.И. Альгофлора сапропелей озер
среднего Урала // Докл. АН СССР. 1945. Т. 50. С. 471-474.
Разумовский Л.В. Оценка качества вод на основе анализа
структуры диатомовых комплексов // Вод. ресурсы. 2004. Т. 31. № 6. С.
742-750.
Снитько Л.В. Водоросли разнотипных водоемов восточной
части Южного Урала. Миасс: ИГЗ УрО РАН, 2003. 166 с.
Снитько Л.В. Фитопланктон // Экология озера
Большое Миассово. Под ред. А.Г. Рогозина, В.А. Ткачева. Миасс: ИГЗ УрО РАН,
2000. С. 94-127.
Снитько Л.В., Рогозин А.Г. К оценке структурной
организации фитопланктона озера Большое Миассово (Южный
Урал) // Экология. 2002. №6. С. 426-431.
Справочник по водным ресурсам СССР: Урал и Юж.
Приуралье. М.- Л. 1936. Т. 12. ч. 1.
664 с.
Таусон А.О. Гидробиология Ильменских озер и их
рыбохозяйственная оценка. Архив Ильменского государственного заповедника, оп.2,
д. № 37. 1940. 316 с.
Чагина Л.Ю. Диатомовые водоросли в поверхностных донных
отложениях озера Большой Кисегач как показатели процесса
эвтрофирования // Сб. науч. тр. Палеолимнологический подход к
изучению антропогенного воздействия на озера. Л.: Географическое общ-во СССР,
1981. С. 84-89.
Шешукова-Порецкая В.С. История водоемов Зауралья на
основе изучения их диатомовой флоры: Сообщ.2. Кыштымская и Челябинская группы
озер // Уч. зап. ЛГУ. Сер. биол. наук. Вып. 40. 1955. № 91. С.
105-162.
Ярушина М.И., Танаева Г.В., Еремкина Т.В. Флора
водорослей водоемов Челябинской области. Екатеринбург: УрО РАН, 2004. 307 с.
Round F.E., Crawford
R.M., Mann D.G. The Diatoms. Biology morphology of genera. Cambridge,
etc.: Cambridge Univ. Press, 1990. 747 p.
Stockner J.G.,
Benson W.W. The succession of diatom assemblages in the recent sediments of Lake Washington // Limnol. a. Oceanogr. 1967. Vol. 12. P. 513-532.
Секция 4
Использование
альгоиндикации в оценке качества
водной и наземной
среды
АЛЬГОИНДИКАЦИЯ И АЛЬГОТЕСТЫ
В ЭКОЛОГО-ТОКСИКОЛОГИЧЕСКОЙ
ОЦЕНКЕ КАЧЕСТВА
ВОДНЫХ ЭКОСИСТЕМ
Бакаева Е.Н.,1,2 Черникова Г.Г. 1, Игнатова Н.А.2
Algal indication and algal tests in
toxicological-ecological
assessment of water ecosystems quality
Bakaeva E.N. 1,2, Chernikova G.G. 1, Ignatova N.A. 2
1Южный отдел Института водных проблем РАН, г. Ростов-на-Дону
e-mail: rotaria@mail.ru
2Гидрохимический институт, г. Ростов-на-Дону
Состояние водных объектов требует особого внимания
ввиду исключительной роли воды, как в народном хозяйстве, так и в круговороте
вещества в природе. Экологическое состояние, как вод, так и донных отложений
водных объектов, в последнее время все больше интересует с точки зрения
токсикологии, так как известна общая тенденция последнего времени – активное
распределение токсикантов в водной среде и аккумуляция их в донных отложениях.
Аналитический контроль прогрессирующего возрастания
количества новых химических веществ невозможен, к тому же он осложнен
аддитивностью и синергетическим действием большинства соединений. Только сама
биота может дать оценку суммарного токсического действия загрязняющих веществ,
которое является одной из главных причин
негативных последствий антропогенного загрязнения природных вод.
Первоначально в основу исследований качества вод был положен метод биоиндикации, основанный на изучении
состава и структуры гидробиоценозов. Альгоиндикация является составной частью
этого методического подхода. Согласно мировому опыту оценка
эколого-токсикологического состояния водных объектов невозможна без данных
оценки интегральной токсичности с помощью биотестирования, которое вместе с
химическим анализом и биоиндикаций составляет триаду методологии
экотоксикологической оценки состояния водных экосистем (таблица). Поэтому
в настоящее время все более широкое
применение находит метод биотестирования. Этот методический подход стал
использоваться ввиду того, что
токсическое влияние загрязняющих веществ на гидробиоту гораздо показательнее
сравнения измеренных концентраций химических элементов и соединений с их
предельно допустимыми содержаниями. Таким образом, метод биотестированиия наиболее показателен с экологической точки
зрения. Биотестирование более целесообразно и в экономическом плане, поэтому
часто предвосхищает ресурсоемкие гидрохимические исследования.
Токсичность – характеристика
биологическая, и может быть определена
только с участием живых организмов. Методология биотестирования - способ
интегральной оценки токсичности комплекса веществ, присутствующих в водной
среде и проявляющих или не проявляющих свои эффекты в зависимости от формы их
нахождения, соотношений, взаимовлияний и ряда условий среды. Метод
биотестирования основан на использовании представительных тест-объектов
различных систематических групп и трофических уровней живых организмов. В
альготестах в качестве тест-объектов при оценке токсичности поверхностных вод
общепринятыми являются представители
зеленых микроводорослей – родов Chlorella, Scenedesmus.
Менее активно используют представителей сине-зеленых – родов Synechocistis, Microcistis,
диатомовых – Thalassiosira pseudonana, Phaeodactylum tricornutum,
Sceletonema costatum, род Chaetoceros.
Прием биотестирования для оценки токсичности
природных сред не нов, его используют
в качестве основного методологического подхода при разработке
регламентов на химические вещества (ПДК), однако методики оценки природных сред
имеют ряд особенностей. Метод
биотестирования вод и донных отложений нельзя отнести к количественным.
Результат выражается словесно: «оказывает/не оказывает» проба воды токсическое
действие. Можно выделить уровень токсичности, который выражается также
словесно: «острое», «подострое», «хроническое» токсическое действие. Важно то, что биотестирование
позволяет получать интегральную оценку
токсичности, вызываемую суммарным действием всего комплекса загрязняющих
веществ, содержащихся в водной среде, с учетом их синергетического и
антагонистического взаимодействия.
Преимущества метода биотестирования:
-
временной показатель (определение токсичности возможно за 2 – 24 часа в
зависимости от используемого тест-показателя).
-
охватывают все основные компоненты водной экосистемы, поскольку основаны на использовании
набора методик (не менее трех). Применение набора тест-объектов обусловлено
спецификой жизнедеятельности живых организмов, проявляющих различную
чувствительность к одному и тому же виду загрязнения.
-
менее материалоемки, в сравнении с химическими.
-
менее затратны (менее дорогостоящи), в сравнении с химическими.
-
возможно проведение исследований в полевых условиях.
До настоящего момента широко не
используются в мониторинге на сети Росгидромета в связи с тем, что:
-
не хватает специалистов-гидробиологов (штатные гидробиологи перегружены
обработкой проб гидробиологических проб).
-
нет необходимых помещений (биотестирование нельзя проводить в химических
лабораториях)
С учетом всех особенностей метод
биотестирования должен использоваться в системе мониторинга отдельным блоком.
Альготесты должны быть обязательной составляющей, поскольку основаны на
использовании автотрофных организмов, являющихся поставщиками первичной
продукции водных объектов. Цель биотестирования в мониторинге поверхностных вод
суши – осуществлять скрининг проб воды и донных отложений водного объекта и в режимных, и оперативных наблюдениях,
особенно в случае чрезвычайных ситуаций (ЧС). В последнем случае есть
возможность выбрать пробы для дальнейшего дорогостоящего химического анализа.
Таблица
Сравнение типов антропогенного воздействия на водные
экосистемы и методов их исследования
|
Характер загрязнения
|
Биогенные вещества*
|
Химические вещества
|
|
Метод исследования
|
Химический
|
Биоиндикация
(гидробио-
логический)
|
Химический
|
Биоиндикация
(гидробио-
логический)
|
Биоиндикация
(накопление)
|
Биотести-рование
|
|
Оценка загрязнения
|
ПДК
|
Сапробность,
трофность
|
ПДК
|
Сапробность,
трофность
|
Концентрация
|
ОТД
ХТД
|
|
Объект исследования
|
Вода,
донные отложения
|
Аборигенные сообщества
(ценозы)
водных экосистем
|
Вода,
донные
отложения
|
Аборигенные сообщества
(ценозы)
водных
экосистем
|
Ткани животных и
растений
|
Тест-объекты
(ткани, клетки, организмы,
популяции, вид
экосистема)
|
* В случае превращения в лимитирующий
по максимуму фактор (в случае эвтрофирования) можно рассматривать как частный
вариант токсического воздействия.
ОТД
- острое токсическое действие; ХТД - хроническое токсическое действие
Все это делает необходимым и актуальным проведение
исследований по оценке эколого-токсикологического состояния водных объектов
комплексом методов: альгоиндикацией и биотестированием с использованием
альгологических тест-объектов. Нами проведены исследования реальных водных
экосистем р. Дон, Цимлянского водохранилища, о. Голубое и модельных экосистем
при моделировании загрязнения в натурных условиях. Изучение проводили
комплексом методов, включающим изучение альгоценозов и оценку токсичности вод и
донных отложений методом биотестирования с использованием альготестов.
Результаты показали, что экотоксикологические показатели состояния альгоценозов
и ответ альгологических тест-объектов являются индикаторами общего состояния
экосистемы, ее «экологического благополучия», устойчивости к антропогенным
воздействиям, что особенно важно в условиях роста техногенных нагрузок на
водные объекты и роста загрязненности особо опасными и токсичными химическими
соединениями.
ВИДОВОЕ РАЗНООБРАЗИЕ ДИАТОМОВЫХ
ВОДОРОСЛЕЙ – ИНТЕГРАЛЬНЫЙ ПОКАЗАТЕЛЬ ТЕХНОГЕННОГО ЗАГРЯЗНЕНИЯ
Бакулина
Л.С.,
Самодурова Л.Е., Емельянов А.В.
Species
diversity of diatoms as integral indice
of
anthropogenic contamination
Bakulina L.S., Samodurova L.E., Emeliyanov A.V.
ГОУВПО «Тамбовский государственный университет
им. Г.Р. Державина»
GOUVPO
"Tambov state
university "
тел. (4752) 72-37-89,
факс (4752) 71-22-70
e-mail: zoobottsu@yandex.ru
Значительным
числом отечественных и зарубежных исследований установлено, что действие
повреждающих факторов любой природы в первую очередь сказывается на видовом
разнообразии сообществ, которое, в свою очередь, является основным фактором
буферизации биологических систем [1, 2, 3, 4]. Диатомовые водоросли, являясь
одним из ключевых компонентов микробиоты пресноводных водоемов и водотоком [5],
должны рассматриваться как потенциальный объект фонового мониторинга экосистем.
Высокий уровень толерантности представителей этого отдела и космополитический
характер ареалов большинства видов предопределяют возможность проведения
диагностических и мониторинговых работ в зонах повышенной экологической
опасности в пределах обширных территорий [5, 6].
Цель
исследования состояла в оценки изменчивости видового богатства сообществ диатомовых
водорослей под действием стоков промышленных вод.
Работа
проводилась в июне 2008 г.
в среднем течении р. Ржавка (правый приток р. Ворона). Отбор проб воды
производился на основе рекомендаций, изложенных в «Методике изучения биогеоценозов
внутренних водоемов» [7]. Пробы изучались по общепринятой методике [8, 9].
Постоянные препараты приготовлялись с помощью анилиноформальдегидной прозрачной
смолы Эльяшева с показателем преломления 1,68. Микроскопическое изучение низших
водорослей для их таксономического определения проводилось в микроскопах МБИ –
3 и «PZO» при увеличении
120х и 1200х. Пробы изучались дважды – после сбора и
после фиксирования. Определение водорослей проводилось с помощью определителей
и общепринятым методик исследований [9, 10, 11]. Наименование и порядок видов
приводится по Шютту [12] с использованием филогенетической классификации для центрических
диатомей [13, 14, 15, 16].
Изучаемая
территория находится в пределах охранной зоны госзаповедника «Воронинский». В
основу анализа положены видовые списки диатомовых водорослей отобранные в двух
точках. Первая располагалась на 100
м выше места впадения сточных вод маслоперерабатывающего
предприятия ОАО «Маслобойный завод «Инжавинский», вторая – на 300 м ниже. На территории
каждого стационара проводился отбор трех проб воды из основных сред обитания
диатомей: пены и поверхностной пленки воды, поверхности высшей водной
растительности, из средней части водной толщи (в данном случае 0.5 м). Пробы донного грунта
не брались. Это было обусловлено пониманием того, что донные отложения являются
местом аккумуляции большого спектра поллютантов различной природы,
накапливающихся в среде на протяжении многих десятков лет. Данное
обстоятельство позволяет использовать различные показатели населения бентоса
для определения фонового уровня загрязнения и хронического воздействия
токсикантов и ксенобиотиков, но затрудняет интерпретацию данных работах по
диагностике повреждающего воздействия залповых выбросов промышленных стоков.
По
итогам проведенной инвентаризации флоры диатомовых выявлено 178 видов, относящихся
к 2 классам (Сentrophyceae,
Рennatophyceae), 4
порядкам (Тalassiosirales,
Melosirales, Aulacoseirales, Raphales),
16 сeмействам (Stephanodiscaceae, Melosiraceae, Aulacoseira, Fragilariaceae, Diatomacea, Tabellariaceae, Naviculaceae, Achnanthaceae, Eunotiaceae, Cymbellaceae, Gomphonemataceae, Epithemiaceae, Rhopalodiaceae, Nitzschiaceae, Surirellaceae) (табл. 1, 2).
Увеличение
специфичной доли в видовом населении участков указывает на возможность использования
видового разнообразия видов диатомовой группы в качестве индикатора
загрязненности поверхностных вод. Данное обстоятельство подтверждается низкой
долей высокотолерантных видов от общего числа зарегистрированных (12.92%) и
высокими показателями индексов Жаккара (0.13) и Серенсена (0.54).
С
помощью меры Коуди (табл. 1) было проанализировано изменение видовых населений
вдоль градиента фактора (наличие или отсутствие сточных вод). Результаты
сравнения показывают, что выше и ниже места впадения сточных вод с маслобойного
производства качественный состав сообществ диатомовых водорослей претерпевает
кардинальные изменения. Так, на глубине 0,5 м вообще не встречено сходных видов, а на
поверхности высших водорослей обнаружен только один вид (Meridion circulare var. circulare) общий для двух участков.
Таблица
1
Изменение
видовых населений вдоль градиента фактора
|
Локалитет
|
Число прибавившихся
видов
|
Число утраченных
видов
|
Значение
индекса Коуди
|
|
Поверхность
высшей водной растительности
|
143
|
10
|
66,5
|
|
Водная толща
|
13
|
1
|
6,0
|
Отдельный интерес представляло
выявление вопроса о сходстве видового состава трех локалитетов в каждом из
стационаров. Для этого был избран индекс Серенса, рекомендованный к использованию
в экологических исследованиях по установлению разнообразия количественных мер,
на основе сопоставления видовых обилий [17, 18].
Для стационара, расположенного выше
места впадения сточных вод (табл. 2) его значения показали высокую степень
специфичности населения всех локалитетов. Особо высокие различия установлены
для пары поверхностная пленка – водная толща.
Таблица 2
Сходство видовых структур
диатомовых (индекс Серенса)
|
Локалитет
|
Поверхностная пленка, пена
|
Водная толща
|
Поверхность высших водорослей
|
|
Поверхностная пленка, пена
|
-
|
0,04
|
0,36
|
|
Водная толща
|
0,04
|
-
|
0,16
|
|
Поверхность высших водорослей
|
0,36
|
0,16
|
-
|
Полученные сведения показывают
значительные различия в составе диатомовых как между контрольным и загрязненным
участками, так и в различных локалитетах внутри каждого стационара. Приведенные
данные являются первыми по составу диатомовых водорослей р. Ржавка и могут быть
использованы в качестве контрольных значений в процессе многолетнего слежения
за состоянием данной реки.
Авторы
выражают искреннюю признательность сотрудникам Воронежского государственного
университета Г. А. Анциферовой, С.Н. Богатыревой за помощь в определении
видового состава диатомовых водорослей.
Работа
выполнена в рамках ИОП по направлению «Живые системы».
Список литературы
1. Неронов В.М., Букварева Е.Н.,
Бобров В.В. Зоогеография и современные задачи сохранения биоразнообразия.
Успехи современной биологии, Вып.1, 1993. С. 643-651.
2. Примак Р. Основы сохранения
биоразнообразия / Пер. с англ. О.С. Якименко, О.А. Зиновьевой. М.: Издательство
Научного и учебно-методического центра, 2002. 256 с.
3. Heywood, V. H. Global
Biodiversity Assessment.
Cambridge: Cambridge
University Press, 1995.
4.
Tilman, D. The ecological consequences of change in biodiversity: A search for
general principles // Ecology. 1999. V. 80. P. 1455-1474.
5. Жизнь
растений. В 6-ти т. Гл. ред. чл.-кор. Ж71 АН СССР, проф. Ал. А. Федоров. Т.3. Водоросли.
Лишайники. Под ред. проф. М.М.Голлербаха. М., «Просвещение», 1977. 487 с.
6. Лукомская К.А. Микробиология с
основами вирусологии: Учеб. пособие для студентов пед. институтов по биол. и
хим. спец. М.: Просвещение, 1987. 192с.
7. Методике изучения биогеоценозов внутренних
водоемов. М., 1975. С. 73-117.
8. Жузе А.П. К методике технической
обработки горных пород в целях диатомового анализа // Диатомовый сборник. Л.,
1953. С. 206-220.
9. Диатомовые
водоросли СССР. Ископаемые и современные. Л., 1974. Том I. 403 с.
10. Анциферова Г.А. Эволюция
диатомовой флоры и межледникового озерного осадконакопления центра Восточно-Европейской
равнины в неоплейстоцене // Тр. НИИ геологии Воронеж. ун-та. Вып. 2. Воронеж,
2000. 198 с.
11. Kolbe R.W. Grundlinien
einer allgemeinen Ökologie der Diatomeen // Ergebt. D. Biol. 1932. Bd. 8. S.
221-348.
12.
Schütt F. Bacillariales (Diatomea) // Engler A., Prantl K. Die
natürlichen Pflanzenfamilien. Leipzig, 1896. Bd. 1. Abt. 1 b. S. 31-150.
13. Глезер З.И. К разработке новой
классификации диатомовых водорослей // Систематика, эволюция, экология
водорослей и их значение в практике геологических исследований. Тез. докл. II Всес. палеоальгол. совещ. Киев, 1981. С. 108-110.
14. Николаев В.А. К построению системы
центрических диатомовых водорослей (Bacillariophyta) // Ботан. Журнал. 1984. Т. 69. № 11. С. 1468-1474.
15.
Ross R.P., Sims P.A. Observations on family and generic limits in the Centrales
// Nova Hedwigia, 1973. Bech. 45. P. 97-121.
16.
Simonsen R. The Diatom System Ideas on Phylogeny // Bacillaria. Braun. Schweig., 1979. V. 2. P. 9-71.
17. Песенко Ю.А. Принципы и методы
количественного анализа в фаунистических исследованиях. М.: Наука, 1982. 287 с
18. Мэгарран Э. Экологическое разнообразие и его
измерение. М.: Мир, 1992. 181 с.
Интегральные методы выделения
мониторинговых групп
и таксонов водорослей
Баринова С.С.
Integral methods of algal monitoring groups
and taxa allocation
Barinova S.S.
Institute of Evolution
University of Haifa
Mount Carmel, Haifa
31905 Israel.
Tel:+9724-8249697; Fax: +9724-8246554
E-mail: barinova@research.haifa.ac.il
Мониторинг водных объектов – это
часть любой программы мониторинга окружающей среды, поскольку водный объект
заключает сумму влияний, воздействий на ландшафтный участок. Это отражение не
только состояния водной среды, но, через нее, отражение воздействия на наземные
объекты, растительность, почву и воздух. Бассейновый подход к оценке влияний на
ландшафтный выдел, принятый в ряде стран и наиболее развитый в Европейском Сообществе
в рамках EU FWD, ярко демонстрирует эффективность интегральных методов от
конкретных данных мониторинга до экологического картирования и системы принятия
решений.
Путь от постановки задачи
мониторинга до системы принятия решений в схематичном виде выглядит следующим
образом:
1. выделение объекта мониторинга
через СМИ и связи с общественностью;
2. оценка на основе первичного
обследования;
3. установление целей и задач
мониторинга;
4. заключение о проблемах и
объектах, для которых должна быть разработана система мониторинга;
5. определение методов и объектов
мониторинга;
6. выделение эталонного участка для
объекта мониторинга;
7. установление стандартов для
эталонного объекта;
8. определение объекта, а также
необходимых показателей, по которым будет проводиться мониторинг;
9. определение
пространственно-временной системы сбора данных мониторинга;
10. определение системы отображения
полученных в результате мониторинга данных (классификация, индексы,
картирование);
11. определение критериев для системы
принятия решений.
Водоросли занимают ключевое место
в системе оценки состояния водного объекта, поскольку находятся в основании
трофической пирамиды и первыми принимают на себя воздействия, оказываемые на
него. Вместе с тем, организмы, развиваясь во времени, аккумулируют воздействия,
давая, тем самым, интергальный ответ на сумму воздействий. Кроме того, циклы
развития водорослей, как одноклеточных организмов, варьируют в пределах от
нескольких часов до нескольких суток, давая тем самым не только интергальный,
но и быстрый ответ на воздействия. С другой стороны, виды в альгоценозах
обладают разной степенью устойчивости к воздействующим факторам, и, следовательно,
по составу сообщества и обилию каждого их входящих в него видов можно видеть
характер и интенсивность воздействия определенных факторов. Таким образом,
водорослевые сообщества могут служить максимально удобным объектом в системе
мониторинга, обладая быстрым, интегральным и избирательным на показатели
ответом на воздействия.
Система мониторинга, упомянутая
выше, в полной мере имеет отношение к мониторингу водорослевых сообществ.
Следовательно, все шаги должны быть пройдены последовательно. К настоящему
времени в руках альгологов имеется достаточно инструментов и методов для
создания собственной полнокровной части мониторинговой структуры. Вхождение в
общую структуру мониторинга водного объекта возможна уже со стадии (2), то есть
сбора альгологических проб на, по-возможности, часто расположенных станциях на
бассейне реки. Здесь существуют два пути: (а) частичного участия, когда
используется только результат определения видового состава и выделения
видов-индикаторов и (б) полного, когда к дальнейшей системе подключаются
показатели среды. Если есть химико-физические данные, то с помощью
интегрально-статистических методов, например программы CANOCO, возможно
установление не только индикаторных видов, но также главных воздействующих
факторов и видов-биосенсоров на эти факторы. Примером может служить наше исследование
воздействия промышленного комплекса в пос. Дальнегорск Приморского края на
сообщества р. Рудная, когда кроме индикаторов органического загрязнения и
ацидификации были выделены биосенсорные виды на бор. По результатам оценок,
таким образом, возможно определить цели и задачи альгологического мониторинга
бассейна р. Рудная (стадия 3), а именно, отслеживание органического загрязнения
воды, ацидификации и концентрации бора на основе сбора альгоценозов и
химических показателей воды по избранным показателям (стадия 5), что следовало
из выявленных проблем (стадия 4). Расположение станций мониторига может быть
минимально необходимым и достаточным для стадии (6), причем эталонный участок
может быть как в верховье загрязняемого бассейна, так и представлять собой
назагрязненный участок регионального уровня. Важно при этом проводить наблюдения
по тем же показателям, что и на травмированных участках бассейна.
Для того, чтобы в последствии
представить результаты альгологического мониторинга как основы для системы
принятия решений, необходимо вписаться в существующую систему стандартов,
принятую для каждого региона или государства. В случае использования стандартов
ИСО или ЭДУ, мы не можем привязать альгологические данные. Однако, если
используются интегральные шкалы показателей, то это возможно. В качестве одной
из наиболее детализированных систем оценок, объединяющих физические, химические
и биологические показатели водного объекта, можно привести систему Жукинского
(в последнем варианте - Романенко с соавторами, 1990). Также детализирована, но
менее структурирована система Франции. Другие системы представляют только часть
из первых двух и существенно снижают возможности использования. В выборе
классификационной системы, которая будет использована для мониторинга, важным
является континуальность показателей и охват их амплитудой всего возможного для
существования водной экосистемы интервала. На основе показателей эталонного
объекта в системе классификации выделяется интервал, который будет основой для
стадии (7). Стадия (8) определяет связь между данными загрязненных и эталонного
участков в процессе мониторинга, а стадия (9) выделяет на основе (2) только
необходимые станции и пространственно- временную шкалу последующего
мониторинга.
Наиболее трудной для альголога
точкой в системе может быть форма и порядок представления данных (10). Именно
здесь на основе классификации объединяются данные по среде и альгоценозам.
Видовой состав с указанием обилия каждого вида (система представления может
быть долевой, процентной или балльной от 3 до 11 в разных подходах) является
основой для расчета индексов органического загрязнения, солености или
ацидификации, которые затем классифицируются по выбранной интегральной
классификации. Физико-химические данные классифицируются там же. Сравнение
осуществляется не только по рангам классификации, но и подвергается обсчету.
Индексы состояния экосистемы (WESI) как частное от деления ранга по биотическим
индексам, в частности, индексам сапробности, на ранг химических показателей
показывают степень токсического воздействия на альгоценоз в конкретном участке
бассейна. Здесь необходимо отметить, что интегральные индексы WESI могут быть
вычислены для каждого химического параметра в отдельности или для их гуппы в
целом. В любом случае это оценка воздействия веществ или их групп на
фотосинтетическую активность водоролслей. В частности, высокие ранги нитратов
говорят о их недопотреблении водорослевым сообществом, а, следовательно, о
токсическом воздействии на фотосинтез в анализируемой экосистеме. Высокие ранги
аммония при низких рангах индекса сапробности показывают токсикоз от аммиака. В
любом случае, полученные оценки и расчеты подвергаются картированию, то есть
привязываются к местности. Основой для картирования (стадия 10) являются ранги
классификации биотических индексов и физико-химических показателей, а также
индексы WESI. В результате появляется система экологических карт на бассейновой
основе (возможно, в ГИС), где участки русла, соответствующие станции отбора
проб до выше расположенной станции, окрашены в цвета, соответствующие классам
качества воды (как, например в EU FWD – от голубого до красного). Параллельно
может быть сделана серия карт с окрашиванием не только русла, но и участка
бассейна, сток с которого определяет химические и биотические показатели на
станции. Суммирование серии карт дает точки и показатели, наиболее важные для
системы последующего мониторинга. Таким образом, водорослевые сообщества в
соединении с показателями среды их обитания могут дать важную, можно сказать,
решающую, информацию для стадии (11) системы принятия решений.
В процессе сначала первичных
оценок, а затем мониторинга, нельзя недооценивать роль полученных альгологами
данных по биоразнообразию. Так, число видов входящих в крупные таксономические
ранги на уровне отдела может быть также включено в систему мониторинга. Важно
не только отслеживать состав и обилие видов отдела в сообществе на конкретной
станции, но и рассчитать референтную группу, изменение состава которой будет
свидетельствовать об изменениях среды обитания. Это возможно на основе теории
множеств, если расположить видовое богатство водорослей отделов от наибольшего
в обе стороны к наименьшему. Полученная эмпирическая кривая для каждого
сообщества водорослей будет по форме приближаться к Гауссовой. Расчет
стандартного отклонения укажет на группы, составляющие более 68 процентов
множества видов. Динамика от станции к станции (в пространстве) или в течение
времени (как за год, так и за ряд лет) даст интегральную картину изменения
сообществ и позволит определить тренд этих изменений. Оценки могут быть
картированы по участкам русла.
Аналогичные расчеты и построения
могут быть сделаны для индикаторных групп водорослей. Однако, в силу
интегральности уже самого биоиндикационного метода, располагать анализируемые
индикаторные группы необходимо в соответствии со значением индикаторного веса
каждой группы на оси, где сила показателя, например, солености, увеличивается в
одну сторону. Картина распределения будет приближаться к нормальному
распределению, давая возможность обсчета и выделения референтной группы,
изменение которой в процессе мониторинга укажет тренд изменения среды. Так,
например, для р. Хадера, загрязняемой в верхней части бассейна, удалось
проследить изменение органического загрязнения и тренд самоочищения. При
выделении групп биоиндикаторов на несколько показателей весьма эффективно и
выразительно использование экограмм по Ватанабе. Это звездчатые диаграммы
показателей среды и составленные параллельно с ними звездчатые диаграммы
референтных таксономических и индикаторных групп для тех же станций в тот же
временной период.
В заключении хотелось бы
отметить, что наши представления о том, что, на первый взгляд, надо подвергать
мониторингу, находятся в существенной мере под воздействием нашего, уже имеющегося,
чаще всего регионального, опыта. Возможно, что для уже известных нам проблем в
частном регионе эти показатели вполне адекватны. Однако, при переходе к
объектам в другом регионе наши довлеющие представления могут и мешать. Так,
например, для более южных регионов четырех-сезонность наблюдений развития
сообществ водорослей или трехсезонность, когда мониторингу подвергаются водные
объекты только в течение вегетационного периода, становятся излишне громоздкими,
поскольку в южных регионах Евразийского континента сезонность снижается до двух
или совершенно стирается. Соответственно и временная шкала (9) должна быть
снижена до 1-2 раза в год. В то же время, такие показатели, как органическое
загрязнение, засоление, ацидификация являются общеупотребимыми, как доказала
наша работа по сравнению воздействия промышленных комплексов на сопоставимые по
размеру бассейны рек Кишон и Рудная, находящихся примерно в том же широтном
поясе на противоположных сторонах Евразийского континента.
Таким образом, для наглядной
демонстрации изменений в экосистеме, использование интегральных методов анализа
сообществ водорослей и среды их обитания, выраженных в экологических картах
бассейна и экограммах, дает фактологически обоснованную и наглядно доступную
основу для системы принятия решений и связей с общественностью.
Заселение почвенными водорослями отвалов
фосфогипса
Бачура Ю.М.,
Храмченкова О.М.
Colonization of
phosphogypsum dumps by soil algae
Bachura Y.M., Hramchenkova O.M.
Учреждение
образования
«Гомельский
государственный университет имени Франциска Скорины»
Республика Беларусь,
г. Гомель, ул. Советская, 104, биологический факультет,
кафедра ботаники и
физиологии растений, 246019, тел. 0232-57-89-05
e-mail: bachura@gsu.by
Почвенные водоросли
одними из первых поселяются на различных безжизненных субстратах естественного
или антропогенного происхождения. Являясь
эксплерентами по жизненной стратегии и обладая низкой конкурентной мощностью и
высокой энергией размножения, они способны быстро осваивать свободное
пространство. Вместе с тем, особенности водорослевых группировок служат дополнительной
характеристикой изменяющегося субстрата, позволяя отследить первичные сукцессионные
процессы, лежащие в основе их естественного восстановления (Колесников, 1974,
Штина, 1985).
ОАО «Гомельский химический завод» является одним из
крупнейших предприятий химической промышленности Беларуси и производит серную и
фосфорную кислоты, комплексные азотно-фосфорно-калийные удобрения, гранулированный
аммофос, аммонизированный суперфосфат, фтористые соли, фунгициды и т.д. На Гомельском
химическом заводе применяется технология обработки апатитового концентрата,
приводящая к образованию твердых фосфогипсовых отходов, которых за 45 лет
функционирования завода накоплено около 18 млн. т (Артемьев и др.,
1999).
Целью данной работы было
изучение состава и последовательности
заселения почвенными водорослями отвалов фосфогипса.
Отбор образцов для исследования проводили в июле 2008
года по общепринятой в почвенной альгологии методике (Штина, Голлербах, 1976)
на отвалах фосфогипса разного возраста: I категория отвалов – полное отсутствие высших растений
– свежие отвалы (I); II категория отвалов – наличие травянистой
растительности, всходы древесных растений – отвалы среднего возраста, отбор
проб осуществляли на трех типах участков: 1) без растений (IIа), 2) с наличием мохового покрова (IIб), 3) с высшими растениями, включая мхи (IIв); III категория
отвалов – присутствие травянистых и древесных растений – старые отвалы (III).
Качественный состав водорослей выявляли с помощью чашечных
культур «со стеклами обрастания». Идентификацию водорослей осуществляли с
помощью микроскопа Nicon Eclipse 80i и определителей
(Андреева, 1998; Ettl, Gärtner, 1995; Komárek, Anagnostidis, 2005). Для каждого представителя определяли сумму
баллов обилия на одном стекле обрастания, рассчитывая интегральный показатель
развития альгогруппировок (ИПР) (Кабиров, 1997). Состав жизненных форм определяли
в соответствии с классификацией, разработанной Э.А. Штиной и М.М. Голлербахом
(1976). Статистическую обработку данных проводили с
применением программы Statistica 6.0.
В ходе проведенных исследований на
отвалах фосфогипса были выявлены представители 26 родов почвенных водорослей (в
их составе идентифицировано 24 вида), относящиеся к 18 семействам, 13 порядкам,
5 классам отделов Cyanophyta, Xanthophyta и Chlorophyta. Наибольшим флористическим разнообразием
характеризовался отдел зеленые водоросли, доля представителей которого составила
60,61%, затем соответственно – синезеленые (36,36%) и желтозеленые водоросли
(3,03%). Большинство семейств отличались небольшим количеством представителей
(1-2 вида), за исключением семейств Merismopediaceae, Nostocaceae
и Chlorellaceae.
Особенности изменения состава и
степени обилия группировок почвенных водорослей на стеклах обрастания
представлены на рисунке.
Как видно из диаграммы, на всех
категориях отвалов, кроме старовозрастных, преобладали представители отдела Chlorophyta (76,9-100%). Согласно литературным данным (Штина,
Голлербах, 1976, Штина, 1985) именно зеленые водоросли чаще всего являются
первопоселенцами нарушенных почв и антропогенных безжизненных субстратов.
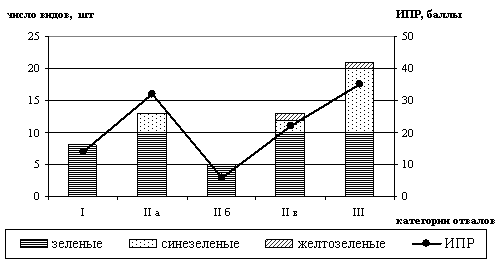
Рисунок. Изменение качественного состава и обилия
альгогруппировок на отвалах фосфогипса
(I – свежие
отвалы; IIа – отвалы среднего возраста без растений, IIб – отвалы среднего возраста
с наличием мохового покрова, IIв – отвалы среднего возраста с высшими растениями,
включая мхи;
III – старые
отвалы; ИПР – интегральный показатель развития альгогруппирповок)
На участках средневозрастных отвалов
фосфогипса со мхами наблюдалось резкое уменьшение числа почвенных водорослей,
что, возможно, обусловлено более низкой конкурентной способностью водорослей по
сравнению с другими растениями, в том числе и мхами. На старых отвалах фосфогипса
отмечено усложнение таксономической структуры водорослей, в основном за счет
резкого увеличения доли синезеленых водорослей в составе альгогруппировок
(47,6%).
Уровень развития водорослей (ИПР) на
всех категориях отвалов фосфогипса изменялся пропорционально с изменением
количества выявленных видов водорослей.
Для оценки сходства видового состава
альгогруппировок на отвалах фосфогипса различного возраста использовали метод
ранговой корреляции. Предварительно на основании полученных данных провели оценку
встречаемости каждого вида водорослей. Для анализа использовали виды,
встречаемость которых была равна или ниже 80% (все виды, кроме Chlorella vulgaris Beijir
и Pseudococcomyxa simplex (Mainx) Fott) (Кабиров и др., 1999).
По расчетам коэффициентов ранговой
корреляции выделили пять основных и две переходные группы водорослей,
представители которых тесно взаимосвязаны между собой. Сопоставление выделенных
групп со встречаемостью водорослей на отвалах фосфогипса привело к выявлению
приуроченности сформированных групп
водорослей к отвалам фосфогипса различных категорий.
Так, представители родов Elliptochloris sp. и Chlorosarcinopsis sp., являлись обязательными «обитателями» свежих отвалов
фосфогипса (группа I), где процессы колонизации
субстрата находились на ранних стадиях.
Типичными для участков средневозрастных отвалов
фосфогипса без растений оказались следующие виды и рода водорослей (группа IIа): Palmellopsis sp., Fernandinella alpina Chod. и Microcystis pulverea (Wood) Forti in De Toni, а также Myrmecia bisecta Reisigl
(в составе переходной группы между
отвалами фосфогипса I и IIа категорий), Chlamydomonas oblongella Lund и Tetracystis aggregata Broun et
Bold (в составе переходной группы между
отвалами фосфогипса IIа и IIб категорий). Большинство из представителей группы IIа, включая и переходные виды, способны к образованию
слизи, которая не только защищает клетки водорослей от проникновения различных
токсикантов, но и способствует склеиванию частиц минерального субстрата.
К участкам средневозрастных отвалов фосфогипса со
мхами были приурочены Keratococcus bicaudatus (A. Braun) B. Petersen и Chlorella
ellipsoidea Gern, а
также Tetracystis aggregata Broun et Bold, который с одинаковой частотой
встречаемости отмечен на отвалах фосфогипса IIа и IIб категорий.
Комплекс видов, тяготеющих к средневозрастным отвалам
фосфогипса с высшими растениями, включая мхи, был следующим: Chlamydomonas
sp., Chlorococcum sp., Scotiellopsis rubescens Vinatz., Merismopedia sp., Neospongiococcum sp., Stichococcus bacillaris Näg. и
Heterococcus sp. (группа IIв). Перечисленные представители относятся к различным
жизненным формам (C-, Ch-, X-, H-) и не имеют четко выраженных общих черт.
В целом на средневозрастных отвалах
фосфогипса наблюдалась дифференциация групп водорослей в зависимости от
особенностей формирования растительного покрова высшими растениями, при этом
часто виды групп различных участков средневозрастных отвалов фосфогипса
«взаимозаменяли» друг друга.
Старые отвалы отличались наличием
следующих водорослей (группа III):
Leptosira terricola (Bristol) Printz., Leptolyngbya molle
(Kütz.) Gom., Leptolyngbya tenuis (Gom.) Anagnost. et Komárek, Leptolyngbya
foveolarum (Rabenh. ex Gom.) Anagnost.
et Komárek, Microthamnion kuetzingianum Näg., Tolypothrix
sp., Phormidium dimorphum Lemm., Bracteacoccus
minor (Chod.) Petrová, Nostoc paludosum Kütz., Nostoc punctiforme
(Kütz.) Hariot, Nostoc linckia (Roth) Born. et Flah.. Практически
все перечисленные представители, кроме Bracteacoccus
minor (Chod.) Petrová, являются нитчатыми или колониальными
водорослями, развитие которых способствует механическому скреплению частиц формирующегося
органического вещества; многие способны к образованию слизи, содействующей склеиванию
частиц. Именно на данном этапе заселения фосфогипса водорослями наблюдается
появление представителей отдела Cyanophyta,
способных к фиксации атмосферного азота, что свидетельствует о некотором
улучшении условий существования водорослей.
Для двух видов водорослей (Synechocystis
salina Wisl. и Chlorella minutissima Fott et Nováková) не
выявлена значимая корреляционная связь с какой-либо из описанных выше групп
водорослей; они могут встречаться спорадически на отвалах разной степени
сукцессии.
Анализ взаимосвязи качественного
состава почвенных водорослей с «возрастом отвалов» фосфогипса позволяет
предположить здесь постепенную смену водорослевых группировок, происходящую
наряду с освоением отвалов высшими растениями. Заселение отвалов фосфогипса
начинают зеленые водоросли, одноклеточные, преимущественно Ch-жизненной формы, затем постепенно наблюдается
усложнение таксономической структуры (за исключением участков средневозрастных
отвалов с моховым покровом) за счет развития зеленых водорослей, способных к
образованию слизи. В дальнейшем активное развитие в составе альгогруппировок
получают синезеленые водоросли.
Исходя из полученных данных, можно
предположить, что по составу почвенных водорослей, выявленных на отвалах
фосфогипса, можно судить о «возрасте» отвалов; обнаружение одного вида
какой-либо из выделенных групп водорослей указывает на присутствие на
фосфогипсовом субстрате остальных видов из данной группы.
Список литературы
Андреева В.М. Почвенные и аэрофильные зеленые
водоросли (Chlorophyta: Tetrasporales, Chlorococcales, Chlorosarcinales).
СПб: Наука 1998. 352 с.
Артемьев В.И.
Гомель. Справочник: справочное издание. Мн.: Высш.шк., 1999. 373 с.
Кабиров Р.Р. Участие почвенных водорослей в процессах
формирования растительного покрова на отвалах Канско-Ачинского угольного
месторождения (КАТЭК) // Экология. 1997. № 3. С. 218–220.
Кабиров Р.Р., Суханова Н.В., Хайбуллина Л.С. Выделение
почвенных альгоценонов методом Браун-Бланке. Уфа, 1999. 35 с. Деп. в ВИНИТИ
31.03.99, № 1014-В99
Колесников Б.П. О научных основах биологической
рекультивации техногенных ландшафтов // Проблемы рекультивации земель в СССР.
Новосибирск: Наука, 1974. С. 5–19.
Штина Э.А. Почвенные водоросли как пионеры зарастания
техногенных субстратов и индикаторы состояния нарушенных земель // Журнал общей
биологии. 1985. Т. XLVI, № 4. С. 435–443.
Штина Э.А., Голлербах М.М. Экология почвенных
водорослей. М., 1976. 143 с.
Ettl H., Gärtner G. Syllabus der Boden-,
Luft- und Flechtenalgen. Stuttgart -
Jena - New York, 1995. 721s.
Komárek J., Anagnostidis
K. Cyanokaryota.
1 Teil: Chroococcales. Süsswasserflora von Mitteleuropa. Bd 19/1. Jena-Stuttgart-Lübeck-Ulm, 1999. 548 s.
Komárek J.,
Anagnostidis K. Cyanokaryota. 2 Teil: Oscillatoriales. Süsswasserflora von Mitteleuropa.
Bd 19/2. München, 2005. 759 s.
Сезонная динамика фитопланктона и цианотоксинов,
определяемых методом жидкостной хроматографии,
тандемной масс-спектрометрии высокого разрешения,
в оз. Сестрорецкий Разлив (2008 г.)
Воякина Е.Ю.,
Жаковская З.А., Мильман Б.Л., Русских Я.В, Целикова Л.В.
Seasonal dynamics of
phytoplankton and cyanotoxins detected
by high performance
liquid chromatography and tandem
mass-spectrometry in
the Sestroretskyi
FLOOD Lake
(2008)
Voyakina E.Ju.,
Zhakovskaja Z.A., Milman B.L., Russikh Ya.V., Tselikova L.V.
Санкт-Петербургский
научно-исследовательский центр
экологической
безопасности РАН (НИ ЦЭБ РАН)
197100 г. Санкт
- Петербург, ул. Корпусная, 18, тел. (812) 235 75 93, факс (812) 235 43 61
e-mail: katerina-voyakina@rambler.ru
Со второй половины XX века вследствие интенсивного развития промышленности
и сельского хозяйства усиливается
антропогенное эвтрофирование водоемов, что в свою очередь приводит к нарушению
экологического баланса и массовому
развитию отдельных видов водорослей (или «цветению»). При современном состоянии
водных экосистем «цветение» водоемов становится все более частым явлением.
Известно, что все планктонные водоросли выделяют в
среду различные метаболиты (Сиренко и др., 1997; Хатчинсон, 1969). Метаболиты
водорослей, особенно синезеленых, могут обуславливать как возникновение токсических эффектов, так и появление неприятных запахов воды (Falconer, 1999; Carmichael, 2001). Запахи различных видов водорослей уже
давно представляют трудно разрешимую проблему для организаций, занимающихся
водоснабжением.
В настоящее
время «цветут» практически все водоемы Северо–Запада России. «Цветет» и
крупнейшее в Европе Ладожское озеро - единственный источник водоснабжения г.
Санкт – Петербурга. Большие проблемы создает «цветение» и для жителей г.
Сестрорецк. С массовым развитием фитопланктона в водоемах региона связывают онкологические
и кишечные заболевания, аллергические дерматиты, серозный менингит и др.
(Водоросли…, 2006). Таким образом, проблема вредоносного цветения водорослей
давно уже стала актуальной для водоемов
Северо-Запада России.
По способу воздействия на млекопитающих выделяют
несколько групп цианотоксинов: нейротоксины, гепатотоксины и липополисахариды.
Для водоемов Северо-Запада России
наиболее актуальны две группы цианотоксинов: нейротоксины и гепатотоксины (Pawlic-Skowronska et all, 2004; Wood et all, 2006).
Нейротоксины
представляют собой низкомолекулярные алкалоиды, действующие на нервную систему.
В настоящее время благодаря успехам аналитической химии удалось выделить из токсичных синезеленых
водорослей и структурно определить три нейротоксина (анатоксин-а,
анатоксин-а(s) и гомоанатоксин).
Гепатотоксины – это циклические гепто- или
пентапептиды, содержащие необычные аминокислоты. К настоящему времени описано
множество разновидностей таких пептидов, различающихся структурой и степенью токсичности.
Большинство из них обнаруживается в самых различных родах водорослей, а
некоторые виды содержат несколько видов
токсинов. Гепатотоксин, попавший в организм животного, вызывает разрушение
печени, и через некоторое время
наступает летальный эффект. Наиболее известные и хорошо изученные гепатотоксины – микроцистины. В настоящее время их насчитывается около 60 видов. В
Ладожском озере были обнаружены токсигенные штаммы синезеленых водорослей,
продуцирующих гепатотоксины (Громов и др., 1996).
В качестве объекта исследования для отработки методики
по обнаружению цианотоксинов в природной воде использовали оз. Сестрорецкий
разлив. Озеро Сестрорецкий Разлив – самый крупный водоем в черте г. Санкт-Петербурга.
Площадь озера – 11,04 км2, средняя глубина не превышает 1,6 м. Озеро расположено в пределах водосборного бассейна
и в непосредственной близости от Финского залива. В настоящее время озеро находится в критическом
состоянии, биогенная нагрузка на озеро превышает допустимую на порядок
(Кондратьев, Гронская, 2002).
Отбор проб осуществлялся в приплотинной части озера с
мая по октябрь 2008 г.
один – два раза в месяц. Количественные пробы фитопланктона объемом 1 л отбирали простым зачерпыванием с поверхности воды, фиксировались
раствором Люголя и концентрировались осадочным методом. Биомасса определялась стандартным методом, а
объем клеток - методом геометрического подобия. К доминирующим относили виды водорослей,
составлявшие более 10% от общей биомассы. Параллельно отбирали воду на
определение цианотоксинов и биогенных элементов.
Определение микроцистинов проводили в лабораторных
условиях с помощью иммуноферментного экспресс-метода Microcystin Tube ELISA Kit. Для определения цианотоксинов использовали
комплексный метод жидкостной хроматографии - тандемной масс-спектрометрии на
хромато-масс-спектрометре LTQ OrbiTrap с линейной и орбитальной ловушками с режимом
электроспрей ионизации (ESI+).
Характеристичные масс-спектры аналитов регистрировали в условиях
масс-спектрометрии высокого разрешения и тандемной масс-спектрометрии.
В составе количественных проб фитопланктона в оз.
Сестрорецкий Разлив за вегетационный период 2008 г. было обнаружено 77
таксонов рангом ниже рода, относящихся к 7 отделам: Cyanophyta – 13, Dinophyta – 5, Euglenophyta – 7, Cryptophyta – 5,
Xanthophyta – 1, Bacillariophyta – 16, Chlorophyta
– 30. По числу видов преобладали зеленые и диатомовые водоросли. Среди зеленых
наибольшим видовым богатством отличались хлорококковые водоросли. Число видов
водорослей, обнаруженных в пробах в течение сезона, оставалось достаточно высокое (от 16 до 37). По составу видов-индикаторов сапробности
данная акватория может быть охарактеризована
как β-мезасапробная (значение индекса сапробности – 1,7).
В
течение сезона наблюдалась активная
вегетация фитопланктона, среднее
значение численности было 32,4
млн. сч. ед./л, биомассы – 42,0
мг/л. Минимальные значения показателей обилия были отмечены в октябре
(биомасса -14,6 мг/л), максимальные – в августе (61,6 мг/л). Значения
коэффициента видового разнообразия также значительно варьировали (0,9 – 2,2
бит/мг). Основной вклад в вегетацию фитопланктона вносили синезеленые водоросли,
создавая от 30 до 90 % от общей
биомассы. В конце мая и в октябре в
планктоне доминировали диатомовые и криптофитовые водоросли.
Для
хода сезонной динамики фитопланктона было
характерно два пика обилия – поздневесенний (за счет вегетации
диатомовых) и летний (за счет синезеленых водорослей). В течение сезона в планктоне
доминировали: Aphanizomenon flos-aquae (L.) Ralf et Born et Flah., Planktothrix agardhii (Gom.) Anagn.et Kom., виды рода Aulacoseira Thw. (A. ambigua (Grun.) Sim., A. islandica (O. Müll) Sim., A. italica (Kütz) Sim.), Cryptomonas rostrata Troitz emend Kisel. В период «цветения» в июле и августе
монодоминантом был токсигенный вид – Planktothrix agardhii, на
его долю приходилось более 70 % биомассы.
По литературным данным виды рода Planktothrix
способны продуцировать различные нейротоксины
и микроцистины (Carmichael, 2001). Более того,
доказано, что Planktothrix agardhii способен выделять в 10 раз больше микроцистина, чем
вид Microcystis aeruginosa, вид из которого его выделили первоначально. Именно в
этот период нами были обнаружены такие цианотоксины, как микроцистин - LR и анатоксин-а.
В конце июля в
воде с помощь экспресс-метода ELISA были отмечены незначительные концентрации
микроцистина – LR (0,36 мкг/л).
В пробах воды
из оз. Сестрорецкий Разлив обнаружены детектируемые количества анатоксина-а.
Полученные методом тандемной масс-спектрометрии массы фрагментных ионов
согласуются с особенностями молекулярной структуры анатоксина-а и литературными
данными, что подтверждает идентификацию. Рассчитанный изотопный состав пиков анатоксина-а,
обнаруженного в пробах, соответствует
теоретическому. В июле и августе концентрация анатоксина-а в воде варьировала от 0,8 до 5,0 мкг/л. Максимальная
концентрация анатоксина-а была отмечена
в августе в период максимальной
вегетации водорослей в оз. Сестрорецкий Разлив (биомасса Planktothrix
agardhii – 46,9 мг/л).
В нашей стране не разработаны ПДК для цианотоксинов, в
тоже время в ряде стран (Канада, США, Австралия) концентрация анатоксина-а выше 3 мкг/л
считается опасной для жизни человека (Svrcek&Smith, 2004). А в 1997 г всемирная организация по здравоохранению
установила для питьевой воды в качестве
предельно допустимой концентрацию микроцистина-LR или его эквивалента – 1 мкг/л.
Таким образом, в нашей работе впервые для водоемов Северо-Запада России
приводятся реальные концентрации в воде
цианотоксинов. Результаты свидетельствуют о существующей возможности выявления
цианотоксинов в воде природных объектов и необходимости организации контроля.
Использованные приборы и методики позволяют с высоким уровнем достоверности
идентифицировать цианотоксины и проводить их определение.
По структурным
показателям фитопланктона исследованную акваторию можно отнести к гиперэвтрофным
водоемам. Полученные результаты показали, что в летний период вода в оз. Сестрорецкий
Разлив может представлять серьезную угрозу для населения Курортного района г.
Санкт-Петербурга.
В настоящее время в условиях постоянно возрастающей
антропогенной нагрузки необходима разработка новых подходов и новых критериев к
оценке качества воды водоемов. Необходимы новые знания о проблеме вредоносного
цветения водорослей и метаболитах водорослей различных таксономических групп
водорослей, особенно цианотоксинов. А отсутствие систематического контроля за
появлением опасных цианотоксичных веществ в воде может быть оправдано только новизной
проблемы и недостаточной разработанностью химико-аналитической процедуры по
идентификации цианотоксичных веществ в природной воде Северо-Запада России.
Список литературы
Водоросли,
вызывающие «цветение» водоемов Северо – Запада России. - М.: КМК. - 2006. - 367
с.
Громов
Б.В., Мамкаева К.А., Волошко Л.Н. К изучению токсичных «цветений» в озерах северо-запада
России // Эколого-физиологические исследования водорослей и их значение для
оценки состояния природных вод – Ярославль, 1996.- С.22.
Кондратьев
С.А., Гронская Т.П. Водоемы Санкт - Петербурга – общие сведения// Водные объекты
Санкт - Петербурга. СПб, 2002. – С. 88-93.
Сиренко Л. А., Кирпенко Ю.А., Кирпенко И.И.
Биологически активные метаболиты сине-зеленых водорослей и их роль в
эпидемиологии // Гидробиол. журнал. 1997. т. 33, N 3. С. 51 – 62.
Хатчинсон Д. Лимнология. М. 1969. 592 с.
Carmichael W.W. Health
effects of toxins – producing cyanobacteria: “the cyanoHABs”// Hum.Ecol. Risk. Assess. 2001. Vol.
7. P. 1393 – 1407.
Falconer, I.R. An overview of problems caused by toxic blue-green algae
(cyanobacteria) in drinking and recreational water// Environ. Toxicol. – 1999 -
№ 14 – Р. 5-12.
Svrcek C., Smith D.W. Cyanobacteria toxins and the current state of
knowledge on water treatment options: a review // J. Environ. Eng. Sci. - 2004.-vol.3. P.155 - 185
Pawlic-Skowronska
B., Skowronski T., Pirszel J., Adamczyk A. Relationship between cyanobacterial
bloom composition and anatoxin-a and microcystin occurrence in the eutrophic
Dam reservoir (se Poland) // Pol. J. Ecol. – 2004.- P.479-490.
Wood S.A., Stirling
D.J., Briggs L.R., Sprosen J., Holland P.T., Ruck J.G., Wear R.G. Survey of
cyanotoxins in New Zealand waterbodies between 2001 and 2004 // N. Z. J. Mar.
Freshwater Res. – 2006. 40 - P.585-587.
ВОДОРОСЛЕВЫЕ
СООБЩЕСТВА РАЗЛИЧНЫХ ЛАНДШАФТОВ КОЛЬСКОГО СЕВЕРА В ОЦЕНКЕ СОСТОЯНИЯ ВОДНЫХ
ЭКОСИСТЕМ
Денисов Д.Б.
Algae communities from
different landscapes of the Kola North
in freshwaters state
monitoring
Denisov D.B.
Институт проблем
промышленной экологии Севера КНЦ РАН
184209 Мурманская
область, г. Апатиты, ул. Ферсмана, 14a
тел. (81555)
79-776, факс (81555) 74-964
e-mail: denisow@inep.ksc.ru
Формирования качества пресных вод арктических и
субарктических регионов, функционирование их экосистем протекает в специфичных
высокоширотных условиях. Особенностью территории Мурманской области является ее
высокая обводненность (суммарная площадь озер 1651 км2) и необычайно
большое разнообразие водоемов, различающихся по генезису, ландшафтному
положению, геологическому строению их водосборов, гидрологии и другими
условиями формирования качества вод. Наличие множества природно-ландшафтных
комплексов со своим рельефом и
микроклиматом обуславливает существование разнотипных водоемов на
сравнительно небольшой территории, что обуславливает значительную вариабельность
естественно-природных показателей состояния их экосистем. Данные о структуре и
таксономическом составе водорослей фитоперифитона и фитопланктлона
озерно-речных систем необходима для создания и уточнения систем биоиндикации,
расширения представлений о многообразии условий в пределах одного водного
объекта в зависимости от ландшафта, особенностях локальных местообитаний, а
также определяющих факторов развития в условиях обедненных биогенными
элементами высокогорных водотоков как научной основы для реконструкции условий
формирования качества пресных вод высокоширотных регионов в ходе локальных и глобальных
изменений окружающей природной среды.
В период с 2005 по
2008 гг. были проведены исследования водорослевых сообществ в водоемах и
водотоках различных ландшафтов Кольского севера: тундровые ландшафтные комплексы (побережье Баренцева моря);
северо-таежные ландшафтные комплексы (Центральная часть полуострова); система
горных микроландшафтов (Хибинский горный массив). Оценивались видовой состав и структура водорослевых
сообществ планктона и перифитона, гидрохимические характеристики качества вод,
уровень содержания хлорофиллов. Особое внимание было уделено интенсивно
загрязняемым водоемам в зоне воздействия горно-перерабатывающей промышленности.
Отбор и анализ проб фитопланктона и фитоперифитона был произведен с
использованием рекомендованных стандартных методик (Руководство…, 1983;
Руководство…, 1992). Отбор проб для анализа фитопланктона осуществлялся
стандартным батометром Рутнера емкостью 2.2 л, объем пробы составлял 1 л. В случае, если глубина
водоема превышала 10 м,
отбор производился с поверхности (1
м) и глубины 10 м для оценки вертикального распределения
водорослей. Каждая проба фиксировалась раствором формалина, концентрировалась
отстойным методом с последующим центрифугированием в течение 10 мин. при 5000
тыс. оборотов.
Анализ содержания хлорофиллов «а», «b» и «с» в планктоне был проведен стандартными методами,
адаптированными для условий Кольского Севера, описанными ранее (Кашулин и др.,
Шаров, 2004). Фитоперифитон был
отобран с каменистых субстратов посредством скребка, пробы анализировались, по
возможности, в нефиксированном состоянии, или фиксировались растворов
формалина. Отбор осуществлялся в литоральной зоне озер с глубины около 0.5 м. Подсчет и
таксономическая идентификация водорослей осуществлялась на световых микроскопах
«Leitz Biomed» и
«Carl Zeiss Jena NU 2E» с иммерсионным
объективами при увеличениях 400-1000 х.
Тундровые ландшафтные комплексы (побережье Баренцева
моря). Исследование видового состава и структуры сообществ
фитопланктона, численности и биомассы, показало, что все водоемы
соответствуют олиготрофному трофическому статусу и представляют собой водоемы,
типичные для горно-тундровой зоны Кольского полуострова, с низким содержанием
биогенных элементов. Содержание хлорофиллов находится в пределах, характерных
для субарктических водоемов и подтверждает олиготрофный трофический статус
изученных озер. Фитоперифитон изученных озер отличается большим числом видов,
численностью и биомассой по сравнению с фитопланктоном, и вносит значительных
вклад в общую биомассу, образуемую автотрофами в водоемах.
Северо-таежные ландшафтные комплексы (Центральная
часть полуострова). Видовой состав и
структура сообществ водорослей для исследованных водоемов неодинакова и
специфична для каждого водоема, что свидетельствует о широком спектре условий
для развития водорослей в озерах региона в зоне серенной тайги центральной
части Кольского полуострова. Были обнаружены водоемы с доминированием зеленых
водорослей, что не является характерной чертой субарктических водных экосистем,
в то время как для большинства озер доминантами по численности и биомассе были
диатомовые. Значительную долю (до 34 %) во многих водоемах составляют
представители отделов Chrysophyta и Xantophyta – типичных представителей субарктических
озер. Водоросли перифитона водотоков характеризуются значительным обилием
(покрытие 80-100% субстрата при толщине обрастаний до 8 см). В структуре сообществ
значительную долю (до 85 %) составляют красные водоросли рода Batrochospermum, характерные для незагрязненных водотоков.
Происходит формирование значительного количества фитобиомассы, играющей ведущую
роль в круговоротах веществ и утилизации биогенных элементов, что может быть
использовано для оценки потенциала и интенсивности самоочищения водных объектов
региона при органическом загрязнении.
Система горных микроландшафтов
(Хибинский горный массив). На
модельном водосборе оз. Большой Вудъявр проведен сравнительный анализ
фитоперифитона и фотопланктона различных водоемов и водотоков, установлены
различия в соотношении основных отделов водорослей и общей численности на базе
бассейнового подхода. Было установлено, что наиболее интенсивно фитоперифитон
развивается в водных объектах, загрязняемых фосфатами и стоками очистных
сооружений г. Кировска, уровень развития его напрямую зависит от прозрачности
воды. Было показано, что высокое содержание взвеси ингибирует развитие
фитоперифитона, поэтому в интенсивно загрязняемых шахтными водами реках
фитоперифитон не был обнаружен или развивался слабо. Также было установлено,
что на развитие фитоперифитона благотворно влияют воды из самоизливающихся
скважин в Хибинском массиве, которые характеризуются сравнительно высокой общей
минерализацией (47-62 мг/л) и значениями pH (до 9.7). Самыми бедными в отношении обрастаний
оказались верховья рек и перевальные озера. Было отмечено, что фитоперифитон
способен развиваться в истоках горных рек (600-700 м над у.м.) при полном
отсутствии почвы и растительности и минимальных концентрациях биогенных
элементов. Очевидно, для минерального питания водорослей большое значение имеют
процессы выветривания.
На примере модельной горной реки были установлены
механизмы, регулирующие развитие перифитона в июле: перифитон наиболее
интенсивно развивается в пределах поймы реки на пологом участке, где развит
почвенный покров и растительность. Рост перифитона обеспечивают поступающие с
этого участка водосбора биогенные элементы, их источником дополнительно
являются временные лужи с гниющими растительными остатками (листья и пр.). Дальнейшая
разработка вопросов функционирования пойменных экосистем может помочь оценить
возможности экосистем рек для процессов самоочищения. Сезонные изменения в
структуре сообществ перифитона проявляются в смене видового состава и
численности водорослей: в августе в горных реках кроме синезеленых и диатомовых
водорослей развиваются золотистые, общая численность водорослей в конце лета и
в начале осени увеличивается.
Были отмечены эффекты массового развития
водорослей на стоке озер в апреле, когда водоем покрыт льдом. В горных
водоемах, не испытывающих загрязнение, наблюдалось массовое развитие
синезеленых водорослей, в то время как в озерах, подверженных загрязнению
биогенными элементами активно развивались зеленые нитчатые водоросли рода Ulothrix и диатомовые рода Fragilaria и Melosira lineata. Очевидно в условиях фона массовое
развитие водорослей происходит за счет наличия неиспользуемых биогенных
элементов в озере, покрытом льдом, которые в то же время востребованы
водорослями на стоке, где возникают благоприятные световые условия. Это
доказывает сезонная динамика азота и нитратов, максимальное содержание которых
на стоке приходится на апрель-май.
Интенсивно загрязняемые водоемы. Было показано, что при интенсивном загрязнении рудничными
водами апатитовой промышленности водоросли развиваются в условиях постоянно
доступных биогенных элементов. Концентрации хлорофилла «а» в фитопланктоне на
порядок превышают его содержание в фоновых водоемах, может наблюдаться
«цветение» воды в отдельных участках акватории. Доминирующие в течение всего
сезона диатомовые водоросли находятся в зависимости от концентрации кремния, а
также значений pH. Многолетняя динамика
концентрации хлорофиллов показала, что в разные годы влияние различных
гидрохимических характеристик на развитие водорослевых сообществ не одинаково.
В фоновых водоемах наблюдается «классическая» картина зависимости водорослей от
биогенных элементов, которые находятся в дефиците. При этом массового развития
диатомовых водорослей не происходит, что подтверждается отсутствием зависимости
от содержания кремния.
Было установлено, что продолжительные осадки вызывают
перестройку видового состава водорослей, а также стимулируют наступление
максимальных концентраций хлорофиллов «а» и «b», содержание хлорофилла «с» в большей степени
определяется температурой. Интенсивная прямая солнечная радиация угнетает
развитие водорослей, что наблюдается в период полярного дня.
Список литературы
Кашулин Н.А., Денисов Д.Б., Сандимиров С.С.,
Даувальтер В.А., Кашулина Т.Г., Малиновский Д.Н., Вандыш О.И., Ильяшук Б.П.,
Кудрявцева Л.П. Антропогенные изменения водных систем Хибинского горного
массива (Мурманская область), Т.1. Апатиты: Изд-во Кольского научного центра
РАН, 2008. 250 с.
Руководство по
методам биологического анализа поверхностных вод и донных отложений / Под. ред.
В.А.Абакумова. Л.: Гидрометеоиздат, 1983.
Руководство по гидробиологическому мониторингу
пресноводных экосистем. Под ред. В.А. Абакумова. С-Пб, Гидрометиздат, 1992. 318
с.
Шаров А.Н. Фитопланктон водоемов Кольского
полуострова. Петрозаводск: Карельский научный центр РАН, 2004. 113 с.
СООБЩЕСТВА ПОЧВЕННЫХ ВОДОРОСЛЕЙ КАК ИНДИКАТОРЫ СОСТОЯНИЯ ПОЧВ В РАЙОНАХ
НЕФТЕДОБЫЧИ
Дорохова М.Ф.
Soil algae communities as indicators of soil conditions
in oil production regions
Dorokhova M.F.
Московский государственный университет им. М.В. Ломоносова,
Географический факультет
119991, ГСП-1, Москва, Воробьевы горы
(495)939-21-31; (495)932-88-36
e-mail: dorochova@mail.ru
Изучение микробиоты в почвах нефтедобывающих районов
России показало, что водоросли наиболее чутко реагируют на техногенные
изменения почв и грунтов. Это определяет перспективность альгоиндикации
состояния почв и грунтов в районах добычи нефти.
Специфика технологии добычи и состава нефти определяет
круг экологических проблем, характерных для районов нефтепромыслов. Он включает
механическое нарушение почвенного покрова, загрязнение почв нефтью и их засоление,
а также заболачивание территории. Ответная реакция водорослевых сообществ в
нефтедобывающих районах адекватно отражает направление и интенсивность
техногенной трансформации наземных экосистем, что было показано Т.А. Ельшиной
(1986) и Н.М. Зимониной (1998).
Целью наших исследований являлось дальнейшее изучение
индикационных возможностей сообществ почвенных водорослей в условиях
разнообразных техногенных нагрузок, связанных с добычей нефти, на экосистемы.
Работы проведены на нефтепромыслах Калининградской
области (подзона южной тайги). Водоросли изучены в ненарушенных и техногенно
трансформированных почвах, характерных для почвенного покрова территории.
Использованы общепринятые в почвенной альгологии
методы исследования, а при обсуждении результатов – данные, полученные в ходе
модельных полевых экспериментов.
Критериями оценки сообществ и группировок водорослей традиционно были:
видовое разнообразие, состав доминирующих видов, соотношение экологических
групп и численность.
Ненарушенные почвы (агродерново-подзолистые,
дерново-подзолистые глееватые, дерново-глеевые слабооподзоленные и
дерново-подзолистые глееватые остаточно-карбонатные) характеризуются кислой, слабокислой
или нейтральной реакцией (рН = 5,0-7,0), низким содержанием водорастворимых
солей (менее 0,068 %) и нефтепродуктов (менее 0,06 г/кг). Для альгофлоры всех
ненарушенных почв под культурной и луговой растительностью характерны высокое
видовое разнообразие, представленность четырех основных отделов водорослей,
преобладание типично почвенных видов (доля амфибиальных и гидрофильных видов не
превышает 10%) и довольно высокое содержание видов, устойчивых к действию нефти
(35-43%). Последнее, по-видимому, обусловлено эмиссией газообразных
углеводородов нефтяными залежами.
В
техногенно преобразованных ландшафтах
происходит изменение всех показателей альгогруппировок в
соответствии с характером и интенсивностью трансформации почв.
Техногенные
грунты кустовых площадок и
рекультивированных амбаров характеризуются слабым и умеренным загрязнением
нефтепродуктами (0,1- 1,7 г/кг), засолением (содержание водорастворимых солей
достигало 1,7%), нейтральной и слабощелочной реакцией (рН = 6,0-7,5), разреженностью
растительного покрова и большой неоднородностью условий увлажнения. Отсутствие конкуренции с высшими
растениями и невысокие уровни загрязнения техногенных субстратов определяют
интенсивное развитие водорослей на их поверхности. Их общее видовое
разнообразие нередко достигает значений, характерных для сообществ водорослей
ненарушенных дерново-подзолистых пахотных и залежных почв, а численность на 1-2
порядка превышает максимальные показатели, зарегистрированные для ненарушенных
почв. Состав сообществ водорослей коренным образом отличается от такового
фоновых участков. Ведущую роль в них играют синезеленые водоросли, устойчивые
не только к приоритетным загрязнителям, но и к высокой инсоляции и
иссушению субстрата. Нередки случаи полного «выпадения» из состава альгоценозов
зеленых и желтозеленых водорослей. Появляются галотолерантные и галофильные
виды, возрастает число алкалофильных видов. По основным показателям альгофлора
техногенных грунтов сходна с альгофлорой засоленных щелочных почв южных регионов.
Поступление
в ландшафты минерализованных буровых сточных вод (как правило, хлоридного состава) вызывает засоление
дерново-подзолистых глееватых почв (содержание солей достигает 0,8%), а в
непосредственной близости от места сброса сточных вод – также умеренное
загрязнение их нефтепродуктами (1,1 г/кг). Поступление загрязнителей
сопровождается подщелачиванием почв (рН изменяется от 5,0 до 6,0-6,5) и усилением
в них восстановительных процессов. В центральной части ореола загрязнения
лесная растительность погибает, интенсивно развиваются водоросли. Их разнообразие
довольно велико, а состав и структура сходны с таковыми альгоценозов техногенных
грунтов, что обусловлено сходным составом загрязнителей. Типично «лесные» виды
исчезают, замещаясь галотолерантными, галофильными и резистентными к действию
нефтепродуктов (в основном, из отдела синезеленых). Доля гидрофильных видов
возрастает.
Устойчивость во времени изменений в
составе водорослевых сообществ зависит от уровня первичного воздействия на почву. В краевых частях ореола загрязнения уже через
2 года начинается восстановление сообществ организмов исходных почв, отражающее
освобождение корнеобитаемого слоя почвы от основной массы водорастворимых
солей. В центральной части ореола загрязнения изменения сообществ водорослей
устойчивы во времени, что свидетельствует об очень высоком первичном уровне
техногенной нагрузки на почву.
Влияние
нефти на почвенные водоросли изучено
на участке аварийного разлива и на экспериментальных площадках.
Хроническое загрязнение
агродерново-подзолистых почв сырой нефтью в краевой части ореола загрязнения
вызывает их засоление (содержание водорастворимых солей в момент исследования
на порядок превышало фоновые значения), подщелачивание (на 0,5 единицы рН),
слабое загрязнение нефтью (0,2-0,5 г/кг), усиление восстановительных процессов
и смену высокопродуктивных лугов сильно разреженными вейниковыми сообществами. Общее
разнообразие водорослей в трансформированных почвах в целом находится на
фоновом уровне, однако, резко изменяются видовой состав и структура
водорослевых сообществ. Их основу составляют виды, устойчивые к повышенным содержаниям
солей и нефти (в основном, синезеленые и зеленые водоросли). Увеличивается
разнообразие гидрофильных видов, что отражает характер изменения
окислительно-восстановительных условий в загрязненных почвах. Чутким
индикатором техногенного засоления и подщелачивания почвы является состав
комплекса диатомовых водорослей: существенную роль в нем играют галофильные
виды, существенно увеличивается доля алкалофильных видов.
Моделирование процессов загрязнения-самоочищения почвы
от нефти или ее компонентов в полевых условиях позволяет получить информацию о
глубине повреждающего действия поллютантов на микробиоту в зависимости от
первичного уровня ТГ нагрузки и о характере ее изменения во времени. Проведено
две серии модельных экспериментов в почвах разных типов.
В первой серии экспериментов изучалось влияние высокой
дозы нефти на сообщества водорослей дерново-глеевых слабооподзоленных,
агродерново-глеевых и дерново-подзолистых глееватых остаточно-карбонатных почв.
Изучалось влияние на фототрофный компонент микробного сообщества как
обессоленной (товарной), так и сырой нефти. Установлено, что в любом случае
высокая доза нефти (100 л/м2) вызывает не только битуминизацию
почвы, но и изменение щелочно-кислотных условий и содержания водорастворимых
солей. Изменения физико-химических свойств почвы максимальны при загрязнении ее
сырой нефтью. Внесение высокой дозы нефти во всех случаях вызывает резкое
ингибирование почвенных водорослей. Через 7 дней после начала эксперимента
численность водорослей составила менее 7% от фонового уровня. В условиях
гумидного климата Калининградской области период острого токсического действия
нефти на водоросли относительно непродолжительный: уже через год после
экспериментальной заливки нефти в почвах подзолистого типа начинается
восстановление группировок водорослей, главным образом за счет развития зеленых водорослей.
Во второй серии экспериментов изучалась ответная
реакция сообществ водорослей основных типов почв Калининградской области на
разную первичную нагрузку (использовалась обессоленная нефть). Выявление
ответных реакций сообществ водорослей на градиент концентрации нефти осуществлялось
на основании данных количественного учета применительно к разным
эколого-морфологическим группам водорослей. Это позволило определить особенности
изменения структуры группировок водорослей, одновременно получив данные о
доминирующих группах и о численности. Параллельно общепринятыми методами
определялся видовой состав водорослей в группировке. Установлено, что для
большинства почв области диапазон содержаний нефти в корнеобитаемом слое,
равный 15-50 г/кг, является критическим, при котором даже при однократном
загрязнении происходят необратимые качественные изменения сообществ водорослей.
Таким образом, в результате проведенных исследований
установлено, что для районов нефтепромыслов Калининградской области характерна перестройка
сообществ почвенных водорослей в направлении формирования сообществ, характерных
для засоленных щелочных почв аридных районов, что отражает основные направления
геохимической трансформации почв. Устойчивость техногенных изменений микробиоты
зависит от интенсивности и длительности техногенного воздействия на почвы.
Список литературы
Ельшина Т.А. Почвенные
водоросли как индикаторы некоторых видов техногенного загрязнения почвы (на
примере загрязнений, связанных с нефтедобычей): Автореф. дис….канд. биол. наук.
Л.: ЛГУ, 1986. – 16 с.
Зимонина Н.М. Почвенные водоросли нефтезагрязненных
земель. – Киров, 1998. – 170 с.
К вопросу о численности, биомассе и продукции
почвенных водорослей на породных отвалах
Крайнего Севера
(на примере Юньягинского угольного разрЕЗа)
Зимонина Н.М.
Studies of soil algae
quantity, biomass and production on mine dumps in Extreme North (case study of
Yunyaginsky coal pit)
Zymonina N.M.
Вятский государственный
гуманитарный университет
610002, г. Киров (обл), ул. Красноармейская, д.26
Тел.: (8332) 67-89-75 Факс (8332)37-51-69,67-86-56
Многолетняя эксплуатация месторождений угля Печорского
угольного бассейна привела к созданию техногенных ландшафтов, обязательным
элементом которых являются породные отвалы (Гецен и др., 2001). Одним из
условий снижения отрицательного влияния отвалов на окружающую среду является
образование на их поверхности устойчивого почвенно-растительного покрова. Изучение
структуры и механизмов восстановительного процесса остаётся на сегодняшний день
актуальной задачей для науки и производства.
Почвенные водоросли являются первопоселенцами и
составляют начальный этап естественного освоения минеральных субстратов
промышленных отвалов (Неганова, 1975; Кабиров, 1991). Роль водорослей в
восстановительных процессах прежде всего раскрывается в показателях их численности,
биомассы и продукции. Наиболее полно в количественном отношении
охарактеризованы альгогруппировки отвалов угольных разработок Кузбасса
(Шушуева, 1977). Для зоны тундры сведения о численности и биомассе водорослей
угольных отвалов единичны (Дорохова, 1989; Патова, Дорохова, 2005). Целью
исследования стало выявление
количественных характеристик альгогруппировок угольных отвалов в зависимости от
особенностей грунта и степени развития высших растений. В качестве модельных,
выступили отвалы пород угледобывающего производства закрытой шахты «Юнь-Яга»
(Воркутинский промышленный район).
Для количественного альгологического анализа на
плоских вершинах отвалов отобраны грунты: четверточный суглинок (pH=8,15) и углистый аргиллитовый щебень (pH=6,5; 7), на участках без высших растений и под
разнотравно-злаковой растительностью (ОПП – 95%). Отбор и обработка проб
проведены общепринятыми в альгологических исследованиях методами (Штина,
Голлербах, 1976). На отвалах проведён флористический анализ почвенных
водорослей (Патова, Дорохова, 2005; Андреева, 2006). Мы ограничились выявлением
доминирующих видов с использованием методов прямого микроскопирования и
чашечных культур со стёклами обрастания.
Результаты исследования показали, что значения и
структура количественных показателей в исследованных экотопах существенно
различаются. На суглинистых субстратах наибольшая
интенсивность развития водорослей отмечена на незадернованных грунтах. На
данном участке количество клеток водорослей достигало 1 млн 200 тыс. в 1г
грунта, величина биомассы 10 кг/га. Ведущее значение в структуре численности и
биомассы принадлежало нитчатым синезелёным водорослям: Phormidium ambiguum, Ph. foveolarum, Ph. animalis, Ph. autumnale, Ph. lividum. Численность
и биомасса синезелёных водорослей составила 1 млн. 117 тыс. в 1 г грунта и 10 кг/га
соответственно. Заметное участие в структуре биомассы синезелёных принимают гетероцистные водоросли:
Anabaena variabilis, Nostoc punctiforme. Их
биомасса составила 1,21 кг/га, что на порядок выше чем в других исследованных
экотопах. На долю одноклеточных зелёных и диатомовых водорослей приходится не
более 2% от общей численности клеток на участке. Средняя биомасса зелёных
водорослей в данном экотопе составила 1,10 кг/га, диатомовых - 0,7 кг/га, или
9% и 6% от общей биомассы соответственно. Основу численности и биомассы
диатомовых водорослей составили мелкоклеточные формы Navicula mutica со средним объёмом клеток - 475 мкм 3 .
На суглинке под разнотравно-злаковой растительностью
по сравнению с незадернованным грунтом численность водорослей уменьшается в
пять раз, а биомасса – в два раза. В структуре биомассы лидирующие
позиции начинают занимать одноклеточные зелёные водоросли. По сравнению с
незадернованным суглинком, под разнотравно-злаковой ассоциацией увеличиваются
количество и размер клеток зелёных водорослей. Численность клеток зелёных
водорослей составила 29 тыс. в 1г грунта, биомасса –3,9 кг/га. Под
разнотравно-злаковой растительностью, по сравнению с «голым» суглинком
снизились количество и биомасса клеток синезеленых и диатомовых водорослей. Численность
синезеленых водорослей составила 175 тыс. в 1 г грунта, биомасса –1,0 кг/га, диатомовых –
4,8 тыс. в 1 г
грунта и 0,5 кг/га соответственно. Биомасса диатомовых водорослей представлена
в основном крупноклеточными Hantzschia amphioxys со средним объемом клеток 1892
мкм3. Число клеток Navicula mutica уменьшилось по сравнению с
«голым» суглинком, они образуют только 23% биомассы диатомовых.
На аргиллитовом
щебне господствующее положение занимает одноклеточные зеленые водоросли. На
незадрнованном щебне их численность составила 54 тыс. в 1 г грунта, биомасса – 6,9
кг/га. На задернованном щебне по сравнению с «голым» грунтом, биомасса зеленых
водорослей увеличивается до 9,7 кг/га,
на фоне снижения количества клеток до 41 тыс. в 1 г грунта, что может быть связано,
как со сменой видового состава, так и преобладанием процессов роста над процессами
размножения. Под разнотравно-злаковой растительностью, по сравнению с незадернованным
щебнем, количество и биомасса синезеленых и диатомовых водорослей
увеличиваются. Численность синезеленых возрастает с 19 до 54 тыс. в 1 г грунта, биомасса – с 0,13
до 1,51 кг/га. Численность диатомовых увеличивается с 2 до 7 тыс. кл/г,
биомасса – с 0,8 до 5 кг/га.
Продукция определялась путем суммирования достоверных
прибавок биомассы за исследуемый период (10 дней). Продуктивность
альгруппировок возрастала в ряду: задернованный суглинок (9 кг/га),
задернованный щебень (14 кг/га), незадернованный щебень (26 кг/га),
незадернованный суглинок (33 кг/га).
Таким образом, характер грунта оказывает существенное
влияние на значение и структуру количественных показателей водорослевых
сообществ, а присутствие высших растений во многом определяет динамику
количественных показателей и продуктивность альгогруппировок. Несмотря на
невысокие значения, органическое вещество водорослей играет определенную роль в
формировании техногенных биогеоценозов, особенно на, лишенных высшей растительности
участках.
Список литературы
Андреева В.М. Почвенные неподвижные зеленые микроводоросли
(Chlorophyta) в зоне промышленного загрязнения г. Воркуты
(Республика Коми) // Новости систематики низших растений, 2006. – Т. 40. – С.
13-18.
Гецен М.В., Какунов Н.Б., Рубцов А.И. и др.
Экологические последствия ликвидации
угледобывающих шахт в условиях Арктики (на примере закрытой шахты «Юнь-Яга»
Воркутинского промышленного района) // Экологические проблемы при ликвидации
шахт и разрезов. Сборник докладов научно-практической конференции. Пермь:
«Золотой город», 2001. С.298-305.
Дорохова М.Ф. Формирование и значение группировок
почвенных водорослей в условиях промышленного загрязнения (на примере
угледобычи): Автореф. дис. … канд. биол. наук. М., 1989. 24с.
Кабиров Р.Р. Почвенные водоросли железорудных отвалов
Южного Урала // Ботан. Журн., 1990. – Т.74, №2. –С.208-216.
Неганова Л.Б. Развитие почвенных водорослей на
промышленных отвалах как первый этап зарастания: Автореф. дис. … канд. биол.
наук. – Сведловск, 1975. –25с.
Патова Е.Н., Дорохова М.Ф. Почвенные водоросли //
Природная среда тундры в условиях открытой разработки угля (на примере
Юньягинского месторождения). Сыктывкар, 2005. С. 126-144.
Штина Э. А., Голлербах М. М. Экология почвенных
водорослей. М.: Наука, 1976.144с.
Шушуева М. Г. Формирование водорослевых группировок на
отвалах угольных разработок в Кузбассе: Автореф. дис. …биол.наук. Л., 1977. 24
с.
ИЗМЕНЕНИЕ СООБЩЕСТВ ДИАТОМЕЙ КОЛЬСКОГО ПОЛУОСТРОВА
В СВЯЗИ С АНТРОПОГЕННОЙ ТРАНСФОРМАЦИЕЙ ВОДНЫХ ЭКОСИСТЕМ
Каган Л.Я.
Changes of Kola
Peninsula diatoms
communities
as a result of water ecosystems anthropogenic transformation
Kagan L.I.
Институт проблем промышленной экологии Севера КНЦ РАН,
184209, Апатиты, Мурманская обл., Ферсмана, 14
8 (81555) 63311, факс: 8 (81555) 74964
e-mail: kaganM@mail.ru
Существенные изменения экосистем
водоемов Кольского полуострова произошли во второй половине ХХ в. в связи с
развитием в регионе мощного горно‑промышленного комплекса, городов и
энергетических систем. Наибольшая концентрация крупных промышленных производств
приурочена к водосбору наиболее крупного водоема Мурманской области оз. Имандра.
С целью восстановления изменения
экосистемы оз. Имандра на протяжении последних 50 - 60 лет был изучен видовой
состав комплексов диатомей, изменения их статистических показателей в колонках
седиментов из различных зон загрязнения, установленных по многочисленным
гидрохимическим и гидробиологическим показателям (Моисеенко и др., 2002).
Выявленные изменения комплексов
диатомей позволяют говорить о трех стадиях в антропогенной трансформации
экосистемы озера. На первой стадии комплексы диатомей отражают природную среду
относительно чистого олиготрофного озера во всем ее многообразии. Вторая стадия
- стадия начала кризиса экосистемы, в которой нарастающее промышленное загрязнение
водоема вызывает переход системы в состояние неустойчивого равновесия и перестройку
комплексов диатомей. Это период наибольшего разнообразия диатомовой флоры,
когда наряду с ранее существовавшими видами появляются виды, более
приспособленные к новым условиям среды, к более высокому уровню трофии водоема
- эврибионтные, бетамезосапробные, алькалифильные. В третьей стадии дальнейшее
развитие кризиса экосистемы приводит к регрессу большинства видов, доминируют
один или несколько эврибионтных видов.
Наблюдаемые нами в осадках озера
морфологические изменения створок диатомей являются дополнительным и надежным
критерием преобразований экосистемы. Изменения морфотипа эврибионтного вида Aulacoseira
islandica, доминирующего в осадках сильно загрязненных зон экосистемы
озера, особо показательны. Во время первой перестройки комплексов диатомей,
которую вызвало повышение трофности водоема, створки Aulacoseira islandica
увеличиваются в диаметре, структура створок, хотя тонкая, но хорошо различима.
Комплексы диатомей на этой стадии еще довольно разнообразны. На стадии
углубляющегося кризиса экосистемы озера, когда этот вид становится в осадках
абсолютным доминантом, створки мельчают, панцири их очень тонкие, структура
различима только при большом увеличении (более х 1800). Морфологическая
изменчивость A.islandica зависит от наличия доступного кремния и
трофического статуса озер. По мере истощения кремния структура створок
становится более тонкой. В осадках губы Белой наблюдаются уродства створок
реофильных видов Ceratoneis arcus, Meridion circulare, Cymbella ventricosa,
попадающих из относительно чистых рек и ручьев в неблагоприятную загрязненную
среду губы. Створки разновидностей Fragilaria capucina, предпочитающих
мезотрофные воды, мелки и часто уродливы, что также говорит о превышенном для
них уровне загрязнения.
В 1993-1996 гг. в рамках
международного проекта МОЛАР выполнялись комплексные исследования по реконструкции
динамики аэротехногенных нагрузок на Крайнем Севере (Кольский полуостров) на
основе изучения донных осадков из оз. Горное в Чуна-тундре. Колонка мощностью 18 см отбиралась в зоне
аккумуляции озера Чуна-тундры на глубине 16.5 м с использованием трубки гравитационного
типа с автоматически закрывающейся диафрагмой. Колонка донных отложений разделялась
по вертикали через 1см, в полученных пробах
определялся видовой состав диатомей. Кроме того, в каждой пробе
производилось определение химического состава, а также абсолютный возраст для
верхних 6 см
ДО на основе хронологии 210 Pb,
выполненный в Ливерпульском университете, Великобритания (Кашулин и др., 2007).
Анализ видового состава
диатомей, выделенных из 18 см
колонки донных осадков горного озера в Чуна-тундре, не показал резких изменений
структуры сообщества. Разнообразие
диатомей не высокое и не менялось на протяжении рассматриваемого интервала
времени, около 700 лет, принимая во внимание среднюю скорость осадконакопления
0.02 см/год. Это и преобладание видов родов Eunotia и Pinnularia говорит о стабильных
закисленных условиях водоема еще в доисторическое время. Тем не менее вверх по
разрезу происходит частичное замещение одних
видов на другие, преимущественно со слоя 4 - 5 см. Ацидофильная
разновидность Frustulia
rhomboides
var. saxonica замещается «более
кислой» разновидностью Frustulia rhomboids (рН-оптимум
5.1), нейтральная Eunotia
arcus, с рН
оптимумом выше 6.0, ацидобионтной E.exigua, растет
участие во флоре и других ацидобионтных видов в 5 раз, а количество нейтральных
падает в 1.5 раза. Изменение видового состава диатомей вверх по разрезу колонки
и расчеты теоретической рН воды говорят об эпизодическом подкислении озера в
отдельных частях, связанном с аэротехногенным загрязнением окружающей среды.
Изменения диатомовой флоры
выявляются и на более ранних этапах в озере Чуна-тундры. Среди диатомей встречаются
патологические формы, прежде всего среди
видов с широкой экологической амплитудой: перифитона E. lunaris, E. arcus, E. praerupta и
бентоса – Pinnularia
viridis
var. intermedia . Сначала
фиксируются единичные случаи, начиная со слоя 15-16 см (его возраст примерно
500 лет), где встречена P. viridis var. intermedia с
разрушенной структурой ребер в центре и на полюсах створки. Выше постоянно
встречаются пустые сворки этого вида. Со слоя 9 - 10 см патология у
перечисленных видов рода Eunotia
встречается
чаще, со слоя 4 - 5 см
практически в каждой пробе. В слое 5 - 6 см встречена P. viridis var. intermedia с искривленными
и редуцированными ребрами, с нарушенной правильностью очертаний створки.
Имеются данные о доиндустриальном атмосферном загрязнении, в частности озер
южной Швеции, о трансграничных переносах загрязняющих веществ (Pb) из Европы на очень ранних этапах, начиная
с греко-римской культуры (Renberg
et al., 1994) Это влияние загрязняющих веществ
Западной Европы на экосистемы Скандинавии особенно стало ощутимо в Х1Х в., когда
накопление (Pb) стало
выше фонового в 10-20 раз. По данным Даувальтера В. А. (Моисеенко и др, 2000) первый пик Pb зафиксирован в слое 10-12 см, с которого начинаются
частые единичные случаи патологии створок диатомей. Появление в донных осадках
патологических форм диатомей еще на ранних этапах существования озера
подтверждает факт трансграничного переноса загрязняющих веществ из Европы в
Фенноскандию.
На северо-западе Кольского п-ва
изучение диатомей проводилось в ходе комплексных исследований ИППЭС КНЦ РАН в
озерно-речной системе Пасвик, находящейся в зоне выбросов комбината
«Североникель» и хозяйственно-бытовых сбросов г. Никель (Moiseenko et al., 1994) Установлено, что в прошлом
олиготрофные воды р. Пасвик в течение последних 60 лет подвергаются эвтрофированию
вследствие зарегулирования реки и хозяйственной деятельности на водосборе. В
верхнем течении реки трофический статус вод вырос незначительно, слегка
увеличилось биоразнообразие видов. В нижнем течении эвтрофирование прогрессирует
за счет суммарного потока фосфора и органических веществ из озер в окрестностях
г. Никель. Сменился полностью состав видов. В верхней части донных осадков (оз.
Куэтсъярви) доминируют планктонные алькалифильные виды, индикаторы эфтрофных
вод Diatoma
elongatum
- 42%, Asterionella formosa – 22%, Stephanodiscus minutulus – 17%. Наблюдается пик
концентрации диатомей в слое 4 - 6
см и выше – до 170 млн ств/г, значение индекса Стокнера
максимальное для здешних вод – 3.6, разнообразие флоры, рассчитанное по индексу
Менхиника, падает в 2 раза.
ОЦЕНКА СТЕПЕНИ
ОРГАНИЧЕСКОГО ЗАГРЯЗНЕНИЯ ПОЙМЕННЫХ ОЗЁР
ГОСУДАРСТВЕННОГО
ПРИРОДНОГО ЗАПОВЕДНИКА «НУРГУШ»
(КИРОВСКАЯ ОБЛАСТЬ)
Киселёв Г.А.
Estimation of the
organic pollution degree in floodplain
lakes of the state natural reserve
«Nurgush» (the Kirov
Region)
Kiselev G.A.
Санкт-Петербургский
государственный университет. Санкт-Петербург
Университетская
набережная, д. 7/9
e-mail: greenkiss@mail.ru
Государственный природный заповедник «Нургуш»,
расположен на правобережной пойме реки Вятки в пределах одного из самых
северных расширений её дельты. Всего в пределах заповедника насчитывается около
60 пойменных озер и 5 постоянных протоков («речек»), объединяющих все пойменные
водоемы в единую систему. Наиболее крупные пойменные озера, несомненно, представляют
собой остатки древнего русла р. Вятки.
Согласно Программе экомониторинга Кировской области
для контроля состояния экосистем её южной части, входящей в Ветлужский биогеографический
район Восточно-Европейской провинции зоны лиственных лесов в 1997 г. начались работы по
организации Нургушского опорного полигона (на основе заповедника «Нургуш»).
На первом этапе проведены экспедиционные работы по
предварительной оценке экологического состояния территории опорного полигона. В
рамках этих исследований в 1996-2002
г.г. был изучен видовой и некоторые особенности экологического
состава водорослей 8 пойменных озёр: Могильное, Малое Кривое, Нургуш, Кривое,
Чёрное, Нефёдово, Калеичи и Старица.
В альгофлоре озёр заповедника «Нургуш» выявлено 532
вида и внутривидовых таксона, относящихся к сине-зеленым, эвгленовым,
динофитовым, золотистым, диатомовым, зелёным, желто-зеленым водорослям.
Наибольшего качественного разнообразия достигают диатомовые
(245 – 46,46 % от общего числа видов и внутривидовых таксонов), зелёные (160 –
29,85 %), и сине-зеленые (68 – 12,69 %) водоросли.
Сравнение с данными Э.А. Штиной (1997) показывает, что
230 видов и внутривидовых таксонов являются новыми для водоёмов Кировской
области. Большинство обнаруженных водорослей являются широко распространёнными
видами. В озёрах заповедника Нургуш найдено 160 видов и внутривидовых таксонов
водорослей - индикаторов степени органического загрязнения, что составляет 30%
всего видового состава. Для оценки степени загрязнённости водоёмов
органическими веществами нами был использован метод Пантле – Бука в модификации
Сладечека.
Основную часть видов и внутривидовых таксонов (132)
можно отнести к условно «чистым» видам (от χ-сапробов до
β-мезосапробных) и всего 28 к условно «грязным» (от
β-α-мезосапробных до полисапробных). Большинство видов водорослей
доминирующих в альгофлоре обследованных озёр (т.е. имеющие высокие оценки
обилия и встречающиеся в большинстве озёр) относится к группе β –
мезосапробов, т. е. видов, обитающих в водах с умеренным уровнем органического
загрязнения (Баринова и др., 2006).
Содержание органических веществ в водоёмах заповедника
различно и изменяется в течение вегетационного периода. Об этом нам говорят данные
степени сапробности озёр (таблица 1).
Степень содержания органических веществ возрастает в
течении лета. В большинстве озёр отмечено увеличение значений индекса
сапробности к концу летнего периода. В первых числах июня вода в озёрах ещё
продолжает опускаться после весеннего паводка, и её уровень в разных озёрах выше
летнего на 0,5–1м. Но, несмотря на значительную степень влияния разлившихся вод
реки Вятки, уже в это время проявляются отличия в степени сапробности водоёмов.
Так, самыми «чистыми» (b-о-сапробные) являются воды оз. Кривое, оз. Малое Кривое и оз. Нефёдово.
За весь летний период только воды этих трёх озер относятся ко второму классу
чистоты. Надо отметить, что это лучшие показатели сапробности. У всех
остальныех озёр в начале лета класс чистоты вод третий (о-aмезосапробные и b-мезосапробные). Индекс сапробности изменяется в
пределах 1,67-2,01.
Таблица 1
Показатели сапробности озёр заповедника Нургуш
|
Название озера
|
Вегетационный
сезон 2001г.
(начало июня)
|
Вегетационный
сезон 2001г. (конец июля - начало августа)
|
Вегетационный
сезон 1997 г.
(начало августа)
|
|
|
Степень
сапроб-ности
|
Значе-ние индек-са
|
Класс чисто-ты
воды
|
Степень
сапроб-ности
|
Значе-ние индек-са
|
Класс чисто-ты
воды
|
Степень
сапроб-ности
|
Значе-ние индек-са
|
Класс чисто-ты
воды
|
|
Могильное
|
o-a
|
1,72
|
III
|
b
|
1,95
|
III
|
o-a
|
1,77
|
III
|
|
Малое
Кривое
|
b-o
|
1,68
|
II
|
o-a
|
1,88
|
III
|
o-a
|
1,8
|
III
|
|
Нургуш
|
o-a
|
1,89
|
III
|
b
|
1,95
|
III
|
o-a
|
1,83
|
III
|
|
Кривое
|
b-o
|
1,69
|
II
|
o-a
|
1,86
|
III
|
|
|
|
|
Чёрное
|
o-a
|
1,83
|
III
|
b
|
2,12
|
III
|
|
|
|
|
Нефёдово
|
b-o
|
1,67
|
II
|
b
|
1,99
|
III
|
|
|
|
|
Калеичи
|
b
|
2,01
|
III
|
o-a
|
1,84
|
III
|
|
|
|
|
Старица
выше впадения р. Прость
|
o-a
|
1,82
|
III
|
o-a
|
1,81
|
III
|
|
|
|
|
Старица
ниже впадения р. Прость
|
o-a
|
1,76
|
III
|
o-a
|
1,86
|
III
|
|
|
|
|
Старица
ниже впадения р. Боровка
|
b
|
1,91
|
III
|
b
|
1,91
|
III
|
|
|
|
Данные сапробности за конец июля – начало августа
говорят об увеличении содержания органических веществ в воде. Уже все водоёмы
входят в третью группу чистоты вод. Половина из них о-a-мезосапробные, а другие b-мезосапробные. Индекс сапробности изменяется то 1,81
- оз. Старица выше впадения р.Прость до 2,12 – оз. Чёрное. В оз. Старица
впадают две реки, которые привносят в него дополнительную органику, тем самым,
ухудшая показатели сапробности до 1,91 (b-мезосапробные).
Таким образом, распределение сапробионтов в озёрах
заповедника свидетельствует о достаточно большой чистоте их вод. Повышение
индесов сапробности в течение лета находит себе объяснение в накоплении
органических веществ автохтонного происхождения. Водоросли, как еще в свое
время предполагал Пюттер (Putter), а затем
подтвердил Б.С. Алеев (1933), выделяют в воду, особенно после гибели, большое
количество органических соединений (Жадин, 1940). Накоплением подобного рода
веществ обусловлено естественными процессами, протекающими в пойменных озерах.
Интегральные показатели
количественного развития
фитопланктона и его
фотосинтетическая активность
на отрезке реки Свислочь в границах мегаполиса
Ковалевская Р.З., Михеева
Т.М., Лукьянова Е.В.
The integral indices of phytoplankton quantitative development and its
photosynthetic activity on the Svisloch River section within the limits of
megalopolis
Kovalevskaya R.Z., Mikheyeva T.M.,
Lukyanova E.V.
Белорусский госуниверситет
220030, Минск, проспект Независимости, 4
(+375 17) 209-58-03, факс:
(+375 17) 209-58-14
e-mail: mikheyeva@tut.by
Река Свислочь, являясь главной водной магистралью г.
Минска, подвержена широкому комплексу антропогенного воздействия. В результате
создания Вилейско-Минской водной системы река обводнена, ее верхнее течение
практически полностью зарегулировано и превращено в ряд русловых водохранилищ,
часть из которых находится в пределах города. Для сезонного регулирования стока
используется второе по величине в республике Беларусь Заславское водохранилище,
расположенное в десяти километрах на северо-западе от г. Минска. Водосбор реки
в пределах города почти полностью включает всю застроенную территорию г.
Минска, сток с которой отводится ливневой канализацией. В последнее десятилетие
муниципальными властями постоянно проводятся работы по реконструкции, очистке и
благоустройству водосборной территории и отдельных участков реки, что оказывает
влияние на ее функционирование и экологическое состояние.
На протяжении 2006–2008 гг. изучали характер влияния города на количественное
развитие, структурные и функциональные характеристики фитопланктона в речном
потоке. В работе приведены материалы, отражающие пространственную и временную
изменчивость интегральных количественных параметров сообщества (общая биомасса,
содержание хлорофилла-а, скорость фотосинтеза), его фотосинтетическую
активность (ассимиляционное число, Р/В-коэффициент) в вегетационных сезонах
трех лет.
На 7 постоянных створах с апреля по ноябрь в первой декаде каждого
месяца с поверхностного горизонта отбирали пробы для измерения указанных
параметров. Первый и последний створы находились вне пределов г. Минска –
первый (створ 1) в канале поступления Вилейской воды в реку в нескольких
километрах выше Заславского водохранилища, последний (створ 7) – в 10 км ниже города и 9 км ниже сброса стока с
городских очистных сооружений. В границах города два первых створа (2 и 3) были
приурочены к выходу речного потока из двух последовательно расположенных высоко
проточных водохранилищ (Дрозды, Комсомольское озеро), используемых для
рекреации. Последующие створы были расположены на участке реконструированного
русла в густонаселенном районе с наличием промышленных объектов (створы 4 и 5)
и затем на юго-восточной границе городской территории в 0,5 км ниже Чижовского
водохранилища многопрофильного назначения (створ 6). Общая протяженность
наблюдаемого городского отрезка водотока составила более 40 км.
Для измерения величин указанных параметров использовали общепринятые
методы. Скорость потенциального фотосинтеза (Aпот.) определяли в люминостате методом склянок в кислородной модификации,
содержание хлорофилла-а спектрофотометрическим методом ацетоновых
экстрактов в осадках, собранных на ядерных фильтрах с размером пор 1 мкм.
Величины ассимиляционных чисел (САЧ) фитопланктона, приводимые в работе,
выражены в единицах углерода, ассимилированного
на единицу хлорофилла-а (Chl-a, без учета феопигментов) за
сутки. Для перехода от измеренных в кислороде значений скорости фотосинтеза к
единицам углерода принимали ассимиляционный коэффициент равным 1,25 (1 мг О2
эквивалентен 0,3 мг С).
При расчете суточных Р/В-коэффициентов было сделано допущение, что
траты фитопланктона на дыхание составляют 20% от свежесинтезированного
органического вещества (валовой продукции), а содержание углерода в сырой биомассе
водорослей –10 %.
Морфометрические особенности речной системы – чередование русловых и
водохранилищных участков – обусловливают некоторые различия сезонной динамики
рассматриваемых характеристик фитопланктона, более проявляющиеся в периоды
неустойчивой с выпадением осадков погоды. Межгодовые различия сезонной динамики
развития и функционирования фитопланктона в речном потоке в значительной мере
обусловлены различиями климатических характеристик и уровенного режима в разные
годы.
Особенности сезонной динамики интегральных показателей фитопланктона на
выходе из двух, ограничивающих городской отрезок реки водохранилищ (створы 2 и
6), отражены в таблице 1.
Таблица 1
Сезонная динамика интегральных характеристик фитопланктона
р. Свислочь
в начале и конце городского отрезка
|
Годы
|
Створ
|
Месяц
|
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
Сезон
|
|
Общая биомасса, мг/л
|
|
2006
|
2
|
0,58
|
1,88
|
3,39
|
4,06
|
3,98
|
4,53
|
0,92
|
0,41
|
2,47±1,71
|
|
2007
|
1,45
|
1,36
|
5,41
|
7,42
|
21,53
|
2,36
|
1,8
|
0,77
|
5,26±6,97
|
|
2008
|
6,22
|
1,87
|
1,02
|
12,92
|
7,65
|
4,42
|
1,63
|
0,21
|
4,49±4,30
|
|
2006
|
6
|
0,49
|
7,64
|
4,66
|
6,35
|
16,66
|
5,64
|
4,66
|
3,40
|
6,18±4,74
|
|
2007
|
3,81
|
6,3
|
1,7
|
2,29
|
5,57
|
5,87
|
1,23
|
0,26
|
3,38±2,33
|
|
2008
|
1,74
|
8,73
|
3,52
|
2,97
|
12,73
|
7,63
|
4,17
|
0,64
|
5,26±4,08
|
|
Содержание хлорофилла-а,
мкг/л
|
|
2006
|
2
|
2,99
|
7,42
|
7,66
|
19,67
|
25,09
|
30,88
|
14,42
|
3,93
|
14,01±10,33
|
|
2007
|
4,22
|
4,24
|
8,18
|
8,83
|
44,20
|
8,90
|
6,46
|
1,95
|
10,87±13,70
|
|
2008
|
11,45
|
6,21
|
5,67
|
11,99
|
25,9
|
12,65
|
4,87
|
3,19
|
10,24±7,28
|
|
2006
|
6
|
3,38
|
28,74
|
19,12
|
55,98
|
102,61
|
42,25
|
24,36
|
7,03
|
35,43±32,18
|
|
2007
|
22,38
|
38,55
|
11,97
|
34,41
|
35,80
|
33,40
|
6,80
|
2,27
|
23,20±14,43
|
|
2008
|
17,72
|
30,17
|
24,03
|
28,9
|
88,04
|
52,88
|
15,37
|
5,04
|
32,77±26,34
|
|
Относительное (%)
содержание хлорофилла-а в сырой биомассе
|
|
2006
|
2
|
0,52
|
0,39
|
0,23
|
0,48
|
0,63
|
0,68
|
1,57
|
0,96
|
0,68±0,42
|
|
2007
|
0,29
|
0,31
|
0,15
|
0,12
|
0,21
|
0,38
|
0,36
|
0,25
|
0,26±0,09
|
|
2008
|
0,18
|
0,33
|
0,56
|
0,09
|
0,34
|
0,29
|
0,30
|
0,17
|
0,282±0,14
|
|
2006
|
6
|
0,69
|
0,38
|
0,41
|
0,88
|
0,62
|
0,75
|
0,52
|
0,21
|
0,56±0,22
|
|
2007
|
0,59
|
0,61
|
0,70
|
1,50
|
0,64
|
0,57
|
0,55
|
0,87
|
0,76±0,32
|
|
2008
|
1,02
|
0,35
|
0,68
|
0,97
|
0,69
|
0,69
|
0,37
|
0,09
|
0,61±0,32
|
|
Скорость фотосинтеза, мг О2/л
сут
|
|
2006
|
2
|
0,23
|
0,70
|
1,30
|
3,63
|
4,93
|
7,70
|
2,32
|
0,24
|
2,63±2,47
|
|
2007
|
0,18
|
0,30
|
1,01
|
2,00
|
6,34
|
2,58
|
0,78
|
0,12
|
1,66±2,00
|
|
2008
|
1,84
|
0,68
|
1,19
|
1,71
|
5,26
|
2,87
|
0,54
|
0,17
|
1,78±1,65
|
|
2006
|
6
|
0,24
|
2,65
|
0,84
|
6,33
|
10,79
|
6,04
|
3,76
|
0,64
|
3,91±3,33
|
|
2007
|
1,88
|
3,73
|
1,25
|
3,37
|
4,84
|
4,34
|
0,63
|
0,00
|
2,50±1,79
|
|
2008
|
2,66
|
4,48
|
3,20
|
2,83
|
9,97
|
6,77
|
1,53
|
|
4,491±2,83
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
На промежуточных участках речного потока резких отличий от наблюдаемой
динамики на створе 2 не наблюдалось.
Уровень величин всех приведенных показателей свидетельствует о высокой
эвтрофированности городского отрезка реки. Более высокая степень трофности
характерна для конечного створа (6), принимающего поверхностный сток со всей
территории города. Обращает на себя внимание отсутствие синхронности в динамике
общей биомассы водорослей и содержания хлорофилла-а,. Относительное содержание хлорофилла в сырой биомассе колеблется
в широких пределах, достигая в отдельных случаях чрезвычайно высоких значений
(более 1%). В пункте полного смешения речных вод с поступающим с городских
очистных сооружений стоком (створ 7) значения интегральных характеристик
фитопланктона несколько ниже, чем на предыдущем створе, что является, прежде
всего, результатом разбавления большим объемом очищенных вод. Высоко
эвтрофированным оказался участок канала переброски Вилейской воды в реку (створ
1), относительно большая часть которого проходит через сельскохозяйственные
угодья. Среднесезонные значения рассматриваемых показателей на этих створах
приведены в таблице 2.
Таблица 2
Среднесезонные величины интегральных характеристик фитопланктона
на крайних створах наблюдаемого отрезка р. Свислочь в 2006–2008 гг.
|
Годы
|
В, мг/л
|
Chl-a, мкг/л
|
Chl-a, %
|
A пот,
мг О2/л*сут
|
В, мг/л
|
Chl-a, мкг/л
|
Chl-a, %
|
A пот,
мг О2/л*сут
|
|
Створ 1
|
Створ 7
|
|
2006
|
6,3±6,1
|
39,5±26,5
|
0,75±0,32
|
5,0±3,5
|
5,2±3,9
|
25,8±21,9
|
0,54±0,22
|
2,4±1,8
|
|
2007
|
3,4±2,5
|
31,4±32,4
|
0,80±0,32
|
4,8±4,0
|
2,7±2,4
|
15,5±11,0
|
0,63±0,20
|
1,9±1,7
|
|
2008
|
15,7±9,2
|
50,9±24,1
|
0,39±0,26
|
6,2±2,4
|
5,5±3,5
|
22,4±15,4
|
0,47±0,13
|
3,0±1,6
|
Формирование
уровня продукции автотрофных сообществ обусловлено в значительной мере их
фотосинтетической активностью, что определяется как внешними, так и внутренними
факторами. Измерение скорости фотосинтеза фитопланктона в люминостате при
одинаковых температурных и световых условиях исключает их влияние и позволяет
определить значение прочих факторов, контролирующих фотосинтез. В таблице 3 представлены среднесезонные
величины САЧ и Р/В-коэффициентов на всем отрезке речной системы, наблюдаемые в
вегетационных сезонах трех лет. Вариабельность САЧ на каждом из створов на
протяжении сезона достаточно высока – отношение максимальных и минимальных
значений колеблется на отдельных створах от 2 до 7. Наиболее высокие величины
максимальных значений отмечены на первых 4-х створах. Особенно высокими они были
в 2007 г.
– более 80 мгС/мг хлорофилла в сутки – в створах 1 и 2, в то время как на
последних двух створах они составляли менее 50 мгС/мг хлорофилла в сутки.
Пространственная и межгодовая вариабельность среднесезонных значений САЧ
относительно невелика. Тенденция их снижения в створах 6 и 7, наиболее подверженных
влиянию города, во все годы очевидна.
Таблица 3
Фотосинтетическая активность фитопланктона на отрезке
р. Свислочь вегетационных сезонах 2006-2008 гг.
|
Годы
|
Створы
|
Среднее
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
САЧ, мг С/ мг хлорофилл-а в сутки
|
|
2006
|
33,6±11,6
|
43,3±17,5
|
43,4±11,7
|
39,9±16,1
|
34,5±11,1
|
30,5±10,8
|
28,3±13,0
|
36,2±6,8
|
|
2007
|
50,6±17,8
|
40,5±25,6
|
45,8±17,2
|
42,0±12,7
|
42,3±16,1
|
31,8±5,8
|
35,8±11,8
|
41,2±6,3
|
|
2008
|
37,9±8,5
|
50,3±13,4
|
51,2±26,3
|
54,6±15,0
|
|
37,3±6,5
|
33,4±17,6
|
44,1±7,5
|
|
Р/В-коэффициент
|
|
2006
|
2,13±1,47
|
2,43±1,86
|
2,29±1,99
|
2,34±2,03
|
2,07±2,75
|
0,47±0,28
|
1,19±0,71
|
1,85±0,73
|
|
2007
|
2,83±1,20
|
0,83±0,76
|
1,97±1,69
|
1,83±0,86
|
1,64±1,12
|
1,86±0,81
|
1,93±0,78
|
1,84±0,59
|
|
2008
|
1,11±0,69
|
1,90±2,00
|
1,47±1,20
|
1,90±1,03
|
–
|
2,04±0,89
|
1,38±0,44
|
1,56±0,36
|
Сезонная вариабельность Р/В-коэффициентов на створах более значительна,
чем САЧ. Отношение максимальных и минимальных величин в отдельных случаях
достигает 20. Наиболее низкие максимальные значения, также как и САЧ,
приурочены к последним створам. В целом уровень суточных Р/В-коэффициентов
фитопланктона на рассматриваемом отрезке р. Свислочь высок. В пространственном
распределении двух показателей фотосинтетической активности не отмечалось строгой
закономерной связи.
Таким образом, из приведенных показателей наиболее отчетливо негативное
влияние города на функционирование фитопланктона проявилось в снижении
фотосинтетической активности (САЧ).
ОЦЕНКА
ЭКОЛОГИЧЕСКОГО СОСТОЯНИЯ СОЛОНОВАТОВОДНЫХ
ВОДОЕМОВ ПО ИНДИКАТОРНЫМ
ВИДАМ ВОДОРОСЛЕЙ (НА ПРИМЕРЕ
ТИЛИГУЛЬСКОГО
ЛИМАНА, СЕВЕРО - ЗАПАДНОЕ ПРИЧЕРНОМОРЬЕ)
Ковтун О. А.,
Герасимюк В. П.
Ecological assessment
of brackish water
bodies state
by indicate species of algae (case study of the Tigulskiy estuary,
northwest
Prichernomorye)
Kovtun O.A., Gerasimyk V.P.
Одесский
национальный университет имени И. И. Мечникова
ул. Дворянская 2,
Одесса, 65082, Украина, тел. 7465716
е-mail:
hydrobiostation@gmail.com
Чрезвычайное разнообразие экологических условий, в
которых обитают водоросли и их поразительная лабильность к условиям
существования имеет большое значение в связи с использованием их в качестве
индикаторных организмов, в том числе и определения степени загрязнения воды. Преимущество
этого метода состоит в том, что он дает возможность определять среднее
загрязнение за продолжительный промежуток времени, в отличие от химических
методов, дающих только единовременный результат.
Использование водорослей как индикаторов санитарного
состояния водоемов широко известно. Разработаны списки индикаторных организмов
и методы оценки загрязнения вод по этим организмам. Однако, невзирая на это,
многими исследователями [4] отмечается, что в водоемах, в которые
поступает мало органических веществ и где преобладают процессы антропогенного
евтрофирования, использование водорослей-индикаторов сапробности становится
мало эффективным и должно использоваться с осторожностью. Например, такие
α-мезосапробы, как Oscillatoria tenuis, Nitzschia palea и др.,
интенсивно развиваются и в практически чистых (олигосапробных или
β-мезосапробных) водах [6; 9], и такие примеры не единичны. С другой
стороны, водоросли сами влияют на качество воды - и это, по мнению
О. П. Оксиюк [7], одна из актуальнейших проблем прикладной
альгологии. Водоросли поглощают различные загрязняющие примеси, обеспечивают
фотосинтетическую реаэрацию, но вместе с тем синтезированное ими органическое
вещество может стать источником существенного ухудшения качества воды по многим
показателям.
Способность поверхностных вод к самоочищению
определяется эффективностью функционирования биотической составляющей
экосистемы. Известно, что формирование водной экосистемы происходит под
действием и в результате процессов, протекающих и в бассейне водосбора, и во всем водоеме в
целом. Даже весьма подробный химический анализ, оценивая среду обитания, лишь
косвенно может указывать факторы, оказывающие влияние на экосистему или
являющиеся результатом ее жизнедеятельности [2]. Что же касается шкалы видов-индикаторов
сапробности морских вод, то в настоящее время она еще разработана недостаточно
и для многих видов морских диатомовых водорослей отношение к степени
загрязнения воды органическим веществом остается еще невыясненным. В литературе
[1; 3; 8], однако, имеются
отдельные сведения, касающиеся использования морских водорослей в качестве
показателей степени загрязнения морской воды.
На основе результатов исследований, полученных при
изучении водорослей Тилигульского лимана за период с 1990 по 2003 гг., и литературных
данных за предшествующий период времени, нами проведен сравнительный сапробиологический
анализ. Установлено, что основным ядром таксонов диатомовых водорослей
исследуемого водоема являются мезосапробы. Наибольшее количество видов (54)
отмечено для бета-мезосапробной группы, тогда как альфа-мезосапробов найдено
только 20. Эврисапробов обнаружено 15 таксонов и среди них такие широко
распространенные в лимане виды, как Diatoma vulgare f. lineare,
Martiana martyi, Gomphonema acuminatum, G. angustatum, C. scutellum var.
parva, Navicula peregrina, N. viridula, Amphora libyca, Nitzschia linearis,
Rhopalodia gibba, R. gibberula. Обнаружен 1 вид, который встречается в
олиго-бета-мезосапробной зоне – Stephanodiscus rotula, а также 2 вида из
бета-альфа-мезосапробной зоны - Cyclotella meneghiniana и Anorthoneis
hummii. Ксеносапробов в лимане выявлено 4 вида - Diatoma tenue,
Achnanthidium pyrenaica, Amphora ovalis и A. pediculus, которые
являются часто встречающимися бентосными видами. Олигосапробов обнаружено 6
видов - Cocconeis euglypta,
C. placentula, Pinnularia microstauron, Navicula ramosissima, Plagiotropis
lepidoptera и Nitzschia sigma.
Интересным является обнаружение в лимане вида-индикатора эвтрофных вод Черного
моря - Striatella unipunctata.
Сравнительный анализ по сводным литературным данным
показал, что количество альфа-мезосапробов уменьшилось только на 1 %, а
бета-мезосапробов увеличилось на 1,8 %. Несколько уменьшилось и количество эврисапробов
(с 10,7 до 8,3 %) (табл. 1). Виды с неизвестной сапробностью составили 43,7 %.
Таблица 1
Соотношение экологических групп водорослей
микрофитобентоса (в %)
Тилигульского лимана (фактор сапробности)
|
Экологические группы
|
Оригинальный анализ
|
|
Литературные данные
(до 1965 г.)
|
Наши данные
(1990-2003 гг.)
|
|
Альфа-мезосапробы
|
12,0
|
11,0
|
|
Бета-мезосапробы
|
28,0
|
29,8
|
|
Бета-альфа-мезосапробы
|
0,7
|
1,1
|
|
Олигосапробы
|
2,7
|
3,3
|
|
Олиго-бета-мезосапробы
|
-
|
0,6
|
|
Ксеносапробы
|
2,7
|
2,2
|
|
Эврисапробы
|
10,7
|
8,3
|
|
С неизвестным отношением к
органическому загрязнению
|
43,2
|
43,7
|
Величина индекса сапробности вод Тилигульского лимана
(2,3) характеризует его как бета-мезосапробный водоем. Сравнительная
характеристика показала, что общее экологическое состояние лимана остается в
настоящее время достаточно стабильным и, как и ранее [5], лиман является
бета-мезосапробным водоемом. Таким образом, данные оригинальных исследований и
проведенного анализа свидетельствуют о незначительных изменениях экологического
спектра диатомовых водорослей бентоса Тилигульского лимана.
В Тилигульском лимане вода имеет слабо щелочную
реакцию, что определяет встречаемость двух групп водорослей – алкалифилов и
индифферентов. По нашим данным, величина рН в лимане колеблется в пределах 7,5
– 8,7 (среднее значение 8,1). Значение рН медленно увеличивается от зимы к концу
весны, затем снижается летом и вновь увеличивается к осени. Большое значение на
поддержание карбонатного равновесия в водоеме оказывает река Тилигул и
некоторые другие водотоки, впадающие в лиман (мелкие реки и ручьи), с водами,
обогащенными Са2+, концентрация которого может достигать 196 мг/л.
Отмеченные экологические факторы также проявляют в отношении видового состава
диатомовых водорослей определенное влияние.
В период наших исследований отмечено преобладание
алкалифилов, которые представлены в лимане 149 таксонами (82,3 %). Среди них
наиболее часто встречались: в бентосе - Martiana martyi, Оpephora marina, Lyrella lyra, Achnanthes brevipes,
Cocconeis euglypta, C.
scutelum, Diploneis didyma, D. subadvena, Gyrosigma prolongatum, G. fasciola,
Navicula pennata var. pontica,
Amphora caroliniana, A. hyalina,
A. pediculus; в обрастаниях - Melosira
moniliformis, M. varians, Diatoma vulgare f. lineare, Synedra ulna,
Licmophora communis, L. gracilis, Cocconeis scutellum и др.
Группа индифферентов значительно уступала (16 таксонов или 10,7 %) алкалифилам.
В нее входили Navicula salinarum, Gyrosigma spenceri, Diatoma tenue,
Tabularia fasciculata, T. tabulata, Nitzschia communis, N. linearis, N.
vermicularis, Rhopalodia musculus, Surirella ovalis. Как следует из табл. 2,
за период с 1965 г.
по настоящее время таксономический состав по отношению к рН практически не
изменился, однако количество индифферентов, и, в меньшей степени, алкалифилов,
несколько уменьшилось, что закономерно взаимосвязано с увеличением поступления
морской воды и практически двукратным увеличением солености воды в водоеме.
Таким образом, гидрометеорологические условия, динамика компонентов химического
состава воды и физико-химические особенности минерализованной воды являются основными
факторами формирования таксономического состава, распределения диатомовых
водорослей и, в конечном счете, продуктивности исследуемого водоема.
Таблица 2
Соотношение экологических групп водорослей
микрофитобентоса (в %)
Тилигульского лимана (фактор активной реакции среды)
|
Экологические группы
|
Оригинальный анализ
|
|
Литературные данные
(до 1965 г.)
|
Наши данные
(1990-2003 гг.)
|
|
Алкалифилы
|
74,0
|
82,3
|
|
Индифференты
|
10,7
|
10,5
|
|
С неизвестным
отношением к рН
|
15,3
|
7,2
|
Прогноз изменений экосистемы Тилигульского лимана при дальнейшем
увеличении солености и изменении гидрологического режима лимана, несомненно,
представляет как научный, так и практический интерес. Мы считаем, что в ближайшем
будущем, в случае возобновления работы промышленных предприятий одесского
региона, с морской водой из Одесского залива в лиман будет поступать
бóльшее количество загрязнений, что приведет к увеличению доли
эврисапробных видов и повлияет, в общем, на таксономический состав всех групп
гидробионтов. Главной рекомендацией для улучшения (или сохранения)
экологического состояния лимана будет грамотная, продуманная регуляция попусков
морской воды через искусственный канал, которая должна осуществляться в весеннее
время, когда соленость воды Одесского залива значительно уменьшается за счет
паводковых вод Днепра, Днестра и Дуная. Кроме того, большое значение имеет
удержание в лимане пресных вод во время весеннего половодья с целью максимального
разрушения зимней стратификации и перемешивания распресненной воды лимана.
Таким образом, мы считаем, что как и во всем Черном
море, процесс антропогенных изменений в Тилигульском лимане будет
сопровождаться, по-видимому, обеднением его флоры, упрощением структуры всех
донных сообществ, снижением продуктивности и стабильности макро- и микроценозов.
Список литературы
1. Алфимов Н. Н. О роли диатомовых и перидиниевых
водорослей в самоочищении морских вод // Ботан. журн. - 1959. – Т. 44, № 6. –
С. 868-872.
2. Баринова С. С., Медведева Л. А.,
Анисимова О. В. Биоразнообразие водорослей-индикаторов окружающей среды. -
Tel Aviv: PiliesStudio, 2006. – 499 с.
3. Гусляков
Н. Е. Методы изучения морского фитобентоса. Микрофитобентос / Руководство
по методам биологического анализа морской воды и донных отложений / Под ред.
д.б.н. А.В. Цыбань. – Л.: Гидрометеоиздат, 1980. - С. 166-170.
4. Коган
Ш. И. Водоросли как показатели евтрофирования водоемов // Актуальные
проблемы современной альгологии: тезисы докладов I Всесоюзной конференции.
Черкассы, сентябрь 1987 г.
– Киев, 1987. - С. 10-11.
5. Лиманы
Северного Причерноморья // Полищук В. С., Замбриборщ Ф. С., Тимченко
В. М., Новиков Б. И., Гильман В. Л., Журавлева Л. А.,
Александрова Н. Г., Іванов А. И., Россова Є. Я., Мороз
Т. Г. / Отв. ред. Миронов О. Г. - Киев: Наукова думка, 1990. – 204 с.
6. Макрушин А. В.
Биологический анализ качества вод. – Л.: Ин-т зоологии, 1974. – 60 с.
7. Оксиюк
О. П. Роль водорослей в формировании качества воды // Актуальные проблемы
современной альгологии: тезисы докладов I Всесоюзной конференции. Черкассы,
сентябрь 1987. – Киев, 1987. – С. 18.
8. Прошкина-Лавренко
А. И., Алфимов Н. Н. Об использовании диатомовых водорослей при
оценке санитарного состояния морских вод // Ботан. журн. - 1954. – Т. 39, № 1.
– С. 108-112.
9. Унифицированные
методы исследования качества воды. Индикаторы сапробности. – М.: Изд-во СЭВ,
1977. – 91 с.
Продукционные
характеристики фитопланктона
и
их индикаторное значение
Минеева Н.М.
Phytoplankton production characteristics and
their indicator significance
Mineeva N.M.
Институт биологии внутренних вод им. И.Д. Папанина РАН
152742, Ярославская обл., Некоузский район, пос. Борок, тел/факс (48547)
24042
e-mail: mineeva@ibiw.yaroslavl.ru
Оценка трофического состояния водоемов относится к
важнейшим прикладным аспектам гидробиологических исследований. Понятие
трофность (кормность, трофия, трофический статус) соотносят со скоростью
поступления в водоем органического вещества как продуцируемого в экосистеме,
так и попадающего извне. Основным критерием трофии служит скорость образования
автохтонного органического вещества, тесно связанная с развитием его основного
продуцента, в большинстве водоемов ― фитопланктона. Трофия имеет
отношение к зрелости экосистемы, направленности сукцессионных процессов,
взаимодействию водоема с окружающей средой ― водосбором.
Естественные озера за долгий период существования
неоднократно меняли свой трофический статус, поэтому эвтрофирование и
олиготрофизация рассматривались как длительные природные процессы. Во второй
половине XX столетия человечество в глобальном масштабе столкнулось с быстро
развивавшимся антропогенным эвтрофированием, а в последние годы ― со снижением
трофии, которое отмечается для водоемов многих регионов.
Полезным инструментом для управления водными объектами
служит трофическая классификация. Оценка трофических условий может быть либо
качественная (номенклатурная), либо количественная (нумерическая). Понятия
олиготрофия, мезотрофия, эвтрофия прочно вошедшие в обиход лимнологов,
послужили основой для разработки всевозможных количественных критериев трофии.
Все же оптимальным показателем для трофической классификации водных экосистем
можно считать содержание основного фотосинтетического пигмента хлорофилла а (Хл). Первая шкала граничных
концентраций хлорофилла для вод разной трофии предложена Г.Г. Винбергом (1960).
Все последующие шкалы отличаются от нее лишь незначительно, и их авторы также
отдают предпочтение хлорофилльному показателю. В дальнейшем была проделана
огромная работа по выявлению зависимостей между содержанием хлорофилла и
биогенных веществ (общего фосфора, общего азота), а также между хлорофиллом и
прозрачностью воды, что позволило пополнить трофические шкалы этими
параметрами. Следующим этапом стали попытки формализовать трофические шкалы,
заполнив их непрерывным рядом величин. В результате появились разнообразные
индексы трофического состояния (ИТС), к наиболее распространенным из которых
относятся индексы Карлсона, рассчитываемые по содержанию хлорофилла, общего
фосфора и прозрачности (Carlson, 1977), а также предложенный В.В. Бульоном
(1985) ИТС, удачно сочетающийся с концентрациями хлорофилла по шкале трофности
Г.Г. Винберга.
Ранжирование по градиенту трофии продукционных характеристик
фитопланктона, выполненное по данным многолетних наблюдений на водохранилищах
Волги, выявляет их четкие изменения в водах разной трофии (таблица). В
эвтрофных условиях происходит увеличение концентраций не только Хл а, но и дополнительных пигментов
(Хл b,
Хл c,
растительных каротиноидов, феопигментов), процентного содержания Хл а в общем фонде хлорофиллов, но отмечается
снижение других относительных показателей (доля Хл b, Хл c, % феопигментов),
а также пигментных индексов К/Хл, Е480/Е664.
Таблица
Средние величины продукционных характеристик
фитопланктона в водах разной трофии и достоверность различий между ними по
критерию Стьюдента
(по данным многолетних наблюдений на водохранилищах Волги)
|
Параметры
|
Мезотрофные воды
|
Эвтрофные воды
|
t-критерий
|
|
Хл а, мкг/л
|
6.3+0.2
|
24.8+1.1
|
16.5
|
|
Хл b, мкг/л
|
0.6±0.03
|
0.7±0.1
|
1.65
|
|
Хл c, мкг/л
|
1.4±0.1
|
2.6±0.1
|
11.7
|
|
Хл а+b+c, мкг/л
|
7.4±0.1
|
24.3±0.7
|
22.6
|
|
Хл а, %
|
73.9±0.7
|
85.4±0.4
|
14.9
|
|
Хл b, %
|
7.9±0.3
|
3.3±0.2
|
12.6
|
|
Хл c, %
|
18.1±0.4
|
11.3±0.3
|
13.7
|
|
Феопигменты, мкг/л
|
2.0±0.1
|
4.3±0.1
|
16.5
|
|
То же, % от суммы с
«чистым» Хл а
|
33.5±0.8
|
22.2±0.5
|
12.1
|
|
Каротиноиды (К), mSPU/л
|
5.5±0.1
|
17.1±0.6
|
20.2
|
|
К/Хл а
|
1.08±0.02
|
0.83±0.01
|
12.8
|
|
Е480/Е664
|
1.20±0.01
|
0.96±0.01
|
6.37
|
|
Первичная продукция, мг O2/(л·сут)
|
1.43±0.06
|
3.14±0.10
|
14.6
|
|
То же, г O2/(м2
·сут)
|
1.84±0.07
|
3.16±0.09
|
11.5
|
|
Деструкция, мг O2/(л·сут)
|
0.39±0.04
|
0.93±0.04
|
9.55
|
|
То же, г O2/(м2
·сут)
|
2.45±0.18
|
4.45±0.21
|
7.23
|
|
Хл/TP, мкг/мкг
|
0.07±0.003
|
0.50±0.01
|
41.1
|
|
Хл/TN, мкг/мг
|
6.0±0.2
|
23.8±0.7
|
24.4
|
|
U, % от I0
|
0.14 ± 0.01
|
0.25 ± 0.01
|
10.7
|
|
САЧ, мг О2/(мг Хл · сут)
|
223±6
|
140±3
|
12.3
|
|
Д/Хл, мг O2/(мг Хл · ч)
|
2.32±0.10
|
1.70±0.05
|
5.55
|
Изменение по градиенту трофии показателей, непосредственно
характеризующих продуцирование и деструкцию органического вещества, выглядит
следующим образом. При переходе от мезотрофных вод к эвтрофным отмечается увеличение
валовой, эффективной и чистой первичной продукции, а также интенсивности
дыхания (Д). Дыхание ― один из процессов, поддерживающих целостность
экосистемы, должно быть высоким при высокой биомассе, что соответствует увеличению
деструкции в эвтрофных водах.
В эвтрофных водах увеличивается эффективность утилизации
солнечной энергии (I0) фитопланктоном, отражающая переход к
затененной системе, которая характеризуется более высоким коэффициентом
использования света (% U). Растет
также эффективность использования биогенов, свидетельством чего является
увеличение отношений Хл/TP и Хл/TN. В то же время снижаются показатели ассимиляционной и
респираторной активности хлорофилла (САЧ и Д/Хл).
Изменения всех рассматриваемых характеристик по градиенту
трофии не линейны, для большинства из них в определенном интервале ИТС (чаще - на границе мезотрофных и эвтрофных условий) отмечается
более резкое увеличение или снижение.
СЕЗОННЫЕ ОСОБЕННОСТИ РАЗВИТИЯ ФИТОПЛАНКТОНА
ВОДОЕМА ОХЛАДИТЕЛЯ ТЕПЛОВОЙ СТАНЦИИ
(БЕРЕЗОВСКАЯ ГРЭС-1, КРАСНОЯРСКИЙ КРАЙ)
Набатова В.А., Гаевский Н.А., Решеткина Н.А.,
Чупров С.М.
Seasonal
features of phytoplankton development
in the
cooler-reservoir of the heat power station
(Berezovsky
SDPS-1, the Krasnoyarsk
Region)
Nabatova
V.A., Gaevsky N.A., Reshetkina N.A., Chuprov S.V.
Федеральное образовательное учреждение высшего
профессионального образования
«Сибирский государственный университет»,
Институт фундаментальной биологии и биотехнологии
проспект Свободный 79, г. Красноярск, 660041,
(391)-244-87-87
e-mail: nikgna@gmail.com
Водоемы охладители тепловых и атомных станций
представляют особый тип водных экосистем, в которых значительная часть факторов
связана с деятельностью человека. Особые требования к качеству воды, используемой
для охлаждения энергетических агрегатов, вынуждают водопользователей
контролировать химический состав воды и его гидробиологические показатели.
Водоем охладитель Березовской ГРЭС-1 (Красноярский край, г. Шарыпово) образован
в 1986 г.
путем зарегулирования стока реки Береш (бассейн Верхнего Чулыма) в районе
впадения в нее рек Базыр и Кадат. При заполнении водохранилища были затоплены растительные остатки и торфяное месторождение
«Сосняк-Казрак». Массовое всплытие торфа, проявившееся в первые годы существования
водоема-охладителя, мешало работе водозаборных сооружений и сбросного канала, а
также резко ухудшило качество воды. Поэтому в 1993 г. на водохранилище
была сооружена дамба длиной 3,6
км, отсекающая часть водоема площадью 9,7 км2
вместе с основным торфяным месторождением. Образование застойных зон в частях
водоема с малыми глубинами, привело к развитию высшей водной растительности. В
зимнее время сток теплой воды приводит к появлению в юго-восточной части
водоема незамерзающей полыньи площадью до 5 км2.
Площадь зеркала водоема-охладителя при нормальном
подпорном уровне – 35,7км2; полный объем – 193,0 млн. м3;
средняя глубина водоема – 5,97
м, максимальная - 15 м, площадь мелководий с глубинной менее трёх
метров – 19 км2. Характер регулирования стока – сезонный.
Комплексный морфометрический показатель составляет величину 0,92, что
свидетельствует о большой открытости водоема. В водоемах-охладителях с
подобными характеристиками гидрометеорологические факторы активно формируют
гидрологические и гидрофизические процессы. Водообмен в маловодные годы происходит один раз в год. Забор воды из
водоема осуществляется через открытый подводящий канал. Расчетная пропускная
способность – 200 м3/с. Берега водохранилища в основном представляют
собой низкие заболоченные участки, лишь
левый берег в приплотинной части крутой, обрывистый сложен коренной породой.
Воды гидрокарбонатного класса кальциевой группы средней минерализации. Тепловой
режим водоема зависит от метеоусловий и режима работы станции. В июле – августе
в центральной части водоема температура может достигать 25 – 27 °С.
Первые данные о
фитопланктоне водоема – охладителя Березовской были получены в 1986 г. (Чайковская, Кириллов, 1990). Флуоресцентный метод при изучении фитопланктона
водоема охладителя БГРЭС-1 стали применять с 1989 г. В этом году
на большинстве станций преобладали диатомовые водоросли, за ними шли зеленые
водоросли, а синезеленые проявляли себя на станциях в верховьях водоема и
приплотинной части. В июле 1996
г. на всех станциях на первое место вышли зеленые
водоросли, на втором были либо диатомовые, либо синезеленые водоросли. В 1999 г. доминирующее
положение в поверхностном горизонте заняли синезеленые водоросли. Наиболее «урожайным»
в тот период изучения водоема оказался июль 2000 г, в августе на
большинстве станций концентрация хлорофилла достигла 35–85 мг/м3.
В период с 2004 по 2006 гг. гидробиологический
мониторинг водоема охладителя БГРЭС-1 на шести
реперных станциях включал изучение фитопланктона, планктоноядного
зоопланктона и планктоноядных рыб. Сбор информации о структурно-функциональных
характеристик фитопланктона выполнен на основе регистрации прижизненной флуоресценции
хлорофилла «а».
В видовом составе фитопланктона за вегетационный сезон
(апрель-октябрь) 2004 г.
зарегистрировано 47 видов и форм водорослей, относящихся к 6 таксонам: Bacillariophycea – 10 видов, Cyanophycea
– 8, Chlorophyta – 24, Chrysophycea –
1, Dynophyta – 3, Euglenophyta –
1. Большинство видов относились к космополитным планктонным формам (редко
встречались литоральные формы). В сравнении со списками видов водорослей по
другим водохранилищам отмечено невысокое видовое разнообразие.
Видовое разнообразие закономерно увеличивалось от
апреля (6 видов) к июлю (26 видов) и в дальнейшем снижалось к августу (22 вида)
в период «цветения» синезеленых водорослей и до октября (16 видов). К постоянно
встречающимся видам относятся Cyclotella radiosa и Synedra acus. С июня к ним присоединялись Coelastrum microporum, Pediastrum tetras и Tetraedron minimum.
В апреле значительную долю плотностных показателей
фитопланктона (численности и биомассы) составляли Stephanodiscus hantzschii и Asterionella formosa. В
июне и до середины июля доминирование не было выражено, на отдельных станциях
наблюдали увеличение доли разных групп водорослей
по отношению к общим показателям. Так, не превышая 20% от общей биомассы, выделялась
группа двух видов диатомовых – Aulacosira granulata и Cyclotella radiosa, зеленых – Scenedesmus quadricauda и Pediastrum tetras,
синезеленых – Gomphosphaeria lacustris и Anabaena flos-aquae. Со второй половины июля наблюдали массовое развитие
синезеленых водорослей Aphanizomenon flos-aquae, Gomphosphaeria lacustris, Anabaena flos-aquae с
доминированием одного вида до 70%. В отдельные
даты в пробах встречали Microcystis aruginosa
(до 10%). В августе процесс массового развития синезеленых водорослей достигал
максимума. Microcystis aeruginosa в число доминант не входил, но постоянно присутствовал
в пробах. В период «цветения» в пробах регистрировали клетки пиррофитовых - Ceratium hirundinella, диатомовых Сyclotella radiosa и зеленых – рр. Scenedesmus, Pediastrum.
В октябре при общем снижении биомассы основной вклад в плотностные показатели
вносили зеленые водоросли – рр.Tetraedron, Schroederia, Scenedesmus, Staurastrum.
Регистрировался крупный вид зеленой водоросли Closterium sp. Реже встречались клетки диатомовых и синезеленой
водоросли Aphanizomenon flos-aquae. В 2005 г. отмечали сокращение
видового разнообразия по сравнению с 2004 г. Массовое развитие синезеленых регистрировали
с начала июня в комплексе доминант Aphanizomenon flos-aquas, Anabaena flos-aquae, Microcystis aeruginosa до
второй половины августа. Интервал развития синезеленых увеличился по сравнению
с 2004 г.
и включал начало июня – середину августа. Из состава доминант выпала Gomphospheria lacustris. Основные особенности фитопланктонного сообщества в 2006 г.: на протяжении
сезона не регистрировали виды золотистых водорослей, в июле-августе в пробах
присутствовали эвгленовые водоросли. Комплекс доминант составили: в мае –
диатомовая Asterionella formosa, в июле – августе – два вида синезеленых Aphanizomenon flos-aquas, Anabaena flos-aquae. Из
состава доминирующих видов синезеленых водорослей выпали виды Microcystis aeruginosa и
Gomphosphaeria lacustris, которые
встречались единичными колониями.
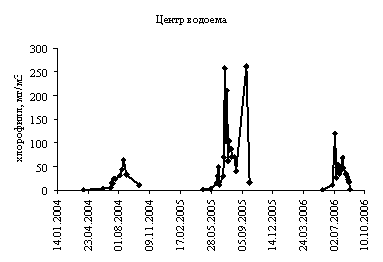
Рис. Динамика
хлорофилла «а» синезеленых водорослей на центральной станции
водоема – охладителя
Березовской ГРЭС-1
Рисунок демонстрирует
межгодовые различия концентрации хлорофилла «а» синезеленых водорослей в центральной
части водоема – охладителя 2004 год характеризовался относительно невысоким и
поздним пиком развития синезеленых водорослей. Наиболее раннее начало цветения
водоема в июне и чрезвычайно высокая степень цветения в июле – августе были
отмечены в 2005 г.
В 2006 году главный максимум цветения развился в начале июля и в целом степень
цветения была ниже, чем в 2005
г., но выше, чем в 2004 г. Анализ сезонных
колебаний метеорологических показателей позволил предположить, что время начала
массового развития синезеленых водорослей определяется суммой среднесуточных
положительных температур (ССПТ) воздуха от даты установления температуры выше 0
°С. По данным 2004 - 2006 г.г.
синезеленые водоросли стали доминировать в июне, когда ССПТ составила 500 –
550 °С. В свою очередь сезонная динамика и степень развития синезеленых
водорослей связана с потоком солнечной радиации.
В период массового
развития синезеленых водорослей участки водоема, питаемые водой рек Базыр,
Береш и Кадат, характеризуются разным соотношением зеленых, диатомовых и
сине-зеленых водорослей. Это указывает на специфику «речных» участков по
сравнению с центральным и приплотинной частями водоема. Особого внимания заслуживает
приплотинный участок водоема, наиболее приближенный к водозабору контура
охладителя БГРЭС-1. Уровень цветения в этой части водоема с июля по сентябрь,
как правило, наиболее высокий.
Работа
выполнена при финансовой поддержке руководства филиала ОГК-4 «Березовская
ГРЭС».
НЕКОТОРЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
АЛЬГОФЛОРЫ ВОДЫ В МЕСТАХ СОДЕРЖАНИЯ МОРСКИХ ЖИВОТНЫХ
Остапчук
Т.В.
Some results of water algal flora researches in the environment of
marine mammals
Оstapchuk T.V.
Научно-исследовательский центр Государственный океанариум Украины
99024, Украина, г. Севастополь, ул. Эпроновская, 7, т. 8-0692-240187, факс
8-0692-242309
е-mail nataliy-andreev@yandex.ru
Важное место среди других гидробионтов, используемых как индикаторы при оценке качества морской среды,
занимают микроводоросли. Особенно это актуально при возросшей антропогенной
нагрузке на прибрежную зону морей. При этом происходит деградация фитоценозов,
сопровождающаяся сменой видового состава, а также изменением соотношения в
сообществе планктонных и бентосных водорослей (Капков и др., 2005, 2008). Показано,
что для своего развития фикобионты требуют строго определенных значений
экологических факторов и поэтому могут служить исследователям в качестве
тест-объекты при экологическом мониторинге изучаемой акватории (Гусляков, 2004).
Целью данной работы было изучение состава
микроводорослей в воде прибрежных вольеров, расположенных на расстоянии до 20 м от берега, в которых
содержались дельфины–афалины (Tursiops truncatus) и дальневосточные сивучи
(Eumetopias jubatus). Для сравнения
параллельно проводилось исследование образцов воды из участков открытой морской
акватории. При отборе проб морской воды для анализа альгофлоры использовался
специальный пробоотборник емкостью 1
л. Посев осуществлялся на жидкие и твердые питательные
среды: № 6 по Громову, Гольдберга и Уолна для выявления более полного спектра
микроводорослей.
Фитопланктон прибрежной части Черного моря, как
указывается в литературе (Рябушко, 2002, 2005), представлен, в основном,
диатомовыми и перединеями. Наши исследования также показали, что доминирующими
в прибрежных вольерах с животными были диатомеи. Чаще всего они встречались в
обросте сетевых перегородок. Здесь обнаруживались представители родов Licmophora, Synedra, Berkeleya, Achnanthes, Cylindrotheca,
Navicula,
Nitzschia и др. Всего было выявлено 32
вида и внутривидовых таксона водорослей: Bacillariophyta, Dinophyta, Chlorophyta, Chrysophyta, Phaeophyta, Rhodophyta.
В составе альгофлоры воды прибрежных вольеров были
обнаружены морские водоросли, принадлежащие в основном к отделу Bacillariophyta (рода Navicula, Licmophora, Amphora, Cylindrotheca, Grammatophor, Nitzschia, Pleurosigma).
Встречались также зеленые водоросли рода Volvox (отдел Chlorophyta).
Выявлено, что в альгоценозах морской воды, взятой из открытой акватории, видовой
состав микроводорослей обеднен. Здесь присутствовали только представители
отдела Bacillariophyta, количество которых было значительно меньше, чем в воде
вольеров с морскими животными.
Нами установлено, что водоросли
достаточно быстро реагировали на изменения параметров водной среды. Отмечено,
что их интенсивное развитие приходилось на весенне-летний период. Кроме того
благоприятные условия для роста микроводорослей и развития гетеротрофной
микрофлоры в районе вольеров формировались в результате постоянного притока
органических веществ в виде продуктов метаболизма морских млекопитающих (Смирнова,
1999).
Диатомовые водоросли, в подавляющем
большинстве, не являются продуцентами токсичных веществ (Рябушко, 2001), однако
при высоких концентрациях, могут быть потенциально опасными для некоторых
гидробионтов, в частности, оказывать негативное влияние на течение заболеваний
кожного покрова у морских млекопитающих. Наши исследования, проводимые ранее (Ostapchuk, 2007) показали, что пик регистрации кожных инфекций
у черноморских афалин, содержащихся в прибрежных вольерах, приходился на период
интенсивного развития водорослей и сопутствующей микрофлоры.
Полученные результаты предварительных
исследований альгофлоры воды в местах содержания морских животных показали, что
альгоценозы воды в вольерах характеризуются видовым разнообразием с
преобладанием диатомовых водорослей. Отмечено, что на период активного развития
микроводорослей в воде вольеров приходился пик кожных заболеваний у морских
животных. Предполагается возможность использования элементов альгомониторинга
для контроля качества воды в местах обитания морских животных, содержащихся в
условиях океанариумов и дельфинариев.
Список литературы
Гусляков Н.Е. Итоги исследования
диатомовых водоростей бентоса Черного моря и сопредельных водоемов // Экология моря. 2004. № 65. С.21 – 27.
Капков В.И., Сабурин М.Ю.,
Беленкина О.А. Восстановление фитоценозов Cystoseira crinita (Phaeophyta) и динамика роста макрофитов на
искусственных рифах // Вестн.Моск.ун-та.Серия 16. Биология. 2005. С.30-34.
Капков В.И., Сабурин М.Ю.,
Беленкина О.А. Водоросли в биомониторинге состояния морских прибрежных
экосистем / Материалы межд.науч.конференции и VΙ Ι Школы по морской
биологии. Ростов-на-Дону. С.169-171.
Рябушко Л.И. негативное влияние
некоторых видов пеннатных диатомовых водорослей на жизнедеятельность морских
гидробионтов // XΙ з,їзд Українське ботанічне товариство (Харків 25-27
вересня 2001). Харьков, 2001. С. 337 – 338.
Рябушко Л.И. Микроводоросли
кожных покровов черноморских дельфинов – афалин в местах их обитания. // В сб.:
«Морські біотехнічні системи». Севастополь. 2002. Вип.2. С. 188 – 203.
Рябушко Л.И. Методические аспекты
изучения биоразнообразия потенциально опасных микроводорослей как индикаторов
состояния морских экосистем // Наук.зап.Терноп.нац.пед.ун-ту им.В. Гнатюка..
Сер.Біологія. Спец.вип. «Гідроекологія». 2005. № 4 (27). С. 201 – 203.
Смирнова Л.Л., Николаенко Т.В.,
Андреева Н.А., Башинский Е.П. Химико– микробиологическая характеристика
прибрежных морских вод с повышенным содержанием органического вещества //
Экология моря. 1999. № 49. С.89 – 93.
Ostapchuk A., Ostapchuk T.
Aetiology, pathogenesis and creeping diseases therapy of the captive bottlenose
dolphins // International Scientific Conference. Modern problems of
microdiology and biotechnology. Odesa. 2007. P. 71.
СОСТАВ И САПРОБИОЛОГИЧЕСКАЯ
ХАРАКТЕРИСТИКА ФИТОПЛАНКТОНА
НЕКОТОРЫХ ВНУТРИГОРОДСКИХ ВОДОЕМОВ САНКТ-ПЕТЕРБУРГА
Павлова О.А., Афанасьева А.Л.
Phytoplankton structure and saprobity characteristic
of some urban water-bodies in St.-Petersburg
Pavlova O.A., Afanasieva A.L.
Учреждение Российской Академии наук Институт
озероведения РАН
г. Санкт-Петербург, ул. Севастьянова, д. 9. Тел. (812)
387-8060, факс (812) 388-7327 е-mail: oksana_pavlova@pochta.ru
На территории Московского парка Победы, расположенного
в южной части Санкт-Петербурга, находятся 9 мелководных ландшафтных водоемов,
испытывающих интенсивное антропогенное воздействие, в первую очередь
рекреационное. Адмиралтейский, Корабельный, Капитанский, Детский и Матросский
пруды соединены между собой протоками и образуют единую водную систему;
Фонтанный, Пейзажный, Командорский и Квадратные пруды являются бессточными. По
гидрохимическим показателям трофический статус водоемов оценивается как
эвтрофный для системы прудов, гиперэвтрофный – для Фонтанного, Командорского и
Квадратных, дистрофный - для Пейзажного
(Теория и практика…, 2007).
Исследование фитопланктона прудов, включающее изучение
видового состава и структурообразующих таксонов и групп, определение количественных показателей
водорослей (численности, биомассы), содержания хлорофилла «а» в воде, а также
расчет индексов сапробности и характеристику трофического статуса, проводили в мае-октябре
2006-2008 гг. Отбор и обработку материалов проводили по стандартным методикам –
количественные пробы фитопланктона объемом 0,5 л отбирали с
поверхностного горизонта, фиксировали раствором Люголя и концентрировали
отстойным методом (Руководство по
методам …, 1983). Биомассу водорослей определяли по объемам массовых видов.
Содержание хлорофилла a (Хл а) в планктоне определяли стандартным
спектрофотометрическим методом в смешанном ацетоновом экстракте (UNESCO, 1966).
Сапробиологическое состояние водоемов определяли на основании индексов по
Пантле и Буку в модификации Сладечека, индикаторная значимость отдельных видов
водорослей оценивалась по спискам сапробных организмов (Водоросли, 1989;
Баринова и др., 2006).
Видовой состав фитопланктона. В планктоне прудов было обнаружено 195 таксонов водорослей
рангом ниже рода (без детального анализа состава диатомей в постоянных
препаратах). Наиболее разнообразными были зеленые водоросли – 75 таксонов (39%
общего числа встреченных форм), синезеленые (19%), диатомовые (15%) и эвгленовые
(10%). Роль основных групп в летнем и осеннем планктоне практически не
отличалась, в июле в большинстве водоемов наблюдали увеличение состава зеленых
водорослей. Максимальное обилие эвгленовых водорослей - показателей органического
загрязнения, характерных для водоемов
урбанизированных ландшафтов (Павлова, 2004), отмечалось в начале лета, затем их
роль существенно снижалась. Самыми разнообразными являются сообщества фитопланктона
в Детском, Адмиралтейском и Командорском прудах. Наименьшее число видов обычно
отмечалось в Пейзажном пруду.
Состав массовых видов, определяющих биомассу
фитопланктона, типичен для альгофлоры озер Северо-Запада и достаточно
однороден. Наибольшей численности достигают виды родов Состав массовых видов,
определяющих биомассу фитопланктона исследованных прудов, был достаточно
однороден. Наибольшей численности достигали Cryptomonas marssonii Skuja, C.
erosa Ehr., C.
curvata Ehr., Chroomonas acuta Uterm., Aphanocapsa delicatissima W.
et G. S. West, Aphanizomenon flos-aquae (L.) Rafls, Microcystis aeruginosa Kütz., Woronichinia naegeliana (Unger) Elenk., Ceratium hirundinella (O. Müll.) Schrank, Peridinium cinctum (Müll.) Ehr., Cyclotella spp., Dinobryon divergens Imh., Chrysococcus rufescens Klebs, Botryococcus braunii Kütz., Chlamydomonas spp., Chlorella spp., Pandorina morum (O. Müll.) Bory, Scenedesmus quadricauda (Turp.) Bréb., Volvox globator (L.) Ehr., Trachelomonas hispida (Perty) Stein
em. Defl., T. volvocina Ehr., Euglena acus Ehr. и
др.
Количественные показатели. Весной наиболее высокая биомасса фитопланктона отмечалась
в Пейзажном пруду (20 мг/л), в остальных прудах она не превышала 4,3 мг/л. В
прудах с максимальным содержанием биогенов – Пейзажном, Командорском,
Квадратных, доминировали криптомонады (Chroomonas acuta, виды рода Cryptomonas); здесь же наблюдались и максимальные величины Хл а –
13,5-42,7 мкг/л. В остальных, как правило, лидировала динофитовая Ceratium hirundinella (до 80%). В прудах с наименьшим содержанием Р -
Матросском и Детском, вновь преобладали Cryptophyta при участии динофлагеллят и золотистых (Dinobryon divergens). Концентрация хлорофилла составляла 0,7-2,1 мкг/л. В
летний период уровень фитопланктона в исследованных водоемах изменялся в
пределах 0,2-20,7 мг/л, содержание Хл а – 1,1-57,4 мкг/л. В 2006 г. наиболее высокие
величины биомассы наблюдались в системе сообщающихся прудов – в среднем 14,1
мг/л, концентрация хлорофилла изменялась от 13,5 до 21,2 мкг/л. В остальных
водоемах биомасса составляла 0,4-5,4 мг/л, Хл а достигал 34,1 мкг/л (Квадратные
пруды). В дальнейшем среднее количество водорослей сократилось и для системы
прудов не превышало 5,3 мг/л, а в Командорском и Квадратных прудах в 2008 г. достигало 9,9-10,3
мг/л; тогда же отмечался максимальный уровень Хл а (до 26,5 мкг/л). Основными
доминантами для Пейзажного, Командорского и Квадратных прудов являются
криптофитовые и эвгленовые водоросли из родов Cryptomonas и
Trachelomonas, достигающие здесь высокой численности. К числу
сопутствующих относятся Oscillatoria princes Vauch., вольвоксовые
Pandorina morum, Volvox globator и
др., динофлагеляты встречаются в незначительных количествах. Для сообщающихся
прудов в первую половину лета характерно массовое развитие крупноклеточных и
колониальных форм - Ceratium hirundinella, Peridinium cinctum, V. globator,
Botryococcus braunii. Субдоминантами обычно выступают разнообразные Chlorococcales, криптомонады, хроококковые синезеленые из родов Woronichinia и Microcystis.В
большинстве прудов в августе наблюдается активная вегетация нитчатых Cyanophyta – Aphanizomenon flos-aquae, A.
klebanhii (Elenk.)
Pechar et Kalina, O. princeps и
видов рода Anabaena. Самое массовое
развитие Aphanizomenon, приближающееся
к стадии цветения, было отмечено в Матросском пруду летом 2006 г. в период
максимального прогрева водной толщи. В середине осени количество
водорослей и содержание Хл а в прудах может достигать экстремально высоких
значений (до 200 мг/л и 547 мкг/л соотв.) за счет цветения криптомонад
(Квадратные пруды) и различных эвгленовых - Euglena acus, E.
spathyrhyncha Skuja,
E. texta (Duj.)
Hubner, Phacus pyrum (Ehr.)
Stein, видов Trachelomonas (Командорский пруд). Интенсивная вегетация водорослей
обусловливалась очень высокими концентрациями биогенных элементов, в первую очередь
фосфора (до 1,25 мг/л). В остальных водоемах количественные показатели
существенно снижаются, биомасса не превышает 1,1 мг/л, содержание Хл а – 3,7
мкг/л, основными доминантами являются Cryptophyta,
вольвоксовые и хлорококковые водоросли.
Характеристика уровня сапробности. Вычисление индексов сапробности было проведено по
численности форм-индикаторов на основе количественных проб. В прудах
Московского парка Победы встречено 124 таксонов, имеющих индикаторное значение
(64% от общего числа). Анализ видового состава
показал, что большинство форм относятся к b-мезосапробам и b-мезо-олигосапробам, характеризующим условия средней
степени загрязнения. Ксеносапробные водоросли,
являющиеся показателями чистых вод, в планктоне прудов не обнаружены.
Индикаторные виды принадлежат в основном
к зеленым, диатомовым, эвгленовым и
синезеленым водорослям.
В мае степень сапробности прудов колеблется от
олигосапробной до β-мезосапробной, индексы составляют 1,63-2,20. Наиболее
низкие величины были получены для Фонтанного прудов, что определяется массовым
развитием олиго-β-мезосапробного Ceratium hirundinella. Большинство прудов по данным весенней съемки
являются олиго-α-мезосапробными (Баринова и др., 2006). В июне-июле
согласно рассчитанным индексам (1,59-2,46) степень сапробности прудов варьирует
от олигосапробной до β-α-мезосапробной. Наиболее низкие индексы
обычно отмечаются для Фонтанного пруда за счет вегетации Ceratium, максимальные – для Пейзажного, Квадратных и Командорского
вследствие массового развития α-сапробных криптомонад (Cryptomonas erosa), а также β-мезосапробных эвгленовых из родов Trachelomonas и
Euglena. Как правило, летом исследованные водоемы являются олиго-α-мезосапробными
со значениями индексов в пределах 1,80-1,99. При благоприятных погодных
условиях и достаточном прогреве водной толщи уровень сапробности снижается,
т.к. в планктоне большинства прудов наблюдается цветение синезеленых
водорослей, в основном β-олиго-мезосапробных Aphanizomenon flos-aquae, Microcystis aeruginosa.
Осенью индексы сапробности в прудах Московского парка Победы заметно возрастают
(1,87-2,39). В результате массового развитием видов-индикаторов высокого
загрязнения органическим веществом – ρ-α- и
β-α-мезосапробных Euglena spathyrhyncha, E. texta (только
в Командорском пруду); α-сапробной C. erosa
и β-мезосапробных показателей умеренного загрязнения – различных зеленых и
эвгленовых водорослей: Scenedesmus quadricauda,
Dyctyospaerium pulchellum Wood,
Pandorina morum, Trachelomonas volvocina,
Euglena acus, а также синезеленых
Woronichinia naegeliana, W.
compacta. Перечисленные виды наибольшей численности достигали
в Квадратных, Командорском, Адмиралтейском и Корабельном прудах. В результате
первый водоем характеризовался как β-α-мезосапробный, три следующих и
Матросский – как β-мезосапробный, в
остальные – как олиго-α-мезосапробные (Баринова и др., 2006).
В целом,
все исследованные пруды по степени сапробности относятся к III классу чистоты и
могут считаться умеренно-загрязненными. В то же время, оценка качества воды и
степени загрязнения водоемов с использованием метода расчета индексов
сапробности не является абсолютно точной. Для некоторых видов водорослей
сапробные валентности еще не определены, и они не учитываются при общей
характеристике уровня возможного загрязнения.
Оценка трофического статуса исследованных водоемов по
показателям фитопланктона. Наиболее
надежной характеристикой для оценки трофического статуса водоемов по
фитопланктону являются средние за вегетационный период величины биомассы
водорослей (Трифонова, 1990). Главным фактором, определяющим эвтрофирование,
является повышение нагрузки биогенов на водоем, прежде всего фосфора,
стимулирующего рост фитопланктона Анализ
динамики биомассы фитопланктона, концентрации хлорофилла а и содержания
общего и минерального фосфора в воде 9 внутригородских водоемов в течение
сезонов 2006-2008 гг. показывает четкую зависимость количественных показателей
водорослей планктона от фона биогенных элементов и подтверждает существующие
представления. В целом, по результатам трех лет исследований к мезотрофным по
фитопланктону относятся Матросский, Капитанский, Корабельный и Детский пруды; Командорский
пруд является высокоэвтрофным водоемом, остальные пруды можно считать
эвтофными. По среднему содержанию хлорофилла а большинство водоемов являются
мезотрофными, Пейзажный пруд – эвтрофным, Квадратные пруды – высокоэвтрофными,
а Командорский пруд – гиперэвтрофным.
Работа
выполнена при частичной финансовой поддержке РФФИ – грант № 08-04-01544.
Список литературы
Баринова С.С, Медведева Л.А.. Анисимова О.В. Биоразнообразие
водорослей-индикаторов окружающей среды. Тель-Авив, 2006. 356 с.
Водоросли. Справочник / Вассер С.П., Кондратьева Н.В.,
Масюк Н.П. и др. Киев: Наук. думка. 1989. 608 с.
Павлова О.А. Структура фитопланктона малых озер в
условиях урбанизированного ландшафта (на примере Суздальских озер г.
Санкт-Петербурга). Автореф. дисс. … канд. биол. наук. СПб. 2004. 24 с.
Руководство по методам гидробиологического анализа
поверхностных вод и донных отложений / под ред. В.А. Абакумова. Л.:
Гидрометеоиздат. 1983. 239 с.
Теория и практика восстановления внутренних водоемов.
СПб.: Изд-во «Лемма», 2007. 394 с.
Трифонова И.С.
Экология и сукцессия озерного фитопланктона. Л.: Наука. 1990. 184с.
UNESCO working
group № 17. Determination of photosynthetic pigments in seawater. Paris. 1966. 69 p.
Голоценовые диатомовые
водоросли в донных осадках озер в оазисе Бангера (Восточная Антарктида)
Пушина З.В.
Diatoms from the Holocene lake
sediment sequences in Bunger Hills (East Antarctica)
Pushina Z.V.
ФГУП
ВНИИОкеангеология
190121, г. Санкт-Петербург, Английский пр., д.
1, т. 535-10-67, факс (812)714-14-70
e-mail: musatova@mail.ru
Использование диатомовых водорослей в целях индикации
водной среды и в мониторинге будет более объективно, если оно учитывает
исследования закономерностей распределения
диатомовых водорослей в осадках в недавнем прошлом – голоцене.
Географические особенности расположения Антарктиды, открытые ото льда в летнее
время озерные водоемы со стабильной
гидрологией, благоприятные для развития диатомовой флоры, практическое отсутствие
терригенного материала при формировании осадков в голоцене, и отсутствие влияния техногенного
фактора позволяет считать район оазиса Бангера одним из ключевых районов в
отношении палеоклиматических построений.
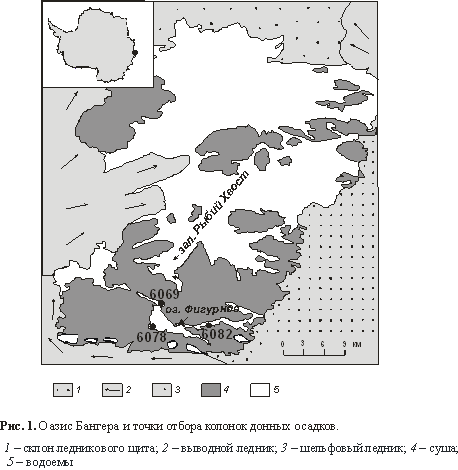
Оазис Бангера представляет собой
свободную от оледенения территорию общей площадью 952 км2, окруженную
с юга, востока и запада выводными ледниками и склоном антарктического ледникового
щита, и отделенную от океана шельфовым ледником Шеклтона на севере (рис. 1).
Одним из основных компонентов природной среды оазиса являются многочисленные
озера, которые значительно различаются по размерам, гидрологическому режиму,
составу вод и биоте. Большинство озер и практически все их типы находятся на
территории Южных Холмов.
Осадки всех изученных
колонок из озер оазиса Бангера, полученных во время экспедиций учеными
РАО и Российско-Немецкой экспедиции, представлены пелитовой фракцией, только в
самых нижних слоях колонок наблюдалось повышение песчаной. Осадки ламинированы,
без следов гравийного переноса, эрозии вследствие донных течений и биотурбации
за счет фаунистической активности. Выделяются два литологических слоя:
терригенный и биогенный, который состоит из двух горизонтов – нижний - сапропели,
образованные остатками водных мхов (moss remains) и верхний, образованный
остатками сине-зеленых и диатомовых водорослей (Verkulich et al., 2002).
Видовое разнообразие
пресноводных диатомей, обнаруженных в осадках, очень низкое – всего определено
15 видов, причем только 4 вида. (Ampora veneta, Diadesmic contenta,
Stauroneis anceps, Hantzschia amphyoxis) имеют высокие количественные
оценки, составляя почти 100% в комплексах. Все эти виды пресноводные,
бентосные. Такое низкое разнообразие бентосных видов в осадках отражает длительный период
ледостава на озерах. Планктонные виды отсутствуют. Это отсутствие, особенно, в
глубоководном озере Фигурное, связано с отсутствием турбуленции (перемешивания),
необходимой для развития кремнистых панцирей диатомей в суспензии в покрытых
льдом озерах. По отношению к показателю
реакции водной среды рH: доминирующий
вид Ampora veneta – алкалибионт; Diadesmic contenta – алкалифил; Stauroneis anceps, Hantzschia amphyoxis -
индифференты. Виды Diadesmic contenta,
Stauroneis anceps, Hantzschia amphyoxis
относятся к группе аэрофилов, которые способны развиваться не только в водном
столбе воды, но и в пересыхающих текучих водотоках Антарктики, определяющих
аллохтонный привнос (Schmidt
et al., 1990,
и др.).
Из осадков озера Фигурное, самого большого на территории оазиса Бангера
(рис.1), были подняты три колонки 6069 (гл. отбора 56 м), 6078 (гл. отбора 118 м), 6082 (75.1 м). Это проточное
озеро, маломинерализованное (17-18 мг/л), по преобладающим ионам вода относится
к типу Na-Ca-Cl-SO4. Постоянство химического состава вод в озере Фигурное по
глубине и по площади отражает интенсивный характер процессов вертикального
перемешивания и межконтурной циркуляции вод в водоеме. Низкое содержание
основных ионов в озере указывает на преимущественное ледниковое питание и на
продолжительный период положительного водного баланса этого транзитного
водоема. Влияние моря на химический состав их вод в настоящее время не
ощущается. Показатель реакции водной среды рН - 6,9-7,4 (Клоков и др., 1989).
Нижний слой осадков, представленный опесчаненным пелитом, формировался
9,5- 7,5 тыс. л. назад. Количество диатомей в осадках крайне низкое. В осадках
колонки 6069 обнаружена только одна створка пресноводного планктонного вида Aulacoseira
granulata. В осадках колонки 6078 створки диатомей встречены тоже редко и
представлены пресноводными бентосными видами Amphora veneta и Stauroneis
anceps. В биогенных осадках,
датируемых 5,5-4,5 тыс. л. назад, обнаружены панцири диатомовых водорослей и
собственно с этого времени начинается развитие диатомовой флоры в озере
Фигурное. В сапропелях, насыщенных остатками водных мхов темного цвета (серые,
темно-серые, зелено-серые и черные) диатомовая экозона 2 определяется по
количественно бедному пресноводному комплексу диатомей. В отдельных интервалах
осадков колонок 6069 и 6082 створки диатомей даже отсутствуют. Диатомеи
представлены пресноводными бентосными
видами Amphora veneta, Stauroneis anceps и Hantzschia amphyoxis.
Обнаружены единичные створки морских диатомей: споры Chaetoceros sp., Thalassiosira
sp. nov., Synedra kamtschatica var. antarctica и др.
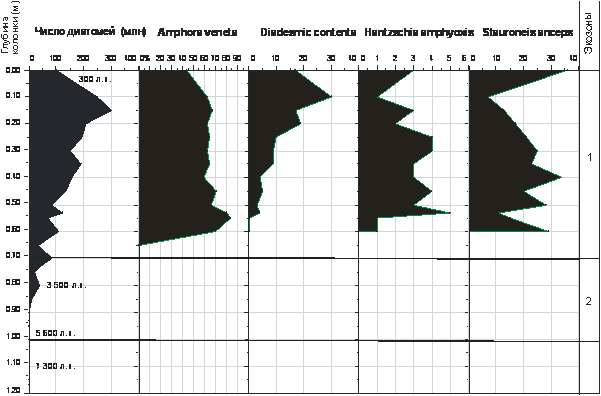
Рис.2. Распределение диатомовых водорослей
(в % от общего состава комплекса) по разрезу колонки
6082
Вышележащие осадки, представленные сапропелями, образованными
сине-зелеными водорослями и диатомеями сероватого, желтоватого и зеленых
оттенков содержат большое количество пресноводных бентосных диатомей при очень
низком видовом разнообразии (экозона 1). В комплексах диатомей
преобладают пеннатные (бентосные) диатомеи. По числу экземпляров доминирует Amphora
veneta (до 90%). Доля видов Stauroneis anceps составила до 40%, Diadesmic
contenta до 30%, Hantzschia amphyoxis до 5%.).
Климатические интерпретации в донных осадках голоцена в водоемах
различных районов побережья Антарктиды неоднозначны. Они показывают
несовпадение как общего климатического тренда, так и кратковременных климатических
флуктуаций в пределах этого периода. На основании изученного материала нами
были сделаны следующие выводы:
- в процессе дегляциации
в раннем голоцене (быстрого разрушения ледовых покровов и поступления
большого количества растаявшей воды) образовалось наибольшее количество
озер оазиса Бангера
- Развитие пресноводной
диатомовой флоры начинается в озерах оазиса около 5-4 тыс. л. назад.
- Условия вегетации
диатомовой флоры на протяжении всего среднего и позднего голоцена были
суровые, что объясняет небольшое видовое разнообразие диатомей,
монодоминантность комплексов, но достаточно благоприятные для массового
развития одного или нескольких видов, которые имеют очень высокие оценки
обилия.
Список литературы
Клоков В.Д., Кауп Э.Б.,
Хендель Д., Цират Р. Химический состав и экологическая характеристика озерных вод оазиса Бангера // Информ. бюл.
Сов. антарктической экспед., 1989. - Вып.111. - С. 91-104.
Schmidt
R., Mausbacher R. and Muller J. Holocene diatom flora and stratigraphy from
sediment cores of two Antarctic lakes (King George
Island) // J. Paleolim. –
3. - 1990. - P. 55-74.
Verkulich
S.R., Melles M., Pushina Z.V., Hubberten H. - W. Holocene environmental changes
and evolution of Figurnoe Lake in the southern Bunger Hills, East
Antarctica. Journal of Paleolimnology. 2002, № 28, p. 253-267.
ВОДОРОСЛИ,
ДОСТИГАЮЩИЕ МАССОВОГО РАЗВИТИЯ И
ВЫЗЫВАЮЩИЕ «ЦВЕТЕНИЕ»
ВОДЫ В ВОДОЕМАХ Г. МОСКВЫ
Романова О.Л.
Algae
reaching mass development and causing bloom
in ponds of
Moscow
Romanova O.L.
ИГКЭ Росгидромета И РАН
107258, ул. Глебовская, 20-б Москва, Россия, т. 169-01-41
e-mail: romanova_orina@mail.ru
Исследованные водоемы г. Москвы имеют разное происхождение и рекреационное назначение. В основном это
искусственные водоемы общегородского назначения.
На состав альгофлоры данных водоемов во многом влияет происхождение и степень антропогенной
нагрузки водоема. Во многом схожи альгофлоры водоемов с одинаковым
происхождением. Однако на массовые виды и виды вызывающие «цветение» воды в
большей степени влияет уровень антропогенной нагрузки. В большинстве водоемов
на протяжение безледного периода массового развития достигали отдельные виды
зеленых, харовых, динофитовых охрофитовых, синезеленых и евгленовых водорослей.
При этом наблюдалось от двух до четырех «цветений», в основном летне-осенний
период. Вызывали «цветение» как правило, синезеленые, охрофитовые, динофитовые
и криптофитовые водоросли. Большинство случаев «цветения» воды были вызваны
синезелеными водорослями. Следует отметить, что синезеленые водоросли
составляют значительную долю в альгофлоре практически всех исследованных
водоемов.
Массовое развитие водорослей относящихся к разным отделам, наблюдалось
в водоемах с относительно благополучным состоянием экосистемы. Как правило, в
этих случаях практически не встречалось большой численности синезеленых
водорослей. В водоемах, экосистемы которых находятся в худшем состоянии,
массового развития и «цветение» воды вызывали в основном, синезеленые
водоросли.
Полученные результаты позволяют сделать вывод, что всем водоемам
свойственно массовое развитие отдельных видов водорослей. Однако какие именно
таксоны водорослей, достигнут массового развития и возможно, вызовут «цветение»
воды в значительной степени зависит от уровня антропогенной нагрузки и от
состояния экосистемы в целом.
МОДИФИКАЦИЯ ДИАТОМОВОГО ИНДЕКСА
ДЛЯ ОЦЕНКИ ЗАГРЯЗНЕНИЯ РЕК ЛАДОЖСКОГО БАССЕЙНА
Русанов А.Г.,
Станиславская Е.В.
MODIFICATION OF DIATOM
INDEX
FOR ASSESSING STREAM
WATER QUALITY IN THE LAKE
LADOGA BASIN
Rusanov A.G., Stanislavskaya E.V.
Институт озероведения РАН
196105, Санкт-Петербург, ул.
Севастьянова, д. 9, тел. 8(812) 3878060; факс 8(812) 3887327
e-mail: a_rusanov@yahoo.com
В настоящее время в Западной и Средней
Европе на основе диатомовых водорослей перифитона разработано большое
количество индексов, используемых для
оценки экологического состояния водотоков. Например, трофический диатомовый индекс Келли и Виттона (Kelly, Whitton, 1995) широко применяется
в биологическом мониторинге трофического статуса рек. Водоросли, благодаря их
широкому географическому распространению и достаточно хорошей изученности экологических
потребностей, могут рассматриваться в качестве универсальных индикаторных
организмов (Баринова и др., 2000). Однако известно, что индикационные
показатели диатомовых водорослей, установленные в
одном географическом регионе, а также индексы на их основе, не всегда применимы
в других районах (Potapova, Charles, 2007). Межрегиональные различия в
таксономическом составе альгофлор, а также влияние региональных факторов,
существенно изменяющих индикаторную значимость видов по отношению к качеству
водной среды, приводят к необходимости разработки индексов, учитывающих
особенности конкретных географических регионов (Kelly et al., 1998; Potapova
et al. 2004).
Цель настоящей работы – разработка индекса
для оценки качества воды в водотоках, основанного на использовании диатомовых
водорослей перифитона и учитывающего региональные особенности Ладожского
бассейна. Для осуществления этой цели
необходимо было решить следующие задачи: 1)
модифицировать список индикаторных таксонов уровня загрязненности воды, и 2) сравнить степень связи полученного индекса и широко
используемых индексов качества воды с изменением концентрации фосфора в
притоках Ладоги и Неве.
Количественные пробы перифитона (135 проб)
отбирали в устьях 18 притоков Ладоги и в истоке Невы в мае, июле и сентябре
2000-2001 гг. Обработку диатомовых водорослей проводили по методу холодного
сжигания хромовой смесью (Балонов, 1975).
Параллельно отбору проб перифитона отбирали пробы
воды для определения концентрации общего фосфора (Pобщ), удельной электропроводности и цветности воды.
Биоиндикационные показатели (оптимумы и границы
толерантности) таксонов определяли по отношению к композиционной переменной
загрязнения водной среды, включающей значения двух гидрохимических параметров – Pобщ и удельной
электропроводности. Значение загрязнения в каждой пробе рассчитывали
суммированием значений Pобщ и удельной
электропроводности, каждое из которых предварительно стандартизировали путем
деления на стандартное отклонение соответствующей гидрохимической переменной.
Численные значения оптимумов и границ толерантности
таксонов в отношении загрязненности воды рассчитывали методом взвешенного
усреднения (ter Braak, van Dam, 1989). Оптимум
(ui) вида,
отражающий чувствительность вида к загрязнению, вычислялся как
среднее арифметическое значений переменной
загрязнения во всех пробах, где встречался вид, взвешенное на относительное
обилие вида:
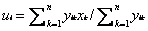 ,
,
где
yik – относительное обилие
(доля биомассы) i-го вида в k-ой пробе; xk – значение переменной
загрязнения в k-ой пробе; n – общее число проб перифитона. Границы
толерантности вида, являющиеся мерой точности индикации уровня загрязнения по
обилию вида, рассчитывались как взвешенное стандартное отклонение оптимума.
Для расчета модифицированного индекса качества (ТL)
для 60-и наиболее массовых таксонов диатомовых водорослей были установлены индикаторные валентности и веса в баллах,
ориентиром для которых служили численные значения экологических оптимумов и
диапазонов толерантности. Значения видовых оптимумов были ранжированы по
возрастанию и разделены на пять интервалов, каждый из которых включал 12 видов.
Значения индикаторной валентности задавались по принадлежности вида к одному из
интервалов значений видовых оптимумов по 5-балльной шкале, варьирующей от 1
(чистые воды) до 5 (сильно загрязненные воды). Значения индикаторного веса,
являющегося мерой разброса по шкале загрязненности, задавались по 3-балльной
шкале. Один балл получали виды, диапазон толерантности которых охватывал 4-5 интервалов
видовых оптимумов, два балла получали виды с диапазоном толерантности,
охватывающим 2-3 интервала оптимумов, и три балла получали виды, если их
диапазон толерантности не превышал одного интервала оптимумов. Далее, используя
установленные значения индикаторных валентностей и весов, для каждой пробы
рассчитывали средневзвешенное значение модифицированного индекса (ТL)
по формуле Зелинки и Марвана (1961):
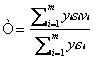 ,
,
где
yi – относительная доля
биомассы i-го вида в пробе; vi – индикаторная валентность
i-го вида; si – индикаторный вес i-го вида.
Параллельно оценка
качества речных вод была проведена при помощи двух трофических диатомовых индексов – индекса Келли и
Виттона (ТKW) (1995) и австрийского индекса (ТA) (Rott et al., 1999), а также индекса
сапробности в модификации Зелинки и Марвана (S) (1961).
Применение метода взвешенного усреднения (ter Braak, van Dam, 1989) позволило установить индивидуальные
индикаторные значения для 60-и наиболее массовых таксонов диатомовых водорослей.
Показателями загрязненных вод в реках Ладожского бассейна являлись Gomphonema parvulum (Kütz.) Kütz., Cocconeis placentula v. euglypta (Ehrenb.) Grun., Fragilaria ulna (Nitzsch) Lange-B., Navicula capitatoradiata Germain, N. pupula Kütz., N. elginensis (Gregory) Ralfs и Nitzschia palea (Kütz.) W. Sm. Индикаторами
чистых вод были Eunotia tenella (Grun.) Hust., E. pectinalis v. undulata (Ralfs) Rabenh., Fragilaria capucina v. rumpens (Kütz.) Lange-B. и Tabellaria flocculosa (Roth) Kütz. Установленные
нами значения индикаторной валентности для
этих видов совпадали с их индикаторными значениями трофности среды, известными
из литературы (van Dam et al., 1994). Однако значительная
часть видов из нашего списка не совпадала с европейским списком
видов-индикаторов (van Dam et al., 1994).
Наиболее значительные расхождения наблюдались для видов рода Eunotia (E. praerupta Ehrenb., E. bilunaris (Ehrenb.) Mills, E. exigua (Breb.) Rabenh.) и Frustulia rhomboides (Ehrenb.) De Toni, которые
в европейском списке индикаторов рассматриваются как показатели олиготрофных
условий (van Dam et al.,
1994; Kelly, Whitton, 1995),
а по результатам нашего исследования являются индикаторами эвтрофирования,
доминируя в гумифицированных водотоках с высоким содержанием фосфора в северной
части Ладожского бассейна. Различия в индикаторной значимости видов между нашим
и европейским списком индикаторов могут быть связаны со специфическими
условиями, характерными для сильно гумифицированных рек Ладожского бассейна.
Известно, что в водоемах с высокой цветностью вод большая часть минерального
фосфора находится в химически связанном состоянии с растворенными в воде
гуминовыми веществами (Jones
et al.,
1988; Meili, 1992).
Очевидно, связывание фосфатов с
гуминовыми веществами приводит к снижению доступности фосфора для водорослей и,
тем самым, благоприятствует развитию видов, нетребовательных к высокому
содержанию биогенных соединений.
Значения
модифицированного индекса (ТL) отрицательно коррелировали
с географической широтой станций отбора проб перифитона (r = -0.55, p < 0.05), указывая на снижение качества вод в реках
Ладожского бассейна с севера на юг. Зональное изменение качества воды в
водотоках отражает более высокий уровень сельскохозяйственной освоенности
водосборной территории в южной части Ладожского
бассейна (Расплетина и др. 2006). Однако
эта градация оказалась неодинаковой для водотоков разного размера. В крупных
реках зональное изменение качества вод было выражено заметно слабее (r = -0.50, p < 0.05), чем в средних (r = -0.63, p < 0.01) и малых (r = -0.68, p < 0.01) реках, наиболее тесно связанных с локальной
обстановкой на водосборе.
Корреляционный анализ показал, что между значениями
модифицированного индекса (ТL) и уровнем Pобщ в исследованных
реках существует тесная связь на высоком уровне статистической значимости
(Таблица). Корреляция ТL с удельной
электропроводностью была несколько выше таковой с концентрацией Pобщ.
Поскольку в реках Ладожского бассейна удельная
электропроводность увеличивается с севера на юг, тесная связь индекса с удельной
электропроводностью подтверждает, что зональный характер изменения качества
воды в исследованных водотоках вызван различиями в сельскохозяйственной
освоенности южной и северной части бассейна Ладоги.
Таблица
Коэффициенты линейной корреляции Пирсона индексов
качества воды,
удельной электропроводности (УЭП) и содержания Pобщ.
|
Индекс
|
УЭП
|
Робщ
|
|
|
|
|
ТL
|
ТKW
|
ТА
|
|
Модифицированный
(ТL)
|
0.80***
|
0.71***
|
|
|
|
|
Келли
и Виттона (ТKW)
|
0.74***
|
0.21
|
0.61**
|
|
|
|
Австрийский (ТА)
|
0.86***
|
0.57*
|
0.86***
|
0.67**
|
|
|
Индекс
сапробности (S)
|
0.74***
|
0.22
|
0.74***
|
0.73***
|
0.75***
|
Коэффициенты корреляции значимы: ***
при р < 0.001; ** при р < 0.01; * при р < 0.05.
Среди индексов ТKW, ТA и S, только ТA достоверно коррелировал с Pобщ;
корреляция ТKW и S с концентрацией Pобщ была
статистически незначимой (Таблица). Однако все три индекса оказались
положительно связаны с изменением удельной
электропроводности. Таким образом, индексы оказались слабо чувствительны
к изменению качества воды, связанного с увеличением концентрации Pобщ, хотя
и отражали увеличение загрязненности рек с севера на юг. Вследствие слабой связи
индексов с изменением концентрации Pобщ, оценки качества вод с использованием данных индексов
были завышены в гумифицированных реках с повышенным содержанием Pобщ в северной
части бассейна Ладоги. Это указывает на неэффективность использования
трофических индексов разработанных в Западной и Средней
Европе, а также индекса сапробности в качестве показателей загрязненности
рек Ладожского бассейна.
В целом, разработанная модификация
диатомового индекса является достаточно эффективным инструментом для оценки
антропогенного загрязнения водотоков Ладожского бассейна. Результаты нашей
работы свидетельствуют о том, что для усовершенствования системы биоиндикации качества
воды по диатомовым водорослям перифитона необходимо принимать во внимание региональные особенности
альгофлоры и учитывать влияние региональных факторов.
Работа выполнена при поддержке РФФИ, грант
№ 08-04-01544.
УСТОЙЧИВОСТЬ Eustigmatos magnus
(B. Petersen) Hibberd
Eustigmatophyta К
ВОЗДЕЙСТВИЮ ХЛОРИДА КАЛИЯ
Сафиуллина Л.М.,
Фазлутдинова А.И., Бакиева Г.Р., Гайсина Л.А.
RESISTANCE OF EUSTIGMATOS MAGNUS
(B. PETERSEN) HIBBERD
EUSTIGMATOPHYTA TO INFLUENCE of potassium chloride
Safiullina L.M., Fazlutdinova A.I., Bakieva G.R., Gaysina L.A.
Башкирский государственный педагогический университет им. М. Акмуллы
450000, Республика Башкортостан, г. Уфа, ул. Октябрьской революции 3а
тел.: 8 (347) 273-02-90, факс 8 (347) 273-34-90
e-mail: saflilya@mail.ru
Наиболее выгодным и эффективным фактором повышения
плодородия сельскохозяйственных почв является правильное применение минеральных
удобрений. Не редко в агроэкосистемы питательные вещества поступают в гораздо
большем количестве, чем требуется для получения первичной продукции. В данных
условиях сельскохозяйственным экосистемам наносится не только экономический
ущерб, но и отмечается изменение их продуктивности. Чтобы избежать отрицательных
последствий чрезмерного внесения удобрений необходимо определить дозы минеральных
веществ на основании результатов функционирования почвенных микроорганизмов в
целом, и альгоценозов в частности.
Сведения о влиянии удобрений на развитие почвенных
водорослей достаточно противоречивы (Голлербах, Штина, 1959).
Калий необходим растениям в любое время года в
качестве физиологического раствора создающего внутреннюю среду организма. При
недостатке калия снижается тургор в клетках. Основным источником калия
вносимого в почвы агроэкосистем является хлорид калия, содержащий 53-60%
действующего вещества. (Микроорганизмы…, 1989).
Нами были проведены эксперименты по изучению влияния
хлорида калия на морфологические показатели одноклеточной водоросли Eustigmatos magnus (J.B Petersen) Hibberd 1981, syn. Pleurochloris magna J.B Petersen 1932. Клетки этой водоросли имеют шаровидные формы с
диаметром 6-12, редко до 21 мкм, с тонкой оболочкой. Хроматофор один,
чашевидный, с глубоко вырезанными лопатовидными краями, что создает впечатление
нескольких хроматофоров, без пиреноида. В протопласте клеток нередко образуются
белковые кристаллы угловатой формы, которые достигают больших размеров, а также
вакуоли клеточного сока, окруженные блестящими зернами (Дедусенко-Щеголева,
Голлербах, 1962). E.magnus входит в
комплекс доминантных видов, постоянно встречающихся в пахотных почвах и в
почвах антропогенно нарушенных территорий (Кабиров, Шилова, 1994; Кузяхметов и
др., 1975; Дубовик, 1995).
Хлорид калия
испытывали в следующих концентрациях (в моль/л действующего вещества): 1х10-3,
5х10-3, 1х10-2, 5х10-2, 0,1, 0,3. Эксперименты
проводили в жидкой питательной среде Болда. Просмотр проводили на 7 и 14 дни. В
каждой серии эксперимента измеряли по 50 клеток водорослей. Достоверность
результатов оценивали с использованием критерия Стьюдента (Лакин, 1990) в программе
Statistica for Windows.
В ходе эксперимента нами было установлено, что
внесение хлорида калия вызывало незначительные изменения размерных признаков E. magnus. Концентрация 0,3 моль/л приводила к полной гибели
клеток. Концентрация 0,1 моль/л вызывала сильную грануляцию протопласта и
деформацию формы клеток. При концентрациях 5х10-2 также наблюдались
грануляция и деформация, при этом размеры клеток уменьшались. Концентрация 1х10-2
так же вызывала грануляцию в клетках E. magnus,
однако уродливость форм исчезла. Данная концентрация приводила к образованию
крупных вакуолей в клетках водоросли. Концентрации 5х10-3 и 1х10-3
не вызывали размерных и морфологических изменений E. magnus.
Путем измерения реакции среды нами было установлено, что хлорид калия не вызывал
значительного изменения рН растворов по сравнению с контролем (контроль
рН=6,92, самая высокая концентрация 0,3 моль/л рН=6,87). Таким образом,
достоверно можно сказать о влиянии именно действующего вещества удобрения на
почвенную водоросль E. magnus.
Схожие результаты о воздействии хлорида калия на Xanthonema exile (Хanthopyta)
имеются в работе Л.А. Гайсиной (2000). По ее данным концентрация 0,3 моль/л так
же вызывала полное разрушение клеток водоросли. Морфологические нарушения при
внесении хлорида калия наблюдались в виде появления бесформенных и эллипсоидных
клеток, а также в виде полного разрушении клеточного содержимого. Как отмечает
автор, удобрение вызывало скачкообразные изменения в увеличении длины клеток.
Однако, по результатам Л.Х. Зариповой (2009) при воздействии этого же удобрения
на Cylindrospermum
michailovskoënse Elenk.(Cyanoprokaryota)
гибель вегетативных клеток и гетероцист наступала уже при концентрациях от
5×10-2 моль/л и более. При концентрациях 1×10-3
моль/л для вегетативных клеток и гетероцист и при 5×10-3
моль/л для спор морфологических изменений в сторону нарушений не наблюдалось.
При
обобщении полученных результатов нами была построена лепестковая диаграмма, где
по осям ординат откладывали размерные признаки водоросли в мкм при
соответствующих концентрациях хлорида калия в моль/л (рис.1).
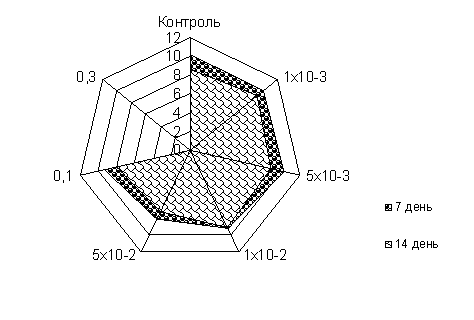
Рис. 1. Влияние хлорида калия
на морфометрические показатели Eustigmatos magnus
Таким образом,
результаты изучения действия хлорида калия на почвенную водоросль E. magnus свидетельствуют о том, что исследованное удобрение
оказывало влияние на морфометрические показатели и вызывало изменение морфологии
клеток. Водоросль проявляла высокую чувствительность к воздействию хлорида
калия. Это позволяет рекомендовать E. magnus для
использования в системе биомониторинга наряду с другими представителями почвенных
эукариотических водорослей.
Список
литературы
Гайсина Л.А.
Биология и экология Xanthonema exile (Klebs) Silva (Xanthophyceae, Chrysophyta). Автореф. дисс…..канд. биол. н. Уфа: БГПИ, 2000. 17
с.
Голлербах М.М.,
Штина Э.А. Почвенные водоросли. Л.: Наука, 1969. 228 с.
Дедусенко-Щеголева
Н.Т., Голлербах М.М. Желтозеленые водоросли //Определитель пресноводных водорослей
СССР. М.; Л., 1962. Вып. 5. 272 с.
Дубовик И.Е. Водоросли
эродированных почв и альгологическая оценка почвозащитных мероприятий. Уфа:
Башк. ун-т. 1995. 156 с.
Зарипова Л.Х.
Биология и экология почвенной цианобактерии Cylindrospermum michailovskoënse (Cyanoprokaryota).
Автореф. дисс. … канд. биол. н. Уфа: БГПУ, им. М. Акмуллы 2009. 17 с.
Кабиров Р.Р. Шилова
И.И. Сообщества почвенных водорослей на территории промышленных предприятий //
Экология. – 1994. - № 6. – С. 16-20.
Кузяхметов Г.Г.,
Минибаев Р.Г., Боев В.Г. Флора водорослей некоторых почв Башкирии // Состав и
динамика численности альгофлоры почв и некоторые вопросы агрофитоценологии.
Уфа, 1975. С. 39-51.
Лакин Г.Ф.
Биометрия. М: Высш. шк., 1990. 352 с.
Микроорганизмы и
охрана почв / Под ред. Д.Г. Звягинцева. – М.: Изд-во МГУ, 1989.-206 с.
АЛЬГОИНДИКАЦИЯ СОСТОЯНИЯ ВОДОЕМОВ-ОХЛАДИТЕЛЕЙ
КАЛИНИНСКОЙ АЭС
Серяков С.А.
ALGAL
INDICATION OF WATER СONDITION IN COOLING RESERVOIRS
of the Kalinin
nuclear power plant
Serjakov S.A.
Тверской институт экологии и права
Tver Institute of
Ecology and Law
Тел. 89109396081; e-mail: seryakov@knpp.ru
Phytoplankton
features as indicator are determined by presence or absence of some algae and
cyanoprocaryotes species as well as by their density. To monitor a reservoir
water condition in hydrocooling water-reservoirs of Kalinin Atomic Power
Station the long term dynamics was observed as compared with other
water-reservoirs which were not included into the cooling system.
Ключевые
слова: альгофлора, сапробность,
водоемы-охладители, тепловое загрязнение, Калининская АЭС, Тверская область.
Индикаторные свойства фитопланктона, как показателя
качества пресного водоёма определяются фактом нахождения или отсутствия
определенных видов водорослей и цианопрокариот, а также степенью их количественного
развития. Изучаемые объекты служат в некотором роде барьером безопасности, по
которому не трудно спрогнозировать возможные последствия воздействия техногенного
фактора на человека. Чтобы оценить состояние вод по гидробиологическим показателям
в водоемах-охладителях КлнАЭС была прослежена их многолетняя динамика.
Решение изучить санитарное состояние водоемов-охладителей
Калининской АЭС - вполне обосновано.
Экологи всего Мира
всё чаще заостряют своё внимание на качестве окружающей среды и в большинстве
случаев на проблемах качества пресных и питьевых вод. Мне также не безразлично
наше «экологическое» настоящее и будущее, так как мы проживаем в районе атомной
станции, мощность которой продолжает нарастать.
В настоящий момент работают три энергоблока с
реакторами ВВЭР-1000 и идет строительство четвертого энергоблока.
Поскольку тема работы связана с водоемами,
использующимися в качестве единого охладителя КлнАЭС, прежде всего нас
заинтересовали вопросы:
- о видовом составе альгофлоры как показателе качества
воды,
- о тепловом загрязнении.
Актуальность темы состоит в том, что при происходящем
в нашей стране решительном развитии атомной энергетики каждому человеку
необходимо осмысление этого события с точки зрения его защищенности. Некоторые
свежие гидробиологические данные о тепловом воздействии и санитарном состоянии
озер, на берегах которых расположен город Удомля Тверской области и КлнАЭС, позволят
получить реальные результаты с точки зрения безопасности человека.
Целью работы было провести биоиндикацию качества воды
озёр-охладителей Калининской АЭС в лабораторных условиях и сравнить с
результатами, полученными в предыдущие годы исследований. Задачи исследования:
1. Выявить видовой состав альгофлоры озёр-охладителей
КлнАЭС.
2. Сравнить полученные результаты с результатами
прошлых лет.
3. Дать заключение о влиянии КлнАЭС на санитарное
состояние водоемов охладителей.
Пробы
планктона и перифитона отбирали на шести станциях озёр-охладителей планктонной
сетью Апштейна из мельничного газа № 40. Материал сразу же был зафиксирован в
4%-ном раствором формалина. Таксономическую принадлежность цианопрокариот и
водорослей устанавливали по атласам сапробных организмов и определителям в
лабораторных условиях. В начале исследований для подсчета числа экземпляров (в
15 полях зрения при увеличении 10×20 и 10х40) использовали микроскопы
Минимед 501 с осветителем, объект и окулярмикрометром, применяя цифровую камеру
Pentax Optio, а
в последние годы микроскоп Olympus CX 31 со
встроенной видеокамерой и выходом на компьютер при использовании программы
определения размеров клеток водорослей SCA.EXE.
Рис. 1. Карта схема озёр-охладителей Калининской АЭС, с
указанием точек отбора проб
Озеро Удомля расположено в 3-х километрах к
северо-востоку от города Удомля Тверской области. Озеро Песьво расположено
юго-западнее озера Удомля. Озера Удомля и Песьво соединены между собой
протокой, зарегулированы гидроузлом на реке Съежа.
Длина озера Удомля с севера на юг – 7,5 километров,
ширина с запада на восток – 1,4 километров при длине береговой линии 26,5 километров,
средней глубине 10 м,
полезном объеме 27 млн м3, полном объеме 122 млн м3
и площади зеркала 12,5 км2.
Ширина озера
Песьво с севера на юг – 4 километра, а с запада на восток – 2,9 километра при
длине береговой линии 17,5
километров, средней глубине 2,7 м, полном объеме 35,4 млн
м3 и площади зеркала 8,7 км2.
Озера Удомля и Песьво относятся к бассейну Балтийского
моря. В них впадают реки Овсянка, Сьюча, Тихомандрица и Хомутовка. Из озера
Удомля вытекает р. Съежа с минимальным среднемесячным расходом Р = 95% в летнюю
межень 0,23 м3/с, в зимнюю межень – 0,29 м3/с. Санитарный
расход воды составляет 0,50 м3/с.
Федеральное государственное учреждение здравоохранения
«Центр гигиены и эпидемиологии № 141» Федерального медико-биологического
агентства России ФГУЗ ЦГиЭ № 141 по договору с Калининской АЭС ведет мониторинг
санитарно-гигиенического состояния озер-охладителей в совпадающими с нашими
контрольными точками. По итогам 2006-2008гг превышений гигиенических нормативов
не было выявлено.
Далее подробнее опишу результаты наблюдений последних лет, а именно 2006-2008гг.
В 2006 году альгофлора на 7
станциях забора проб включала 59 видов водорослей и цианопрокариот.
Из них 14 видов зелёных водорослей, 30 видов диатомовых, 10 видов цианопрокариот
и 5 видов жёлтозелёных. Термофильных
видов не обнаружено. Показатели качества воды, т.е. сапробности (S)
выявленной по формуле Стребле и Краутера
были следующими: min в Т№2 = 0 (октябрь); max в Т№4
= 2,5 (октябрь). Всего было
выявлено 14 индикаторных видов.
В 2007 году на этих же станциях
было выявлено 146 видов водорослей, включая динофлагеляты и цианопрокариоты, преобладающим были диатомеи – 76 видов, зелёных – 39
видов, цианопрокариот – 23 вида. К динофитам отнесли – 4 вида, к золотистым – 2 вида, к эвгленовым – 1 вид, к
красным – 1. Из диатомовых водорослей выявлено 7 теплолюбивых видов, 5
холодолюбивых и 1 эвритермный вид; из зелёных
(Chlorophyta) было найдено 2 термофильных вида: Gonatozygon brebissonii и Ulothrix
moniliformis Kutz. Коэффициент сапробности был: max в Т№3=2,6 (август); min в Т№6=1,9 (май). Индикаторными
свойствами обладал 91 вид.
В 2008 году на 7 точках озёр-охладителей Калининской АЭС Песьво и
Удомля нами было обнаружено 106 видов
индикаторов водной среды из 165 обнаруженных видов водорослей, в период с
мая по октябрь. Из них 89 видов – диатомовые, 48 видов – зелёные, 22 –
цианопрокариоты, 5 –желтозеленые, 1 – золотистые. Термофильных
видов не обнаружено. В т. №3
(сентябрь) индекс качества был min и
составил 1,3; Июньская
вода этой же точки имела max коэффициент среди 7 зон наблюдений, равный 2,8.
Обобщая результаты многолетних исследований 1984-2008гг.,
можно отметить: существенного влияния тепловые сбросы и сточные воды
Калининской АЭС на альгофлору не оказывают.
Распределение фитопланктона по акватории исследуемых
водных объектов КлнАЭС связанно со многими особенностями среды обитания,
например с температурой воды.
Зоны сильного, умеренного подогрева и естественного
температурного режима в водоеме-охладителе характеризуются похожим комплексом
доминирующих видов, особенно среди диатомовых и зелёных водорослей.
Динамика альгофлоры водоемов-охладителей озер Песьво и Удомля показана в табл. 1.
Делая заключение
о качестве воды, хочется дать положительную оценку санитарному состоянию
водоёмов-охладителей Калининской АЭС.
Таблица 1. Динамика развития альгофлоры 1984
–2008гг.
Сброс подогретых вод существенного влияния на
количественное развитие фитопланктона водоема-охладителя не оказывает. Незначительные
потери фитопланктона за счет механического, термического и химического
воздействия в водоеме-охладителе быстро восстанавливаются.
СТРАТИФИКАЦИЯ МОРСКИХ МИКРОВОДОРОСЛЕЙ В ПЕРИФИТОНЕ И
ДОННЫХ ОТЛОЖЕНИЯХ МИКРОКОСМОВ ПОД ДЕЙСТВИЕМ МЫШЬЯКА
Смирнова Л.Л.1,
Андреева Н.А.1, Антонова Л.С.2
Stratification of the marine microalgae in periphyton and
bottom sediments of microcosms under arsenic impact
Smyrnova L.L. 1, Andreeva N.A. 1,
Antonova L.S. 2
1Научно-исследовательский центр Государственный океанариум
Украины
99024, Украина, г. Севастополь, ул. Эпроновская, 7, т. 8-0692-240187,
факс 8-0692-242309
е-mail nataliy-andreev@yandex.ru
2Институт
прикладних проблем физики и биофизики НАН Украины,
г. Киев, Украина
В шельфовой зоне крымского побережья Черного моря и в
Керченском проливе обнаружены участки донных отложений, загрязненные химическими токсикантами. В состав токсикантов входили
продукты гидролиза химических отравляющих веществ (иприта, люизита). В основном
это различные хлорорганические сульфиды и соединения мышьяка (Антонова и др., 2002). Отмечено, что повышенное содержание соединений серы
приводило к доминированию в альгоценозах донных отложений гетероцистных форм
цианобактерий и к уменьшению размеров панциря некоторых видов бентосных
диатомей (Андреева и др., 2008).
Микробиологические исследования загрязненных морских
грунтов показали, что мышьяксодержащие соединения оказывали значительный
биологический эффект на донную микрофлору. При концентрации мышьяка, превышающей
0,06 – 0,08% отмечалось отсутствие жизнедеятельности всех групп микроорганизмов
(Смирнова и др., 2005). Мышьяк, как добавка, присутствует во многих отравляющих
веществах, он устойчив в морской среде и поэтому может быть индикатором мест
захоронения химических токсикантов в море (Garnaga et al., 2006). В донных отложениях
Керченского пролива уровень содержания мышьяка изменяется от фоновых значений
10 – 60 мкг/г грунта до 60000 мкг/г грунта на
участках, загрязненных токсикантами (Рябинин и др., 2004; Смирнова и др.,
2005). Экологическое благополучие морских донных отложений связано со
сбалансированным функционированием как гетеротрофной, так и фототрофной
составляющих микробентоса. При трансформации биогенных элементов в прибрежных
акваториях Черного моря большую роль играют бентосные диатомовые водоросли,
которые являются наиболее изученной группой фотосинтезирующих микроорганизмов (Гусляков,
2004; Рябушко, 2008).Влияние
соединений мышьяка на бентосные альгобактериальные сообщества остается
практически не изученным. В данной работе приводятся результаты исследования
длительного воздействия мышьяка на структуру и разнообразие донной
микроальгофлоры. Экспериментальные работы проводили в лабораторных условиях
методом микрокосмов (Романенко, 2001). Концентрация мышьяка определяли
вольтамперометрическим методом на анализаторе АВА-3.
Из естественной морской воды и донных
отложений были созданы микрокосмы, моделирующие биосистему «морские донные
отложения – придонные слои воды», в которой максимально стабилизированы
химические и биологические процессы. В качестве микрокосмов использовали стеклянные
аквариумы емкостью 30 л.
В песчаный осадок экспериментального микрокосма помещали капсулу с токсикантом,
отобранным из места его захоронения в Керченском проливе. Экспозицию
осуществляли при рассеянном солнечном освещении в течение 12 месяцев. Концентрация
мышьяка в исследуемых биотопах приведена в таблице.
После 4 мес. наблюдений на стеклянных
стенках контрольного микрокосма появилась тонкая несплошная пленка
микрообрастания (0,8 – 1,2 г/м2), в которой доминировали одиночные
клетки диатомовых водорослей. За этот же период на стенках экспериментального
микрокосма образовался плотный слой микрообрастания (15,0 – 19,3 г/м2).
Обрастание стенок микрокосма начиналось на расстоянии 5 см от поверхности грунта,
достигало водной поверхности и дифференцировалось на две четко выраженные зоны
(слоя). Нижняя зона высотой 6
см была темно-зеленого цвета, а верхняя, бурого цвета,
имела высоту 9 см.
Таблица
Содержание мышьяка и численность гетеротрофных
бактерий в различных биотопах микрокосма
|
Исследуемые параметры
|
Биотопы
|
|
Грунт
|
Перифитон
экспериментального микрокосма
|
|
Контрольный микрокосм
|
Экспериментальный микрокосм
|
Зеленый слой
|
Бурый слой
|
|
∑ Мышьяк
|
(15,6–19,3)мкг/г
|
(440,0–221,0)мкг/г
|
(6,7–7,2)мкг/г
|
(3,2–3,9)мкг/г
|
|
Гетеротрофы
|
(8,0–9,5)∙105 кл/г
|
(1,0–2,4)∙106 кл/г
|
(4,8–5,2)∙106 кл/см2
|
(2,5–3,0)∙106 кл/см2
|
При микроскопировании смывов обрастания
со стенок экспериментального микрокосма в верхнем буром слое наблюдались только
диатомовые водоросли (рис.1). Диатомеи представлены популяциями одного или двух
видов. К наиболее устойчивыми к действию мышьяка видам можно отнести
представителей рода Amphora. Доминирующими микроводорослями нижнего, зеленого
слоя микрообрастания являлись нитчатые цианобактерии. Здесь также встречались
представители рода Micrococcus и
ассоциации цианобактерий и диатомей (рис.1).
1 2 3 4 5 6
Рис. 1. Микроводоросли перифитона экспериментального
микрокосма, х400.
1, 2 – верхний бурый слой; 3, 4, 5, 6 – нижний зеленый
слой
Эдификатором большинства микроводорослевых ассоциаций
в нижнем зеленом слое выступали цианобактерии рода Phormidium. Такая структура, по-видимому, обеспечивала устойчивость
каждого партнера ассоциаций к действию мышьяка.
Концентрация этого токсиканта в нижнем слое была в 2 раза выше, чем в
пленке обростания диатомовыми (табл.) и в 100 – 200 раз превышала фоновые
концентрации мышьяка, найденные в пленках микрообрастания в море (0,023 – 0,044
мкг/г пленки микрообрастания).
Особенность альгофлоры донных осадков контрольного и
экспериментального микрокосмов – доминирование диатомовых водорослей. Однако
следует отметить более высокое видовое разнообразие (5 – 6 видов) диатомовых в
контрольном микрокосме. В присутствии соединений мышьяка количество видов
диатомей уменьшалось до 2 – 3. Эти виды диатомовых, возможно, способны к гетеротрофному
или миксотрофному типам питания, поскольку их развитие происходило при лимитированном
освещении (500 – 700 лк).
В экспериментальном микрокосме на поверхности грунта
также наблюдалась выраженная стратификация микроводорослей. Вокруг капсулы с
токсикантом формировались войлокообразные слои микроводорослей с доминированием
нитчатых цианобактерий. По мере удаления от капсулы в грунте встречались единичные
клетки и популяции диатомовых водорослей (рис.2). Во всех исследованных
биотопах экспериментального микрокосма возрастала численность сопутствующих
гетеротрофных бактерий, минерализующих органические остатки и трансформирующих соединения азота и фосфора
(табл.).
1 2 3 4 5 6
Рис.2. Альгофлора грунта в
экспериментальном микрокосме, х400
1, 2 – войлокообразные слои около капсулы;
3, 4, 5, 6 – диатомеи на различном расстоянии от капсулы
Таким образом, проведенные лабораторные исследования показали,
что повышенные концентрации мышьяка в морских грунтах уменьшали видовое
разнообразие альгоценозов. Альгобактериальные ассоциации с нитчатыми цианобактериями
рода Phormidium приобретали
устойчивость к действию мышьяка. Диатомовые водоросли и цианобактерии в этих
ассоциациях сохраняли жизнеспособность при содержании мышьяка до 10 мкг/г.
Сообщества диатомовых водорослей более чувствительны к действию этого
токсиканта. Наиболее устойчивые диатомеи рода Amphora были способны развиваться при концентрации мышьяка, не
превышающей 4,0 мкг/г.
Список литературы
Андреева Н.А., Смирнова Л.Л., Антонова Л.С. Альгофлора
морских донных отложений, загрязненных химическими токсикантами (Керченский
пролив, Черное море // Современные проблемы альгологии. Матер. междунар. науч.
конф. и VII Школы по морской биологии. Ростов-на-Дону: ЮНЦ РАН, 2008. С. 14 –
16.
Антонова Л.С., Гурик В.В., Місюра А.Г., Білявський Г.О. Екологічні проблеми знешкодження хімічних токсикантів,
затоплених в морській економічній зоні України // 4-й Міжнар.Симпоз. «Екологічні
проблеми Чорного моря». Збір. Матеріалів. Одеса: ІНВАЦ, 2002. С. 13 – 19.
Гусляков
Н.Е. Итоги исследования диатомовых
водорослей бентоса Черного моря и сопредельных водоемов // Экология моря. 2004.
Вып. 65. С. 21 – 27.
Романенко
В.Д. Основи гідро екології. Підручник. К.: Обереги, 2001. 728 с.
Рябинин А.И., Шибаева С.А., Орадовский С.Г. Некоторые
макро- и микроэлементы в донных отложениях северо-восточного региона Черного
моря // Экологическая безопасность прибрежной и шельфовой зон и комплексное
использование ресурсов шельфа. Севастополь: ЭКОСИ-Гидрофизика, 2004. Вып.10.
С.144 – 160.
Рябушко Л.И. Микроводоросли бентоса
Черного моря (Чек-лист, синонимика, комментарий) / НАНУ. ИНБЮМ. Севастополь:
ЭКОСИ-Гидрофизика, 2006. 143 с.
Смирнова Л.Л., Андреева Н.А., Антонова Л.С., Мисюра
А.Г., Гурик В.В., Пичугин В.М. Активность микрофлоры как показатель токсичности
морских донных отложений шельфовой зоны Черного моря и Керченского пролива // Экологическая
безопасность прибрежной и шельфовой зон и комплексное использование ресурсов
шельфа. Сбор. науч. трудов. Севастополь, 2005. Вып.12. С.533 – 539.
Garnaga G., Wyse E., Azemard S., Stankevičius A., de Mora S. Arsenic in sediments from the southeastern Baltic Sea // Environ. Pol. 2006. 144. P. 855 –
861.
К ИЗУЧЕНИЮ УСЛОВИЙ МАССОВОГО
РАЗВИТИЯ CYANOPROkARYOTA
В ПРИРОДНЫХ ЭКОСИСТЕМАХ
Снитько Л.В.
Studying conditions of Cyanoprokaryota mass development
in natural ecosystems
Snitko L.V.
Природоохранное научно-исследовательское государственное учреждение
«Ильменский заповедник» Уральского отделения Российской академии наук
456300 Миасс, Челябинской обл., тел. 8 3513 591847
e-mail: snitkol@ilmeny.ac.ru
Исследованию цианопрокариотического «цветения»
водоемов – фундаментальной проблеме и острой практической задаче, посвящено множество публикаций [2, 3].
Мониторинг развития этого опасного явления, ставшего повсеместным в
пресноводных экосистемах в последние десятилетия, требует стационарных
исследований. Массовое развитие Cyanoprocaryota
(Cyanophyta, Cyanobacteria)
отмечено не только в водоемах, подвергаемых антропогенному загрязнению, но и в
заповедных озерах [3], а также тундровых водоемах [6]. Обследование в период
2004-2008 гг. 22 водоемов особо охраняемых природных территорий (ООПТ) разного
статуса и охранного режима, от регионального до федерального, выполненное нами по
заказу министерства радиационной и экологической безопасности Челябинской
области, выявило в них массовое развитие цианопрокариот.
Мониторинговые обследования показателей развития
фитопланктона водоемов проводились в период открытой воды на протяжении
1-2 лет, преимущественно с ежемесячной периодичностью по общепринятым
методикам с одновременным определением гидрохимических характеристик. Обследованные
водоемы замедленного стока являются малыми и средними по площади, средними глубинами
до 20 м,
пресными или с низкой минерализацией. Характеристика заповедных водоемов выполнялась
по следующим показателям развития фитопланктона: таксономическое разнообразие,
эколого-географический анализ выявленных видов, численность и биомасса,
сезонная динамика количественных характеристик основных отделов фитопланктона и
массовых видов, сапробиологический анализ по видам-индикаторам фитопланктона.
Особое внимание было уделено поиску закономерностей
массового развития Cyanoprocaryota, обнаруженного во
всех обследованных водоемах ООПТ Челябинской области. Идентифицировано 57 видов
Cyanoprocaryota из 21 родов и 3 порядков; таксономическим
разнообразием отличались представители Chroococcales – 24
вида из 13 родов. В состав доминирующего комплекса входили Anabaena
flos-aquae Bréb. ex Born. et Flah., A. hassalii (Kutz.) Wittr., A. scheremetievi Elenk., Aphanizomenon flos-aquae (L.) Ralfs ex Born. et Flah., Мicrocystis aeruginosa (Kütz.) Kütz., М. wesenbergii Kom., М. flos-aquae (Wittr.) Kirch., М. viridis (A.Br.) Lemm., Gloeotrichia
echinulata (J. Smith) P. Richt., Planktothrix agardhii (Gom.) Anagn. et Kom., Snowella rosea (Snow.) Elenk., Woronichinia naegeliana (Ung.) Elenk.
В условиях природных экосистем выявление причинно-следственных связей массового развития Cyanoprocaryota, представляет из себя сложную задачу [4]. Воздействию отдельных факторов среды на монокультуры Cyanoprocaryota посвящено много работ [1]. Исследования на
лабораторных альгоценозах – поликультурах водорослей [5], позволили выполнять
многофакторные эксперименты и верифицировать результаты опытов с природными
популяциями фитопланктона [5]. Однако закономерности, выявленные в лабораторном
эксперименте, в условиях природных экосистем, но нашим наблюдениям, выполняются
не всегда. Накопленные нами полевые наблюдения за внешними факторами, при
которых происходит массовое развитие Cyanoprocaryota в водоемах, представляют значительную выборку (свыше 800 проб) объема,
достаточного для применения разнообразных методов параметрической статистики и
различных процедур оценки достоверности предположений причин данного явления.
Распространение вида ограничено пределами
толерантности, между этими пределами есть экологический оптимум, значения
экологического фактора, при котором условия для конкретного вида являются
наиболее благоприятными и потому формируется высокая плотность популяции –
массовое развитие. В данном сообщении рассмотрены конфигурации зон толерантности
массового развития отдельных видов синезеленых водорослей по некоторым гидрохимическим
факторам в условиях природных экосистем обследованных водоемов.
Целью данной работы было построение предположений для
построения нулевых гипотез многофакторного анализа накопленных полевых данных
по распространению вспышек численности цианопрокариотических водорослей. Была построена
лепестковая диаграмма, где по осям ординат откладывали десятичные логарифмы
значений концентраций распространенных поллютантов в регионе и концентраций
биогенных соединений. Выборка сделана только для монодоминантного «цветения» максимальной
степени (III-IV степень - визуальное наблюдение слоя всплывших водорослей)
по всему ряду исследованных водоемов.
За период исследований в выборку поместили данные по
условиям массового развития Gloeotrichia echinulata в
озере Иткуль, Anabaena flos-aquae в озере Тургояк, Мicrocystis aeruginosa в озере Табанкуль, Planktothrix agardhii в озере Малый Теренкуль. При построении
лепестковой диаграммы по осям ординат откладывали десятичные логарифмические
значения (lg) концентраций, обнаруженных в
водоеме биогенных соединений и тяжелых металлов. Конфигурации зон толерантности
к некоторым факторам внешней среды показаны на диаграмме (рис. 1).

Рис. 1. Влияние различных концентраций тяжелых
металлов и биогенных соединений
на массовое развитие синезеленых водорослей Cyanoprocaryota (Cyanophyta, Cyanobacteria)
степени визуального «цветения» Anabaena flos-aquae, Gloeotrichia echinulata,
Мicrocystis aeruginosa, Planktothrix
agardhii в озерах Челябинской области
Из конфигураций зон условий водной среды, при которых
происходит монодоминантное «цветение» Cyanoprocaryota в
озерах региона, видно, что G. echinulata наиболее толерантна к полиметаллическому загрязнению и,
особенно, к присутствию свинца. Массовое развитие М. aeruginosa, P. agardhii, как видно из диаграммы, более
чувствительно к повышению концентраций меди при высоких требованиях к
содержанию запасов доступных биогенов.
Интерпретирование зон конфигураций условий природной
среды, при которых происходит массовое развитие Cyanoprocaryota (Cyanophyta),
позволит правильно выявить экологические факторы, наиболее сильно влияющие на
процесс «цветения» и четко сформулировать нулевые гипотезы для многофакторного
анализа накопленного полевого материала.
Список литературы
1. Абузарова Л.Х. (Зарипова Л.Х.), Кабиров Р.Р.
Влияние тяжелых металлов на морфологию цианобактерии Cylindrospermum michailovskoense Elenk. //
Проблемы региональной. 2008. № 2. С. 86-90.
2. Белякова Р.Н., Яковлева О.Ю. Таксономический и
эколого-географический обзор Cyanoprocaryota,
вызывающих «цветение» водоемов особо-охраняемых территорий северо-запада России
// Альголоогические исследования: современное состояние и перспективы на
будущее. Уфа. 2006. С.17-19.
3. Белякова Р.Н., Виноградова Л.Н., Гогорев Р.М., Волошко
Л.Н., Гаврилова О.В. Водоросли вызывающие
«цветение в водоемах северо-запада России. Санк-Петербург: Наука. 2006. 220 с.
4. Кривцов В. Исследование причинно-следственных
связей формирования биоценозов для контроля процессов эвтрофикации // Экология,
2001, № 3. С. 252-257.
5. Левич А.П., Максимов В.Н., Булгаков Н.Г.
Теоретическая и экспериментальная экология планктонных водорослей. Управление
структурой и функциями сообществ. Москва. МГУ. 1997. 189 с.
6. Патова Е.Н. Cyanophyta в водоемах и почвах восточноевропейских тундр. //
Бот. журн. Т. 89., № 9. С. 1403-1419.
СОДЕРЖАНИЕ СУММАРНОГО ХЛОРОФИЛЛА
В АЛЬГО-ЦИАНОБАКТЕРИАЛЬНЫХ СООБЩЕСТВАХ
ПРИ МОДЕЛЬНОМ ЗАГРЯЗНЕНИИ СВИНЦОМ
Темралеева А.Д.,
Пинский Д.Л.
Институт физико-химических и биологических проблем почвоведения РАН
142290 г. Пущино Московской области, ул.
Институтская, 2, тел. 8(4967)73-04-60
е-mail: temraleeva_anna@mail.ru
Total chlorophyll content in algo-cyanobacterial communities under model
lead contamination
Temraleeva A.D., Pinsky D.L.
Institute of Physico-Chemical and Biological Problems in Soil Science RAS
142290, Institutskaya
2, Pushchino, Moscow region, Russia. Phone: 8(4967)73-04-60
Известно, что контроль пигментов в клетках живых
цианобактерий и водорослей играет важную роль в качественной оценке состояния
альго-цианобактериального сообщества (АЦС). Так например, в работе Савельева
И.Б. по контролю за сбросом ванадия в пресной воде отстойника металлургического
комбината в г.Туле наиболее чувствительными тест-параметрами оказались содержание
хлорофилла и фотосинтетическая активность водорослей (Савельев, 2000).
В данной работе исследовалось содержание суммарного
хлорофилла АЦС, выращенных в водной культуре фоновой (контроль) и искусственно
загрязненной свинцом серой лесной почвы. Свинец вносили в ацетатной форме в концентрациях:
300, 750, 1500 мг/л стерильной дистиллированной воды (в пересчете на
концентрацию катиона). Эти концентрации соответствовали 10000, 25000 и 50000
ПДК свинца (для воды хозяйственно-питьевого водопользования). Одновременно, для
установления влияния ацетат-аниона проводили параллельный опыт с ацетатом
натрия в эквивалентных дозах в пересчете на анион (172, 430, 860 мг/л). Спустя
2 месяца после начала эксперимента проводили измерение содержания суммарного
хлорофилла в водной культуре с использованием спектрофотометрического метода
(ГОСТ 17.1.4.02 – 90).
Статистический анализ полученного материала проводился
с применением программного пакета Statistica 6.1. Были рассчитаны средние и
стандартные отклонения. Значимость различий между средними оценивалась с помощью
t-критерия. Были получены следующие результаты, представленные на рисунке.
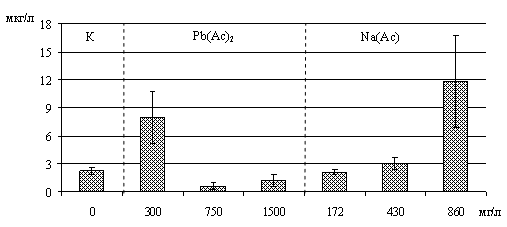
Рис. Содержание суммарного хлорофилла АЦС в контроле и
опытах
Примечание: по оси ординат – содержание суммарного хлорофилла,
мкг/л водной культуры. По оси абсцисс
– концентрация внесенных ацетата свинца (в пересчете на катион) и ацетата
натрия (в пересчете на анион).
Самое высокое содержание хлорофилла наблюдалось в
опытах с внесением ацетата свинца в дозе 300 мг/л и ацетата натрия 860 мг/л, между
которыми статистически значимые различия не выявлены, но содержание хлорофилла
в них значимо больше, чем во всех остальных опытах.
Содержание хлорофилла в контроле значимо больше, чем в
опыте со средней концентрацией свинца, в котором хлорофилльный показатель
значимо меньше всех опытов с внесением ацетата натрия.
Содержание хлорофилла в опыте с максимальной концентрацией
свинца значимо меньше, чем в опытах с внесением ацетата натрия в концентрациях
430 и 860 мг/л. Между собой средняя и высокая доза внесения свинца по содержанию
хлорофилла не отличаются.
Кроме этого при микроскопировании
альго-цианобактериальных пленок нами были отмечены морфологические изменения
цианобактерий в опыте с максимальной концентрацией свинца, выражающиеся в
изменении окраски с сине-зеленой на желтоватую. Аналогичные хлоротические
явления наблюдала Фокина А.И.: при исследовании концентраций свинца от 1 до 8
ммоль/л (от 272 до 2176 мг/л) проявлялось постепенное обесцвечивание про- и
эукариотических водорослей (Фокина,
2008).
Подобные изменения свидетельствуют о токсическом
действии свинца, так как он вызывает исчерпание восстановленной формы
глутатиона и белковых SH-групп, что
приводит к накоплению перекисных ионов, гидроксильных радикалов и Н2О2.
В обоих случаях наблюдается ингибирование активности ферментов и усиление
пероксидазной активности и перекисного окисления липидов. Образование перекисей
в свою очередь ведет к разрывам ДНК и выделению из клеток ионов К+,
Са2+ и Mg2+ в результате повреждений плазматической и
вакуолярной мембраны. Эти нарушения способствуют ингибированию биосинтеза
хлорофилла, фотосинтетической и дыхательной активности, вызывают разрушение
хлоропластов и митохондрий (Ochiai, 1995; Stons, Badchi, 1995).
В тоже время установлено, что при низкой концентрации
свинца, ацетат-анион нивелирует вредное
действие катиона. При дозе свинца 300 мг/л содержание хлорофилла не только
возрастало, но и превысило соответствующий показатель в контрольном опыте по
истечении 2-х месяцев. Анализ водной среды показал, что концентрация свинца в
растворе в результате адсорбции почвой снизилась в 20, 14,7 и 5,6 раз
соответственно (по сравнению с моментом внесения) и стала нетоксичной для исследуемых
организмов. Видимо, увеличению адсорбции способствует изменение реакции среды с
6,54 в контроле до 7,34 в опыте с максимальной концентрацией свинца, что
снижает мобильность свинца в системе
почва - раствор. Кроме того, одной из
форм связывания свинца могло стать образование комплексных соединений металлов
с некоторыми органическими веществами водорослей. При этом хелатообразователями
могут выступать как внеклеточные продукты, выделяемые водорослями в окружающую
среду, так и слизистые вещества оболочек, а также вещества, остающиеся после
отмирания клеток (Вассер и др., 1989).
Используя содержание хлорофилла был рассчитан индекс
токсичности (ИТ) (Кабиров и др., 1995).
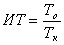 ,
, где
ИТ – индекс токсичности оцениваемого фактора, То – значение
регистрируемой тест-функции (в данном случае содержание суммарного хлорофилла)
в опыте; Тк – значение регистрируемой
тест-функции в контроле.
где
ИТ – индекс токсичности оцениваемого фактора, То – значение
регистрируемой тест-функции (в данном случае содержание суммарного хлорофилла)
в опыте; Тк – значение регистрируемой
тест-функции в контроле.
Исходя из статистически значимых различий (при
p<0,05) между индексами токсичности разных опытов, мы выделили следующие
эффекты разных доз ацетата свинца и натрия (таблица).
Стимулирующий эффект от внесения высокой концентрации
ацетата натрия объясняется, видимо, тем, что ацетат являлся дополнительным
источником энергии для клеток. Однако, возможен и другой механизм:
использование ацетата бактериями как
источник углерода и выделение при этом углекислого газа, который стимулирует
фотосинтез цианобактерий и водорослей.
Положительный эффект на фотосинтетические процессы
оказывает и катион натрия. Известно, что отсутствие Na+ в среде
приводит к нарушению сопряжения между световыми и темновыми реакциями
фотосинтеза из-за существенного снижения транспорта неорганического углерода в
клетки, приводящего к активации оксиногеназной функции
рибулезобисфосфаткарбоксилазы, в результате чего образуются кислородные
радикалы, способные повреждать практически все компоненты клетки (Саари и др.,
2000).
Таблица
Эффекты разных доз ацетата свинца и натрия на АЦС
|
Эффект
|
Величина индекса
токсичности*
|
Пояснения
|
|
Стимуляция
|
ИТС300
= 3,55
ИТА860
=5,26
|
Фактор
оказывает стимулирующее действие на тест - объект. Величина тест-функции
в опыте превышает контрольные значения.
|
|
Норма
|
ИТК
= 1
ИТА172 =0,91
ИТА430 = 1,37
|
Фактор
не оказывает существенного влияния на развитие тест-объекта. Величина
тест-функции находится на уровне контроля.
|
|
Токсичность
|
ИТС750 = 0,27
ИТС1500 = и 0,
54
|
Снижение
величины тест-функции в опыте по сравнению с контролем.
|
*К – контрольный опыт, С300, С750 и С1500 – опыты с
внесением ацетата свинца, в пересчете на катион соответственно 300, 750 и 1500
мг/л; А172, А430 и С860 – опыты с внесением ацетата натрия, в пересчете на
анион соответственно 172, 430 и 860 мг/л.
Внесение ацетата натрия в дозах 172 и 430 мг/л не
оказывало стимулирующего эффекта, а ацетат свинца в концентрации 750 и 1500
мг/л был токсичен и вызывал уменьшение содержания суммарного хлорофилла.
Таким образом, содержание хлорофилла адекватно
отражает физиолого-биохимический статус альго-цианобактериальных сообществ при
загрязнении свинцом и может случить как тест-критерий. Однако, при исследовании
влияния солей металлов на показатели состояния про- и эукариотических
водорослей необходимо учитывать действие как катиона, так и аниона.
Работа поддержана
проектом Министерства образования и науки Российской Федерации
№ 2.1.1/3819.
Список литературы
Вассер С.П., Кондратьева Н.В., Масюк Н.П. и др. Водоросли.
Справочник. – Киев: Наук. думка, 1989. – 608 с.
ГОСТ
17.1.4.02–90. ВОДА. Методика спектрофотометрического определения хлорофилла а.
Государственный контроль качества воды. М.: Изд-во стандартов, 2001. С.
551–563.
Кабиров Р.Р., Черненькова Т.В. Фитотестирование / Сб.
Воздействие металлургических производств на лесные экосистемы Кольского
полуострова под общ.редакцией Сычева В.В. – Санкт-Петербург, 1995. – 252 с.
Саари Л.А., Маркарова Е.Н., Гусев М.В. Влияние
факторов внешней среды на потребность цианобактерии Anabaena variabilis в натрии // Материалы Международной научной конференции
«Автотрофные микроорганизмы», М.: МАКС Пресс, 2000. – С.157-158.
Савельев И.Б. Экофизиологические исследования
фототрофов для разработки методов контроля загрязнения водной среды тяжелыми
металлами //Вестник Московского университета. Сер.16. биология, №2, 2000. – С.
42-48.
Фокина А.И. Влияние
свинца на структуру фототрофных микробных комплексов почвы Автореферат дисс. …
канд.биол.наук, Сыктывкар, 2008, 25 с.
Ochiai E.I. 1995.
Toxicity of heavy metals and biological defense: principes and application in
bioinorganic chemistry / J. Chem. Educ. 72, N 6. P.479 – 484.
Stons S.J., Badchi
D. 1995. Oxidative mechanisms in the toxicity of metal ions // Free Rad. Biol. Med. 18, N 2. P.321-336.
ДОКУМЕНТИРОВАНИЕ МАТЕРИАЛОВ АЛЬГОИНДИКАЦИОННЫХ
ИССЛЕДОВАНИЙ ВОДОЕМОВ РАЗНОГО НАЗНАЧЕНИЯ
Филиппов А.С.
Materials documentation of algal indicative studies
of different water bodies
Filippov A.S.
ГОУ ВПО «Тверской государственный университет»
170100, Тверь, ул. Желябова, 33, тел. 84822778421, факс 84822778416
e-mail: fly-p-andrew@mail.ru
В последнее время в связи с нарастающей антропогенной
нагрузкой на природу возникает необходимость организации комплексного
геоэкологического мониторинга как системы постоянного контроля, оценки и
прогнозирования состояния геосистем.
Индикационный метод – один из основных в системе
мониторинга. Он заключается в определении состояния одного объекта по состоянию
другого, связанного с первым и более доступного для изучения. Ведущую роль
здесь играет биоиндикация (определение состояния геосистем по состоянию
сообществ живых организмов).
Альгоиндикация является одним из наиболее
проработанных видов биоиндикации. Метод альгоиндикации основан на определении
видового состава сообществ и обилия видов водорослей. Он позволяет получить
интегральную оценку результатов всех природных и антропогенных воздействий на
процессы, протекающие в водных экосистемах. Биоиндикация состояния водоемов
различного назначения по сообществам водорослей представляется дешевым и
чувствительным экспресс-методом, в то время как химические анализы
дорогостоящи, но, в то же время, не позволяют напрямую оценить влияние
изменения качества воды на живые организмы. Водоросли как фототрофные организмы,
являются в водных экосистемах первичным звеном многочисленных трофических
цепей. Следовательно, они первыми реагируют на загрязнители, не успевая их
значительно накапливать.
Водорослевое сообщество (альгоценоз) реагирует на
изменение условий среды изменением видового состава и обилия некоторых видов.



а б
.




в г



д е
а - Navicula cryptocephala. 20-40 мкм –
длина; 5-7 мкм – ширина
б - Amphora ovalis. 20-140 мкм – длина; 20-65 мкм – ширина
в - Navicula cuspidata var. ambigua.
г - Cymatopleura ellipt ica. 50-220 мкм –
длина; 40-90 мкм – ширина
д - Melosira varians. 18-25 мкм – длина; 8-35 мкм – ширина.
е - Tabellaria fenestrata. 30-140 мкм – длина; 3-9 мкм – ширина.
Особое внимание при альгоиндикационных исследованиях
следует уделять изучению перифитона и эпифитона. Анализ перифитонных и
эпифитонных сообществ обеспечивает более точную привязку проб, так как выявляет
состояние конкретного участка водоема, в то время как виды фитопланктона могут
быть занесены и попасть в пробу случайно из других мест.
Сложности альгологического метода связаны, прежде
всего, с обеспечением достаточной точности идентификации видов и внутривидовых
форм, которые даже при наличии совершенной микроскопической техники
определяются непросто. Особенно это касается мелкоклеточных цианопрокариот, для
строгого определения которых в последнее время даже требуется прибегать к использованию
молекулярных методов. Именно поэтому первоочередной задачей в освоении альгоиндикационного
метода является технически квалифицированное документирование материалов, которое
делает возможной и доступной консультационную помощь специалистов по
определенным группам водорослей и цианопрокариот.
Нами освоена техника микрофотографии и измерения
размеров клеток компонентов альгофлоры. Съемка проводится на любительскую
камеру Canon IXUS 950 IS. Фотографируемая вместе с микроскопическими
водорослями и цианопрокариотами шкала проградуированного окулярмикрометра
существенно повышает достоверность анализируемых материалов.
При идентификации видов мы опираемся на
атлас-определитель Стребле-Краутера и на рисунки водорослей в работах С.С.
Бариновой. Зачастую помощь оказывают специальные альгологические сайты, где
выложено много информации по водорослям (фотографии, описания). Собранная нами
за несколько лет обследования водоемов, подверженных тепловому загрязнению,
водотоков в черте города и постоянно пополняемая большая коллекция фотографий и
рисунков видов пресноводной альгофлоры (примеры см. на рис.), представляет
собой своеобразную иконотеку, которая значительно облегчает проведение
альгоиндикационной работы.
ОЦЕНКА КАЧЕСТВА СРЕДЫ
ВОДОХРАНИЛИЩ ВЕРХНЕЙ ВОЛГИ
ПО СОСТОЯНИЮ СООБЩЕСТВ
ФИТОПЛАНКТОННЫХ ОРГАНИЗМОВ
Чермных Л.П., Бабий О.П.
The Volga River upstream reservoirs environment water
quality assessment based on phytoplankton coenoses state
Tchermnych L., Babyi O.
Государственное образовательное
учреждение
высшего профессионального образования
Московской области
«Международный университет природы, общества и
человека «Дубна»
г. Дубна Московской
обл., ул. Университетская 19, тел.8(49621)45704
е-mail: museum@uni-dubna.ru
Нарушение структуры и функции
пресноводных экосистем связано с их эксплуатацией в качестве сырьевых и
рекреационных ресурсов. Для интегральной оценки степени загрязнения водоемов и
водотоков часто пользуются суммарным индексом загрязненности вод (ИЗВ), который
включает в себя многие гидрохимические показатели. Этой характеристикой пользуются
при сравнении загрязнений различных участков пресноводных экосистем. Однако,
например, в Московской области многие водоемы и водотоки имеют высокий индекс
загрязненности по химическим показателям, что не всегда соответствует истинному
их состоянию. В то же время гидробиологические методы, используемые в системе
мониторинга водных объектов, не всегда позволяют достоверно оценить
экологическое состояние среды пресных вод, что касается и метода биоиндикации
Пантле и Букка в модификации Сладечека. Поэтому все большего внимания
заслуживает комплексная оценка состояния водной среды гидрохимическими методами
и методом биоиндикации.
Отбор
проб, положенных в
основу настоящего исследования, осуществлен на базе Дубнинской Экоаналитической
лаборатории ФГВУ «Центррегионводхоз» на
Иваньковском водохранилище с 2000 по 2006 годы — в мелководной зоне, в
2007-2008 годах — в акватории. В 2008 году к объектам исследования добавились
озера Волго и Пено (Верхневолжкое водохранилище), озеро Шлино и Вышневолоцкое
водохранилище. Обработка первичного материала с
использованием методов биоиндикации фитопланктонных организмов осуществлялись
по стандартным методикам [7].
В
бассейне Верхней Волги насчитывается несколько десятков водохранилищ, большая
часть из которых (не превышающие 2-3
км 2 по площади водного зеркала) была создана
для поднятия грунтовых вод в колодцах, для пожарного использования и ведения
рыбного хозяйства. Лишь некоторые крупные водохранилища, такие как Иваньковское
были созданы для водоснабжения г. Москвы. Вышневолоцкое водохранилище используется для водоснабжения,
водного транспорта, лесосплава, энергетики и рыбного хозяйства. Озера Волго и
Пено зарегулированы Верхневолжским бейшлотом и служат в основном для
рекреационных целей. Озеро Шлино моренно-подпрудное, предложено к охране со
статусом государственного природного заказника (рис. 1).
На
водосборах Верхневолжского и Вышневолоцкого водохранилищ располагается большое
количество посёлков, где активно ведется сельское хозяйство, и крупных городов
с развитой промышленностью, по берегам расположено много садоводческих
товариществ. В бассейне Иваньковского водохранилища расположено 17 административных
районов, 18 городов. В крупных городах сосредоточено основное промышленное
производство. На берегу водохранилища расположены Конаковская ГРЭС и три ТЭЦ,
расположенные в г. Твери, все станции отводят нормативно-очищенные воды
непосредственно в Иваньковское водохранилище.
Рис.1 Карта-схема расположения исследуемых
водохранилищ Верхней Волги
В
течение нескольких десятилетий бассейне в Верхней Волги проводилась
государственная водоохранная политика, направленная в основном на сокращение
сброса промышленных и хозяйственно-бытовых сточных вод. Несмотря на значительное снижение промышленных выбросов в последние
годы, антропогенное воздействие на экосистему водохранилищ продолжает оставаться достаточно значимым
экологическим фактором, за счет все
увеличивающейся рекреационной нагрузки [5].
Обилие
видов живых существ, населяющих водоем, сложность их взаимодействия, как между
собой, так и с окружающей средой, послужили причиной создания многочисленных
методов оценки состояния природных вод. Большинство этих методов основано на
оценке совокупности показателей: числа видов, численностей и биомасс популяций
гидробионтов и рассчитанных различных соотношений между ними в виде оценочных
индексов. Если используемые индексы адекватно отражают высокую чувствительность
реагирования некоторых сообществ на воздействие поступающих в водоем
загрязняющих веществ, то они позволяют надежно выявлять изменения, происходящие
в экосистеме водоема, не замеченные за долгое время другими методами. В
частности, индексы, основанные на поведении планктонных организмов, из-за
короткой продолжительности их жизни, пригодны для оперативной оценки
обстановки, поскольку могут быстро реагировать на поступление в водоем
загрязняющих веществ. Каждый из таких показателей – индекс биологического
разнообразия Шеннона, сапробиологические показатели, позволяют учесть при
математическом анализе данных новые информационные аспекты [10].
Обобщенный анализ рассчитанных нами индексов
биологического разнообразия и сапробности и индекс загрязненности вод позволили произвести более точную оценку
качества среды исследованных водохранилищ.
Прослежены корреляционные связи между содержанием
некоторых неорганических компонентов среды и
изменениями
структурно-функциональных характеристик фитопланктонных сообществ.
Отмечены особенности цветения исследованных водохранилищ.
Список литературы
1. Абакумов В. А., Ахметьева Н. П.,
Бреховских В. Ф. и др. /Иваньковское водохранилище: Современное состояние и
проблемы охраны. – М.: Наука, 2000.
2. Временные методические указания по комплексной оценке
качества поверхностных и морских вод Утв. Госкомгидрометом СССР 22.09.86 № 250-1163. М.,1986.5 с.
3. Гидрометеорологический режим озер и
водохранилищ СССР. Водохранилища Верхней Волги. Л.: Гидрометеоиздат, 1975.
4. Девяткин В. Г., Кузьмин Г. В.
Фитопланктон // Иваньковское водохранилище и его жизнь. Л.: Наука, 1978.
5. Ланцова И. В., Григорьева И. Л.,
Тихомиров О. А. Водохранилища как объект рекреационного использования:
Монография. – Тверь, 2003.
6. Перечень рыбохозяйственных
нормативов: ПДК и ОБУВ вредных веществ для воды водных объектов, имеющих
рыбохозяйственное назначение. – М.: Изд-во ВНИРО, 1996.
7. Руководство по гидробиологическому
мониторингу пресноводных экосистем. – СПб.: Гидрометеоиздат, 1992.
8. Тарасенко Л. В. Распределение
фитопланктона // Глава в отчете Иваньковской НИС по теме «Исследование
тепломассопереноса и гидрофизических процессов в водной среде, включая устья
рек и внутренние моря», раздел «Характеристики развития биологических сообществ
в Иваньковском водохранилище (1990-1991 гг.)». - М., 1992.
9. Унифицированные методы исследования
качества вод. Ч III. Методы биологического анализа вод. Том 2. –М., 1990.
10. Шитиков В.К., Розенберг Г.С.,
Зинченко Т.Д. Количественная гидроэкология. - М.: «Наука», 2005.
11. Яковлев В.А. Оценка качества
поверхностных вод Кольского Севера по гидробиологическим показателям и данным
биотестирования: (Практические рекомендации). Апатиты, 1998. 27с.
ПОЧВЕННЫЕ ВОДОРОСЛИ – ИНДИКАТОРЫ
ПОСТПИРОГЕННЫХ ПРОЦЕССОВ
Чумачева Н. М.
Soil algae as indicators of postpyrogenic processes
Chumacheva N.M.
Новосибирский государственный педагогический университет (НГПУ)
В статье рассмотрены особенности организации почвенных водорослей
постпирогенных биотопов. Показано, что видовой состав, спектр жизненных форм и
характер повреждения клеточных структур
индицируют разную степень огневого воздействия на среду.
Одним из методов,
позволяющих индицировать состояние среды при различных нарушениях, является
альгоиндикация. В альгологической литературе достаточно широко освещен вопрос о
водорослях - индикаторах природных и антропогенных процессов: промышленных
отвалов (Кабиров, 1993), нефтезагрязнений (Ельшина, 1986), дымогазовых выбросов
(Мельникова, 1986), экологических индикаторов различных природных экосистем
(Штина, 1990).
Однако,
до сих пор мало сведений о водорослях – индикаторах послепожарных местообитаний.
В то же время участившиеся пожары требуют получения комплексной оценки мест
гарей и прогнозирования процессов лесовосстановления. Почвенные водоросли
обладают особой чувствительностью и в то же время проявляют достаточную толерантность по отношению к факторам среды. Определенный набор видов
почвенных водорослей может служить показателем почвенных условий и индицировать
степень нарушения cреды (Некрасова, 1972; Штина, 1990; Кабиров, 1993).
Группировки
почвенных водорослей, формирующиеся под влиянием пирогенного фактора, изучали в
лесных фитоценозах г. Новосибирска и двух прилежащих районах области:
Колыванском и Мошковском. Исследуемые фитоценозы находились на разных стадиях
послепожарного восстановления (табл.1).
Таблица 1
Характеристика постпирогенных биотопов основных мест
исследования
|
Район
исследования
|
Исходный фитоценоз
|
Почвы
|
Вид огневого
воздействия
|
Характер восстановления
|
Возраст гари
|
|
г. Новосибирск
(в черте города)
|
Березняк осоково-разнотравный
|
Серые лесные
супесчаные
|
Локальное выжигание
(пал, костер)
|
Через бурьянную стадию
|
свежая-
3
года
|
|
Мошковский район (Дубровинский лесхоз)
|
Сосняк зеленомошно-брусничный
|
Дерново-подзолистые
супесчаные
|
Беглый низовой пожар
|
Через смену травянистого покрова
|
свежая-
3 года
|
|
Колыванский район (Кудряшевский лесхоз)
|
Сосняк чернично-разнотравный
|
Дернового типа
супесчаные
|
Сочетание низового и верхового пожаров
|
Через луговую стадию и смену древесных пород
|
7-
10 лет
|
По
интенсивности огневого воздействия, охвату площади и направленности
сукцессионных процессов исследуемые гари можно расположить в условный ряд:
локальное выжигание в виде палов и кострищ - гарь после низового пожара – олуговевшая
крупноплощадная гарь.
Биоиндикаторная роль почвенных
водорослей постпирогенных биотопов устанавливалась на основе длительности
этапов сукцессии, характера повреждения клеточных структур, процентном соотношении
живых и аномальных клеток, различии видового состава и числа видов при разной
интенсивности воздействия огня.
Установлено, что характер
сукцессионных процессов почвенных водорослей в местах гарей зависит от длительности
огневого воздействия и степени нарушения биотопа. Легкий обжиг вызывает
кратковременную сукцессию почвенных водорослей, которая характеризуется
нарастанием видового разнообразия в первый месяц после воздействия огня. На
кострищах и крупноплощадных гарях сукцессионные процессы протекают в течение
продолжительного времени (от нескольких месяцев до 2-3 лет и более).
Восстановление альгогруппировки начинается с поселения пионерной группы. На
начальных этапах сукцессии отмечается резкое снижение видового разнообразия
водорослей всех отделов. Пики активности в составе альгогруппировки наблюдаются
на 6-12 месяц, что по времени совпадает с экологическим оптимумом среды
обитания. При повторных пирогенных нарушениях, когда условия обитания приближаются
к крайним точкам по ряду экологических показателей (уплотнение почвы, ухудшение
гидротермического режима и аэрации, развитие процессов эрозии) – состав
альгогруппировки обедняется.
На основе анализа видовой
структуры почвенных водорослей было выявлено следующее соотношения ведущих
отделов: зеленых 93 вида (43%), синезеленых – 62 (29%), зеленых – 50 (23%),
диатомовых – 11 (5%) видов с учетом внутривидовых таксонов. По сравнению с
фоновыми участками произошло увеличение луговых и лугово-степных видов из числа
зеленых и синезеленых водорослей. Одновременно сократилось число типичных
лесных видов из отдела желтозеленых. Этому способствовало комплексное изменение
условий обитания по ряду экологических
факторов: дополнительный обогрев, иссушение и подщелачивание почвы,
элиминация мохового покрова и подстилки, повышенная освещенность.
По отношению к пирогенному
фактору индикационные свойства проявляли отдельные виды водорослей из разных
отделов. При высокой интенсивности огневого воздействия в качестве индикаторов
выступают почвенные убиквисты и термофильные виды водорослей Сh-,Р-,В-форм. Их
появление указывает на присутствие ограничивающего фактора, который в
дальнейшем может стать критическим. При умеренной интенсивности воздействия в
состав альгогруппировки входят виды слизеобразователи Сf- и С-форм, где
преимущественное развитие получают виды родов Nostoc и Gloeocapsa,
а также некоторые представители тенелюбивых водорослей Х-формы. При слабой интенсивности
огня активизируются представители всех отделов, при этом более интенсивно
развиваются виды из родов Cylindrospermum, Chlorhormidium, Chlamydomonas. Безгетероцистные синезеленые (Phormidium tenue, Ph.
molle, Ph.foveolarum, Ph.
uncinatum, Ph.
dimorphum, Plectonema gracillinum,
Schizothrix lardacea) и диатомовые водоросли (Hantzschia amphioxys var. аmphioxys, H. amphioxys var. capitata Nitzschia palea, Navicula atomus, N.
mutica) на гарях выступают в роли экотопических патиентов,
заселяя вновь образованные биотопы, малопригодные для чувствительных
желтозеленых и зеленых водорослей. Оказавшись вне конкуренции, представители
этих групп усиливают свое развитие, резко увеличивая основные фитоценотические
показатели по сравнению с исходной почвой. У синезеленых водорослей этому способствует
более высокая интенсивность роста по
сравнению с зелеными и желтозелеными водорослями, возможность передвигаться и
закрепляться в субстрате с помощью слизистых чехлов, устойчивость к перепаду
температур, а у диатомовых – защита в виде кремнистого панциря, быстрый рост и
интенсивность деления.
Среди
желтозеленых в постпирогенных
биотопах наряду с видами космополитами (Pleurochloris magna, Botrydiopsis arhiza, Monallantus brevicylindrus) развивается ряд видов, имеющих приспособления в виде
утолщенных, инкрустированных или ослизняющихся оболочек (Сhloridella neglecta, Heterothrix bristoliana,
Bumilleria klebsiana, Monodus cystiformis),
а также лугово-степные виды (Polyedriella helvetica,
Heterothrix exilis, Bumelleriopsis brevis, B. terricola, Tribonema vulgare). Ранее часть этих видов была обнаружена на угольных
отвалах (Кабиров, 1993), в вулканических субстратах (Штина и др, 1992), а также
на кострищах г. Уфы (Сугачкова, 2000). Несмотря на свою изначальную природу,
часть мезофильных видов способна приживаться в экстремальных условиях. Таким
образом, в состав альгогруппировок постпирогенных биотопов могут входить виды с
разной резистентностью к пирогенному фактору.
Стратегия
восстановления альгогруппировок зависела от интенсивности огневого воздействия (табл. 2.). Легкий обжиг способствует активизации
водорослей большинства морфотипов, что характеризуется активным спорообразованием,
быстрым нарастанием видового разнообразия, коротким периодом вегетации. При
слабой интенсивности огневого воздействия клетки водорослей остаются без
повреждений. При умеренной интенсивности воздействия огня на почву у водорослей
создается система защиты в виде утолщения клеточных оболочек, выделения слизи,
происходит распад нитей на фрагменты, а также потеря жгутиков и подвижности у
монадных структур. Слизь выделяется как у
отдельных клеток, так и у колоний.
Она предохраняет водоросли не только от высыхания, но и от неблагоприятных
физико-химических свойств субстрата (термического повреждения и проникновения
токсических элементов). При высокой интенсивности огневого воздействия на среду
теряется устойчивость клеток водорослей из всех отделов. При этом происходит
повреждение клеточных структур, наблюдается аномальное развитие, деформация и
лизирование клеток. Состав альгогруппировки обедняется.
Таблица
2
Реакция почвенных водорослей на
пирогенное воздействие разной
интенсивности
|
Степень воздействия
|
Признаки толерантности
альгогруппировок
|
|
Слабая
|
Активная споруляция на начальных этапах сукцессии. Переход
хламидомонадовых (10-15%) в пальмеллоидное состояние. Преобладают
крупноклеточные формы, которые характеризуются накоплением зерен крахмала.
Виды - убиквисты составляют 25%. Пирофитных видов - 35%.
|
|
Умеренная
|
Умеренное образование зооспор на начальных этапах сукцессии и апланоспор
на заключительных этапах. Накопление продуктов запаса у клеток хлорококковых
и хламидомонадовых (до 30%). Укрупнение клеток. Образование слизи у отдельных
клеток (10-15%). Виды - убиквисты составляют 40%. Пирофитных видов 45-50%.
|
|
Высокая
|
Характерна мелкоклеточность, 30% клеток с утолщенными слоистыми
оболочками. Возобновление популяций хлорококковых путем апланоспор и
множественного деления на заключительных этапах сукцессии. Соотношение
вегетативных клеток к апланоспорам составляет 3:2. Пирофитных видов до 70%.
|
Таким
образом, почвенные водоросли, сочетающие чувствительность и резистентность и обладающие
быстрой реакцией на внешнее воздействие, служат отражением пирогенных
процессов, происходящих в почве. Специфичность видового состава, систематическая
и биологическая структура и доминантный комплекс альгогруппировок могут служить
показателями состояния почвенной среды и степени ее нарушенности огнем.
Список литературы
Ельшина Т.А. Почвенные водоросли как индикаторы
некоторых видов техногенного загрязнения
почвы (на примере загрязнений, связанных с нефтедобычей): Автореф. дис. ...
к.б.н. Л., 1986. 18 с.
Кабиров Р.Р. Альгоиндикация с использованием
почвенных водорослей (методологические
аспекты) // Альгология, 1993. Т.3. № 3. С. 73-85.
Мельникова В.В. Почвенные водоросли как
биоиндикаторы загрязнения почв дымо-газовыми выбросами алюминиевого комбината
// Известия АН Тадж. ССР. Отд. биол. наук. 1986. № 3. С.17-20.
Некрасова К.А. Использование водорослей как
индикаторов почвенного плодородия // Методы изучения и практического
использования почвенных водорослей. Тр. Кировского с.-х. ин-та. Киров: Изд-во
Пермского с.-х. ин-та, 1972. С. 257-263.
Сугачкова Е.В. Влияние рекреационной нагрузки на
сообщества почвенных водорослей: Автореф. дис. ... к.б.н. Уфа, 2000. 19с.
Штина Э.А. Почвенные водоросли как экологические
индикаторы // Ботан. журн. 1990. Т.75. № 4. С. 441-452.
Штина Э.А., Андреева В.М., Кузякина Т.И. Заселение
водорослями вулканических субстратов // Ботан. журн. 1992. Т. 77. № 8. С.
33-42.
Секция 5
Современные
методы и подходы
к изучению
пресноводных и почвенных водорослей
ОБНАРУЖЕНИЕ ДИНОФЛАГЕЛЛЯТ РОДА GYRODINIUM
В ФИТОПЛАНКТОНЕ И ГУБКАХ ОЗЕРА БАЙКАЛ ПУТЁМ АНАЛИЗА
0
НУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Анненкова Н.В.,
Беликов С. И., Белых О.И.
Finding dinophlagellates from genus Gyrodinium
in the Baikalian phytoplankton and sponges by analysis of nucleotide sequences
Annenkova N.V., Belikov S.I., Belykh O.I.
Лимнологический Институт СО РАН
Иркутск, Улан-Баторская-3, тел.
+7(3952)51-18-74
e-mail: sorka_14@yahoo.com
Байкал – это древнейшее, самое глубокое озеро
на земле. Будучи пресноводным олиготрофным водоёмом, оно в тоже время известно
огромным разнообразием живых организмов. В Байкале обитают и динофитовые
водоросли (динофлагелляты). Динофлагелляты являются одноклеточными организмами,
традиционно рассматриваемыми в составе фитопланктона различных водоёмов. Цветение
динофитовых наблюдают при самых разнообразных условиях, в том числе, подо льдом.
Последнее характерно для байкальского вида Gymnodinium baicalense Antipova.
Некоторые представители группы токсичны, поэтому их бурное цветение может
негативно влиять на рыбные хозяйства и даже приводить к отравлению людей. В
тоже время не все динофитовые являются автотрофами, известны и гетеротрофы, и
миксотрофы.
В
Байкале в отдельные годы эти водоросли могут составлять до 65% от годовой
первичной продукции фитопланктона [1]. Вместе с тем, байкальские
динофлагелляты остаются мало исследованными как с таксономической, так и с экологических
точек зрений. Сведения начала – середины прошлого века сообщают о наличии
панцирных и беспанцирных динофлагеллят в озере [2]. Н.Л. Антиповой в 1955 г. на основе световой
микроскопии один из беспанцирных динофитовых определен как Gymnodinium coeruleum Dogiel [2]. В данной работе мы решили
использовать дополнительные методы для изучения этого вида, ставшие доступными
в наши дни.
Применяли комплексный подход к анализу динофлагеллят,
включающий и световую микроскопию, и молекулярно-генетические исследования.
Пробы отбирали в поверхностном слое воды из трещин во льду напротив пос. Листвянка
сетью Апштейна и батометром. Микроскопирование проб проводилось при помощи
инвертированного микроскопа Axiovert 200, снабженного ртутной лампой HBO
50W/AC. (Zeiss). Микрофотографии получали камерой Pixera Рenguin 600CL
(DiRectorTM) в программе ВидеоТест-Размер 5.0 (www.videotest.ru). Измерение
клеток проводили в Image-Pro Plus 4.0 (www.mediacy.com).
Из пробы, содержащей исключительно беспанцирных G. baicalense и G. coeruleum, выделили ДНК и амплифицировали фрагмент рибосомной
ДНК, используя сконструированную нами специфическую для динофлагеллят пару
праймеров. Получив ожидаемый продукт длинною 710 п.н., клонировали его с использованием InsTAclone PCR Cloning Kit
("Fermentas", EU) и определяли нуклеотидную последовательность клонов с помощью
автоматического секвенатора CEQ 8800 ("Beckman Coulter", США). При
построении филогенетического древа сравнивались методы ближних соседей,
минимальной эволюции и максимальной парсимонии, а также различные модели
построения деревьев, все они показали сходную топологию.
Известно, что
вид, описанный как G. coeruleum, активен весь тёплый сезон [3]. За период
наших наблюдений (2005-2008 гг.) вид встречался постоянно от единичных
экземпляров до 1-2 тыс. кл/л и в пелагиали, и в литорали. Максимальная
численность в этот период выявлена в литорали Южного Байкала, она достигала 6.3
тыс кл/л. В пелагиали на разрезе Листвянка-Тонхой наибольшую численность (5.4
тыс кл/л) наблюдали в апреле 2007
г. Хотя ранее этот вид вместе с остальными динофлагеллятами
рассматривался в составе байкальского фитопланктона, мы наблюдали отсутствие
свечения его клеток в ультрафиолетовом свете, что доказало его неспособность к
фотосинтезу. Это отличает его от всех прочих байкальских фитопланктонных
динофитовых.
Расшифрованный
фрагмент гена 18S РНК этого динофлагеллята полностью совпал с аналогичной
последовательностью гетеротрофного вида Gyrodinium helveticum (Penard) Takano
et Horiguchi из японского пресноводного озера Шикотсу [4]. Положение
динофлагеллята относительно других видов по данному молекулярно-генетическому
маркеру показано на филогенетическом древе (рис. 1, клон LM083).
Действительно, Н. Л. Антипова также упоминала о схожести описанного ей вида с G. helveticum, но, по её мнению, определяющим различием
между ними является более короткая продольная борозда, остроконическая без
выростов верхушка и голубая, а не розовая окраска у G. coeruleum [2]. Однако накопленные на
сегодняшний день наблюдения свидетельствуют, что окраска не может являться
важным отличительным признаком: часть встречаемых байкальских особей, также как
и ряд представителей японского варианта вида
бесцветны. Кроме этого, Yoshihito Takano и Takeo Horiguchi описали морфологические варианты вида G. helveticum, включающие и характерные для байкальских
особей «шапочки» [4]. По нашим данным, средние
размеры клеток байкальского вида, определенного ранее как G. coeruleum составляют 47.5 (SD 3.1, n =
30) x 27.1 (SD 2.3, n = 30) мкм, что полностью
соответствует размерам G. helveticum [4].
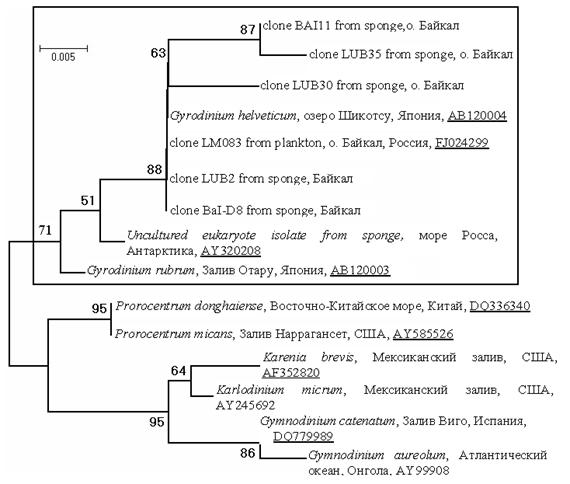
Рис.
1. Молекулярно-филогенетическое древо, построенное методом объединения
ближайших соседей по модели максимального правдоподобия, на основе фрагмента
гена 18S РНК
с
определением индекса бутстрэпа. Выделенная группа содержит представителей
рода
Gyrodinium
Кроме того, мы
наблюдали характерную для рода Gyrodinium Kofoid et Swezy продольную исчерченность клеток у
байкальских особей. Всё это, в совокупности
с абсолютным генетическим сходством по рассмотренному нами маркеру, позволяет
утверждать, что представитель гетеротрофных байкальских динофлагеллят
принадлежит к роду Gyrodinium, то
есть к роду беспанцирных динофлагеллят, чётко отличающихся от других
динофитовых как по морфологическим,
так и по молекулярным данным и распространенному повсеместно. Вероятнее всего,
что мы имеем дело с байкальским вариантом вида G. helveticum, хотя для окончательного диагноза
необходимо провести также и SEM микроскопию. Вид G. helveticum не является эндемичным, он
обитает в пресноводных водах умеренного климата. Стоит отметить примечательную
особенность, связанную с данным видом. Динофлагелляты способны не только к
свободноживущему образу жизни, но и к мутуалистическому. В том числе ряд
динофлагеллят обитает в морских губках: для части из них доказана
симбиотическая природа взаимоотношений, для некоторых же степень ассоциированности
остается не ясной.
Мы провели изучение
динофлагеллят, связанных с байкальскими пресноводными губками,
молекулярно-генетическими методами. Для этого из образцов губок семейства Lubomirskiidae Rezvoy,
относящихся к родам Lubomirskia Dybowski и Baikalospongia Annandale, выделили суммарную ДНК. Сконструированные нами видоспецифические праймеры позволили
вычленить из этой ДНК последовательности, принадлежащие динофлагеллятам, и
амплифицировать искомый фрагмент гена 18S РНК. Так как нам неизвестно насколько велико
разнообразие динофлагеллят в губке, то для их определения было необходимо
применить принципы метагеномного анализа, заключающиеся в клонировании
полученного продукта амплификации и дальнейшего рассмотрения библиотек клонов [5].
ДНК фрагмент клонировали, как описано
ранее. Библиотеки клонов анализировали при помощи рестрикционного анализа ферментами
Alu1 и Ddel и частичного секвенирования (описано ранее).
Оказалось, что
достаточно большая часть этих ДНК последовательностей из исследованных губок
близка к расшифрованному нами планктонному варианту G. helveticum (рис. 1), не смотря на его небольшую
численность в планктоне. Гомология нуклеотидных последовательностей составляет
97 – 99.7 %. Таким образом, байкальские губки концентрируют в себе динофлагеллят,
являясь своеобразным резервуаром для них. Необходимо более детальное исследование
для определения с одним и тем же ли видом мы имеем дело, но уже сейчас ясно,
что последовательности, найденные в байкальских губках принадлежат к роду Gyrodinium. Также дальнейшие
исследования покажут, является ли такое накопление следствием большой
фильтрующей способности губок, а Gyrodinium sp. - важным
звеном в их питании. С другой стороны, возможно, что мы наблюдаем более сложные
взаимоотношения, в которых один вид оказывается местом обитания для другого.
Сведения о нахождении представителей гиродиниумов в губках не единичны, хотя
все они основываются на молекулярно биологических данных. В морских арктических
губках идентифицированы последовательности, близкие к миксотрофному Gyrodinium
galatheanum (Braarud) Taylor [6], на рис. 1 соответствующий клон располагается в
одном кладе с G. helveticum (байкальским и японским
вариантами). Также найдены динофлагелляты, похожие на свободноживущих динофитовых
в морской губке Haliclona simulans Johnston с западного
побережья Ирландии [7].
Примененные в работе методы позволили изменить таксономический статус иccледованного организма, а
также быстро и эффективно провести анализ динофитовых внутри губок. Последнее потребовало
бы гораздо большего времени при использовании стандартных методик
культивирования, а также могло привести к искажению данных из-за неодинаковой
способности динофитовых к росту в искусственных условиях. Обнаружение рода Gyrodinium в озере Байкал открывает возможности для
лучшего изучения взаимоотношений между этим видом и другими организмами, а
также для сравнительного анализа байкальской популяции с популяциями из других
озёр. Несомненно, необходимо провести поиск этого вида и в других близлежащих
озёрах.
Список
литературы
1.
Вотинцев К.К., Мещерякова
А.И., Поповская Г.И. Круговорот органического вещества в озере Байкал.
Новосибирск: Наука, 1975. 188 с.
2.
Антипова Н. Л. // ДАН. Т. 103. 1955. C. 325-328.
3.
А.И.Таничев, Н.А.Бондаренко. В кн: Атлас и
определитель пелагобионтов Байкала. Новосибирск: Наука, 1995. С. 146-181.
4.
Takano Y.,
Horiguchi T. // Phycolog. Res. 2004. V. 52. P. 107–116.
5.
Kunin V,
Copeland A, Lapidus A et all // Microbiol. and Mol. Biol. Rev. V. 72 (4). 2008.
P. 557–578.
6.
Webster N. S., Negri A. P., Munro M., Battershill
C. N. // Envir. Microbiol. 2004. V. 3. P. 288–300.
7.
Kennedy J, Codling C, Jones B, Dobson A, Marchesi
J. // Environmental
Microbiol. 2008. P. 1 – 14.
АНАЛИЗ ТОКСИЧНОСТИ
ФИТОПЛАНКТОНА ГИПЕРТРОФНОГО ОЗ.
НЕРО
Бабаназарова О.В.*,
Р. Кармайер**, Сиделев С.И.*, Зубишина А.А.*, Рахмангулов Р.A.*, Александрина А.М*
Toxic analysis of the hightrophic lake Nero phytoplankton
Babanazarova O.V.*, Kurmayer R.**, Sidelev S.I.*,
Zubishina A.A.*, Rahmangulov R.A.*,
Aleksandrina E.M.*
*Ярославский Государственный университет им. П.Г.Демидова
г. Ярославль, пр-д Матросова,
9. тел/факс 8(4852)478298
e-mail: baba@bio.uniyar.ac.ru
**Институт
Лимнологии г. Мондзее
Эвтрофикация водоемов была
расценена и как проблема возрастания загрязнения природными токсинами во многих
странах Западной Европы и Северной Америки с середины двадцатого столетия.
Особенно много гипертрофных, мелководных водоемов в странах Западной Европы.
Появление и развитие синезеленых водорослей в водоемах, как правило,
сопровождается продуцированием различных типов токсинов: гепатотоксинов,
нейротоксинов, дерматотоксинов. Гепатотоксины продуцируются представителями
родов Microcystis, Anabaena, Planktothrix и Nostoc. В Европе
систематические исследования качественного и количественного состава наиболее
распространенного гепатотоксина – микроцистина проводятся более 10 лет. В
настоящее время, описано более 70 типов различных микроцистинов (Codd et al.,
2005).
С 1999 года на кафедре
экологии и зоологии ЯрГУ им. П.Г.Демидова проводятся мониторинговые ежемесячные
(март, май-октябрь) наблюдения фитопланктона оз. Неро. Исследования 1999 - 2008
гг. показали значительные флуктуации качественных и количественных
характеристик развития планктона оз. Неро. В открытой части озера, прилегающей
к г. Ростову, фитопланктон, как и в 1987 - 89 гг., относится к
планктотрихетовому (осцилляториевому) типу. Однако, внутри сообщества происходят
изменения в сторону лидерства форм, характерных для затухающих мелководных
водоемов, обогащенных органикой. Отмечено значимое увеличение содержания
биогенных элементов в воде центральной части оз. Неро в последние четыре года,
возрастание содержания хлорофилла после зафиксированного спада в 2002-2004гг,
увеличение средних биомасс фитопланктона и вклада синезеленых водорослей с
доминированием планктотрихетового типа. Биомассы планктотрихетового комплекса
составляют более 50-60 % летом, достигая в отдельные периоды 80%. С 2003 года
наблюдается массовое развитие Planktothrix agardhii.
Цель настоящего исследования
– определить и проанализировать наличие природных токсинов (мицроцистинов) при
мониторинге состояния оз.Неро.
Минеральные растворенные формы азота и фосфора, общий
фосфор, качественный и количественный состав фитопланктона, содержание
хлорофилла анализировали общепринятыми стандартными методами. Анализы содержания
микроцистинов в сестоне проводили методами высокоэффективной жидкостной
хроматографии в лаборатории доктора Райнера Кармайера в Институте Лимнологии
Австрийской Академии наук г. Монзее в сентябре 2008 г. согласно
лицензированным методикам и стандартам ISO 20179:2005.
Минеральные формы азота и фосфора, содержание
хлорофилла в сестоне оставались высокими, как и в последние 4 года наблюдений.
Биомасса фитопланктона в летний период 2008 г. достигала средних значений 36,5 мг/л,
характеризовалась постепенным нарастанием с июня к августу и резким максимумом
в сентябре. В составе сообщества преобладали Cyanophyta (32-86% от общей биомассы
фитопланктона), основную часть составляли водоросли планктотрихетового комплекса
29,1-64,4% от общей биомассы: ((Limnothrix redekei (22,2-30,2%), Pseudanabaena
limnetica (3,7-19,2%), Planktothrix agardhii (2-17,3%) и Lyngbya
limnetica (0,4-1,3%)).
Содержание микроцистинов оказалось незначительным и
варьировало от 0,54 до 1,92 мкг/л в пробах июня-сентября 2008 г. Наибольшее количество
микроцистинов отмечено в сетной пробе, отобранной сетью Джеди в оз. Неро в
сентябре 2008 г.
Биомасса фитопланктона в сетной пробе составила 1,39 г/л. При анализе данной
пробы спектр абсорбции был максимальным на длине волны 240 нм, при времени
задержания 14,59 мин. и 19,57 мин., что соответствует микроцистину RR и
микроцистину LR. Концентрации этих цианотоксинов в анализируемом экстракте
составили 198,33 нг и 124,38 нг, соответственно. При пересчете на литр воды это
составило 12,91 мкг/л сетной пробы фитопланктона. Всемирная организация по
здравоохранению установила в 1997
г. предел в 1 мг/л микроцистина-LR или эквивалента этого
токсина, в качестве предельно допустимой нормы содержания данного токсина в
питьевых водах. Этот уровень рассчитан как сумма микроцистина внутриклеточного
и микроцистина, растворенного в воде, при расчете веса взрослого человека около
60 кг и
его потребностей около 2 л
воды в день. Мониторинг цианотоксинов как и в целом развития синезеленых водорослей
проводится в странах Западной Европы и США, как разработанный общепринятый подход (Toxic cyanobacteria in
WATER…, 1999).
При цветении синезеленых
могут формироваться как монодоминантные, так и полидоминантные сообщества, с
разнообразием выраженного токсичного эффекта. Генотипическая вариабельность
видов синезеленых водорослей весьма широка. Молекулярно-биологический анализ
выявляет сосуществование токсичных и нетоксичных популяций синезеленых
(Kurmayer et al., 2002). Так, с развитием планктотрихетовых форм водорослей
значимых зависимостей с содержанием микроцистинов в наших наблюдениях не
обнаружено. В то же время, корреляционный анализ выявил значимое соотношение
содержания микроцистинов в сестоне оз. Неро с биомассой видов рода Microcystis
(коэффициент корреляции Спирмена 0,71, при p<0,05, n =12).
Участие Мicrocystis в фитопланктоне по
биомассе, в целом, было невелико, изменяясь в сезонной динамике от 0,14 до 1,8
мг/л (0,5-2,7% от общей биомассы фитопланктона), наибольшее количество было
отмечено в сентябре. Среди представителей рода в этот период в среднем по трем
станциям преобладал Microcystis wesenbergii (Komarek) Komarek in
Kondrateva – 31,2%, Microcystis smithii Komarek et Anagnostidis – 19,2%
, Microcystis viridis (A.Braun in Rabenhorst) Lemmermann
– 19,3%; Microcystis aeruginosa Kutz – 16%; Microcystis flos-aquae
(Wittrock) Kirchner – 14%. В летний период преимущественно развивались две
последние формы водорослей. Результаты вполне согласуются с известной высокой
токсичностью видов рода Microcystis.
В оз. Неро виды данного рода уступили место доминантов в конце 20-го века,
планктотрихетовый комплекс буквально выдавил их из озера за счет световой
конкуренции (Babanazarova, Lyashenko, 2007), тогда как в других водоемах бурное развитие
представителей рода Microcystis.
велико, например – река Волга. Имея в России преимущественно открытые
поверхностные водозаборы для питьевых и коммунальных нужд, необходимость
включать в мониторинг качества воды анализы на содержание цианотоксинов
очевидна.
Список литературы
Babanazarova O.V., Lyashenko O.A. (2007) Inferring long-term changes in
the physical-chemical environment of the shallow, enriched Lake Nero
from statistical and functional analyses of its phytoplankton. J. Plankton Res.
9: 747-756.
Codd G., Morrison L.F., Metcalf J.S. (2005) Cyanobacterial toxins: risk
management for health protection. Toxicol Appl Pharmacol. 203: 264-272.
Kurmayer R., Dittmann E., Fastner J., Chorus I. (2002).
Diversity of microcystins genes within a population of the toxic cyanobacterium
Microcystis spp., in Lake Wannsee (Berlin,
Germany). //
Microbiol. Ecol. 43: 107-118.
Toxic cyanobacteria in WATER a guide to their public health
consequences, monitoring and management. / Edited by Ingrid Chorus and Jamie
Bartram First published 1999 by E&FN Spon an imprint of Routledge 11 New
Fetter Lane, London EC4P 4EE, 416 p.
НЕКОТОРЫЕ
ОСОБЕННОСТИ ВЗАИМООТНОШЕНИЙ ЦИАНОБАКТЕРИЙ И МИКРОВОДОРОСЛЕЙ С ЧЛЕНИСТОНОГИМИ
Гольдин Е.Б.
Some aspects of interrelations between Cyanobacteria
and
microalgae and arthropods
Goldin E.B.
Южный филиал
Национального университета биоресурсов и природопользования
”Крымский
агротехнологический университет”
а/я 2223, г. Симферополь, АР
Крым, Украина, 95043, тел./факс 380 652 221389
e-mail: Evgeny_goldin@mail.ru
Разнообразные проявления биологической
активности цианобактерий (Ц) и микроводорослей (М) в наземных и водных
экосистемах широко освещены в научной литературе, но сведения о взаимоотношениях
этих организмов с членистоногими (Ч), также доминирующих в природных сообществах
и имеющих ряд точек соприкосновения с ними, немногочисленны (около 300
публикаций с 1954 г.).
Существующие данные свидетельствуют о широких и многосторонних трофических,
симбиотических, антагонистических и паразитических связях различных таксонов Ц
и М с Ч, которые оказывают влияние на жизненные функции ракообразных, клещей и
насекомых. Результаты изучения эколого-биохимических аспектов этих
взаимодействий, полученные в последние годы, позволяют согласиться с гипотезой
о том, что ряд возбудителей “цветений”
из числа Ц и М продуцирует биологически активные вещества (БАВ), которые, в
отличие от известных токсинов, направлены на борьбу с конкурентами и
фитофагами, ингибируя их физиологические функции. Комплексное химическое взаимодействие
Ц и М с фитофагами (“grazers”) в
водных экосистемах, особенно эвтрофированных, включает продуцирование токсинов
и БАВ и действует во многих направлениях. При этом БАВ могут служить не только
средством защиты стрессового, репеллентного или антифидантного (детеррентного)
характера, но и повышать возможности расселения вида. Похожий процесс
происходит у высших растений в наземных экосистемах, хотя между этими явлениями
нельзя проводить полную аналогию. В результате действия БАВ снижаются или
ингибируются активность, рост и плодовитость растительноядных организмов
(например, некоторые Ц и М ограничивают питание и размножение копепод, но не
вызывают у них летального эффекта). Биолого-экологическое значение массовых
видов Ц и М не сводится только к проявлению токсичного эффекта, оно значительно
сложнее. На наш взгляд, предпочтительнее говорить о биологической активности
или биоцидных свойствах массовых видов Ц и М, весьма перспективных в области
биотехнологических разработок препаратов, направленных на биологическое регулирование
численности вредных организмов в сельском хозяйстве и медицине.
Нами проведены модельные опыты по
изучению влияния пресноводных видов Ц и М на метаморфоз массовых видов Ч в
лабораторных условиях (в водной среде решение подобной задачи по ряду причин
было бы сложнее). Часть результатов экспериментов содержится в представленной работе.
Методика и материалы. В модельных экспериментах были испытаны культуры Synechococcus leopoliensis
(Racib.) Komarek, Nostoc muscorum Ag., N.linckia Both., Anabaena variabilis Kütz., Microcystis aeruginosa Kütz. emend. Elenk., Scenedesmus quadricauda (Turpin.) Breb. и Sc. obliquus
(Turpin.) Kütz., полученные из коллекций Института гидробиологии и
Института биологии южных морей НАН Украины. Для их культивирования использовали
среду Фитцджеральда в модификации Горэма (№ 11). При биологическом тестировании
использовали личиночные фазы насекомых-фитофагов на стадии младших возрастов -
гусеницы американской белой бабочки Hyphantria cunea Drury (АББ), златогузки
Euproctis chrysorrhaea L. (З) и личинки колорадского жука Leptinotarsa
decemlineata Say (КЖ). Сбор насекомых проводили в агробиоценозах степного и
предгорного Крыма, при этом отбор тест-объектов вели строго по принципу
однородности материала в возрастном и физиологическом отношении. На протяжении
экспериментов личинок и гусениц содержали в сосудах емкостью 1,0 л, по 10-15 особей в
каждом. Вариант опыта включал пять повторностей. В различных вариантах серии
экспериментов накануне подсадки тест-объектов культурами Ц и М обрабатывали
листья наиболее типичного растения-хозяина, предназначенные для скармливания
подопытным насекомым: для гусениц АББ - клена ясенелистного, З - абрикоса,
личинок КЖ - картофеля. В ходе экспериментов изучали питание (% съеденной листовой
поверхности в расчете на одну особь), метаморфоз и выживаемость тест-объектов.
Изучение ростовых процессов проводилось методом взвешивания насекомых на 10,
15, и 20 сутки. Степень влияния Ц и М на метаморфоз Ч оценивали по числу
окуклившихся личинок и гусениц и по выходу имаго.
Результаты и их обсуждение. Полученные данные подчеркивают специфику действия Ц
и М на трофодинамику Ч и отражают три пути подавления пищевой активности
фитофагов. (1) Сочетание антифидантных и репеллентных свойств приводит к отпугиванию
Ч и игнорированию обработанного корма. Позже негативное отношение переносится
фитофагом и на необработанный корм. Пищевая активность находится на низком
уровне. (2) Питание обработанным кормом игнорируется, но с заменой корма, через
определенный промежуток времени, пищевая активность частично восстанавливается.
(3) Антифидантный эффект и его последействие обусловлены токсическими
метаболитами Ц и М. Их присутствие отрицательно влияет не только на пищевой
режим Ч, но и на другие важные функции их организма. Сокращение объема питания
и нарушение его ритма, обусловленное антифидантным эффектом, вызывает у Ч значительные
физиологические отклонения от нормы. В первую очередь это отражается на
процессе жирового синтеза, коррелирующим с показателями массы, которые являются
важными критериями при определении роли фактора в жизненном цикле насекомого и
индикатором токсичности и отражают динамику роста личиночной стадии и последовательность
перехода в ее следующую возрастную фазу. Изучение динамики роста личинок и
гусениц, подвергшихся на определенной стадии воздействию Ц и М, показывает, что
даже трехдневный контакт с обработанным кормом отражается на физиологии
тест-объектов. Наиболее наглядно отставание в весе от контрольных особей
прослеживается на 10 сутки. В последующий период происходит некоторое сближение
показателей за счет элиминации ослабевших особей в опыте, но возможно и
усиление угнетающего эффекта. Сопоставление результатов взвешивания свидетельствует
о дифференцированном действии различных видов Ц и М в зависимости от особенностей
Ч. При этом заметно, что физиологический эффект коррелирует с антифидантным: Ц
и М, которые в большей степени ингибируют питание насекомых, вызывают
максимальное отставание в весе. Значительная разница в весе между гусеницами
АББ, испытавшими в третьем возрасте влияние водорослей, и контрольными особями
объясняется тем, что происходит не только ингибирование накопления жировых
запасов, но и запаздывание с переходом в очередной возраст. У большей части
насекомых, испытавших влияние активных видов Ц и М в личиночной фазе, в той или
иной степени нарушен метаморфоз. Неполноценное питание, угнетение процессов
роста и отставание в возрасте приводит к тому, что выжившим особям не удается
завершить цикл развития (табл.).
Так, личинки КЖ 2 и 3 возраста,
подвергшиеся действию S. leopoliensis, не окукливаются. Очень вяло протекает процесс и у
гусениц американской белой бабочки. Насекомые, подвергшиеся в 4 возрасте
действию S. leopoliensis, начинают окукливаться только на 10 сутки - в
контроле к этому времени окукливается 26,0% гусениц. Но если обработанный корм
предлагается гусеницам в более раннем возрасте, то покоящейся стадии достигает
еще меньшее число особей (табл.).
Ц и М оказывают отрицательное воздействие на
метаморфоз З. Питание гусениц 2 возраста в течение трех суток кормом,
обработанным N. muscorum, N. linckia, A. variabilis, M. aeruginosa, вполне достаточно, чтобы окуклилось особей на
27,7-55,6% меньше, чем в контроле. Но получение обработанного корма в 3
возрасте приводит к меньшему угнетению.
Вылет имаго происходит лишь из 1,3-11,1% куколок АББ.
У З метаморфоз протекает несколько активнее, но значительная часть окуклившихся
особей погибает, не достигнув имагинальной фазы.
Таблица
Влияние водорослей на метаморфоз американской белой
бабочки.
В каждом варианте 75 гусениц, питавшихся три дня
обработанным кормом. Данные по окукливанию (О) и вылету бабочек (В) приводятся
в % к первоначальному количеству насекомых, взятых в опыт
|
Виды
водорослей
|
Возраст гусениц
|
|
2 возраст
|
3 возраст
|
4 возраст
|
|
О
|
В
|
О
|
В
|
О
|
|
Synechococcus leopoliensis
|
-
|
-
|
14,7±1,3
|
8,0
|
13,3±6,8
|
|
Anabaena variabilis
|
-
|
-
|
33,3±2,1
|
9,3
|
0
|
|
Контроль
|
-
|
-
|
100,0
|
26,7
|
75,6±2,3
|
|
Scenedesmus quadricauda
|
17,3±3,8
|
6,7
|
0
|
0
|
54,7±12,8
|
|
Sc. obliquus
|
18,7±6,4
|
5,3
|
0
|
0
|
45,3±7,7
|
|
Контроль
|
73,3±3,8
|
66,7
|
100,0
|
62,2
|
86,7±2,6
|
Таким образом, ингибирование различных жизненных
функций Ч (питание, рост, метаморфоз), происходящее под влиянием активных видов
Ц и М, приводит к гибели большей части фитофагов на всех фазах развития.
Анализ
структуры сообществ водорослей
Девяткин В.Г.
Analysis of the algal
communities structure
Deviatkin V.G.
Институт биологии внутренних вод им. И.Д. Папанина РАН
e-mail: robinson@mail.ru
В настоящее время нет единой трактовки экологической
классификации водорослей. Нами предлагается классификация экологических группировок
водорослей, основанная на сформированных в процессе эволюции признаках
(Девяткин, 1979). Так, большинство бентосных форм водорослей может быть
дифференцировано от планктонных лишь на основании способности к опорному
движению и гетерополярности клеток или колоний. Свободноплавающие жгутиконосцы
в своем большинстве, видимо, могут рассматриваться как планктонные формы.
Наиболее характерной особенностью типичных представителей микрофитобентоса
следует считать способность к опорному движению. В качестве характерного
адаптивного в эволюционном плане признака типичных для перифитона (обрастаний) водорослей
можно рассматривать часто связанную с редукцией подвижности гетерополярность в
строении их клеток или колоний. Для всплывающих со дна водоемов скоплений
водорослей предлагается термин флотон, при необходимости различая в зависимости
от происхождения бенто- или перифлотон, Для макроскопических колоний нитчатых
водорослей (тина, вата) предлагается
термин мезофитон.
Репрезентативность описания альгоценозов возрастает с
привлечением показателей встречаемости. Сведения о встречаемости видов
существенно расширяют информацию о биологическом разнообразии экосистем и могут
использоваться для биоиндикации. Так, в экстремальных условиях, а также под
влиянием антропогенной нагрузки пространственная и временная организация
альгоценозов становится более однообразной в результате выживания сравнительно
небольшого числа толерантных форм, что отражается на показателях встречаемости
видов, проявляясь в возрастании встречаемости доминирующих форм и индекса
средней встречаемости Fsp. Напротив, при включении в состав флористических
списков большого количества редко встречаемых и случайных форм можно ожидать
понижения значений индекса Fsp. Роль систематических подразделений разного
уровня (родов, семейств, отделов и др.) в формировании биологического
разнообразия в зависимости от встречаемости входящих в их состав таксонов может
быть оценена с помощью флористического индекса Fspp (Девяткин, Митропольская,
2002). Некоторые общие закономерности, установленные для показателей
встречаемости в наземных фитоценозах
применимы и к водным альгоценозам. Рассматриваются различные показатели
встречаемости.
Предлагаются статистические модели формирования и
динамики видового разнообразия водорослей.
При сопоставлении флористических списков фитопланктона
различных водоемов по размерам клеток входящих в их состав видов пресноводные и
морские водоемы заметно различаются. Имеющиеся данные свидетельствуют о преобладании
в планктоне морских водоемах в сравнении с пресноводными более крупноклеточных
форм водорослей. Размерная структура видового состава фитопланктона водоемов
умеренной зоны (крупных рек, озер и водохранилищ) характеризуется значительным
сходством. В составе перифитона по сравнению с фитопланктоном более значительно
участие более крупноклеточных форм. Для изучения размерной структуры сообществ предлагаются
методы построения размерных диаграммы и 3-х мерных графиков.
В целом фитопланктон можно рассматривать как хорошо
скоординированную систему, направленную на эффективное усвоение солнечной
энергии, в которой видовой состав и его размерные характеристики находятся в
постоянной адаптивной связи с меняющимися экологическими условиями. Поскольку
основные экологические показатели демонстрируют заметную периодичность, можно
говорить также о возможности сложившихся за многие годы существования природных
экосистем механизмов ритмической адаптации альгоценозов к устойчивым ритмам
гидрофизических параметров.
Скорость адаптивных процессов и течение внутрисезонной
сукцессии альгоценозов наиболее отчетливо связаны с периодическими колебаниями
уровня солнечной радиации. В периоды повышенной инсоляции (погода антициклонального
типа, поток энергии относительно стабилен) скорость происходящих в
фитопланктоне изменений минимальна. В периоды циклонической активности, характеризующиеся
выпадением атмосферных осадков и
неустойчивостью погодных условий, скорость происходящих в фитопланктоне
изменений возрастает. В то же время планктонное сообщество более стабильно в
периоды высокого видового разнообразия, а также эквитабельности его размерного
состава, которая может быть оценена с помощью индекса Шеннона-Уивера. В периоды
пониженного поступления солнечной энергии видовое разнообразие фитопланктона
понижается, а средние размеры клеток планктонных водорослей возрастают. Рассматриваются
методы оценки скорости трансформации альгоценозов.
Предполагается, что «стратегия адаптации»
фитопланктона к наиболее эффективному усвоению энергии солнечной радиации включает
модификацию его размерного состава: при достаточной обеспеченности элементами
минерального питания преобладают мелкоклеточные формы, которые при сходных значениях
биомассы более интенсивно поглощающие солнечную энергию, чем крупноклеточные. В
условиях недостатка биогенных веществ преимущество могут получать более крупноклеточные
формы. В результате возрастает глубина эвфотической (трофогенной) зоны, а в фотосинтезе
могут участвовать водоросли из более глубоких и относительно лучше обеспеченных
элементами минерального питания водоросли.
Складывающиеся в периоды относительной стабильности
фитопланктона ассоциации водорослей, некоторые из которых носят сравнительно
устойчивый характер и могут повторяться (возобновляться) в течение
вегетационного периода, предлагается называть экоценами. Экоцены можно
рассматривать в качестве элементарных ячеек сукцессии планктонных альгоценозов,
а последнюю как смену характерных для данного водоема экоценов. Продолжительность
существования экоценов обычно составляет несколько суток, а временные границы
часто совпадают со сменой гидрометеорологических условий. В общем виде
сукцессию литорального фитопланктона можно представить в виде модели, имеющей
вид сложной спирали, в которой на основные «годичные кольца» накладываются
дополнительные внутрисезонные витки. Предлагаются методы выделения временных
границ экоценов и оценки их экологической валентности.
Для оценки зависимости показателей продуктивности
фитопланктона от гидрофизических факторов предлагаются использование простых статистических
моделей. Показано, что динамику продукционных процессов в водоеме часто можно достаточно
удовлетворительно смоделировать на основе определений концентрации хлорофилла
«а» и температуры и прозрачности воды.
Рассматриваются сравнительные особенности структуры
сообществ фитопланктона и перифитона. В отличие от литорального фитопланктона,
в формировании которого принимают участие несколько групп водорослей, основную
роль в формировании перифитона обычно играют лишь диатомовые, зеленые и, в
меньшей степени, синезеленые водоросли. Ритмические колебания размерной
структуры перифитона по сравнению с фитопланктоном выражены более слабо. В
процессе формирования сообщества средняя длина и ширина, а также отношение
длины к ширине клеток уменьшаются. Влияние температурного фактора на размерную
структуру перифитона и фитопланктона часто противоположно: в периоды
наибольшего прогрева водоема в перифитоне, в отличие от фитопланктона, преобладают
сравнительно мелкоклеточные формы. Между размерами слагающими сообщество клеток
перифитона, как и фитопланктона, и видовым разнообразием альгоценозов наблюдается
отрицательная корреляция.
Структурные и функциональные характеристики перифитона
зависят от развития фитопланктона, способного «перехватывать» необходимые для
перифитона солнечную энергию и биогенные элементы. Видовое разнообразие, обилие
и продуктивность перифитона в периоды интенсивного развития фитопланктона могут
понижаться. В периоды наибольшего развития фитопланктона перифитон обычно представлен
более мелкоклеточными формами водорослей. В результате может наблюдаться «противофазный»
по сравнению с фитопланктоном ответ перифитона на динамику основных абиотических
факторов, обусловленный конкурентными взаимоотношениями между этими экологическими
группировками водорослей. Таким образом, исследуя экологию перифитона, следует
учитывать его взаимодействие с фитопланктоном, влияние которого может быть
сравнимо со значением некоторых абиотических
факторов.
В целом сообщество перифитона остается преимущественно
автотрофным (чистый фотосинтез положителен) около 2-х месяцев экспозиции
субстрата, а при более продолжительной экспозиции в нем могут преобладать
процессы деструкции. Фотосинтетическая активность единицы биомассы перифитона,
по нашим наблюдениям, составляет около 0.3 мг О2/мг биомассы в
сутки, что заметно ниже ассимиляционной активности фитопланктона (около 0.8 мг
О2/мг биомассы). Суточная ассимиляционная активность хлорофилла «а»
перифитона составляла 50 – 100, что также ниже САЧ литорального фитопланктона
(около 200 мг О2/мг хлорофилла «а»).
В составе микрофитобентоса предлагается выделять
планкто-микрофитобентос, представленный типичными для фитопланктона видами, а
также эвмикрофитобентос, представленный видами, обычно связанными в течение жизненного
цикла с субстратом. За пределами эвфотической зоны микрофитобентос практически
полностью представлен планктонными и эврибионтными формами, а типично
бентосные, т.е. обладающие способностью к опорному движению виды, встречаются в
незначительном количестве (Девяткин, 1978).
Интенсивность фотосинтеза нитчатых водорослей
оценивается величиной » 5-10 мг О2/г сырого или 30 – 50 мг О2/г
сухого веса в час. Суточную продуктивность нитчатых водорослей ориентировочно
можно оценить величиной » 50-100 мг О2/г сырого или 300 – 500 мг О2/г
сухого веса. Если принять содержание углерода в единице сырой биомассы
водорослей » 10% (Винберг, 1960), а
переходный коэффициент от кислорода к углероду = 0.33, то соотношение
продукция/биомасса нитчатых водорослей » 0.2. Для перифитона этот показатель » 1.1, а для фитопланктона » 2.6.
Рассматриваются методы оценки продуктивности
перифитона, микрофитобентоса и нитчатых водорослей (метафитона).
Список литературы
Винберг
Г. Г. Первичная продукция водоемов.
Минск. 1960. 329 с.
Девяткин
В.Г. Микрофитобентос // Иваньковское водохранилище и его жизнь. Л.: Наука,
1978. С. 86-101.
Девяткин
В.Г. Динамика развития альгофлоры обрастаний в Рыбинском водохранилище // Флора
и растительность водоемов бассейна Верхней Волги. Рыбинск: Ин-т биологии
внутр. вод АН СССР, 1979. С. 78-108.
Девяткин
В.Г. Ритмическая компонента в динамике фитопланктона // IV всероссийская конференция
по водным растениям. Тезисы докладов. Борок. 1995. С. 87-88.
Девяткин
В.Г., Митропольская И.В. Встречаемость видов водорослей как показатель биологического
разнообразия альгоценозов // Динамика разнообразия гидробионтов во внутренних
водоемах России. Ярославль, 2002. С. 5-22.
СПЕКТРАЛЬНЫЕ СВОЙСТВА И
ТЕРМОУСТОЙЧИВОСТЬ
НАТИВНЫХ СВЕТОСОБИРАЮЩИХ
КОМПЛЕКСОВ I И II
В КЛЕТКАХ МУТАНТОВ CHLAMYDOMONAS REINHARDTII
Дзюбенко
В.С.*, Ладыгин В.Г., Шегай И.Д.
SPECTRAL CHARACTERISTICS AND TERMOSTABILITY
OF NATIVE LIGHT-HARVESTING COMPLEXES I AND II
IN THE CELLS OF MUTANTS CHLAMYDOMONAS
REINHARDTII
Dzyubenko V.S.*, Ladygin V.G.,
Shegay I.D.
*Институт физиологии растений имени К. А. Тимирязева РАН
127276 г. Москва, ул. Ботаническая, д.35, тел. 8
(499) 231-83-79
e-mail: dzyubenko@ippras.ru
Институт фундаментальных проблем биологии РАН
142290 Московская область, г. Пущино, ул. Институтская, д. 2, тел. 8
(4967) 73-28-64
e-mail: ladyginv@rambler.ru
Метод дифференциальной сканирующей микрокалориметрии
(ДСК) основан на определении теплоемкости образца как функции температуры.
Немонотонное изменение этой функции с пиками повышенной теплоемкости (эндодермами)
свидетельствует о фазовых (структурных) переходах в образце. Положение эндодерм
на температурной шкале и их площадь характеризуют температуру и энтальпию
фазового перехода или термоустойчивости белковых комплексов.
В конце прошлого столетия в серии
работ на изолированных хлоропластах из различных объектов методом ДСК было
обнаружено до 8 эндодерм с максимумами в областях 42.5 - 60.6 – 64.9 – 69.6 –
75.8 – 84.3 и 88.9 0С, которые
рассматриваются как свидетельство термоиндуцированной денатурации
функциональных комплексов фотосинтетического аппарата. Некоторые из
обнаруженных эндодерм идентифицированы, в частности эндодерма с максимумом 75.8
0С в ряде исследований определена
как показатель изменения структуры светособирающего комплекса фотосистемы 2 (LHC-II). Однако
точные показатели параметров структурных переходов могут варьировать в зависимости
от источника хлоропластов, что отразилось в разночтении характеристик отдельных
комплексов в публикуемых работах. Тем не менее, высказывается надежда, что
знание термодинамических параметров
отдельных функциональных комплексов, стабильность и динамической
подвижности их структуры позволит по профилю термограмм определять участки и
характер повреждения или адаптивных перестроек фотосинтетического аппарата в
неблагоприятных условиях роста растений.
Удобной моделью для подобного рода физиологических
исследований является одноклеточная зеленая микроводоросль Chlamydomonas reinhardtii,
а для идентификации эндодерм большую помощь могут оказать ее штаммы с нарушением
синтеза одного, двух или трех хлорофилл-белковых комплексов (одинарные, двойные
или тройные мутанты) [1, 2]. В настоящей работе впервые представлены
исследования по калориметрическому анализу суспензии нативных водорослей по
идентификации эндодерм, связанных с термостабильностью светособирающих
комплексов.
Работа выполнена на целых клетках мутантов Сh. reinhardtii из коллекции В. Г. Ладыгина (ИФПБ РАН): A-66-90; ВФ-5-16 и А-66-90-1с и клеток дикого типа К(+)26. Спектры поглощения
хлорофиллов определяли при комнатной температуре с анализом четвертых
производных. В клетках дикого типа К(+)26 обнаружен максимум при 650
нм, принадлежащий хлорофиллу “b” (хл b), и два максимума при 668 и 683 нм, принадлежащих
суммарному хлорофиллу “a” LHC-I, LHC-II и реакционным центрам ФС-I и ФС-II (РЦ ФС-I и РЦ ФС-II). Показано, что двойной мутант А-66-90 содержит
максимум хлорофилла “b” при 650 нм и два максимума хлорофилла “a” при
667 и 681 нм. Смещение длинноволновых максимумов на 1-2 нм подтверждает
отсутствие у этого мутанта длинноволновых форм хлорофилла “a”,
принадлежащих реакционным центрам фотосистем I и II Анализ
спектров тройного мутанта ВФ-5-16, содержащего только LHC-II показал
наличие высокого содержания хл “b” при
650 нм и хл “a” при
668 и 679 нм. Эти результаты подтвердили, что LHC-II содержит наиболее
коротковолновые формы хл “a” и
высокое содержание хл “b”. Отношение
хлорофиллов “a” / ”b” в этом
комплексе составляет 0.8 – 1.0. Напротив, используя тройной мутант
А-66-90-1с, нам удалось показать, что LHC-I содержит мало или не содержит совсем хл “b”. У
него обнаружены две формы хл “a” при 664 и 681 нм. Причем основную часть хл “a”
составляет длинноволновая форма 681 нм. На основании полученных данных при
изучении нативных светособирающих комплексов можно заключить, что LHC-II включает в
себя практически весь хл “b” и относительно более коротковолновые формы хл “a”, в
сравнении с LHC-I.
Учитывая полученные результаты, мы попытались выявить
термодинамические характеристики светособирающих комплексов в нативных
комплексах мутантов Сh. reinhardtii и сопоставить их с литературными данными, полученными
на изолированных комплексах хлоропластов. Структурные переходы определяли
сканированием теплоемкости суспензии клеток в микрокалориметре ДСК-4 в
интервале температур 40 – 90 0С с анализом термограмм в программе WSCAL.
Показано, что дикий тип К(+)26 Сh. reinhardtii в исследованном интервале температур содержит большой
набор эндодерм, по количеству и положению на температурной шкале сопоставимый с
эндодермами изолированных мембран хлоропластов высших растений. Степень их
разрешения и характеристики зависят от состава среды (рН и ионной силе),
возраста и вероятно от условий предподготовки препарата (в частности светового
режима).
Калориметрическое сканирование мутанта ВФ-5-16,
обогащенного LHC-II, показало повышенную теплоемкость суспензии в
интервале 60 - 650С. Напротив, на суспензии клеток мутанта
А-66-90-1с, содержащего LHC-I, четко выявляется эндодерма с максимумом 680С.
Разность между сканами теплоемкостей этих мутантов позволяет определить четкие
максимумы эндотерм, отражающих термоденатурацию LHC-II (620С)
и LHC-I (680С).
Близкое значение температуры термоустойчивости LHC-I показала
разность между термограммами А-66-90 (LHC-I + LHC-II) и ВФ-5-16 (LHC-II).
Таким образом, на суспензии интактных клеток мутантов Сh. reinhardtii впервые определены параметры термоустойчивости
светособирающих комплексов LHC-I и LHC-II in vivo. В
сочетании с полученными спектральными характеристиками светособирающих
комплексов in vivo
открывается возможность более полно исследовать механизмы повреждения и защиты
фотосинтетического аппарата от неблагоприятных внешних условий.
Список литературы
1. Ладыгин В. Г. Структурно-функциональная организация
фотосистем в хлоропластах Chlamydomonas reinhardtii
// Физиол. растений. 1998. Т. 45. № 5. С. 741-762.
2. Лебедев Н. Н., Тан Цзунчин, Ладыгин В. Г.
Полипептидный состав и формирование пигмент-белковых комплексов в мутантах Chlamydomonas reinhardtii // Биохимия. 1990. Т. 55. № 11. С. 2072-2077.
ОСОБЕННОСТИ ПРОИЗВОДСТВЕННОГО ГИДРОБИОЛОГИЧЕСКОГО
АНАЛИЗА В МУП г. ИЖЕВСКА «ИЖВОДОКАНАЛ»
Иванова Н. А. Шарипова Л. А.
Features of
hydrobiological analysis in the water supply structure “Izhvodokanal” of Izhevsk
town
Ivanova
N.A., Sharipova L.A.
ЦАКВ МУП г.
Ижевска «Ижводоканал»
e-mail: ina@ivk.udm.net
В
последнее время водоканалы России сталкиваются с проблемой ухудшения качества
воды в связи с антропогенным
загрязнением и, как следствие, сильным цветением в источниках водоснабжения
различных видов водорослей, в основном сине-зеленых. Поэтому
гидробиологическому анализу на производстве уделяется все больше внимания.
Особенностями работы производственных
лабораторий является соблюдение нормативных документов (НД). Как правило, производственные
лаборатории являются аккредитованными и имеют программу обеспечения контроля
качества проводимых испытаний. Строго оговариваются определяемые показатели,
методика отбора, консервации, хранения, исследования проб, обработка и выдача
результатов. Обязателен внутренний контроль качества исследований. Также
возможны межлабораторные сверки.
На предприятии «Ижводоканал»
гидробиологический анализ был введен в обязательный производственный контроль в
1998 году. В более полном объеме начал проводиться начиная с 2002 года, когда
специально для этого анализа был приобретен микроскоп фирмы Zeiss и
специалисты прошли курсы повышения квалификации в МГУ и ЗАО «РОСА». Интерес к
гидробиологическим исследованиям со стороны технологов «Ижводоканала» и
Роспотребнадзора по УР был отмечен осенью 2003 года, когда в Ижевском пруду
была зарегистрирована первая вспышка развития сине-зеленых водорослей, и
появился сильный запах в водосетях города, характеризуемый населением как
«запах дуста». Исследования в ЗАО «РОСА» г. Москвы показали наличие в воде
геосмина, вещества, выделяемого некоторыми видами сине-зеленых водорослей. Это
заставило специалистов водоканала расширить анализ фитопланктона, увеличив
количество показателей и количество проб чистой и исходной воды до 5 раз в неделю.
В настоящее время
гидробиологический контроль качества
воды включает в себя определение качественного и количественного состава
фитопланктона, определение биомассы фитопланктона и расчет различных
коэффициентов и индексов. Материальное обеспечение анализа: световые микроскопы
Axiolab «Zeiss» и CX41 «Olympus» с системой
фоторегистрации, фильтровальная установка ПВФ–35, программное обеспечение,
специально разработанное для этого анализа специалистами водоканала, а также
набор определителей и атласов, включающий литературу на русском, немецком,
английском, польском и украинском языках.
Отбор проб из
Ижевского пруда (одного из источников водоснабжения г. Ижевска) на сегодняшний
момент производится в вегетационный период 2 раза в неделю. Параллельно
исследуется чистая вода и вода, проходящая по этапам очистки (фильтры,
отстойники, резервуары чистой воды (РЧВ)). Помимо альгологического анализа в
лаборатории проводится анализ этих же проб воды на микробиологические и
физико-химические показатели. Доставка пробы в лабораторию производится в
сумке-холодильнике в течение двух часов с момента отбора.
Результаты
анализа фитопланктона в исходной воде в вегетационный период напрямую влияют на
технологию очистки воды, поэтому необходимы в самое короткое время. Этот фактор
влияет на выбор методики анализа. Из возможных вариантов подготовки пробы,
микроскопирования и просчета, которые были предложены разными авторами и нами
опробованы, более приемлемым и удобным, на наш взгляд, является метод,
предложенный в «Руководстве по методам гидробиологического анализа
поверхностных вод и донных отложений» под
редакцией В.А. Абакумова.
В
производственном анализе важность различных анализируемых показателей несколько
иная, чем в научных исследованиях. Основной интерес представляют изменение
численности фитопланктона (особенно
доминантов и субдоминантов) во времени, так как определенный уровень численности
водорослей определяет вид и количество используемых реагентов и выбор
технологических режимов очистки. Также с точки зрения очистки необходима
информация о численности сине-зеленых водорослей независимо от того, доминирует
этот вид или нет. Связано это с тем, что опасность прохождения этих водорослей
в чистую воду или размножение их на каком-либо этапе очистки существует всегда.
Менее важен анализ процентного
соотношения численности водорослей по отделам в пробе и соотношение численности
и биомассы для каждого отдела. Что касается биомассы и видового состава
фитопланктона, то это наименее информативные показатели для производства. Хотя
видовой состав фитопланктона в полной мере в точке водозабора изучается за счет
того, что проба берется несколько раз в неделю с одного и того же места и
уровня водоема в течение нескольких лет, а расчет биомассы определяется
счетно-объемным методом автоматически в каждой пробе с помощью разработанного
на предприятии программного обеспечения.
Главная
проблема гидробиологов-производственников – отсутствие общепринятого нормативного
документа, описывающего проведение анализа фитопланктона с учетом
производственных нужд. Те документы, которые используются в работе альгологов, не учитывают специфику
производственных лабораторий водоканалов. Поэтому некоторые лаборатории вынуждены разрабатывать собственные внутренние документы (методики)
на проведение гидробиологического анализа.
Особые вопросы вызывает анализ чистой воды. Обработка воды
коагулянтом часто не позволяет профильтровать достаточно большой объем для
точного определения присутствующих видов в данной пробе. Но и необходимости с
точки зрения производства в этом нет. Особенности просмотра чистой воды:
равномерное распределение клеток на полосах счетной камеры, неподвижность водорослей,
изменение их морфологических особенностей под воздействием реагентов. Опыт
показывает, что достаточно сконцентрировать 1 л чистой воды и подсчитать число клеток на 10
полосах летом и всю камеру Nageotte объемом 0,05 см3
зимой. В таком случае результаты анализа фитопланктона хорошо коррелируют с
результатами физико-химических и микробиологических анализов в этих пробах и
косвенно подтверждаются ими. Поскольку подвижные формы в очищенной воде отсутствуют
- нет необходимости использовать фиксаторы, к тому же их применение еще сильнее
затрудняет определение видов. При фильтровании 50 л чистой воды видовой
состав почти полностью совпадает с видовым составом исходной воды. При
фильтровании же 1-2 литров
и полном просмотре 3-х камер Nageotte видовой состав чистой воды
включает в себя только наиболее часто встречающиеся виды.
Часто возникают проблемы с приобретением и
практическим использованием различных определителей, к тому же в некоторых из
них определение вида основывается на морфологии клеток, изученной методом
электронной микроскопии. В производственных лабораториях, как правило, имеются
только световые микроскопы, и подготовка пробы для анализа не подразумевает
специальную обработку для выявления плохо видимых морфологических особенностей.
К тому же виды постоянно подвергаются уточнениям, изменяются названия, поэтому
требуется много времени на внесение изменений в базу данных. При использовании
определителей разных авторов возникают несоответствия в результатах
исследований при сравнении их по годам и при межлабораторных сравнениях. Между
тем важность точного определения водорослей до вида остается актуальной,
поскольку именно на этом основывается определение видового разнообразия и
видового богатства, некоторых индексов.
В 2004-2007
гг. гидробиологами и технологами «Ижводоканала» велась работа над созданием
теоретической базы по оптимальной борьбе с сине-зелеными водорослями.
Выявлялись «слабые места» станций подготовки воды (СПВ), т.е. конкретные
фильтры, отстойники или резервуары чистой воды, работающие неэффективно.
Последовательно исследовалась вода по этапам очистки с учетом времени
прохождения по ним. Эта проведенная работа позволяет сейчас при минимальном
количестве контрольных анализов получить максимально возможную и наименее затратную
очистку исходной воды от водорослей, даже при возросшей в несколько раз
численности фитопланктона за последние 2 года.
В настоящее
время процент очистки воды на станциях водоподготовки г. Ижевска в среднем
остается примерно одинаковым и находится в пределах 97-99%. Также за последние
несколько лет опытным путем определены некоторые ориентировочные диапазоны
численности водорослей в чистой воде, характеризующие качество воды на выходе в
город.
С
2003 года гидробиологические исследования в водоканале включают в себя
различные эксперименты с участием представителей Московских НИИ и специалистов
из других регионов России. Ведется поиск эффективных способов очистки воды от
сине-зеленых водорослей, включая методы флотации, обработки ультрафиолетовым
излучением, а также такие нетрадиционные методы, как воздействие на водоросли
инфракрасного излучения и структурированной воды.
Сейчас в лаборатории водоканала проводится работа по разработке
внутреннего методического документа, позволяющего при сохранении качества
уменьшить затраты времени на гидробиологический анализ. Особенное внимание при
этом уделяется поиску наиболее оптимального соотношения объемов
профильтрованной воды, получаемого концентрата, объема используемой камеры Nageotte
с количеством просматриваемых полос камеры и числом подсчитываемых клеток в
пробе. Исследуется влияние фиксаторов на численность водорослей в пробе. Разрабатывается система внутреннего контроля
качества гидробиологического анализа.
О ВОЗМОЖНОСТИ
ИСПОЛЬЗОВАНИЯ ПОЧВЕННЫХ ВОДОРОСЛЕЙ
ПРИ СОЗДАНИИ
ИСКУССТВЕННЫХ ЭКОСИСТЕМ И БИОСФЕР
НА ДРУГИХ ПЛАНЕТАХ
Кабиров Р.Р.
About possible using
algae for creation of artificial ecosystems and biospheres on the other planets
Kabirov R.R.
Башкирский
государственный педагогический университет им. М. Акмуллы
г. Уфа ул.
Октябрьской революции 3а, тел. (3472) 273-02-90
е-mail kkabirov@yandex.ru
Человечество начинает активно осваивать
космическое пространство. В перспективе стоит задача создания искусственных
экосистем и биосфер на других планетах. При этом первопоселенцами на
безжизненных субстратах вероятнее всего будет сообщество, включающее бактерии,
микроскопические грибы (гетеротрофный блок) и микроскопические водоросли
(автотрофный блок). Возможно, что сейчас это кажется очень отдаленной перспективой,
однако, к этому надо уже готовиться заранее.
В настоящее время при моделировании и
конструировании различных искусственных экосистем, из водорослей традиционно
используются одноклеточные и колониальные зеленые водоросли из родов (Chlorella, Ankistrodesmus,Scenedesmus и др.) обитающие, как правило, в водных
экосистемах и характеризующиеся слабой устойчивостью ко многим экологическим
факторам. Вне сферы внимания остаются почвенные водоросли, развивающиеся под
жестким экологическим прессом (резкие перепады температуры и влажности, очень
низкие и очень высокие значения рН среды, высокая степень засоления и
загрязнения почвы). Почвенные водоросли являются перспективной группой для
создания искусственных экосистем, способных существовать в очень
неблагоприятных экологических условиях, в том числе и на других планетах.
О возможности использования почвенных
водорослей при освоении других планет в свое время писали Э.А. Штина и М.М. Голлербах (1976 с. 4) «…
почвенные водоросли … перспективные объекты для заселения пространств, включая
внеземные, непригодные для жизни высших растений.
Есть многочисленные данные о высокой
устойчивости почвенных водорослей к неблагоприятным экологическим факторам.
Так, водоросли собранные в пустынях после высушивания в вакууме и пятилетнего
хранения в этих условиях сохраняли свою жизнеспособность (Cameron et al., 1970 цит. по Штина, Голлербах, 1976).
Почвенные водоросли устойчивы и к экстремальным температурам. Специальными
исследованиями было показано, что многие виды выдерживают нагревание до 100-1150
и замораживание при – 79 и – 1950 (Cameron, Blank, 1966). Основываясь на полученных результатах,
авторы делают вывод, что почвенные водоросли могут адаптироваться к условиям
Марса и при наличии капельножидкой воды способны расти в этих условиях.
Можно выделить несколько аспектов
использования почвенных водорослей для заселения других планет. Во-первых,
создание банка видов характеризующихся высокой устойчивостью к экологическим
факторам. В первую очередь эти виды будут наиболее перспективными для решения поставленной
задачи. Поиск таких видов, по-видимому, следует проводить в экологически
«жестких» местообитаниях: песчаных, глинистых и техногенных пустынях, сильно
засоленных почвах, очень кислых и щелочных почвах, почвах загрязненных тяжелыми
металлами, нефтью и нефтепродуктами, на промышленных отвалах и т.д. Выделение
из природного материала водорослей и перевод их в музейную культуру для
дальнейшего изучения. Проведение лабораторных экспериментов по оценке границ
устойчивости выделенных видов к факторам среды. Известно, что разные виды
обладают неодинаковой устойчивостью к различным экологическим факторам. Одни
виды более устойчивы к одним факторам, другие – к другим. Желательно подбирать
виды, которые обладают высокой потенциальной экологической устойчивостью к
целому комплексу факторов среды.
Во-вторых, в природных условиях почвенные
водоросли существуют в ассоциации с другими микроорганизмами, прежде всего
бактериями и микроскопическими грибами. В этом альгомикобактериальном ценозе
(АМБЦ) водоросли являются источником органического вещества для гетеротрофной
части ценоза, а их слизистые чехлы своеобразным резервуаром, который позволяет
запасать и удерживать воду. В свою очередь, бактерии и микроскопические грибы с
одной стороны снабжают водоросли физиологически активными веществами (Саут,
Уиттик, 1990), с другой – разлагают органику в конечном итоге до минеральных
соединений, создавая предпосылки для фотоавтотрофного питания водорослей. Следовательно,
при интродукции на других планетах будут использоваться не водоросли в чистом
виде (свободные от сопутствующих организмов), а ценозы. Способность водорослей
образовывать ассоциации с различными микроорганизмами открывает широкий простор
«конструирования» ценозов с запланированным составом и направленным на
выполнение определенных задач. Для каждой планеты, или различных участков
поверхности одной планеты можно будет сконструировать АМБЦ, способный
эффективно расти в конкретных экологических ситуациях формируя «биологически
активные точки», которые создадут предпосылки для последующих этапов сукцессии.
В-третьих, почвенные водоросли могут
входить в качестве одного их компонентов при организации более сложных
искусственных экосистем на других планетах. Например, нами созданы искусственные
микроэкосистемы, представляющие собой небольшие 3-5 см глобулы сапропеля, обогащенного
полимерами и биологически активными веществами с включенными в них азотфиксирующими
цианобактериями и семенами травянистых растений (Кабиров, 1995). Они предназначены
для рекультивации промышленных отвалов и
других техногенно нарушенных территорий. По такой же схеме можно конструировать
микроэкосистемы для космических целей.
Список литературы
Кабиров Р.Р.
Проблемы и перспективы создания искусственных микроэкосистем для использования
их при рекультивации нарушенных
территорий // Проблемы охраны окружающей среды на Урале : Межвуз. сб. науч. тр.
/ Башкирский пединститут. Уфа, 1995. С.
133-143.
Саут Р., Уиттик А. Основы альгологии. – М.: Мир, 1990.
597 с.
Штина Э.А., Голлербах М.М. Экология
почвенных водорослей. – М.: Наука, 1976. – 143 с.
Cameron
R.F., Blank G.B. Soil studies – desert microflora. XI. Desert soil algae
survival at extremely low temperatures // Space Programs Summary. 1966. V. 4. N 37.
ИЗМЕНЕНИЕ СТРУКТУРЫ ПЛАНКТОННОГО АЛЬГОЦЕНОЗА ПРИ ВНЕСЕНИИИ В СРЕДУ
ЗЕЛЁНЫХ МИКРОВОДОРОСЛЕЙ р. CHLORELLA
Кравцова Г.В.,
Калинина С.Г.
Changes of planktonic algal coenosis structure during inclusion of green
algae from genus Chlorella
Kravsova G.V., Kalinina S.G.
Волгоградское отделение ФГНУ ГосНИОРХ
400001 г. Волгоград, ул. Пугачёвская, 1. Тел/факс
(8442) 97-82-71
Исследовалось влияние штамма Chlorella vulgaris BIN на структуру планктонного
альгоценоза Цимлянского водохранилища в августе 2007 г., в разгар «цветения»
водоёма синезелёными водорослями. Опыт продолжительностью в 9 суток был
поставлен в 7 садках из водонепроницаемой ткани, с полезным объёмом 1,2 м3, установленных в заливе Чаусы на глубине 4 м. На момент закладки опыта
прогрев воды поверхностного слоя достигал 29,0°С, рН - 8,57, содержание растворенного в воде
кислорода составляло 3,0 мг/л, что соответствовало 40% насыщения. Концентрации
биогенных элементов были достаточно высокими, с преобладанием аммонийной формы
азота (NH4 + - 2.1, NO3- - 0.2, PO4 3- - 0.3 мг/л), что благоприятствовало развитию синезеленых.
Опытный – исходный альгоценоз планктона включал 39
видов и характеризовался высокой биомассой водорослей (35,4 мг/л), основу
которой (94%) составляли синезеленые (33,2 мг/л). Среди последних доминировал Microcystis aeruginosa
(22,9 мг/л), с весьма высоким удельным весом в сообществе (около 65% общей
биомассы), определяя четко выраженную монодоминантность его структуры (рис.). В
целом комплекс традиционных возбудителей «цветения» воды синезеленых из рр. Microcystis, Anabaena, Aphanizomenon насчитывал 6
видов, формировавших в общей сложности биомассу в 26,1 мг/л – около 74% от
общей.
Довольно значительную часть сообщества представляли
водоросли осцилляторного комплекса с биомассой 6,0 мг/л – 17% общей. Среди
видов указанной группы наиболее значимыми были: Oscillatoria amoena (1,6 мг/л),
Oscillatoria amphibia (1,5
мг/л), Oscillatoria agardhii (Plantothrix agardhii) (1,1
мг/л) и др. Доля диатомовых и зеленых водорослей в структуре альгоценоза не
превышала 4 и 2% общей биомассы. Среди первых выделялась Aulacoseira granulata
(0,6 мг/л – 1,6%), среди вторых – Actinastrum hantzschii
(0,2 мг/л – 0,4%).
После внесения в садки суспензии хлореллы ее начальная
численность в вариантах опыта изменялась от 3,6 до 60,1 млн. кл/л (в среднем
23,5) при соответствующей биомассе 0,2 – 3,9 мг/л (в среднем 1,5). Таким
образом, испытывались концентрации водоросли, сопоставимые с реально-возможными
для водоемов.
Анализ состояния альгоценоза в течение периода
наблюдений показал, что уже в первый день после внесения хлореллы, количество
синезеленых возбудителей «цветения» воды, и прежде всего, Microcystis aeruginosa,
во всех опытных вариантах снизилось до 0,6 – 12,4, в среднем до 3,8 мг/л, то
есть в 6,8 раза, что, очевидно, явилось причиной одновременного снижения
кислорода в опытных садках до минимальных величин: 0,32-1,76 мг/л или 4-23 %
насыщения. И лишь в контроле, где альгоценоз оставался в исходном состоянии,
концентрация кислорода практически не изменилась (2,56 мг/л – 34 % насыщения).
В дальнейшем, с ростом концентрации хлореллы (в
среднем до 7,4 мг/л), уровень кислорода в садках повысился на третий день наблюдения
до максимума: 3,52 – 6,72 мг/л, вызвав соответствующее увеличение в водной
толще количеств синезеленых водорослей, главным образом, p. Microcystis (до 1-19, в среднем – до 8 мг/л). В свою очередь,
повышение числа последних, очевидно, отрицательно повлияло на состояние
хлореллы, концентрация которой к седьмому дню снизилась (до 5 мг/л) и
продолжала уменьшаться в вариантах с наибольшим количеством возбудителей
«цветения».
Таким образом, в процессе опыта наблюдалась
определенная флюктуация на более низком уровне количеств синезеленых
возбудителей «цветения», положительно коррелировавших с содержанием в воде
кислорода (r = 0,91, 0,02>Р>0,01), что можно представить
следующей схемой: добавление хлореллы → резкое снижение концентрации синезеленых
и кислорода → рост численности хлореллы → увеличение кислорода и
повышение в толще воды количеств синезеленых → торможение роста хлореллы.
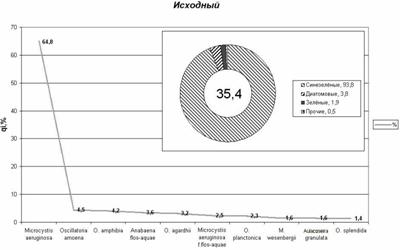
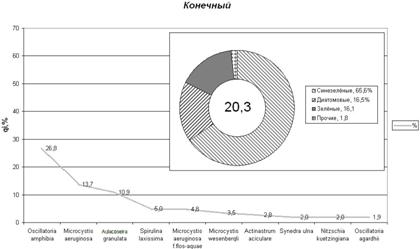
Рисунок. Структура исходного и конечного альгоценозов
планктона в опыте.
Примечание: qi – удельное
обилие вида в сообществе по биомассе,
в центре диаграммы – общая биомасса водорослей в
альгоценозе.
Очевидная связь между содержанием в воде садков
кислорода, уровнем развития синезеленых и их воздействием на штамм хлореллы
позволила объединить опытные варианты в 2 группы: I - с более низкой исходной концентрацией хлореллы и
содержанием кислорода в процессе опыта (в среднем за период наблюдений 1,74
мг/л, то есть 20 % насыщения), и II – с более
высокой исходной концентрацией хлореллы и содержанием кислорода (3,38 мг/л –
около 40 % насыщения). Анализ соответствующих данных свидетельствует о том, что
в интервале опытных значений кислорода (для групп: 0,43 – 6,19 мг/л) при более
низком его содержании (в среднем 20% насыщения) концентрация синезеленых
возбудителей «цветения» уменьшается быстрее, а количество хлореллы оказывается
выше, чем при более высоком уровне кислородного насыщения среды (около 40%),
несмотря на повышенную в целом концентрацию ее внесения. Фактором, регулирующим
количество хлореллы в опытных садках, является также её потребление зоопланктоном,
активность которого в условиях более высокого содержания кислорода обычно выше.
В целом, результаты изменения структуры исходного
альгоценоза после добавления в садки штамма хлореллы на конечный день
наблюдений свидетельствуют о том, что во всех опытных вариантах произошло
уменьшение количества синезеленых возбудителей «цветения» воды относительно
исходного в среднем в 5 раз (26,1 против 5,2 мг/л; достоверно при Р<0,001),
а их удельный вес снизился в среднем до 25 % против 74 % в общей биомассе
водорослей сообщества. Остаточные количества видов р. Microcystis
составили в среднем 20 % от их исходных концентраций, р. Anabaena –
14 %, Aphanizomenon flos-aquae – при чрезвычайно низком исходном значении вида в
структуре ценоза – выпал полностью.
Среди видов р. Microcystis наибольшей устойчивостью к воздействию штамма проявил
себя M. wesenbergii,
колонии которого отличаются более толстым защитным слоем окружающей слизи, а
также более мелкоклеточные виды этого рода: M. Grevillei, M. aeruginosa f. flos-aquae. В процессе
микроскопирования проб в поле зрения регулярно отмечались достаточно крупные
остатки колониальной слизи M. aeruginosa и
вышеуказанных форм, без клеток водорослей, окруженные миксотрофными бесцветными
жгутиконосцами и простейшими. Визуально в пробах воды они могут выглядеть как
детритные пленки, «хлопья», имитирующие присутствие «живых» колоний.
Общая биомасса синезеленых за время опыта снизилась в
2,5 раза (достоверно при Р<0,001), а их удельный вес в структуре альгоценоза
уменьшился с 94 до 66%. При этом значительно возросло абсолютное и относительное
количество зеленых, без учета внесенного штамма (в 5 и 8 раз, соответственно,
0,1>Р>0,05), диатомовых (в 2 и 4 раза, 0,1-0,2>Р>0,05-0,1) и прочих
водорослей. В результате структура альгоценоза приобрела большую выровненность,
полидоминантность и, несмотря на практически одинаковое с исходным число видов
(39 и 41) – более высокое общее разнообразие. Доминантом в альгоценозе становится
Oscillatoria amphibia.
Обобщая все вышеизложенное, можно констатировать, что
в целом результаты эксперимента в изолированной среде, выполненного в «жестких»
условиях интенсивного «цветения» водоема синезелеными водорослями, выявили
резкое уменьшение количества возбудителей этого процесса из рр. Microcystis,
Anabaena
и Aphanizomenon при внесении в садки штамма хлореллы во всем
диапазоне испытанных концентраций. Наибольший эффект отмеченного снижения и максимальный
рост хлореллы проявился в вариантах с невысоким исходным количеством
интродуцента (3,6-17,3 млн. кл/л) и связанным с этим более низким содержанием
кислорода, на уровне 20% насыщения среды, когда указанные виды синезеленых
наименее жизнеспособны, а активность потребителей хлореллы снижена.
Поведение возбудителей «цветения» при внесении в садки
штамма хлореллы не может быть связано с закономерной природной сменой видов,
поскольку в этот период на остальной акватории залива интенсивность развития
видов р. Anabaena продолжала оставаться
достаточно высокой (около 5 мг/л) и заметной – для Aphanizomenon flos-aquae (0,4 мг/л). Интенсивное развитие видов р. Microcystis
продолжалось в водохранилище еще до конца сентября. Трофическое обеспечение
водорослей на конец эксперимента также оставалось достаточно высоким,
сопоставимым с начальным.
Полученные материалы подтверждают вероятность
ингибирования видов синезеленых – традиционных возбудителей «цветения» воды
штаммом Chlorella vulgaris BIN, даже при низких концентрациях
водоросли. Аналогичный вывод был сделан и по результатам подобного эксперимента
со штаммом Chlorella vulgaris ИФР
№ С-111 и планктонным альгоценозом залива Осадного Волгоградского водохранилища
в августе 2006г., находящимся в стадии «слабого» «цветения» воды. Общая
биомасса синезеленых в опыте 2006г. была существенно ниже, чем в 2007г. (1,8 против
33,2 мг/л), как и концентрация возбудителей «цветения» воды (1,5 против 26,1
мг/л). Доминировала в сообществе Anabaena flos-aquae с биомассой 1,2 мг/л, что соответствовало 34 % от
общей. Выпадение из планктона указанного вида и сопровождающего его Microcystis aeruginosa
произошло быстро и полностью в течение недели. В эксперименте 2007 года на
Цимлянском водохранилище остаточные количества доминировавшего в сообществе Microcystis aeruginosa
продолжали регистрироваться в течение всего периода наблюдений и составляли на
конец опыта значительную часть популяции: около 20%.
Материалы опытов позволяют уточнить и некоторые
экологические особенности других видов фитопланктона, проявляющиеся в природных
условиях. В частности, подтверждается высокая конкурентоспособность Oscillatoria amphibia в
среде с низким содержанием кислорода, что наблюдалось и в опыте 2006 года, в то
время как О. agardhii
лучше развивается при достаточно высоком его уровне. Подтверждается и
оксифильность Aulacoseira granulata, занимающей
руководящие позиции в среде с более высоким содержанием кислорода.
В целом, результаты исследований свидетельствуют о
необходимости продолжения работ в направлении, открывающем возможности
использования биологических методов регулирования интенсивности «цветения» воды
синезелеными водорослями, что является одной из приоритетных современных задач
по улучшению качества воды водоемов.
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ
НАТИВНЫХ КОМПЛЕКСОВ ФОТОСИСТЕМ
У МУТАНТОВ ЗЕЛЕНОЙ ВОДОРОСЛИ CHLAMYDOMONAS REINHARDTII
Ладыгин В. Г.
Structural-functional organization
of photosystems chloroplast native complexes in the mutants
of green alga Chlamydomonas
reinhardtii
Ladygin V. G.
Институт фундаментальных проблем биологии РАН
142290 Московская область, г. Пущино, ул. Институтская, д. 2, тел. 8
(4967) 73-28-64
e-mail: ladyginv@rambler.ru
С помощью мутагенов (N-нитрозоэтилмочевины, УФ-С-излучения и гамма-радиации)
были получены одинарные, двойные и тройные мутанты с нарушением синтеза одного,
двух или трех пигмент-белковых комплексов фотосистем. Установлены спектральные
формы хлорофилла и полосы излучения флуоресценции, характерные для каждого из
4-х нативных хлорофилл-белковых комплексов: реакционных центров ФС-1, ФС-2 и
связанных с ними светособирающих комплексов 1 и 2 (ССК 1 и ССк 2)
соответственно. Показано, что до 60-70 % молекул хлорофилла входит в состав
светособирающих комплексов и лишь 25-30 % молекул хлорофилла a составляют антенну реакционных центров ФС-1 и ФС-2.
Изучены фотохимические свойства и проведена количественная оценка величины
фотосинтетической единицы и числа реакционных центров ФС-1 и ФС-2. Обнаружено,
что потеря светособирающих хлорофилл-белковых комплексов 1 и 2 не приводит к
уменьшению числа реакционных центров ФС-1 и ФС-2 в расчете на хлоропласт.
Установлено, что каждый из 4-х хлорофилл-белковых комплексов может автономно
принимать участие в образовании мембранной системы хлоропластов. Если мембраны
тилакоидов формировались за счет двух или только одного из хлорофилл-белковых
комплексов, например, ФС-2, то стехиометрическая плотность этих белковых частиц
на 1 кв. мм внутренней (EF) гидрофобной
поверхности скола увеличивалась соответственно в 2 или 4 раза. Нами предложена
принципиальная схема организации фотосистем хлоропластов зеленых водорослей и высших
растений. Она основана на том, что хлорофилл а-белковый комплекс реакционного центра ФС-2 вместе со
светособирающим хлорофилл a/b-белковым
комплексом 2 (ССК-2) входит в состав 160 Å частиц, локализованных на
внутренней (EF) гидрофобной поверхности скола
мембран тилакоидов в области гран, а хлорофилл а-белковый комплекс реакционного центраФС-1 – вместе со
светособирающим хлорофилл а (или a/b)-белковым комплексом 1 (CCК 1) входит в состав 140 Å частиц,
локализованных на внешней (PF) гидрофобной
поверхности скола мембран межгранных участков тилакоидов.
Использование
современных методов математической
обработки
данных в альгологических исследованиях
(на
примере анализа альгогруппировок еловых лесов)
А.Б. Новаковкий,
И.В. Новаковская
THE MODERN
MATHEMATICAL METHODS FOR ALGOLOGICAL DATA ANALYSIS (BY THE EXAMPLE OF SPRUCE FOREST
SOIL ALGA COMMUNITIES)
A.B. Novakovsky, I.V. Novakovskaya
Институт Биологии Коми НЦ УрО РАН
167982, Сыктывкар,
ул. Коммунистическая, 28
е-mail: novakovsky@ib.komisc.ru, novakovskaya@ib.komisc.ru
В современной альгологии, как и во многих других
науках, одним из актуальных вопросов является анализ накопленного обширного
фактографического материала. Использование разработанных в настоящее время
вычислительных средств позволяет существенно ускорить и облегчить обработку
больших массивов данных, визуализировать полученные закономерности, проводить
анализ результатов на статистическую достоверность. Все это в совокупности дает
возможность получать более объективные результаты.
Существует множество программных средств,
разработанных для автоматической обработки ботанических данных. Однако
специалисты зачастую слабо информированы о них. Трудности вызывает как
понимание используемых алгоритмов, так и интерпретация полученных результатов.
Поэтому эти программы используются достаточно редко.
Цель работы – познакомить специалистов альгологов с
существующими математическими подходами для анализа данных, их возможностями и
недостатками на примере анализа альгогруппировок еловых лесов подзон средней и
южной тайги.
В качестве объекта исследования были взяты почвенные
водоросли фоновых и подверженных аэротехногенному загрязнению еловых лесов в подзонах средней и южной тайги Республики
Коми (влияние эмиссий целлюлозно-бумажного комбината и объездной автомобильной
дороги) и Кировской обл. (выбросы г. Киров и Слободской, Кирово-Чепецкого
химического комбината, объекта хранения и уничтожения химического оружия
«Марадыковский», бумажной фабрики). В течение трех полевых сезонов на стационарных
пробных площадках в разные периоды вегетационного сезона с июня по октябрь 2003
– 2005 гг. были проведены
почвенно-альгологические сборы. Изучено
104 смешанные пробы с 17 ключевых участков в разных еловых ассоциациях. Отбор проб проводили общепринятыми в
почвенной альгологии методами (Голлербах, Штина, 1969 и др.). Для выявления видового
состава использовали культуральные методы, включающие чашечные, водные и
агаровые культуры. Всего в почвах исследованных еловых лесов обнаружено 112
видов водорослей (121 разновидность, включая номенклатурный тип вида) из шести
отделов: Cyanophyta – 7, Euglenophyta – 4, Eustigmatophyta – 3, Xanthophyta – 8
(11), Bacillariophyta – 25 (27), Chlorophyta – 65 (69). В ельниках, не
испытывающих антропогенное воздействие, обнаружено 93 (98) вида: Cyanophyta – 4, Euglenophyta – 4, Eustigmatophyta – 2, Xanthophyta – 5, Bacillariophyta – 22 (24), Chlorophyta
– 56 (59). В почвах ельников, расположенных в зонах с высокой степенью
аэротехногенного загрязнения, обнаружен 71 (79) вид водорослей: Cyanophyta – 4, Euglenophyta – 1, Eustigmatophyta – 2, Xanthophyta – 7
(10), Bacillariophyta – 6 (7), Chlorophyta – 51
(55).
Для обработки альгологических данных использовались 2
основных подхода – ординация данных и их кластеризация.
Принцип ординации
заключается в представлении рассматриваемых объектов в виде точек многомерного
пространства, где свойства выступают как их координаты. Использование данного
принципа позволяет проецировать эти точки на пространство с уменьшенной
размерностью (до 2-х или 3-х мерного) и имеет своей целью графически показать
взаимное расположение исследуемых объектов. Одним из основных условий при таком
проецировании является сохранение расстояний между объектами (Legendre, Legendre
L., 1998; Пузаченко, 2004). Выделяют методы прямой и
непрямой ординации.
Проведенная непрямая ординация альгологических проб
показала, что ключевые участки хорошо разделяются по своему видовому составу на
три непересекающиеся группы по местам сбора и степени антропогенной нагрузки:
фоновые, территорию Кирово-Чепецкой агломерации и окрестности г. Сыктывкара.
Наложение дополнительных факторов (содержание тяжелых
металлов и нефтепродуктов в почве) позволило выявить, что отрицательная
максимальная корреляция, наблюдается между видовым разнообразием почвенных водорослей
и содержанием тяжелых металлов Cd, Co, Ni в верхних
горизонтах почв.
Существенным недостатком непрямых методов ординации
являются сложности с интерпретацией полученных осей. Кроме того, методы
ординации не позволяют четко разделять группы рассматриваемых объектов между
собой. Все это не позволяет опираться только на эти методы при анализе данных.
Другим методом, изначально разработанным для решения
задач разбиения всей совокупности рассматриваемых объектов на отдельные группы
(классы) со сходными характеристиками и определения взаимных отношений между
ними является кластеризация. Таких
методов разработано довольно много (Василевич,
1969; Песенко, 1982; Шитиков и др., 2003 и др.).
С помощью кластерного анализа было выявлено что, для
альгогруппировок всех обследованных сообществ фоновых и аэротехногенно
загрязненных участков наблюдается относительно невысокое сходство
систематического состава, коэффициент Съеренсена-Чекановского составил около 40
%. По рассчитанному коэффициенту обособляются следующие группы кластеров:
группировки почвенных водорослей фоновых участков и испытывающих аэротехногенное
загрязнение.
Таким образом, полученные с помощью кластерного
анализа результаты подтвердили разбиение на группы, ранее выделенные методами
ординации. Существенным недостатком
кластерного анализа является невозможность наложения экологических факторов,
оказывающих влияние на альгогруппировки.
Кроме того, проведенный статистический анализ позволил определить степень корреляции между числом
видов водорослей и средним содержанием ряда биогенных и микроэлементов в почвах
ключевых участков, а также обнаружить статистически значимую отрицательную
связь между числом видов и содержанием в почве Cd и Ni.
Таким образом, использование всех этих методов в
совокупности позволило дополнить результаты и получить более объективные
выводы.
Результаты ординации, кластерного и статистического
анализов показали, что в условиях изменения физико-химических параметров почв и
накопления тяжелых металлов и нефтепродуктов, в структуре альгогруппировок еловых
лесов отмечаются изменения, свидетельствующие о трансформации экосистем
исследованных нами ельников в зонах антропогенного влияния. В первую очередь,
это связано с уменьшением видового разнообразия водорослей и изменением
таксономической структуры альгогруппировок.
Список литературы
Василевич В.И. Статистические методы в геоботанике. Л.:
Наука, 1969. 232 с.
Голлербах М.М., Штина Э.А. Почвенные водоросли. Л.:
Наука, 1969. 228 с.
Песенко Ю.А. Принципы и методы количественного анализа
в фаунистических исследованиях. М.: Наука, 1982. 287 с.
Пузаченко Ю.Г. Математические методы в экологических и
географических исследованиях. М., 2004. 416 с.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д.
Количественная гидроэкология: методы системной идентификации. Тольятти, 2003. 463 с.
Legendre L., Legendre P. Numerical ecology. Amsterdam: Elsevier Science BV,
1983. 419
p.
МОРФОЛОГИЧЕСКИЕ СТРУКТУРЫ ОСЦИЛЛАТОРИЕВЫХ ВОДОРОСЛЕЙ CYANOPHYTA (CYANOPROkARYOTA).
ПОЛЕВЫЕ И ЛАБОРАТОРНЫЕ НАБЛЮДЕНИЯ
Орлеанский В.К.1,
Колотилова Н.Н.2, Жегалло Е.А.3, Тембрел Е.И.4,
Карпов Г.А.4,
Брянская А.В. 5
Morphological structures of Oscillatoriales algae Cyanophyta (Cyanoprokaryota, Cyanobacteria).
Natural and laboratory observations
Orleansky V.K.1, Kolotilova
N.N.2, Zhegallo E.A.3, Tembrel E.I.4, Karpov G.A.4,
Bryanskaya A.V.5
1Институт микробиологии РАН
Москва 117312, пр-т 60 лет Октября, 7, тел. (499) 135-04-41
е-mail orleanor@mail.ru
2МГУ им. Ломоносова, Москва
3Палеонтологический
институт РАН, Москва
4Институт вулканологии и сейсмологии ДВО РАН,
Петропавловск-Камчатский
5Институт цитологии и генетики СО РАН, Новосибирск
Полевые наблюдения и лабораторные эксперименты показали,
что представители пор. Оscillatoriales
могут формировать различные морфологические структуры. В процессе выполнения
работы, авторами основное внимание было
уделено только бентосным формам.
Биопленки. Это наиболее типичное образование при росте этого
типа водорослей. Как в природе, так и в лаборатории эти синезеленые водоросли
(цианобактерии) разрастаются по
поверхности субстрата (Рис.1). В природных условиях это можно наблюдать в
летнее время, когда после дождя зеленеет поверхность мелководных луж. В лабораторных
условиях отмечается, что активно растущие
водоросли могут колонизировать поверхность чашки Петри в пределах суток. Через
сутки растущая пленка уже обладает определенной механической устойчивостью
(Рис.2).
Лабораторные наблюдения показали, что бентосным формам
водорослей этого типа нужна опора. Эту
опору они находят также и в пленке поверхностного натяжения воды на переходе фаз вода-газ,
образуя в лабораторных сосудах «верхний рост», то есть как раз под пленкой
этого поверхностного натяжения.
Кроме этого, постоянно отмечается обрастание стенок
сосудов и даже часто выше уровня среды
(Рис.3). Можно предположить, что
такое явление происходит за счет капиллярного подтока питательной среды по
трихомам самих водорослей, растущих по стенкам сосудов.
Кольца Образование колец осциллаториевыми при росте, особенно
на агаровой поверхности, распространенное явление (Рис.4). На термальном
источнике Камчатки авторами обнаружены кольца, сформированные коллоидной серой,
выделяемой источником. Эта периодически ( с определенными промежутками времени)
выделяемая сера налипает на трихомы радиально растущих по поверхности воды
колоний осциллаториевых водорослей и
фиксируется там в виде своеобразных радиальных кругов серы (кольца
Карпова) (Рис.5).
Альго-бактериальные маты. Маты –
структуры, формирующиеся путем нарастания пленок водорослей,
накладывающихся в процессе роста друг на
друга, с образованием слоистости. В
природных водоемах такая слоистость сохраняется в виде слоистого донного осадочного формирования мощностью до 20 и
более см (Рис. 6). Иногда между биопленками имеется минеральный прослой.
Слоистые маты – наиболее древние биологические образования, дошедшие до
нас в осадочной геологической летописи
планеты Земля, в форме слоистых структур, называемых строматолитами (Рис.7), которые датируются возрастом от 3,5 миллиарда
лет. Современные маты образуются в термальных источниках, в солоноватых
водоемах (лагунах) и в щелочных озерах.
Их образование обусловлено периодическим изменением среды, связанным или с
выпадением минерального осадка, или чередованием подсыхания и последующего
обводнения поверхности водорослевого роста, или с изменением температурного
режима среды. Для получения слоистой структуры в лаборатории авторами была использована проточная установка лоткового типа, в которую
среда подавалась насосом с подогревом до 66о С, а по мере потока
среды температура падала до 31о С (моделирование условий термального
источника). В эксперименте удалось
вырастить не только природный биоценоз, но и
получить слоистость, аналогичную
полевым наблюдениям (Рис.8).
Бугрообразные
постройки. Эти постройки связаны с водорослевыми матами
и с выпадением минерального осадка на термальных источниках в виде кремнезема.
Такие постройки конусообразной формы
авторы обнаружили на термальных источниках Камчатки. Размер этих построек 10 – 150 см ширины и высотой до
полуметра (Рис. 9, 10). Формируются они на выходах источников, с повышенным содержанием кремния.
На вертикальных срезах построек четко прослеживается слоистость (Рис. 11).
Шарообразные
структуры. Эти структуры формируются
в условиях гидромеханического перемешивания
водной толщи. В природных условиях такие структуры образуются как
результат разрушения выросших биопленок, куски которых находятся определенное
время в условиях турбулентности, что обуславливает округлую, шарообразную форму
(Рис.12). Размеры их от миллиметровых значений до 10 см и
более. В условиях выпадения
минеральных осадков может формироваться, как и в матах, чередующаяся слоистость. В ископаемом состоянии такие
структуры называются онколитами. Иногда отдельные шары слипаются с образованием
одной оболочки (полионколиты) (Рис. 13, 14).
Плавающие
пленки. Данное явление обусловлено тем, что водоросли - это фотосинтетики, образующие в процессе
своего роста кислород, который выделяется в виде газовых пузырей, как на
поверхности, так под биопленкой. По мере накопления газа, газовые пузырьки с
поверхности отрываются и уходят в воздушную среду, а газ под пленкой
формирует бугорок (Рис. 15). Активное газовое накопление может оторвать выросшую пленку синезеленых
водорослей (цианобактерий) от дна и она начинает плавать по поверхности водоема
(Рис. 16). В речных мелководьях такие плавающие пласты содержат песок, мелкую
гальку и представляют определенную опасность для гидротурбин электростанций.
Шатры. В лабораторных условиях, а также и в природе,
образующийся газ может приподнимать
участок биопленки. Образуется шатрообразная структура с газовым пузырем,
удерживающим такую форму структуры (Рис.17).
Столбики. За счет подъемной силы газовых пузырьков, в природе и в лаборатории, отмечается другая структура, в виде столбиков. Эта
структура образуется тогда, когда от
выросшей биопленки, отрывается одним концом относительно удлиненная полоска биопленки, которая, за счет газового
пузырька, поднимается вертикально и формирует столбообразную структуру (Рис.18)
Тяжи. Как упоминалось выше, для роста бентосным формам осциллаториевых водорослей,
необходима опора. В её отсутствие,
опорой может стать соседний трихом, что приводит к образованию тяжей, жгутов из
трихомов (Рис.19). Интересно отметить, что часто тяжи создаются при продувании
сосудов воздухом. Такие тяжи стойко переносят гидромеханическое воздействие, но трихомы быстро разбегаются по поверхности
сосуда при остановке продувания.
В природе и в лаборатории неоднократно нами
отмечался факт, когда биопленка водорослей лопается (дырявится) с образованием
дырчатой ткани, часть её сжимается и собирается
в виде жгутов, тяжей (Рис. 20).
Ряды. Интересно отметить еще одну особенность, изучаемых
нами организмов. Авторы неоднократно отмечали, что трихомы
могут по поверхности субстрата формировать визуально четко оформленные
параллельные волнообразные ряды. Такое явление наблюдается в природе, в потоке
некоторых термальных источников
(Рис.21). В лаборатории такая структура была неустойчива и быстро, буквально на
глазах, распадалась, если культуральный сосуд был потревожен.
Минеральные
чехлы, футляры. Как в природных, так и в лабораторных условиях авторы
обнаруживали или моделировали
образование минеральных футляров около нитей осциллаториевых водорослей.
На термальных источниках (гейзерах), авторы наблюдали кремневые футляры (Рис. 22), а в лаборатории
получали фосфатные чехлы.
«Ловчие
сети». Многие синезеленые водоросли
(цианобактерии), являясь автотрофными организмами, могут использовать и органические соединения.
Они часто развиваются в евтрофицированных
водоемах, сточных водах, загрязненной нефтью почве. На разливах нефти по почве,
довольно обычное явление роста этих организмов. В лабораторных условиях отмечено, что осциллаториевые могут
создавать своеобразные «ловчие сети», в которых они сжимают, а
затем отфильтровывают планктонную бактериальную взвесь. (Рис. 23,24).
Внесенная нами культура актиномицетов была полностью оплетена трихомами
осциллаториевых. В связи с этим уместно напомнить, что еще много лет назад
советская исследовательница Горюнова С.В. предложила гипотезу, что описанные
явления есть факт хищничества, а
осциллаториевые водоросли – одни из первых хищников на планете Земля.
Работа
выполнена при финансовой поддержке
программы Президиума РАН «Происхождение биосферы и эволюция
геобиологических систем», Интеграционным проектом СО РАН 10, грантом РФФИ
08-04-01798-а
Иллюстрации
Рис. 1. Рост
культуры в чашке Петри.
Рис. 2.
Механическая устойчивость водорослевой пленки.
Рис. 3. Рост культуры в сосуде над уровнем питательной среды.
Рис. 4. Кольцевые
формировании осциллаториевых
Рис. 5. Серные термальные
источники – «кольца Карпова»
Рис. 6. Слоистоосадочное
формирование – «альго-бактериальный мат» ,
лагуны оз. Сиваш (Крым)
Рис. 7. Ископаемый слоистый пластовый строматолит.
Рис. 8. Лабораторная биомодель
слоистого водорослевого мата, аналога мата
термальных
источников. Белое пространство между черточками 1 мм
Рис. 9, 10. Бугрообразные
постройки на термальных источниках (Камчатка)
Рис. 11. Вертикальный срез бугрообразных
построек.
Рис. 12. Шарообразный рост
разрушенной биопленки водорослей, после
шторма.
Рис. 13. Вертикальный срез
ископаемого шарообразного онколита
Рис. 14. Вертикальный срез экспериментального шарообразного онколита
Рис. 15. Газовый пузырь под
растущей пленкой осциллаториевых водорослей
Рис. 16. Плавающая пленка
синезеленых водорослей
Рис. 17. Приподнятая пленка
водорослей, оторванная и удерживаемая газовым пузырем.
Рис. 18. Столбообразный рост
осциллаториевых в лаборатории
Рис. 19. Группирование водорослей в тяжи.
Рис. 20. Дырчатая структура
пленки водорослей с образованием тяжей и круглых
отверстий.
Рис. 21. Волнообразные ряды,
сформированные трихомами водорослей.
Рис. 22. Кремнистые футляры
осциллаториевых на гейзерных источниках.
Рис. 23. Формирование «ловчего
мешка» в лабораторном стакане
Рис. 24. Окончание стадии
закрытия «ловчей сети».

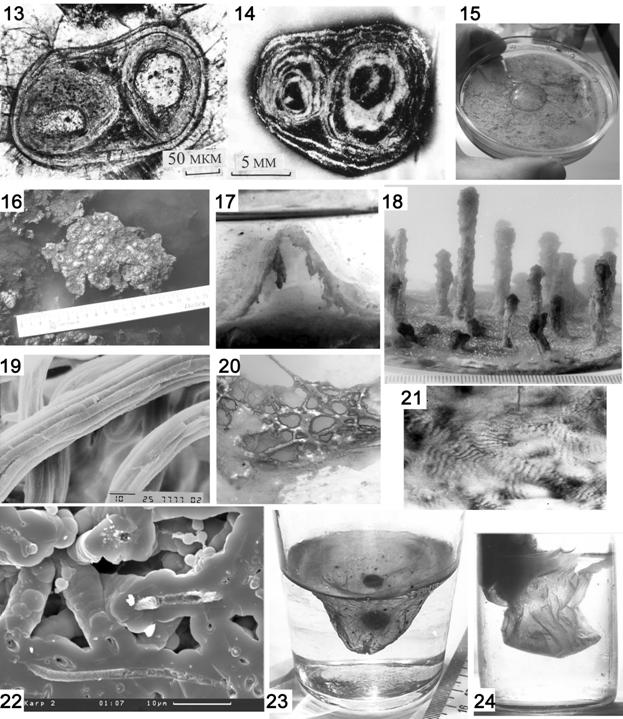
ОЦЕНКА ТРАНСФОРМАЦИИ ПРЕСНОВОДНЫХ ЭКОСИСТЕМ ПО СТРУКТУРЕ ДИАТОМОВЫХ КОМПЛЕКСОВ
Разумовский Л.В.
ASSESSMENT OF TRANSFORMATION
IN FRESHWATER ECOSYSTEMS BY DIATOM ASSEMBLAGES STRUCTURE
Razumovskiy L.V.
Учреждение Российской академии наук Институт водных проблем РАН
119333, Москва, ул. Губкина, д.
3 ,тел.(499)135-15-04 ,факс (499)135-54-15
e-mail: razum@aqua.laser.ru
Как и любой метод, диатомовый анализ имеет свои
достоинства и недостатки, а так же границы применения. Вместе с тем, диатомовый
анализ имеет значительный неиспользованный информационный резерв. Наглядным подтверждением
этого факта, является метод графического сопоставления таксономических
пропорций в диатомовых комплексах, разработанный автором (Разумовский, 1997, 2004).
В линейной системе
координат существуют три исходных типа распределения таксономических пропорций:
линейный, экспоненциальный и логистический (Шитиков и др., 2005). Они соответствуют
трем основным, нециклическим, реакциям экосистемы на воздействующие факторы
среды.
Линейный тип
распределения, характерен для переотложенных комплексов. Это позволяет
проводить их достоверное распознавание при палеореконструкциях. Сортировка
створок в переотложенном комплексе происходит по их размерам и массивности.
Поскольку каждый вид имеет устойчивые среднестатистические параметры по этим признакам,
то очертания графиков выравниваются, приобретая линейные очертания. В
прижизненном распределении такие «простые» правила отсутствуют, поэтому
пространственно-временные закономерности для любых биологических объектов будут
априорно иметь нелинейный характер.
Экспоненциальный тип распределения характерен для
малых озер (<1 км2) и небольших водотоков (ручьев, малых рек).
Логистический тип распределения присущ более крупным и сложным экосистемам, как
проточным, так и непроточным. В естественных условиях существует большое количество
промежуточных форм распределения таксономических пропорций. Все они являются
комбинационными вариантами этих двух нелинейных типов распределения.
При
анализе в логарифмической системе координат, таксономические пропорции описываются
результирующими прямыми линиями. Первоначально исследования проводились только
для озер, т.к. они являются наиболее показательными и удобными объектами
исследования. Однако в дальнейшем было выяснено, что аналогичные закономерности
присущи пресноводным экосистемам и проточного генезиса.
При
сравнительном анализе озер одной размерности результирующие линии образуют
некую совокупность (генерацию). Сравнительный анализ может иметь
пространственный или временной характер. Для озер малого (<1 км2)
и среднего (1–4 км2) размера был получен ряд основополагающих
закономерностей, объяснимых с позиций иерархического уровня самоорганизации
озерных экосистем в каждой ландшафтно-климатической зоне. Были выделены три
основных сценария их пространственно-временной трансформации.
Для озер малого размера характерен первый из
выявленных сценариев трансформации диатомовых комплексов. При увеличении
негативной нагрузки происходит процесс вращения результирующих линий вокруг
некой точки или локальной области (рис. 1). Этот процесс происходит до определенного
предела, после чего результирующие линии перемещаются из области
гипотетического вращения, что соответствует стадии деградации биоценоза в
озере.
В логарифмической системе координат была получена
зависимость между значениями x (порядком
таксонов) и y (их процентными пропорциями) через два коэффициента.
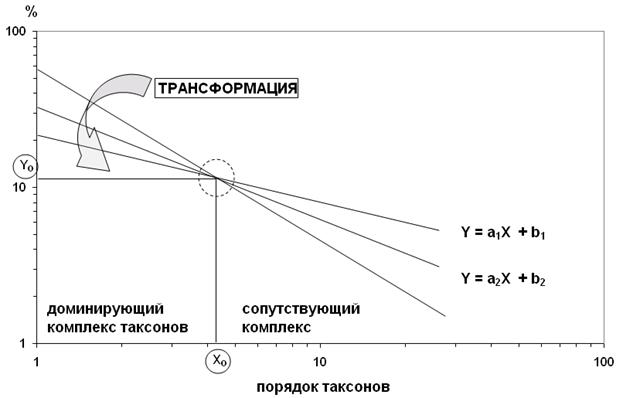
Рис. 1. Обобщенная
модель трансформации диатомовых комплексов из озер малого размера
Первый из них, аi
выражает уровень совокупного негативного воздействия на экосистему. Зависимость
имеет степенной характер, т.к. при продвижении к источнику воздействия ее сила
будет расти нелинейно.
Второй коэффициент ki имеет композиционную структуру. Его линейный
компонент характеризует число доминирующих таксонов (xo)
и их минимальную процентную долю (yo) позволяющую сохранить трофо-метаболическую
целостность экосистемы. В обобщенном понимании, это число таксонов и их
пропорций, которое характеризует минимальный размер озера, как элементарной, дискретной,
целостной, единицы в иерархической структуре для анализируемой
ландшафтно-климатической области. Все остальные озера: средней и большой
размерности, простой или сложной структуры, можно всегда «разложить» на эти
элементарные экологические единицы – малые биотопы.
Для озер среднего размера характерен второй из
выделенных сценариев трансформации диатомовых комплексов. Он выражен в виде
веерообразного вращения вокруг некой общей области. При последовательном
увеличении внешней нагрузки область второго типа трансформации ограничена теми результирующими
линиями, которые иллюстрируют начальный и конечный этап деградации диатомовых
комплексов (рис. 2). Таким образом, трофо-метаболическая целостность озер
среднего размера поддерживается не только доминирующим комплексом (вращение
вокруг локальной области), но и группой сопутствующих видов (веерообразный
разворот).
Существует третья модель трансформации, которую нельзя
свести к двум первым – параллельное расположение результирующих линий. Такое
расположение было отмечено вдоль градиентов растепления (в пространстве) и при
изменении глубин (во времени). Аналогичное явление отмечено для группы озер с
разным показателем рН (Алимов, 2000). Во всех рассмотренных случаях речь идет
не о внешних негативных факторах воздействия – меняются свойства самой среды обитания
(tоC, рН и др.)
Три сценария трансформации
могут соответствовать или экологическим модуляциям (когда система не деградирует),
или экологическому регрессу (когда происходит упрощение структуры). Эти два
классификационных типа являются вариациями состояний экосистемы в рамках
парадигменной теории экологических модификаций, которая была разработана В.А.
Абакумовым (Руководство…, 1992).
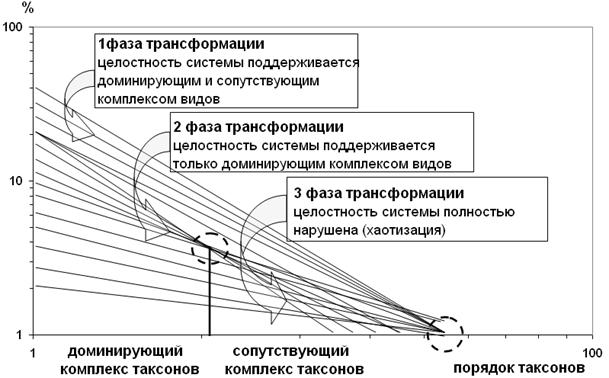
Рис. 2. Обобщенная
модель трансформации диатомовых комплексов из озер среднего размера
Однако в классификационной системе существует третий
вариант модификации – экологический прогресс, когда происходит усложнение
экосистемы и она переходит в более высокую категорию. В силу специфики исходных
задач этот вариант трансформации экосистемы не рассматривался.
Если
предложенная модель реалистична на общедисциплинарном уровне, будет нетрудно
найти пример экологического прогресса для другой биологической группы. Аналог
подобного «обратного» перехода был найден. В работе, посвященной анализу
бактериологических показателей качества воды, проанализирован многолетний ряд
наблюдений по нескольким группам микроорганизмов на створе р. Москва
(Долгоносов и др., 2006). При определенных условиях в реке происходит фазовый
переход и скачкообразное увеличение бактериологических показателей на несколько
порядков. Графически это выглядит как полной аналог модели, которая была
создана на основе трансформации диатомовых комплексов. Следовательно,
способность к самоорганизации на более высоком уровне является неотъемлемым
компонентом любой биологической системы или ее экологического блока.
Список литературы
Алимов А.Ф. Элементы теории функционирования водных
экосистем. СПб.: Наука, 2000. 147 с.
Долгоносов Б.М..
Корчагин К.А., Мессинева Е.М. Модель флуктуаций бактериологических показателей
качества речной воды // Вод. ресурсы. 2006. Т. 33. № 6. С. 686–700.
Разумовский Л.В. Биоиндикация уровня антропогенной
нагрузки на тундровые и лесотундровые ландшафты по диатомовым комплексам озер
Кольского полуострова. М.: ИРЦ Газпром, 1997. 92 с.
Разумовский Л.В.
Оценка качества вод на основе анализа структуры диатомовых комплексов // Вод.
ресурсы. 2004. Т. 31. № 6. С.742–750.
Руководство по
гидробиологическому мониторингу пресноводных экосистем / Под ред. Абакумова
В.А. СПб.: Гидрометеоиздат, 1992. 320 с.
Шитиков В.К., Розенберг
Г.С., Зинченко Т.Д. Количественная гидроэкология: методы, критерии, решения.
М.: Наука , 2005. Кн.1. 281 с.
МУТАГЕНЕЗ В ИЗУЧЕНИИ ФОРМИРОВАНИЯ МЕМБРАННОЙ СИСТЕМЫ
ХЛОРОПЛАСТА У ЗЕЛЕНОЙ ВОДОРОСЛИ CHLAMYDOMONAS REINHARDTII
Семенова Г. А., Ладыгин
В. Г.
Mutagenesis in studying formation of green alga
Chlamydomonas reinhardtii chloroplast membrane system
Semenova G. A., Ladygin V. G.
Институт теоретической и
экспериментальной биофизики РАН
142290 Московская область, г.
Пущино, ул. Институтская, д. 3 тел. 8 (4967) 73-37-96
e-mail: ladyginv@rambler.ru
Институт фундаментальных
проблем биологии РАН
142290 Московская область, г.
Пущино, ул. Институтская, д. 2, тел. 8 (4967) 73-28-64
e-mail: ladyginv@rambler.ru
В качестве мутагенов мы использовали гамма-лучи с
энергией излучения 0.66 Мэв (Cs137) и 1.25 Мэв (Co60), которые
оказывают сильное летальное и мутагенное действие на клетки зеленой водоросли Chlamydomonas reinhardtii.
Только часть клеток погибает в момент воздействия гамма-излучения. Значительная
доля клеток с потенциально летальными изменениями гибнет в процессе первых двух клеточных делений.
Частота мутаций для обоих источников
гамма-квантов имеет прямо пропорциональную зависимость по всем типам
видимых пигментных мутантов, оптимальной дозой для получения которых служит ЛД99 . Это летальная доза, при которой
погибает 99 % клеток и выживает около 1 %, из которого выделяли
мутанты..
В этой работе представлены результаты исследования
пигментов и структурной организации пластид четырех типов мутантов Chlamydomonas reinhardtii:
белого, двух желтых, двух светло-зеленых и темно-зеленого. Показано, что
пластида белого мутанта, по размерам мало отличающаяся от контрольной,
заполнена только матриксом. Развитие ее ламеллярных структур блокировано на
стадии формирования пузырьков в результате отсутствия пигментов. Накопление значительного
количества каротиноидов у желтых мутантов сопровождается образованием большого
числа пузырьков, по-видимому без хлорофилла. Мутанты, восстанавливающие синтез
хлорофилла на свету, в процессе зеленения вначале формируют проламеллярное
тело, а затем – и тилакоиды. Уменьшение содержания пигментов в 2-3 раза у
светло-зеленых мутантов сопровождается редукцией ламеллярной системы до стадии
формирования единичных тилакоидов. Повышенное накопление пигментов у
темно-зеленых мутантов по сравнению с контрольным сопровождается формированием
большого числа тилакоидов, заполняющих практически весь матрикс. На основании
обнаружения всех остальных этапов формирования ламеллярной системы хлоропластов
от единичных пузырьков до упаковки тилакоидов в граны, свойственных высшим
растениям, доказывается принципиальная идентичность организации мембранных структур
хлоропластов изучаемой зеленой водоросли и высших растений. Благодаря
полученным нами пигментным мутантам, впервые удалось изучить все этапы
формирования структуры хлоропластов.
СОВРЕМЕННЫЕ МЕТОДЫ
ИЗУЧЕНИЯ СОДЕРЖАНИЯ
РАСТИТЕЛЬНЫХ
ПИГМЕНТОВ В ВОДОЕМАХ
Сигарёва Л.Е.
MODERN METHODS OF STUDIES OF PLANT PIGMENTS IN
WATER BODIES
Sigareva L.E.
Учреждение РАН
Институт биологии внутренних вод им. И.Д. Папанина
152742, п. Борок,
Ярославская обл., Некоузский р-н, тел. 8 (48547) 24110
e-mail: sigareva@ibiw.yaroslavl.ru
Введение. Уникальность растительных пигментов в изучении водоемов
обусловлена возможностью использования этих
молекулярных маркеров при оценках состава, состояния, обилия и продуктивности
водорослей, а также продукционных свойств водной экосистемы. Обоснованием индикаторного
значения растительных пигментов могут служить следующие положения: 1) хлорофилл
незаменим для фотосинтеза, и четкая количественная связь между этими
параметрами позволяет оценивать первичную продукцию органического вещества; 2)
оптические свойства растительных пигментов, отражающие их концентрацию, могут
быть измерены инструментально, что весьма важно для натурных исследований
водоемов и проведения сравнительных оценок; 3) распространение растительных
пигментов (в активной и деградированной формах) обусловлено изменчивостью
биотических и абиотических факторов продуктивности и экологической зональности водоема.
В докладе будут освещены следующие
вопросы.
Актуальность изучения содержания растительных пигментов в водоемах
в связи с современными экологическими исследованиями
водорослей и их использованием в мониторинге состояния водоемов. Место
альгологических проблем, которые изучаются с помощью информации о растительных
пигментах, в продукционной гидробиологии.
Теоретические основы методов изучения растительных пигментов в водоемах
базируются на знаниях о составе и свойствах пигментов в различных условиях.
Состав пигментов водорослей зависит от таксономической
принадлежности водорослей и их физиологического состояния. Основные группы
пигментов – хлорофиллы, каротиноиды, фикобилины. Представления о продуктах деградации
хлорофилла (хлорофиллид, феофитин, феофорбид).
Свойства (химические и физические) растительных пигментов,
используемые при определении их содержания в водоемах. Растворимость пигментов,
отношение к действию света и его отсутствию, влияние кислорода, тепла, кислот и
щелочей. Сравнение свойств пигментов в нативном состоянии и в экстрактах.
Способность пигментов к поглощению света. Удельные коэффициенты экстинкции.
Понятие о флуоресценции, люминесценции, фосфоресценции. Спектры поглощения видимого
света и их использование для количественного и качественного определения
пигментов. Дифференциальные спектры. Спектральные характеристики флуоресценции
отдельных групп водорослей.
Методы изучения содержания растительных пигментов в водоемах
были сгруппированы по различным признакам: по месту проведения определений –
полевые и лабораторные; по расстоянию между аппаратурой и объектом – контактные
и дистанционные; по характеру изменения состояния растительного материала перед
определением пигментов – экстрактные и безэкстрактные; по типу использования
физических свойств пигментов – поглощение света в видимой области и его излучение
в различных условиях; по типу использованного контроля – чистый растворитель
или исходный экстракт; по принципу работы соответствующей аппаратуры -
спектрофотометрические, флуоресцентные, хроматографические (бумажная,
тонкослойная, жидкостная); по типу источника света, по характеру веществ для разделения
смеси пигментов на отдельные компоненты и др.
Излагаются особенности основных
современных методов определения растительных пигментов. Преимущества и
недостатки. Области применения. Процедура и формулы для расчета концентраций
пигментов стандартным спектрофотометрическим методом. Роль этого метода на
современном этапе мониторинга состояния водоемов.
Содержание доклада в целом основано на
обобщении литературных сведений о методах измерения концентраций растительных
пигментов, а также на собственном опыте использования стандартного
спектрофотометрического метода в изучении продуктивности фитопланктона,
микрофитобентоса и «продукционных» свойств донных отложений. Ниже приведен
краткий список используемой литературы.
Работа выполнена при частичной
финансовой поддержке Российского фонда фундаментальных исследований по проекту
08-04-00384.
Список литературы
Апонасенко А.Д., Сидько Ф.Я., Васильев В.А.
Определение концентраций хлорофилла фитопланктона по дифференциальным спектрам
поглощения света // Методические вопросы изучения первичной продукции планктона
внутренних водоемов: Сб. матер. конф. СПб: Гидрометеоиздат, 1993. С. 97-100.
Бриттон Г. Биохимия природных пигментов. М., Мир.
1986. 422 с.
Гавриленко В.Ф., Ладыгина М.Е., Хандобина Л.М. Большой
практикум по физиологии растений. Учеб. пособие. М., «Высш. школа», 1975. 392
с.
Гаевский Н.А., Шатров И.Ю., Гольд В.М. Флуоресцентный
анализ пигментов фитопланктона // Методические вопросы изучения первичной продукции
планктона внутренних водоемов: Сб. матер. конф. СПб: Гидрометеоиздат, 1993. С.
101-109.
Гительсон А.А. Дистанционное измерение концентраций
хлорофилла «а» по спектрам диффузного рассеянного водой излучения //
Методические вопросы изучения первичной продукции планктона внутренних
водоемов: Сб. матер. конф. СПб: Гидромет., 1993. С. 110-113.
Карнаухов В.Н. Спектральный анализ в клеточном
мониторинге состояния окружающей среды. М.: Наука, 2001. 186 с.
Кондратьев К.Я., Поздняков Д.В. Оптические свойства природных
вод и дистанционное зондирование фитопланктона. Л., 1988.
Корнюшенко Г.А. Хроматографический метод и возможности
его использования для изучения пигментов фитопланктона // Методические вопросы
изучения первичной продукции планктона внутренних водоемов: Сб. матер. конф.
СПб: Гидромет., 1993. С. 86-96.
Методические рекомендации по дистанционным методам
контроля качества поверхностных вод суши. Выпуск 3. Отв. ред. Гительсон А.А.
Л., Гидромет. 1989. 47 с.
Поздняков Д.В. Определение концентрации хлорофилла
фитопланктона по данным дистанционного лазерного зондирования // Методические
вопросы изучения первичной продукции планктона внутренних водоемов: Сб. матер.
конф. СПб: Гидромет., 1993. С. 114-119.
Сигарева Л.Е. Спектрофотометрический метод определения
пигментов фитопланктона в смешанном экстракте // Методические вопросы изучения
первичной продукции планктона внутренних водоемов: Сб. матер. конф. СПб:
Гидромет., 1993. С. 75-86.
Сигарева Л.Е. Пигментная модель фитопланктона и ее
использование // Методические вопросы изучения первичной продукции планктона
внутренних водоемов: Сб. матер. конф. СПб: Гидрометеоиздат, 1993. С. 120-125.
Сигарева Л.Е. Формирование и трансформация фонда
растительных пигментов в водоемах верхневолжского бассейна. Автореф. дис. … докт.
биол. наук. М., 2006. 47 с.
Сигарева Л.Е. Методология использования растительных
пигментов в изучении пресноводных экосистем // Водные экосистемы: трофические
уровни и проблемы поддержания биоразнообразия. Материалы Всероссийской конф. с
международным участием «Водные и наземные экосистемы: проблемы и перспективы
исследований». Вологда, ООО «Центр оперативной полиграфии «Коперник», 2008. С.
99-102.
Сухоруков Б.Л. Дистанционная спектрометрия
пресноводных экосистем. Автореф. дис….докт. физико-мат. наук. Краснодар. 2004.
47 с.
Kirk J. T. O. Light and photosynthesis in aquatic ecosystems. London, 1983. 405 p.
Korthals H.J.,
Steenbergen C.L.M. Separation and quantification of pigments from natural
phototrophic microbial populations // FEMS Microbiology Ecology. 1985. V. 31.
P. 177-185.
Mantoura R.F.C.,
Llewellyn C.A.
The rapid determination of algal chlorophyll and carotenoid pigments and their
breakdown products in natural waters by reverse-phase high-performance liquid
chromatography // Analytica Chimica Acta. 1983. V. 151. P. 297-314.
Pickney J., Papa
R., Zingmark R. Comparoson of high-perfomance liquid chromatographic, spectrophotometric,
and fluorometric methods for determining chlorophyll a concentrations in
estuarine sediments // Journal of Microbiologcal Methods. 1994. V. 19. P.
59-66.
Pocock T., Krol M.,
Huner N.P.A. The Determination and Quantification of Photosynthetic Pigments by
Reverse Phase High-performance Liquid Chromatography, Thin-Layer
Chromatography, and Spectrophotometry // Photosynthesis Research Protocols.
(Ed. Carpentier R.), Humana Press Inc., Totowa, 2004. P. 137-148.
Wasmund N., Topp I.,
Schoris D. Optimising the storage and extraction of chlorophyll samples //
Oceanologia. 2006. 48 (1). P. 125-144.
НАЧАЛЬНАЯ СТАДИЯ КОЛОНИЗАЦИИ СУБСТРАТА ФИТОПЕРИФИТОНОМ:
ЭКСПЕРИМЕНТ И МОДЕЛИРОВАНИЕ
Сысова Е.А.
Initial stage of
phytoperiphyton’s substrate colonization:
experiment and simulation
Sysova E.A.
Государственное научно-производственное объединение
«Научно-практический центр Национальной Академии Наук
Беларуси по биоресурсам»
220072 г. Минск, ул. Академическая 27, Беларусь, тел. 2841585, факс 2841036
e-mail: sysovaelena@mail.ru
Важным моментом в динамике фитоперифитона является
начальная стадия колонизации субстрата. Мнения авторов относительно
первопоселенцев на субстрате расходятся. Так, существует мнение, что наиболее
ярко выраженной особенностью формирования фитоценозов фитоперифитона является
быстрая смена пионерных видов в сообществе, не являющихся типичными
обрастателями [1]. В то же время, Е. Акс
с соавт., исследуя развитие перифитона на стеклянных дисках, обнаружили, что
первыми колонизаторами были типично перифитонные виды [2]. Развитие сообщества
начинается с заселения субстрата видами водорослей с высокой скоростью
иммиграции [3]. Она определяется относительной концентрацией водорослей в
столбе воды и их способностью плотно прикрепляться к субстрату. В результате на
первой стадии образуется однослойное сообщество из плотно прикрепленных к
субстрату видов. Натурные исследования, несомненно, являются самым важным
моментом при изучении динамики фитоперифитонных сообществ в естественных
водоемах. Однако сложность и большая трудоемкость таких экспериментов в сильной
степени ограничивают объем их проведения. Как аналитические качественные
исследования, так и вычислительный эксперимент являются наиболее перспективными
направлениями исследований поскольку позволяют решать поставленные задачи в
кратчайшие сроки с наименьшими затратами, обладая при этом наибольшей
информативностью. В настоящее время не существует универсальных математических
моделей для проведения вычислительного эксперимента по определению
пространственно-временной динамики сообщества перифитона на поверхности
конкретного субстрата в течение продолжительного периода наблюдений. По крайней
мере, в доступных литературных источниках таких моделей нет. Поэтому построение
подобной модели, на основе которой можно было бы наиболее полно исследовать
изучаемое явление, несомненно, представляет большой интерес и является
актуальной проблемой на сегодняшний день.
Эксперименты проводили на озерах Обстерновской группы
Миорского района Витебской области: мезотрофном оз. Укля и слабоэвтрофном
оз. Обстерно в июле 2008 г. Для
проведения экспериментов были выбраны биотопы со сходным типом растительности:
смешанные заросли тростника обыкновенного (Phragmites australis (Cav.) Trin. ex Steud) и
кубышки желтой (Nuphar luteum (L.)). В зарослях были установлены экспериментальные
установки, представляющие собой металлические конструкции с натянутыми
полосками тефлоновой химически инертной ленты, для исследования динамики
начальной стадии колонизации субстрата. Тефлоновая лента, введенная в практику
А.П. Остапеней и Т.А. Макаревич [4], в подобных исследованиях
используется, начиная с 80-х гг. ХХ в.
Для проведения вычислительного
эксперимента в указанной области исследований была разработана модель
обрастания субстрата, описывающая процесс колонизации первопоселенцев с учетом
пограничного слоя и процесс деления клеток водорослей на субстрате в различных
приближениях [5]. Модель относится к имитационным индидуально-ориентированным
моделям, т.е. рассматривает развитие отдельных клеток сообщества. На рисунке 1
приведены результаты моделирования динамики численности Achnanthes minutissima на начальной стадии обрастания субстрата
и данные эксперимента, проведенного в оз. Обстерно. Результаты
моделирования на рис. 1 а получены по трехпараметрической, а на рис. 1 б
– по двухпараметрической модели развития с интерполяцией периода деления и
коэффициента делящихся клеток по времени. Видно, что в обоих случаях результаты
моделирования хорошо отслеживают поведение данного вида в эксперименте, однако,
данные, полученные по двухпараметрической модели, лучше согласуются с экспериментом,
как в качественном отношении, так и в количественном выражении. Это в первую
очередь связано с тем, что трехпараметрическая модель, основанная на
необходимости знания равновесной численности фитоперифитона, получает его с
помощью процедуры перенормировки численности фитопланктона, которая на стадии
экспоненциального роста не может являться надежной величиной. Проведенное
сопоставление позволяет заключить, что стадию экспоненциального роста лучше
моделировать с помощью двухпараметрической модели с временной интерполяцией
коэффициентов, а трехпараметрическую использовать после окончания этой стадии.
а б


Рис.1. Сопоставление
результатов моделирования динамики численности A.minutissima (кривая
1)
с
экспериментальными данными (кривая 2) для трехпараметрической (а)
и
двухпараметрической (б) моделей
На рисунке 2 изображена рассчитанная и полученная экспериментально
динамика численности Cymbella silesiaca в озерах Укля (рис. 2 а) и Обстерно (рис.
2 б). И в том, и в другом случае моделирование проводилось по
двухпараметрической модели, причем подобранные в расчетах коэффициенты были
равными. Получившееся в результате моделирования согласие рассчитанной
динамики численности с экспериментом в обоих случаях при одинаковых входных
параметрах модели говорит об идентичном поведении C. silesiaca в озерах разного уровня трофии. Несмотря
на различия в численности данного вида в разных озерах на порядок, поведение
рассчитанных кривых качественно одинаковое.
а б


Рис.2. Сопоставление результатов моделирования
динамики численности C. silesiaca
с экспериментальными данными в озерах Укля
(а) и Обстерно (б). Обозначения см. рис.1
Результаты моделирования динамики
обрастания видов различных экологических группировок представлены на
рис. 3. На рисунке 3 а изображено поведение типично перифитонного
вида Gomphonema parvulum в оз. Укля на стадии его экспоненциального роста. На кривых
видно как происходит выход на период насыщения. Отметим, что во всех вариантах
моделирования скорость течения около субстрата составляла 1 мм/с, а
максимальная собственная скорость клеток или скорость их осаждения составляла
0.1 мкм/с. Для согласования результатов численного моделирования с экспериментальными
данными поводился подбор величины периода деления и коэффициента, отражающего
долю делящихся клеток от их общего числа. Величина продолжительности стадии «чистой»
поверхности составляла обычно 9 – 13 суток. За этот период коэффициент
«прилипания» клеток к субстрату возрастал от 0 до своего максимального
значения, который в приведенных расчетах составлял 0.5 – 0.8. На рисунке 3 б
изображена динамика численности типичного фитопланктонного вида Cyclotella comta. То, что этот вид является типичным представителем фитопланктона,
можно было определить и по результатам моделирования, поскольку для получения
согласия с экспериментом пришлось уменьшить коэффициент «прилипания» почти на
порядок. Это, в свою очередь, говорит о том, что на поверхность субстрата
попадает большое количество этого вида, однако для согласия с экспериментом необходимо
предположить, что лишь их малая часть остается на субстрате.
а б


Рис. 3. Сопоставление результатов моделирования
динамики численности G. parvulum в оз. Укля (а)
и C. comta в оз. Обстерно (б) с
экспериментальными данными. Обозначения
см. рис.1
По результатам
экспериментальных данных, описывающих начальную стадию колонизации
фитоперифитона, проведено численное исследование применимости различных моделей
описания этого процесса. Предложенная двухпараметрическая модель размножения
хорошо работает при моделировании начальной стадии колонизации, когда наблюдается
экспоненциальный рост перифитонного сообщества. Однако описание окончания этой
стадии, когда происходит выход на «стационарный» период развития перифитона с
помощью такой модели затруднен, поскольку по своей сути она плохо моделирует
именно область, когда достигается равновесное значение численности. Более
сложная трехпараметрическая модель развития перифитонного сообщества
реалистичнее описывает этот процесс, и адекватно описывает начальную стадию
колонизации субстрата первопоселенцами. Отметим, что основной трудностью в последнем
случае является задание равновесного значения плотности фитоперифитона,
величина которой полностью определяет его динамику в любой момент времени.
Анализ результатов численного моделирования по динамике фитоперифитона на
начальной стадии колонизации и их сопоставление с экспериментальными данными
позволяют сделать вывод об адекватности разработанной модели рассматриваемому
процессу обрастания субстрата. Дальнейшее ее развитие предполагает введение
процесса межвидовой конкуренции за местоположение на субстрате, что позволит
реалистично описать начальную стадию колонизации субстрата водорослями.
Работа выполнена при финансовой поддержке
Белорусского республиканского фонда фундаментальных исследований (грант №
Б08М095).
Список литературы
1. Девяткин, В.Г. Динамика развития альгофлоры
обрастаний в Рыбинском водохранилище / В.Г. Девяткин // Флора и
растительность водоемов Верхней Волги. Рыбинск: Ин-т биологии внутр. вод АН СССР, 1979.– С.78-108.
2. Changes in the algal composition, bacterial
metabolic activity and element content of biofilms developed on artificial
substrata in the early phase of colonization /Ács
É. [et al] // Acta Bot. Croat. 2007. – Vol.66 (2). – P. 89-100.
3.
Hoagland, K.D. Colonization and community structure of two periphyton
assemblages, with emphasis on the diatoms (Bacillariophyceae). / K.D. Hoagland, S.C.
Roemer & J.R. Rosowski // Am. J. Bot. - 1982. – Vol. 69. – P. 188–213.
4. Макаревич, Т.А.
Исследование продукционных характеристик перифитона при помощи
экспериментальных субстратов из гибких материалов / Т.А. Макаревич, А.П.
Остапеня // Экология и биологическая продуктивность Баренцева моря: Тез. Докл.
Всесоюзной конф.2-4 июля Мурманск 1986, С. 135-137.
5. Сысова, Е.А.
Численное моделирование обрастания субстрата фитоперифитоном / Е.А. Сысова //
Материалы XIV международной конференции студентов, аспирантов и молодых ученых «Ломоносов»
Москва, 2007 / Отв. ред. И.А. Алешковский, А.И. Андреев. – Т.1. – М: СП
«Мысль», 2007. – С. 107.
МАКРОФИТОПЕРИФИТОН
АКВАТОРИЙ, ПЕРСПЕКТИВНЫХ
ДЛЯ
ОРГАНИЗАЦИИ БЕРЕГОВЫХ БИОТЕХНИЧЕСКИЙ КОМПЛЕКСОВ
Танковская И.Н.,
Евстигнеева И.К.
Macrophytoperiphyton
of water areas, perspective
for the organization
of coastal biotechnical complexes
Tankovskaya
I.N., Evstigneeva I.K.
Институт биологии южных морей НАН Украины
пр. Нахимова, 2; г. Севастополь, 99011, Украина
е-mail:
logrianin@nm.ru
Гидротехнические сооружения, к которым относятся и
береговые волнорезы, рассматриваются как способ создания дополнительных
поверхностей литоконтура для успешного функционирования гидробионтов.
Сообщества обрастания таких конструкций способны стать источником и резервом
биоразнообразия прибрежного мелководья моря. Только визуальные наблюдения
свидетельствуют о том, что водоросли-макрофиты - непременные компоненты обрастания,
поставщиками которых являются соседние акватории. К сожалению, исследований,
посвященных фитокомпоненте перифитона прибрежного мелководья Черного моря,
весьма недостаточно, хотя полученные при этом сведения могли бы расширить
представление о биоразнообразии флоры данного водоема и о степени сходства и
различия альгоценозов двух жизненных форм – бентоса и перифитона.
В связи с этим целью работы стало исследование
состава и структуры альгоценозов бентоса и перифитона в
пространственно-временном аспекте. Районами исследования стали бухта
Ласпи и заповедная акватория Карадага, считающиеся перспективными для
организации береговых биотехнических комплексов.
В ходе трехгодичных исследований были получены данные,
позволившие утвердиться во мнении, что макрофитоперифитон (МФП)
гидротехнических сооружений – резерв биоразнообразия моря, а в некоторых
районах – его непосредственный источник. Доказательством тому является хотя бы
тот факт, что доля видов, родов, семейств и порядков в структуре фитоперифитона
исследованных акваторий составляет 36 – 75% во флоре бентали всего Черного
моря. Во флоре Южного берега Крыма доля порядков, семейств и родов
фитоперифитона бухты Ласпи даже несколько выше, а видов та же, что и в бухте.
Как правило, для фитоперифитона свойственна пестрота таксономического состава,
довольно высокое видовое разнообразие всего сообщества и Rhodophyta, в частности.
Исследование особенностей пространственно-временной
изменчивости сообщества обрастания волнорезов показало, что его видовое
разнообразие варьирует во времени в более широких границах, а, значит, и с
большим размахом , чем в пространстве. При этом временная изменчивость у
каждого из отделов проявляется в своей степени, что в большей мере выражено у Phaeophyta.
Показано, что зеленые водоросли в своем распределении
индифферентны к ориентации поверхностей волнореза по отношению к сторонам
света, а бурые и красные в этом ракурсе проявляют избирательность.
Исходя из среднего значения коэффициента Жаккара можно
утверждать, что около 50% видов, зарегистрированных на волнорезах в течение
года, непременно входят в состав фрагментов МФП на каждой станции, обеспечивая
тем самым стабильность функционирования сообщества обрастания в целом.
У каждого вида и отдела своя частота встречаемости,
которая в той или иной мере детерминирована сезонным комплексом факторов среды
и местом произрастания на гидротехническом сооружении. В целом, большинство
перифитонных макроводорослей относится к категориям постоянных и случайных
компонентов ценоза.
Из известных для фитобентоса Черного моря
экологических групп наибольшее развитие в МФП получают те же, что и в природных
поселениях: ведущая, однолетняя, олигосапробная и морская. Количество видов в
большинстве групп увеличивается от зимы к лету с последующим снижением осенью.
Сезонная гетерогенность экологических спектров более типична для бурых
водорослей и менее – для красных.
Сопоставление сообществ МФП и МФБ акватории бухты
Ласпи позволило сделать вывод о том, что первые отличаются большим
флористическим и таксономическим разнообразием. На искусственном субстрате
среднемесячное число видов выше, а степень его вариабельности ниже, чем на
естественном. В таксономической структуре МФП больше политипичных родов и
порядков. Подобно этой структуре экологические спектры и доминирующие экологические
группы альгоценозов двух жизненных форм не всегда идентичны друг другу.
Изучение сезонной динамики количества видов в МФП и
МФБ бухты Ласпи показало, что весной и в начале лета данный показатель в
сообществах меняется синхронно, тогда как большую часть года он колеблется
противофазно. Обращает на себя внимание тот факт, что минимум показателя в
сообществе МФП сочетается с максимумом в МФБ и, наоборот. Такой характер
совместного функционирования должен способствовать устойчивому развитию
экосистемы моря в целом. Видовая структура МФБ проявляет большую пластичность,
чем МФП, что, возможно объясняется разными сроками истории этих поселений.
Установлено, что фитоперифитон в известной степени
проявляет черты фитобентоса. Сходство МФП и МФБ, в частности, наблюдается на
уровне таксономической структуры зеленых и бурых водорослей, соотношения (пропорций)
всех таксонов и доли политипичных родов у трех отделов, перечня таких родов и
семейств у красных водорослей и только семейств – у зеленых. О степени качественного
сходства МФП и МФБ свидетельствуют высокие значения коэффициента общности видов
и надвидовых таксонов. Кроме того, совпадает большая часть спектра групп, доминирующих
или занимающих после них второе место в экологическом составе двух типов
альгоценозов. Для сообществ МФП заповедных (Карадаг) и неохраняемых (Ласпи)
акваторий характерно сходство экологического состава и отличие в степени
таксономического разнообразия, наиболее выраженного у вторых. Последнее может
быть связано не только с охватом для исследования меньшего числа месяцев, но и
с ухудшением экологической ситуации, наблюдаемого в акватории заповедника
последние годы.
Количественное и
качественное подобие и одновременно существующее своеобразие альгоценозов
бентоса и перифитона подтверждают значимость гидротехнических сооружений как
средства поддержания естественного биоразнообразия прибрежья Черного моря.
Волнорезы, активно заселяющиеся макрофитами, среди которых немало хозяйственно
ценных видов, могут стать моделью для создания береговых биотехнических
комплексов марикультурного и мелиоративного назначения.

































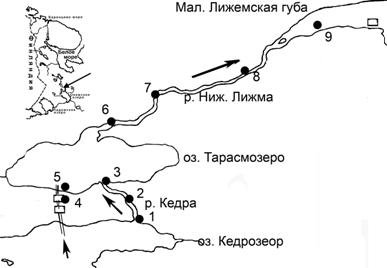






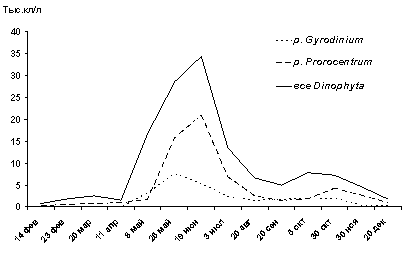




























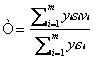 ,
,








































